文章信息
- 胰腺癌患者胰腺切除术后腹主动脉旁淋巴结状态与其预后及临床病理特征的关系
- Relationship of Para-aortic Lymph Nodes (PALN) Status with Prognosis and Clinicopathological Features of Pancreatic Cancer Patients After Pancreatectomy
- 肿瘤防治研究, 2017, 44(10): 665-671
- Cancer Research on Prevention and Treatment, 2017, 44(10): 665-671
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0349
- 收稿日期: 2017-04-05
- 修回日期: 2017-05-11
2. 730000 兰州, 甘肃省人民医院肿瘤外科;
3. 730000 兰州, 兰州大学循证医学中心
2. Department of Surgical Oncology, Gansu Provincial Hospital, Lanzhou 730000, China;
3. Evidence-Based Medicine Center, Lanzhou University, Lanzhou 730000, China
胰腺癌(pancreatic cancer, PC)因起病隐匿,疾病进展快,预后极差,成为消化系统最致命的恶性肿瘤之一[1]。据美国癌症中心统计,2013年美国约有4.5万人被确诊为胰腺癌,其中死亡人数约为3.8万人,其死亡人数居肿瘤死亡总人数第四位,仅次于肺癌、男性前列腺癌(女性乳腺癌)、结直肠癌[2]。2015年,中国胰腺癌发病率已经上升至第9位,死亡率位列第6位[3]。研究显示,中国胰腺癌发病率呈逐年上升趋势,其中农村地区上升明显,城市地区上升略缓,短期内胰腺癌仍是威胁人们健康的主要癌症之一[4]。手术切除是可能治愈胰腺癌,延长患者生存期的最有效的手段[5]。由于超过90%行胰腺切除的胰腺癌患者术后淋巴结病理检查均为阳性,淋巴结阳性已被认为是影响胰腺癌患者术后生存期的重要因素[6]。
目前腹主动脉旁淋巴结(para-aortic nodes, PALN, station 16)的处理及术后病理结果已成为胰腺癌术后关注的焦点。无论是肿瘤切除还是明确分期,胰腺切除术中是否行必要的PALN清扫依然无明确结论[7]。尽管有研究者认为16组淋巴结清扫应该是胰腺扩大切除术的一部分,但该观点还未得到专家共识[8]。本研究采用Meta分析的方法针对已发表的胰腺切除术PALN病理结果与患者预后及临床病理特征的文献进行分析,以期为胰腺癌患者术中是否行16组淋巴结清扫提供依据,并为胰腺切除术PALN阳性患者预后判断及临床病理特征分析提供理论参考。
1 资料与方法 1.1 文献检索计算机检索PubMed数据库、Cochrane图书馆、Embase数据库、CNKI数据库、万方数据库及中国生物医学文献(CBM)数据库,均从建库开始截至2016年7月,查找胰腺癌患者行胰腺切除术后腹主动脉胖淋巴结病理检查结果与患者临床病例特征及生存率相关文献,语种限制为中文和英文,种族不限。数据库检索采用自由检索和主题词检索相结合,中文检索词包括:胰腺癌、胰腺恶性肿瘤、胰腺切除术、腹主动脉旁淋巴结、PALN、16组淋巴结;英文检索词包括:pancreatic cancer, pancreatic neoplasms, lymph nodes, para-aortic lymph nodes, aortocaval lymph nodes, LN 16, LN 16b1, station 16。尽可能追溯参考文献及灰色文献,全面查找相关研究。
1.2 纳入排除标准纳入标准:(1)研究类型为随机对照试验、病例对照研究、队列研究,回顾性或前瞻性研究均可;(2)研究对象均为胰腺癌患者,经术前影像学评估可行胰腺切除术,患者可给予术前降期治疗;(3)明确报道了术后患者PALN状态,并至少报道了结局指标中的1项;(4)胰腺切除术可包括胰十二指肠切除术、远端胰腺切除术、全胰切除术,重建方式不限,是否行扩大切除术不限。
排除标准:(1)未明确报道16组淋巴结状态的研究;(2)病例报告,样本量小于10例的研究;(3)无可用数据提取的研究;(4)综述、重复发表的文献;(5)与作者联系未获得相关数据的文献。
1.3 文献筛选及数据提取有两名研究员以背靠背的形式独立进行文献筛选和数据提取,数据核对无误后录入Excel 2007表格中。若过程中出现分歧,可商议或寻求第三方解决。数据提取的主要内容有:(1)基本资料:作者、发表年代、国家、研究类型、患者数量、胰腺切除术式、PALN清扫数目、PALN阳性率及患者的随访时间;(2)结局指标:1年和2年生存率、R1切除率、淋巴结转移、T分期等。
1.4 文献质量评价依据Newcastle-Ottawa Scale(NOS)[9]文献质量评价量表对纳入文献进行质量评价。条目包括:(1)病例确定是否恰当(1分);(2)病例的代表性(1分);(3)对照的选择(1分);(4)对照的确定(1分);(5)设计和统计分析时考虑病例和对照的可比性(2分);(6)暴露因素的确定(1分);(7)采用相同的方法确定病例和对照组暴露因素(1分);(8)无应答率(1分)。满分为9分,累积分数越高则纳入的研究质量越高。
1.5 统计学方法应用STATA 12.0软件进行Meta分析,连续变量采用标准化均数差(standardized mean difference, SMD)及其95%可信区间(confidence interval, CI),二分类变量采用比值比(odds ratio, OR)及其95%CI,显著性水平设定为α=0.05。绘制森林图展示数据合并结果,绘制漏斗图进行发表偏倚风险评估。采用Q检验对纳入的研究进行异质性检验,若P > 0.1或I2 < 50%,提示研究间异质性较小,选择固定效应模型进行数据合并;若P < 0.1或I2 > 50%,提示研究间异质性较大,分析异质性来源,若经分析异质性无明确来源且仍存在,则选用随机效应模型进行数据处理。
2 结果 2.1 文献检索与筛选结果按照预先制定检索策略进行数据库检索,共获得326篇,其中英文277篇,中文49篇,追溯参考文献和邮件联系作者未得到相关文献。采用EndNote X6对文献去重后,根据纳入排除标准进行严格筛选。最终纳入14个研究[10-23]进行数据合并,文献筛选流程图见图 1。
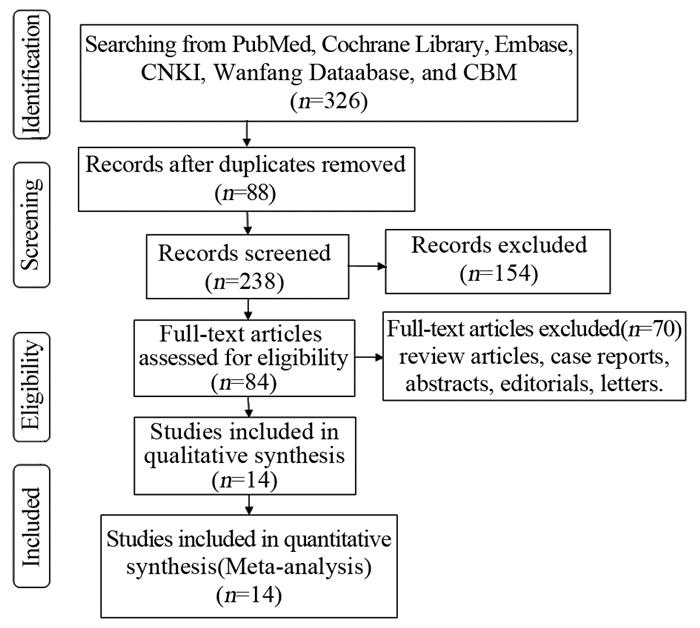
|
| 图 1 文献筛选流程图 Figure 1 PRISMA flow chart of study selection process |
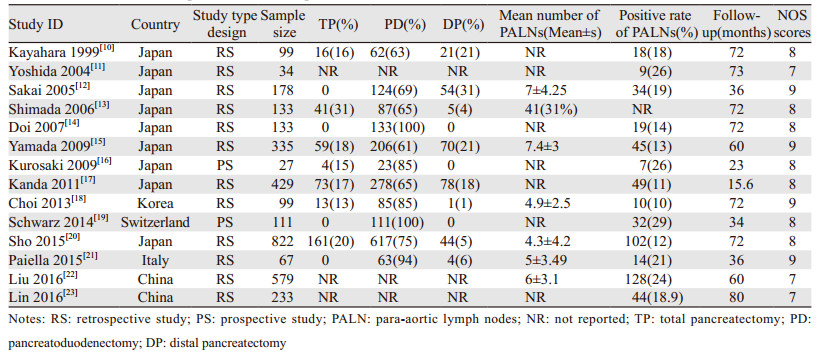
纳入的14篇文献发表年限为1999年至2016年,来自日本的研究最多(64.29%, 9/14),其次为中国(14.29%, 2/14),韩国、瑞士、意大利各1篇(7.14%)。多数为回顾性研究(85.71%, 12/14),仅有2项(14.29%)为前瞻性研究。纳入患者数从22例至822例不等。在报告了胰腺切除术式的研究中,行胰十二指肠切除术的比例较高,远端胰腺切除和全胰切除次之。仅有部分研究报告了16组淋巴结清扫例数,平均数目均不超过10枚,报告了PALNs淋巴结病理结果的研究中,其阳性率均不超过50%。纳入的研究均进行了至少1年的随访,随访时间范围为15.6月到80.0月。按照NOS评分标准对纳入的研究进行质量评价,结果显示纳入的研究得分均大于6分,平均分为8.07±0.73,提示纳入的研究质量均较高,见表 1。
|
纳入的研究中7项报告了患者1年生存率,8项研究报告了患者2年生存率,异质性检验结果提示,报告了1年生存率(I2=0.0%, P=0.709)的研究间和报告了2年生存率(I2=0.0%, P=0.685)的研究间均未见明显统计学异质性,故采用固定效应模型进行数据合并,Meta分析结果显示,PALN阳性患者1年生存率(OR=0.55, 95%CI: 0.41~0.73, P=0.001)和2年生存率(OR=0.46, 95%CI: 0.33~0.63, P=0.001)均明显低于PALN阴性患者,差异具有统计学意义(均P < 0.05),见图 2。
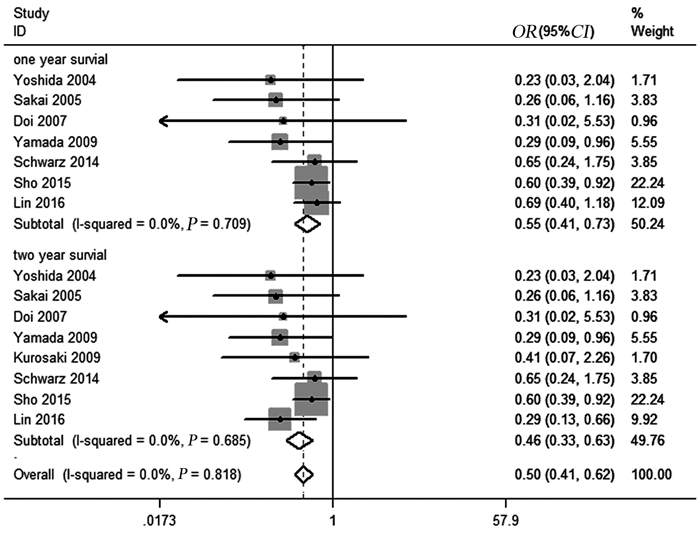
|
| 图 2 PALN阳性与PALN阴性患者生存率的比较 Figure 2 Forest plots of survival rates between PALN+ patients and PALN− patients |
纳入的研究中仅有4项报告了患者R1切除率,异质性检验结果提示研究间无明显统计学异质性(I2=0.0%, P=0.473),采用固定效应模型进行数据合并,Meta分析结果显示,PALN阳性可能会提高肿瘤R1切除率(OR=2.45, 95%CI: 1.79~3.36, P=0.001),增加肿瘤手术切缘阳性的可能,见图 3。
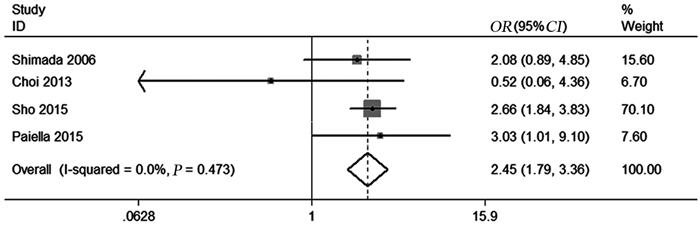
|
| 图 3 PALN阳性与PALN阴性患者R1切除率的比较 Figure 3 Forest plots of R1 rates between PALN+ patients and PALN- patients |
纳入的研究中仅有4项分别报道了胰腺癌患者12组、13组、14组、17组淋巴结转移的情况,异质性检验结果提示研究间均未见明显的统计学异质性(均P > 0.1, I2 < 50%),故采用固定效应模型进行数据合并,Meta分析结果显示,PALN阳性胰腺癌患者较PALN阴性患者12组(OR=3.34, 95%CI: 2.13~5.23, P=0.001)、13组(OR=1.52, 95%CI: 1.05~2.19, P=0.025)、14组(OR=2.76, 95%CI: 1.90~4.01, P=0.001)、17组(OR=2.41, 95%CI: 1.63~3.57, P=0.001)淋巴结转移率高,差异有统计学意义(均P < 0.05),见图 4。
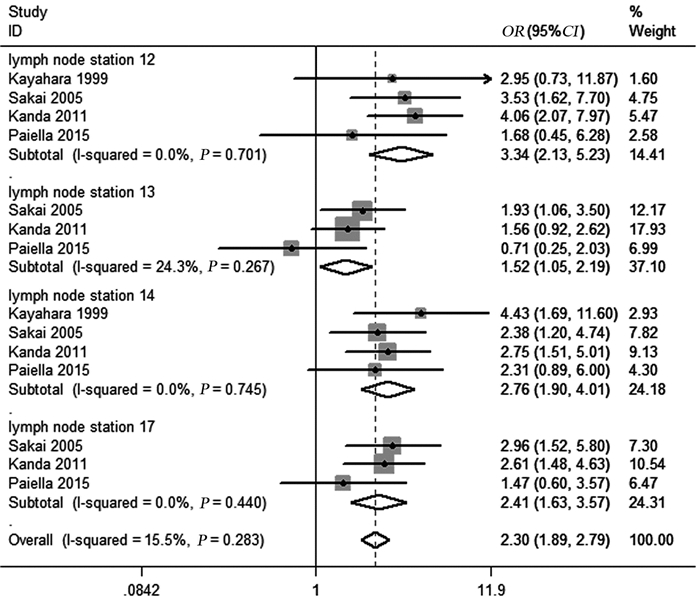
|
| 图 4 PALN阳性与PALN阴性患者淋巴结转移的比较 Figure 4 Forest plots of lymph node metastasis between PALN+ patients and PAL− patients |
纳入的研究中6项报告了胰腺癌患者T1/T2期患者数,异质性检验结果提示研究间存在统计学异质性(I2=61%, P=0.025),故采用随机效应模型进行数据合并,Meta分析结果显示PALN阳性胰腺癌患者T1/T2期所占比例低于PALN阴性患者(OR=0.31, 95%CI: 0.10~0.98, P=0.046),差异有统计学意义(P < 0.05),见图 5。
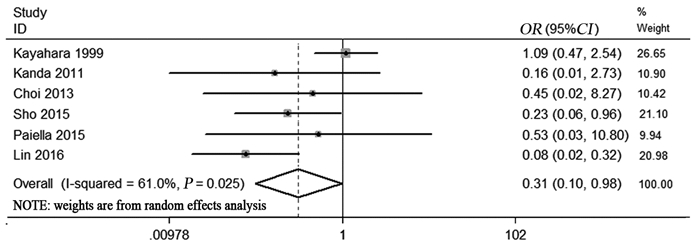
|
| 图 5 PALN阳性与PALN阴性患者T1/T2期的比较 Figure 5 Forest plots of T1/T2 stage between PALN+ patients and PALN− patients |
同样,纳入的研究中6个报告了胰腺癌患者T3/T4期患者数,异质性检验结果提示研究间异质性较小(I2=0.0%, P=0.948),故采用固定效应模型进行数据合并,Meta分析结果显示胰腺癌PALN阳性患者与阴性患者T3/T4期所在比例差异无统计学意义(OR=1.12, 95%CI: 0.91~1.37, P=0.290),见图 6。
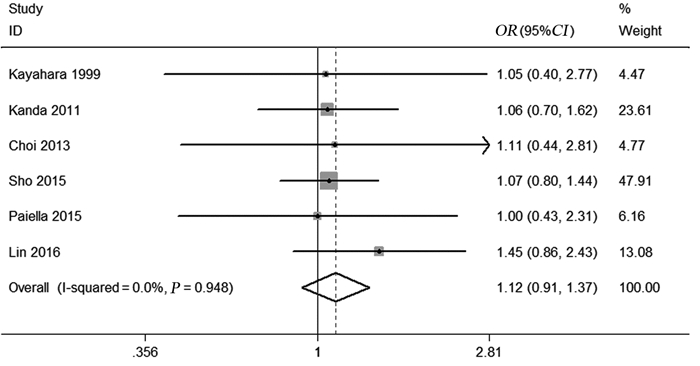
|
| 图 6 PALN阳性与PALN阴性患者T3/T4期的比较 Figure 6 Forest plots of T3/T4 stage between PALN+ patients and PALN- patients |
对纳入的研究绘制漏斗图进行发表偏倚风险评估,结果显示各个研究均向漏斗图顶部聚集,提示本研究所纳入的文献未见明显发表偏倚,见图 7。
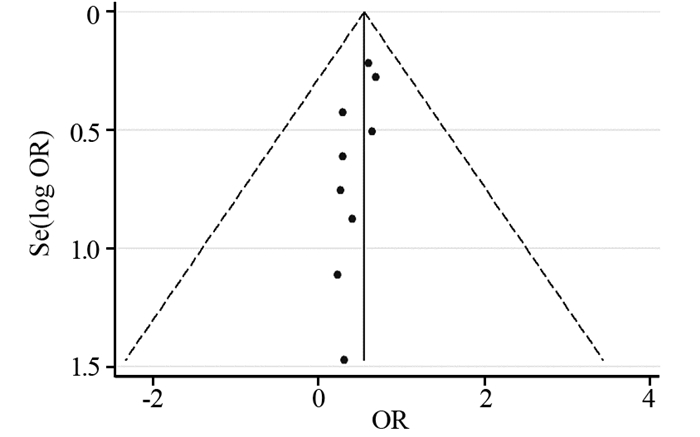
|
| 图 7 纳入研究的发表偏倚评估 Figure 7 Assessment of publication bias |
近年来,随着外科技术的不断发展,胰腺癌的手术治疗策略也在不断进步。新的手术入路的探索,吻合技术的改良,肿瘤切除及淋巴结清扫范围的更新,不仅有效的提高了手术的安全性,同时也进一步改善了胰腺癌患者术后疗效及远期生存率[24]。随着NCCN胰腺癌诊治指南的不断更新,对胰腺癌手术指征及手术方式的把握日趋规范[25]。然而,由于胰头癌极易出现腹主动脉旁(16组)淋巴结的转移,且有学者认为胰腺癌发生16组淋巴结转移时即发生了远处转移且失去了根治性手术的机会,严重影响患者的预后[26],因此对腹主动脉旁淋巴结的处理仍是目前争议的焦点。
本研究共纳入12项回顾性研究和2项前瞻性研究,涉及胰腺癌患者3 279人。Meta分析结果显示,在近期生存率及R1切除率方面,PALN阳性患者1年生存率和2年生存率均明显低于PALN阴性患者,同时提示PALN阳性可能会提高肿瘤R1切除率,增加肿瘤手术切缘阳性的可能。在其他组淋巴结转移方面,PALN阳性会增加12组、14组、17组淋巴结转移的风险,但对于13组淋巴结无明显影响。在T分期方面,PALN阳性胰腺癌患者T1/T2期所占比例低于PALN阴性患者,而T3/T4期二者差异无统计学意义(P=0.290)。Agalianos等[27]对纳入的2 467例胰腺癌的Meta分析结果提示,16组淋巴结阳性明显的降低了胰腺癌患者近期生存率(P=0.002),也增加了患者手术切缘阳性的机会(P < 0.00001),与远处淋巴结转移密切相关(P < 0.00001)。Paiella等[28]对纳入的13项(2 141例患者)研究进行了Meta分析,结果显示与PALN阴性患者相比,PALN阳性患者死亡率较高(P < 0.001),中位生存期明显降低(P < 0.01)。与本研究结果相一致,进一步证实胰腺癌患者术后PALN阳性是影响其预后的重要因素。
胰腺癌诊治指南(2014版)指出,若术前影像学检查提示腹主动脉旁、腹腔干周围及肠系膜上动脉左侧的淋巴结出现转移则可视为远处转移(M1),不建议患者行手术切除。但在术前无明确的影像学证据支持,而在术中疑有上述淋巴结转移者,应考虑行淋巴结冰冻活检,最终根据患者的综合情况选择手术策略[29]。然而,目前对于术前16组淋巴结转移的判断仍无有效的方法。Maemura等[30]认为,PET识别PALN淋巴结转移的敏感度可达50%,而CT对其基本无鉴别能力,MRI已被广泛的应用于临床,但其有效性仍需进一步验证。也有研究证实CA199水平的变化可能会成为PALN阳性诊断的有效指标[31]。如果术前不能明确判断16组淋巴结的状态,将会直接影响患者的治疗策略及预后。由于跳跃式转移和微转移的存在,胰腺癌12组、14组、17组淋巴结的转移常与16组淋巴结的转移相关,该现象存在于大多数实体瘤中,如胆管癌和结肠等[32]。术前及术后是否接受辅助治疗是影响胰腺癌患者生存率的重要因素,由于缺乏16组淋巴结阳性胰腺癌患者远期生存资料报道的文献,本研究只能从近期生存率方面进行分析。胰腺癌切除术后之所以局部复发率较高,除与手术患者选择不当外,还与手术时是否完成了胰周组织清扫及第二站淋巴结(包括胰体组、胆总管组、主动脉旁组、腹腔干组)密切相关[33]。由于胰腺癌细胞的嗜神经性,胰腺钩突部的肿瘤往往会通过神经束膜间隙向远处转移,很容易形成束膜间癌巢,因此要特别注意肠系膜上血管鞘及周围组织的清扫。同时,清扫腹主动脉旁淋巴结的重点应在腹主动脉、左肾静脉及下腔静脉构成的三角区域。
虽然本研究尽量避免实施中的各种偏倚,但仍可能具有以下局限性:(1)纳入的研究多数为回顾性研究,缺乏前瞻性、大样本、多中心的证据,建议今后临床试验设计应严格按照CONSORT声明,尽可能开展RCT研究;(2)纳入的研究中多数未明确报告患者术前是否接受辅助治疗及辅助治疗的方案,不可排除新辅助治疗对本研究结果的干扰;(3)接受何种手术方式对患者生存期的影响较大,本研究中多数患者接受了胰十二指肠切除术,仅有部分接受了全胰切除术及远端胰腺切除术,但纳入的研究中未能分别明确报告该三类患者的结局指标,未来研究需按照手术方式的不同对胰腺癌患者术后指标进行分层分析。
综上所述,胰腺癌患者行胰腺切除术后,腹主动脉旁淋巴结阳性患者近期生存率低,手术切缘阳性的风险较高,远处转移的可能较大。PALN状态与胰腺癌患者预后及临床病理特征相关。
| [1] | Garrido-Laguna I, Hidalgo M. Pancreatic cancer:from state-of-the-art treatments to promising novel therapies[J]. Nat Rev Clinl Oncol, 2015, 12(6): 319–34. DOI:10.1038/nrclinonc.2015.53 |
| [2] | DeSantis CE, Siegel RL, Sauer AG, et al. Cancer statistics for African Americans, 2016:Progress and opportunities in reducing racial disparities[J]. CA Cancer J Clin, 2016, 66(4): 290–308. DOI:10.3322/caac.v66.4 |
| [3] | Chen W. Cancer statistics:updated cancer burden in China[J]. Chin J Cancer Res, 2015, 27(1): 1. |
| [4] | Ma Q. Perineural invasion and pancreatic cancer[J]. Pancreatology, 2016, 16(1): S28. |
| [5] | Hidalgo M. Pancreatic cancer[J]. N Engl Jf Med, 2010, 362(17): 1605–17. DOI:10.1056/NEJMra0901557 |
| [6] | 杨尹默. 胰腺癌外科治疗的现状、存在问题与展望[J]. 中国普通外科杂志, 2016, 25(9): 1231–5. [ Yang YM. Surgical managements of pancreatic cancer:current status and future directions[J]. Zhongguo Pu Tong Wai Ke Za Zhi, 2016, 25(9): 1231–5. DOI:10.3978/j.issn.1005-6947.2016.09.001 ] |
| [7] | 陈博滔, 陈梅福. 交界性可切除胰腺癌的研究进展[J]. 中国普通外科杂志, 2016, 25(3): 448–55. [ Chen BT, Chen MF. Research progress of borderline resectable pancreatic cancer[J]. Zhongguo Pu Tong Wai Ke Za Zhi, 2016, 25(3): 448–55. DOI:10.3978/j.issn.1005-6947.2016.03.025 ] |
| [8] | Tol JA, Gouma DJ, Bassi C, et al. Definition of a standard lymphadenectomy in surgery for pancreatic ductal adenocarcinoma:A consensus statement by the International Study Group on Pancreatic Surgery (ISGPS)[J]. Surgery, 2014, 156(3): 591–600. DOI:10.1016/j.surg.2014.06.016 |
| [9] | Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses[J]. Eur J Epidemiol, 2010, 25(9): 603–5. DOI:10.1007/s10654-010-9491-z |
| [10] | Kayahara M, Nagakawa T, Ohta T, et al. Analysis of paraaortic lymph node involvement in pancreatic carcinoma[J]. Cancer, 1999, 85(3): 583–90. DOI:10.1002/(ISSN)1097-0142 |
| [11] | Yoshida T, Matsumoto T, Sasaki A, et al. Outcome of paraaortic node-positive pancreatic head and bile duct adenocarcinoma[J]. Am J Surg, 2004, 187(6): 736–40. DOI:10.1016/j.amjsurg.2003.07.031 |
| [12] | Sakai M, Nakao A, Kaneko T, et al. Para-aortic lymph node metastasis in carcinoma of the head of the pancreas[J]. Surgery, 2005, 137(1): 606–11. |
| [13] | Shimada K, Sakamoto Y, Sano T, et al. The role of paraaortic lymph node involvement on early recurrence and survival after macroscopic curative resection with extended lymphadenectomy for pancreatic carcinoma[J]. J Am Coll Surg, 2006, 203(3): 345–52. DOI:10.1016/j.jamcollsurg.2006.05.289 |
| [14] | Doi R, Kami K, Ito D, et al. Prognostic implication of para-aortic lymph node metastasis in resectable pancreatic cancer[J]. World J Surg, 2007, 31(1): 147–54. DOI:10.1007/s00268-005-0730-5 |
| [15] | Yamada S, Nakao A, Fujii T, et al. Pancreatic cancer with paraaortic lymph node metastasis:a contraindication for radical surgery?[J]. Pancreas, 2009, 38(1): e13–7. DOI:10.1097/MPA.0b013e3181889e2d |
| [16] | Kurosaki I, Kawachi Y, Nihei K, et al. Liver perfusion chemotherapy with 5-Fluorouracil followed by systemic gemcitabine administration for resected pancreatic cancer:preliminary results of a prospective phase 2 study[J]. Pancreas, 2009, 38(2): 161–7. DOI:10.1097/MPA.0b013e31818815f7 |
| [17] | Kanda M, Fujii T, Nagai S, et al. Pattern of lymph node metastasis spread in pancreatic cancer[J]. Pancreas, 2011, 40(6): 951–5. DOI:10.1097/MPA.0b013e3182148342 |
| [18] | Choi SH, Kim SH, Choi JJ, et al. Clinical necessity of the immunohistochemical reassessment of para-aortic lymph nodes in resected pancreatic ductal adenocarcinoma[J]. Oncol Lett, 2013, 6(5): 1189–94. |
| [19] | Schwarz L, Lupinacci RM, Svrcek M, et al. Para-aortic lymph node sampling in pancreatic head adenocarcinoma[J]. Br J Surg, 2014, 101(5): 530–8. DOI:10.1002/bjs.2014.101.issue-5 |
| [20] | Sho M, Murakami Y, Motoi F, et al. Postoperative prognosis of pancreatic cancer with para-aortic lymph node metastasis:a multicenter study on 822 patients[J]. J Gastroenterol, 2015, 50(6): 694–702. DOI:10.1007/s00535-014-1005-4 |
| [21] | Paiella S, Malleo G, Maggino L, et al. Pancreatectomy with Para-Aortic Lymph Node Dissection for Pancreatic Head Adenocarcinoma:Pattern of Nodal Metastasis Spread and Analysis of Prognostic Factors[J]. J Gastrointest Surg, 2015, 19(9): 1610–20. DOI:10.1007/s11605-015-2882-4 |
| [22] | Liu C, Yu L, Luo G, et al. Which patients with para-aortic lymph node (LN16) metastasis will truly benefit from curative pancreaticoduodenectomy for pancreatic head cancer?[J]. Oncotarget, 2016, 7(20): 29177–86. DOI:10.18632/oncotarget.v7i20 |
| [23] | Lin JY, Zhang XM, Kou JT, et al. Analysis of prognostic factors for pancreatic head cancer according to para-aortic lymph node[J]. Cancer Med, 2016, 5(10): 2701–7. DOI:10.1002/cam4.2016.5.issue-10 |
| [24] | 黄江, 白利杰, 张生军, 等. 局部切除胰体尾联合血管切除重建治疗晚期胰腺癌的疗效分析[J]. 中国普通外科杂志, 2016, 25(9): 1253–8. [ Huang J, Bai LK, Zhang SJ, et al. Efficacy analysis of local resection of the body and tail of the pancreas combined with vascular resection and reconstruction for advanced pancreatic cancer[J]. Zhongguo Pu Tong Wai Ke Za Zhi, 2016, 25(9): 1253–8. DOI:10.3978/j.issn.1005-6947.2016.09.005 ] |
| [25] | Clancy TE. Surgery for pancreatic cancer[J]. Hematol Oncol Clin North Am, 2015, 29(4): 701–16. DOI:10.1016/j.hoc.2015.04.001 |
| [26] | Gall TM, Tsakok M, Wasan H, et al. Pancreatic cancer:current management and treatment strategies[J]. Postgrad Med J, 2015, 91(1080): 601–7. DOI:10.1136/postgradmedj-2014-133222 |
| [27] | Agalianos C, Gouvas N, Papaparaskeva K, et al. Positive para-aortic lymph nodes following pancreatectomy for pancreatic cancer. Systematic review and meta-analysis of impact on short term survival and association with clinicopathologic features[J]. HPB (Oxford), 2016, 18(8): 633–41. DOI:10.1016/j.hpb.2016.04.007 |
| [28] | Paiella S, Sandini M, Gianotti L, et al. The prognostic impact of para-aortic lymph node metastasis in pancreatic cancer:A systematic review and meta-analysis[J]. Eur J Surg Oncol, 2016, 42(5): 616–24. DOI:10.1016/j.ejso.2016.02.003 |
| [29] | Sohal DP, Mangu PB, Laheru D. Metastatic pancreatic cancer:American society of clinical oncology clinical practice guideline summary[J]. J Oncol Pract, 2017, 13(4): 261–4. DOI:10.1200/JOP.2016.017368 |
| [30] | Maemura K, Takao S, Shinchi H, et al. Role of positron emission tomography in decisions on treatment strategies for pancreatic cancer[J]. J Hepatobiliary Pancreatic Sury, 2006, 13(5): 435–41. DOI:10.1007/s00534-006-1102-8 |
| [31] | Gaedcke J, Gunawan B, Grade M, et al. The mesopancreas is the primary site for R1 resection in pancreatic head cancer:relevance for clinical trials[J]. Langenbeck Arch Surg, 2010, 395(4): 451–8. DOI:10.1007/s00423-009-0494-8 |
| [32] | Rahbari NN, Bork U, Motschall E, et al. Molecular detection of tumor cells in regional lymph nodes is associated with disease recurrence and poor survival in node-negative colorectal cancer:a systematic review and meta-analysis[J]. J Clinl Oncol, 2012, 30(1): 60–70. DOI:10.1200/JCO.2011.36.9504 |
| [33] | Strobel O, Hank T, Hinz U, et al. Pancreatic cancer surgery:the new r-status counts[J]. Ann Surg, 2017, 265(3): 565–73. DOI:10.1097/SLA.0000000000001731 |
 2017, Vol. 44
2017, Vol. 44


