文章信息
- CD20+多发性骨髓瘤的临床特点和治疗研究
- Clinical Characteristics and Treatment of Multiple Myeloma with Positive Expression of CD20
- 肿瘤防治研究, 2017, 44(1): 34-37
- Cancer Research on Prevention and Treatment, 2017, 44(1): 34-37
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.01.007
- 收稿日期: 2016-04-15
- 修回日期: 2016-09-05
多发性骨髓瘤(multiple myeloma, MM)是浆细胞异常克隆增生产生的肿瘤,肿瘤细胞起源于骨髓中的浆细胞,而浆细胞是B淋巴细胞发育到最终功能阶段的细胞。B细胞阶段细胞多数表达CD20,而多数浆细胞表达CD38、CD138, 不表达CD20;但临床上也发现有一小部分患者浆细胞CD20阳性,那么这群患者与CD20阴性的患者有何不同,是否是一个独立的存在,在治疗上的选择能否应用抗CD20治疗等问题均值得进一步探讨,现回顾性分析北京大学第三医院确诊的CD20+多发性骨髓瘤患者,以期对临床工作有一定的帮助。
1 资料与方法 1.1 资料来源2012年1月1日至2014年12月31日在本院通过骨髓检查、免疫球蛋白及影像学检查等共确诊多发性骨髓瘤患者143例,其中CD20表达阳性者12例。
1.2 临床诊断根据临床表现、实验检查、骨髓穿刺及病理报告(全部患者的病理报告均由病理科医师复诊后确诊)作出诊断;诊断标准详见WHO诊断及疗效标准[1]。
1.3 骨髓细胞形态学检查及骨髓活检12例患者全部进行骨髓穿刺及骨髓活检。骨髓细胞形态学检查采用瑞氏吉姆萨染色;活检标本常规HE染色及免疫组织化学检查,免疫组织化学采用链菌素生物素-过氧化物酶标记物(Strep-tavidin-biotin complex, SABC)法进行免疫分型。
1.4 流式细胞术检测CD20及其他抗原每例患者骨髓标本共检测3管,每管中加入100 μl肝素抗凝标本及直标抗体,采用四色荧光抗体组合:FITC/PE/PerCP5.5/APC,抗体组合分别为CD38/CD56/CD45/CD138,CD20/CD19/CD45/CD38,胞质Kappa/胞质Lambda/CD45/CD138以及同型对照,振荡混匀后室温避光孵育20 min,溶血、洗涤、上机检测。所有抗体均购自美国Becton Dickinson公司,用FACSCalibur型流式细胞仪(美国Becton Dickinson公司)以及CellQuest软件获取并分析50 000个白细胞,通过CD45/侧向角散射光强度(SSC)和CD38/SSC联合设门识别浆细胞,并分析计算该群细胞中各抗原的阳性率和表达强度,抗原阳性率≥20%为阳性。检测结果以平均荧光强度(mean fluorescence intensity, MFI)相对于同型对照 < 1个log为阴性(negative),MFI在1~2个log为2+(dim),MFI≥2个log为3+(bright)。
1.5 实验室检查所有患者均进行了血常规、免疫球蛋白定量、免疫固定电泳以及血、尿κ、λ轻链等检查。
1.6 影像学检查患者在治疗前均进行全身骨扫描、头颅X片、CT等影像学检查。
1.7 治疗(1)伴明显高黏滞血症者,行血浆置换术,每次清除20~30 ml/kg,每2~3天1次(2~6次为1疗程);(2)根据患者的一般情况及治疗意愿选择不同化疗方案,包括:硼替佐米、表阿霉素、地塞米松(PAD);硼替佐米、环磷酰胺、地塞米松(PCD);沙利度胺,地塞米松(TD)。
1.8 疗效评价参考NCCN指南,疗效分为完全缓解(CR)、部分缓解(PR)、病情稳定(SD)、疾病进展(PD)。
1.9 统计学方法采用SPSS21统计软件进行统计分析,预后影响因素的单因素分析采用Kaplan-Meier检验,并绘制生存曲线,P < 0.05为差异有统计学意义。
2 结果 2.1 临床资料143例MM患者中CD20+12例,占所有MM患者的8.4%。12例患者中男8例、女4例,平均发病年龄为57.4岁,中位年龄55.5(40~81)岁。
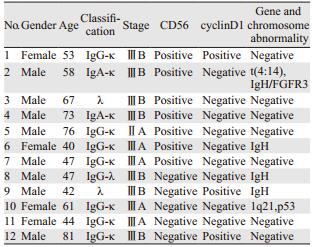
2.2 临床特点12例患者中IgG-κ型7例,IgG-λ1例,IgA-κ 2例,λ轻链型2例。分期:ⅡA1例,ⅢA4例,ⅢB7例,见表 1。
|
12例患者骨髓细胞形态学检查均发现15%以上的浆细胞。
2.4 实验室检查 2.4.1 血常规12例患者均有贫血,血Hb 68~115 g/L,平均85 g/L。
2.4.2 遗传学检查荧光原位杂交(FISH)结果显示:t(4;14)、IgH/FGFR3;1q21、p53,各1例;基因学检测显示IgH重排3例,见表 1。
2.4.3 流式细胞学检查12例患者中CD56阳性者7例;cyclinD1阳性者3例;在CD20的表达强度上,仅有CD20dim表达的4例,仅有CD20bright表达的2例;6例同时存在CD20dim和CD20bright的表达,其中4例CD20dim的比例高于CD20bright的比例,见表 2。

|
12例均进行了化疗,方案为PAD,PCD,TD。其中3例进行了自体外周血造血干细胞移植。
2.5.2 疗效12例患者中,25%(3/12例)获得CR并进行了自体外周血造血干细胞移植,目前仍持续CR中;PR4例,SD1例,PD4例。
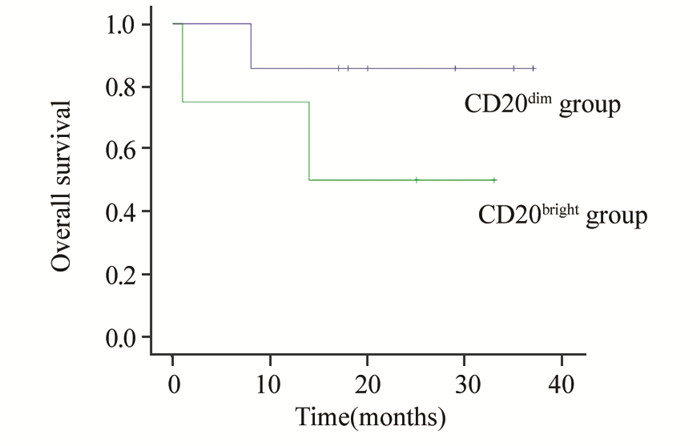
CD20dim共8例,包括仅有CD20dim表达的4例和4例同时存在CD20bright和CD20dim的表达且CD20dim的比例高者;CD20bright共4例患者,包括2例仅有CD20bright及2例同时存在CD20bright和CD20dim的表达但CD20bright比例高者。CD20dim与CD20bright组生存差异无统计学意义(P=0.218),见图 1。
|
| 图 1 CD20dim与CD20bright多发性骨髓瘤患者的生存时间 Figure 1 The survival time in CD20dim and CD20bright patients of MM |
多发性骨髓瘤是一种恶性浆细胞病,其肿瘤细胞起源于骨髓中的浆细胞,而浆细胞是B淋巴细胞发育到最终功能阶段的细胞。多发性骨髓瘤异质性很高,存在多种染色体异常[2-3]。典型的异常浆细胞在流式细胞仪上的特点是CD45/SSC值较有核红细胞大;CD45阴性或弱阳性;CD38强阳性;CD19、20均为阴性;多数CD56阳性;少数胞质k(ck)或胞质λ(cλ)阳性[4]。但近来有部分文献报道MM患者中的浆细胞可能会表达CD20,不同的文献报道的发生率不同,在13%~22%之间[5]。本研究中共有12例患者表达CD20,约占同期全部MM患者的8.4%,较国外的报道稍低。在CD20的表达强度上,文献报道CD20的表达相对较弱[6-7],本组患者中,细胞表面弱表达CD20的占8例,细胞表面CD20强表达4例;CD20强弱表达情况的不同与MM患者的临床特点及预后等的关系值得进一步探讨。
先前的研究指出[8],骨髓瘤患者CD20的表达与较低的生存率有关,预后较差。部分研究也支持这一观点,如Yokote等[9]报告1例CD20+多发性骨髓瘤发生了肺实质浸润,预后很差。然而最近的研究显示CD20+和易位t(11; 14)相关;而t(11; 14)是预后较好的标记。Matsuda等研究了138例CD20表达的MM患者[10],发现CD20的表达与淋巴细胞样的浆细胞形态有关;同时CD20表达与t(11; 14)易位之间有相关性,约15%的患者(7例)CD20阳性伴有t(11; 14)易位。Robillard等[11]研究也有类似发现,在83%的CD20+MM患者(10/12)中可发现t(11;14)、cyclin D1等表达。
CD20是一个特别的靶点,在几乎所有的B细胞表面表达,无明显的脱落、分泌或内化。在各种B淋巴细胞增殖性疾病中选择抗CD20的治疗均有一定的疗效,但在多发性骨髓瘤治疗中的作用存在着一些争议。有两个临床试验对MM患者的Ⅱ期对利妥昔单抗的效果进行了研究,第一个临床试验中发现1/19患者经过第一次治疗后局部反应,第二个临床试验中的患者对利妥昔单抗治疗均无反应。但这两个临床试验存在的问题是没有依据患者浆细胞表面CD20的表达水平选择相应的治疗[12-13]。还有可能的原因是骨髓瘤细胞表面CD20的表达是异构的,并且只能在13%~22%的患者中检测到,且表达水平不同。有研究者[14]认为MM祖细胞表达CD20,故而抗CD20治疗应该是非常有希望的一个选择。由于MM的异质性很强,在CD20阳性的患者人群中,有cyclin D1+和cyclin D2+的不同表达,cyclin D2+亚组显示疾病更具有侵袭性,预后更差,被认为在多种治疗无效时可以选择抗CD20治疗,因此有越来越多的研究在确定抗CD20治疗多发性骨髓瘤的效果[15-19]。有临床试验发现10%的CD20+多发性骨髓瘤患者应用利妥昔单抗治疗后可获得部分缓解。另外一项研究发现50%~57%的CD20+患者应用利妥昔单抗后可获得10月左右的疾病稳定期。该治疗耐受性良好,除了短暂的恶心,只有发热和寒战等不良反应。先应用利妥昔单抗治疗4疗程,随后每隔一月一次维持治疗。治疗后经骨髓流式细胞术检测发现浆细胞克隆CD20表达明显减少。因此临床医生在给患者选择初始治疗时,高CD20的表达是一个重要的考虑因素,但也需要进行进一步大规模的临床试验来证明治疗的效果。
MM是一组异质性很强的疾病,有部分患者预后较差,如果患者有CD20的表达,多种治疗效果不佳时抗CD20治疗也可以是一种新的治疗选择。
| [1] | Swerdlow SH, Campo E, Harris HL, et al. WHO classification of tumours of haematopoietic and lymphoid tissues[M]. Fourth Edition. Lyon: IARC Press, 2008 : 202 -8. |
| [2] | Bolli N, Avet-Loiseau H, Wedge DC, et al. Heterogeneity of genomic evolution and mutational profiles in multiple myeloma[J]. Nat Commun, 2014, 5 : 2997. |
| [3] | Lohr JG, Stojanov P, Carter SL, et al. Widespread genetic heterogeneity in multiple myeloma: implications for targeted therapy[J]. Cancer Cell, 2014, 25 (1) : 91–101. DOI:10.1016/j.ccr.2013.12.015 |
| [4] | Wang J, Jing HM, Li M, et al. Clinical analysis and treatment of 14 multiple myeloma patients with extramedullary plasmacytoma[J]. Zhongguo Zhong Liu Lin Chuang, 2014, 41 (10) : 639–42. [ 王晶, 景红梅, 李敏, 等. 14例髓外浆细胞瘤患者的临床特征分析及治疗[J]. 中国肿瘤临床, 2014, 41 (10) : 639–42. ] |
| [5] | Kapoor P, Greipp PT, Morice WG, et al. Anti-CD20 monoclonal antibody therapy in multiple myeloma[J]. Br J Haematol, 2008, 141 (2) : 135–48. DOI:10.1111/j.1365-2141.2008.07024.x |
| [6] | Katopodis O, Liossis SN, Viglis V, et al. Expansion of CD8+ T cells that express low levels of the B cell-specific molecule CD20 in patients with multiple myeloma[J]. Br J Haematol, 2003, 120 (3) : 478–81. DOI:10.1046/j.1365-2141.2003.04087.x |
| [7] | Yavasoglu I, Sargin G, Kadikoylu G, et al. Immunohistochemical evaluation of CD20 expression in patients with multiple myeloma[J]. Rev Bras Hematol Hemoter, 2015, 37 (1) : 34–7. DOI:10.1016/j.bjhh.2014.11.013 |
| [8] | Ruiz-Argüelles GJ, San Miguel JF. Cell surface markers in multiple myeloma[J]. Mayo Clin Proc, 1994, 69 (7) : 684–90. DOI:10.1016/S0025-6196(12)61350-0 |
| [9] | Yokote T, Akioka T, Miyamoto H, et al. Pulmonary parenchymal infiltrates in a patient with CD20-positive multiple myeloma[J]. Eur J Haematol, 2005, 74 (1) : 61–5. DOI:10.1111/ejh.2005.74.issue-1 |
| [10] | Matsuda I, Mori Y, Nakagawa Y, et al. Close correlations between CD20 expression, a small mature plasma cell morphology and t (11;14) in multiple myeloma[J]. Rinsho Ketsueki, 2005, 46 (12) : 1293–7. |
| [11] | Robillard N, Avet-Loiseau H, Garand R, et al. CD20 is associated with a small mature plasma cell morphology and t (11;14) in multiple myeloma[J]. Blood, 2003, 102 (3) : 1070–1. DOI:10.1182/blood-2002-11-3333 |
| [12] | Treon SP, Pilarski LM, Belch AR, et al. CD20-directed serotherapy in patients with multiple myeloma: biologic considerations and therapeutic applications[J]. J Immunother, 2002, 25 (1) : 72–81. DOI:10.1097/00002371-200201000-00008 |
| [13] | Niklas Z, Kirchbacher K, Vesely M, et al. Rituximab treatment provides no clinical benefit in patients with pretreated advanced multiple myeloma[J]. Leuk Lymphoma, 2006, 47 (6) : 1103–9. DOI:10.1080/10428190600564803 |
| [14] | Matsui W, Wang Q, Barber JP, et al. Clonogenic multiple myeloma progenitors, stem cell properties, and drug resistance[J]. Cancer Res, 2008, 68 (1) : 190–7. DOI:10.1158/0008-5472.CAN-07-3096 |
| [15] | Moreau P, Voillat L, Benboukher L, et al. Rituximab in CD20 positive multiple myeloma[J]. Leukemia, 2007, 21 (4) : 835–6. |
| [16] | Greipp PT, Kapoor P, Morice WG, et al. Reply to 'Rituximab in CD20 positive multiple myeloma' by P Moreau et al[J]. Leukemia, 2008, 22 (1) : 214–5. DOI:10.1038/sj.leu.2404972 |
| [17] | Bergua JM, Cabrera C, Arteta EG, et al. Rituximab in CD20 positive multiple myeloma[J]. Leukemia, 2008, 22 (5) : 1082–3. DOI:10.1038/sj.leu.2405010 |
| [18] | Gozzetti A, Fabbri A, Lazzi S, et al. Reply to 'Rituximab activity in CD20-positive multiple myeloma'[J]. Leukemia, 2008, 22(5): 1083; author reply 1083-4. |
| [19] | Shiratori S, Kondo T, Kubota K, et al. Loss of CD20 expression following rituximab-combined chemotherapy in CD20-positive and CyclinD1-positive multiple myeloma[J]. Rinsho Ketsueki, 2008, 49 (11) : 1536–40. |
 2017, Vol. 44
2017, Vol. 44


