文章信息
- 局部晚期鼻咽癌颅底骨质破坏与骨转移的相关性
- Correlation Between Skull Base Invasion and Bone Metastases in Locally Advanced Nasopharyngeal Carcinoma Patients
- 肿瘤防治研究, 2016, 43(10): 854-857
- Cancer Research on Prevention and Treatment, 2016, 43(10): 854-857
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.10.006
- 收稿日期: 2015-12-14
- 修回日期: 2016-05-11
鼻咽癌是中国南部发生率较高的头颈部肿瘤,就诊时70%的患者属于局部晚期鼻咽癌[1]。随着IMRT技术在鼻咽癌中的应用,局部晚期鼻咽癌的局部控制率明显提高,尽管给予同期放化疗,但远处转移的发生率仍然较高,骨转移是最常见的转移部位[2]。在局部晚期鼻咽癌中,由于鼻咽与颅底紧密相邻的解剖位置,导致鼻咽癌颅底骨质破坏发生率高,文献报道25%~63%鼻咽癌出现颅底骨质破坏[3-5]。颅底骨质破坏导致骨质的完整性破坏,特别斜坡、岩尖及颈椎受侵肿瘤容易进入椎静脉系统,而椎静脉系统无静脉瓣的特殊解剖结构,可能有利于肿瘤的骨转移。本研究对518例局部晚期鼻咽癌进行回顾性分析,探讨颅底破坏与鼻咽癌患者骨转移的相关性。
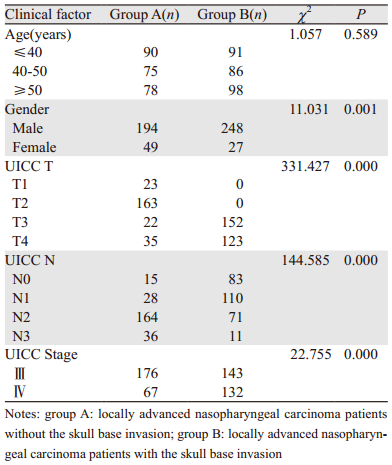
1 资料与方法 1.1 一般资料2008年1月1日至2010年3月31日广州市番禺区中心医院初治的Ⅲ期、ⅣA期、ⅣB期(UICC 2002版分期标准)局部晚期鼻咽癌患者518例纳入临床研究。入组病例中,男女比为5.8:1,年龄17~75岁,中位年龄45岁。所有病例均经病理组织学确诊为鼻咽未分化型非角化型癌(WHOⅢ型),按是否有颅底骨质破坏分为A、B两组。A组(无颅底骨质破坏)243例,中位年龄46岁;B组(有颅底骨质破坏)275例,中位年龄45岁。临床分期采用UICC 2002分期标准,所有病例治疗前经鼻咽部MRI检查,分期检查还包括病史、体格检查、血液生化、胸片/胸部CT、腹部B型超声/CT等检查。518例入组患者中61例经治疗后发生骨转移(其诊断主要根据全身骨显像与CT或核磁共振联合确诊)。61例中有35例发生椎体转移,多为颈、胸、腰椎多部位转移,11例合并椎体及其他骨转移(肋骨、骨盆、股骨、锁骨、顶骨),15例发生除椎体外其他骨转移。61例患者中有40例发生单一骨转移;21例发生骨转移联合脏器转移,其中联合肝转移10例、联合肺转移9例、联合其他脏器转移2例。两组患者临床资料比较显示B组患者的男性、UICC T3~4、UICC Ⅳ所占的比例多于A组,但A组UICC N2~3的比例多于B组,两组比较差异有统计学意义(P < 0.05),见表 1。
|
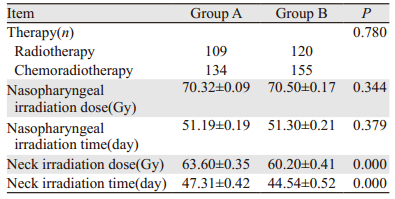
两组患者的放射治疗及联合化疗情况见表 2。两组患者的治疗模式、鼻咽照射剂量及照射时间差异无统计学意义,但A组的颈部照射剂量高于B组,颈部照射时间长于B组(P < 0.05)。
|
截止观察日期为2015年6月31日。518例3年后失访6例,4年后失访3例,5年后失访5例,随访率为97.3%。随访时间7.3~93.5月,中位随访时间60.3月。A组中位随访时间63.8月;B组中位随访时间62月。两组随访时间经t检验差异无统计学意义(P > 0.05)。
1.4 统计学方法应用SPSS 20.0软件进行统计分析。临床各因素对骨转移发生的影响采用Cox多因素回归分析,组间计数资料比较采用χ2检验,组间及组内计量资料比较采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 两组患者骨转移事件518例中骨转移发生率为11.8%(61/518),其中A组16例(6.6%),首次出现骨转移事件的中位时间14.0月;B组45例(16.4%),首次出现骨转移事件的中位时间19.1月。两组骨转移发生率比较差异有统计学意义(χ2=11.875, P=0.001)。
2.2 B组患者骨转移事件B组275例,按初治颅底骨质破坏情况分为单一部位破坏(1个颅底骨质破坏)、联合部位破坏(2个及以上颅底骨质破坏)。两种颅底骨质破坏患者的骨转移发生率比较差异无统计学意义,见表 3。

|
61例骨转移患者按是否合并其他脏器转移分为单一骨转移及联合转移。B组中45例骨转移患者中单一骨转移的发生率明显高于A组16例骨转移患者(P < 0.05),见表 4。
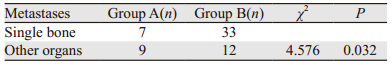
|
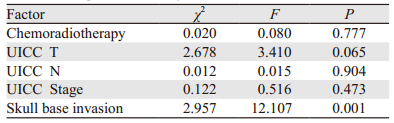
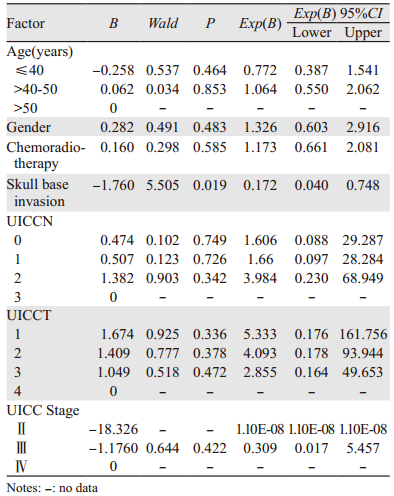
单因素及多因素分析显示颅底骨质破坏是影响骨转移的不良预后因素,见表 5~6。
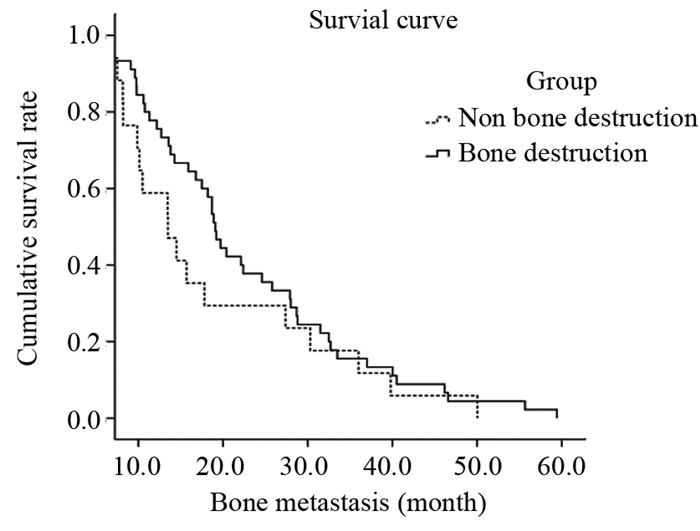
61例发生骨转移患者中,A、B两组出现首次骨转移事件的中位时间分别为14.0月、19.1月,组间比较差异无统计学意义(P > 0.05),见图 1。
|
| 图 1 两组患者无骨转移生存时间 Figure 1 Survival time of two groups of patients without bone metastases |
鼻咽由于特殊的解剖结构与颅底骨质密切相连,导致鼻咽癌引起颅底骨质破坏的发生率高。Wang等报道50%以上的鼻咽癌患者出现颅底骨质破坏[3]。本文518例患者中有275例(53.1%)出现颅底骨质破坏,与文献报道一致。颅底骨质破坏是鼻咽癌的不良预后因素。Li等[5]对838例颅底骨质破坏患者按风险进行分析显示:低风险颅底骨质破坏患者的治疗后生活质量、总生存率及无远处转移发生率明显优于高风险颅底骨质破坏患者。但笔者对患者的转移灶并没有进行分层比较,无法判断颅底骨质破坏与各脏器转移特别是骨转移的关系。本研究结果显示颅底骨质破坏患者的骨转移发生率明显高于无颅底骨质破坏者(16.4% vs. 6.6%,P < 0.05);在61例发生骨转移者中,B组单一骨转移发生率明显高于A组(73.3% vs. 43.8%,P < 0.05)。颅底骨质破坏会导致鼻咽癌患者较高的骨转移发生率,究其原因,可能有以下因素:(1)颅底骨质破坏属于T3病变,本身就是远处转移高发的不良预后因素,Li等[5]报道已证实颅底骨质受侵其远处转移发生率高;本研究中的单因素及多因素也显示颅底骨质破坏是局部鼻咽癌骨转移的不良预后因素;同时在远处转移中,以骨转移最常见,Li等[6]报道576例患者中,91例发生转移,其中骨转移51例(56.1%)。(2)颅底骨质邻近脑桥、延髓通路,一旦骨质的完整受损,肿瘤细胞容易进入脑脊髓腔通路,从而导致椎体转移。(3)颅底骨质破坏导致邻近的椎静脉受损,肿瘤细胞进入椎静脉,而椎静脉系统无相应的静脉瓣,从而易发生骨转移。
颅底骨质破坏的范围及部位不同,患者的局部控制及远处转移率不同,Han等[7]根据颅底骨质侵犯范围分为前颅底骨质受侵、中颅底骨质受侵、后颅底骨质受侵,认为后颅底骨质受侵患者的预后差,应归为T4分期。Li等[5]也报道后颅底骨质受侵患者远处转移发生高。本研究没有按颅底侵犯范围进行分层分析,仅根据侵犯部位的多少进行骨质破坏亚分析,得出联合部位骨质破坏组与单一部位骨质破坏组的骨转移发生率无差别,可能是不合理的分层分析导致试验结果偏倚。本研究A、B两组骨转移患者的无骨转移中位生存时间分别为14.0月、19.1月(P > 0.05),与文献报道相一致(14.4月)[6]。A组没有出现期望优于B组结果的原因可能影响无远处转移生存的因素除了颅底骨质破坏因素,还与其他T分期、N分期等有关。
本结果显示颅底骨质破坏与局部晚期骨转移密切相关,而临床是否对颅底骨质破坏患者及早进行干预可预防或减少骨转移发生率、延迟骨转移发生时间?唑来膦酸在早期乳腺癌、前列腺癌的辅助治疗中已得到证实能有效降低乳腺癌、前列腺癌的远处转移发生率,尤其骨转移发生率及骨转移事件发生率[8-10]。其减少骨转移发生的主要机制是抑制破骨细胞生长,诱导细胞生长、分化、成熟,更重要的是改善骨微环境,从而抑制肿瘤细胞生长[11]。有临床研究表明唑来膦酸联合化疗能减少鼻咽癌骨转移患者的骨转移事件发生率、提高总生存率及无疾病进展生存率[12]。本试验表明颅底骨质破坏的鼻咽癌患者具有高风险的骨转移发生率。对颅底骨质破坏的鼻咽癌患者,唑来膦酸联合放化疗是否获得如乳腺癌、前列腺癌相同的疗效,即减少骨转移发生率,提高总体生存率,预防骨转移事件的发生?本研究结果显示局部晚期鼻咽癌患者颅底骨质破坏与放疗后骨转移发生关系密切,但是两组患者的总体生存率差异无统计学意义,影响患者总生存的因素较多,包括T、N分期、其他脏器转移及患者的综合治疗情况。而本研究的关注重点是找出鼻咽癌骨转移的高危风险因素,如颅底骨质破坏是其高危因素之一,临床期望通过静滴唑来膦酸来消除颅底骨质破坏这个高风险骨转移因素,从而减少鼻咽癌骨转移的发生率。这也是该试验今后的研究方向。
| [1] | Zhang L, Zhao C, Ghimire B, et al. The role of concurrent chemoradiotherapy in the treatment of locoregionally advanced nasopharyngeal carcinoma among endemic population:a meta-analysis of the phase Ⅲ randomized trials[J]. BMC Cancer, 2010, 10 : 558. DOI:10.1186/1471-2407-10-558 |
| [2] | Pan CC, Lu J, Chen P, et al. Evaluation of the prognostic significance of refinement and stratification of distant metastasis status in 1016 cases of nasopharyngeal carcinoma[J]. Zhonghua Zhong Liu Za Zhi, 2013, 35 (8) : 595–9. [ 潘长穿, 卢进, 陈萍, 等. 1 016例鼻咽癌远处转移患者的转移分层细化及其临床意义[J]. 中华肿瘤杂志, 2013, 35 (8) : 595–9. ] |
| [3] | Wang R, Mao M. MRI findings of NPC invasion in skull base[J]. Chin Med Image Tech, 2001, 17 : 428–9. |
| [4] | Roh JL, Sung MW, Kim KH, et al. Nasopharyngeal carcinoma with skull baseinvasion: a necessity of staging subdivision[J]. Amer J Otolaryngol, 2004, 25 (1) : 26–32. DOI:10.1016/j.amjoto.2003.09.011 |
| [5] | Li YZ, Cai PQ, Xie CM, et al. Nasopharyngeal cancer: impact of skull base invasion on patients prognosis and its potential implications on TNM staging[J]. Eur J Radiol, 2013, 82 (3) : e107–11. DOI:10.1016/j.ejrad.2012.10.016 |
| [6] | Li AC, Xiao WW, Shen GZ, et al. Distant metastasis risk and patterns of nasopharyngeal carcinoma in the era of IMRT: long-term results and benefits of chemotherapy[J]. Oncotarget, 2015, 27 (6) : 24511–21. |
| [7] | Han J, Zhang QH, Kong F, et al. The incidence of invasion and metastasis of nasopharyngeal carcinoma at different anatomic sites in the skull base[J]. Anat Rec (Hoboken), 2012, 295 (8) : 1252–9. DOI:10.1002/ar.v295.8 |
| [8] | Gnant M, Mlineritsch B, Schippinger W, et al. Endocrine therapy plus zoledronic acid in premenopausal breast cancer[J]. N Engl J Med, 2009, 360 (7) : 679–91. DOI:10.1056/NEJMoa0806285 |
| [9] | Bundred NJ, Campbell ID, Davidson N, et al. Effective inhibition of aromatase inhibitor-associated bone loss by zoledronic acid in postmenopausal women with early breast cancer receiving adjuvant letrozole: ZO-FAST Study results[J]. Cancer, 2008, 112 (5) : 1001–10. DOI:10.1002/(ISSN)1097-0142 |
| [10] | Dearnaley DP, Mason MD, Parmar MK, et al. Adjuvant therapy with oral sodium clodronate in locally advanced and metastatic prostate cancer: long-term overall survival results from the MRC PR04 and PR05 randomised controlled trials[J]. Lancet Oncol, 2009, 10 (9) : 872–6. DOI:10.1016/S1470-2045(09)70201-3 |
| [11] | Neville-Webbe HL, Coleman RE. Bisphosphonates and RANK ligand inhibitors for the treatment and prevention of metastatic bone disease[J]. Eur J Cancer, 2010, 46 (7) : 1211–22. DOI:10.1016/j.ejca.2010.02.041 |
| [12] | Jin Y, An X, Cai YC, et al. Zoledronic acid combined with chemotherapy bring survival benefits to patients with bone metastases from nasopharyngeal carcinoma[J]. J Cancer Res Clinl Oncol, 2011, 137 (10) : 1545–51. DOI:10.1007/s00432-011-1027-8 |
 2016, Vol. 43
2016, Vol. 43