文章信息
- 甜菜红素恢复HeLa、HepG2和A549细胞线粒体形态完整和促进细胞核坏死的作用
- Betanin Induces Nuclear Necrosis and Mitochondria Intact of HeLa, HepG2 and A549 Cells
- 肿瘤防治研究, 2016, 43(10): 835-841
- Cancer Research on Prevention and Treatment, 2016, 43(10): 835-841
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.10.003
- 收稿日期: 2015-11-16
- 修回日期: 2016-01-29
2. 830052 乌鲁木齐,新疆农业大学食品科学与药学学院;
3. 830052 乌鲁木齐,新疆农业大学动物科学学院
2. College of Food Science and Pharmacology of Xinjiang Agricultural University, Urumchi 830052, China;
3. College of Animal Science of Xinjiang Agricultural University, Urumchi 830052, China Corresponding Author: LUO Qiujiang, E-mail: qjl@xjau.edu.cn
甜菜红素是一类抗氧化剂色素[1],具有抗疲劳[2]、抗辐射[3-4]、治疗胃炎[5]、增强免疫力[6]和补血[7]的作用。同时,该物质也可抑制小鼠皮肤内肿瘤[8],以及拮抗大鼠食管癌的发生[9],通过诱导实验性肺癌小鼠肿瘤细胞凋亡和抑制血管发生,从而抑制肿瘤的生长[10],导致骨髓白血病细胞株K562凋亡[11]。雒秋江等[12]在甜菜红素抑制HeLa细胞增殖的研究中,证实甜菜红素具有抑制肿瘤生长的作用,且抗肿瘤的效率与甜菜红素浓度呈正相关。
线粒体是真核细胞内一种重要的细胞器,其结构和功能异常与肿瘤发生发展密切相关。国外学者Otto warbugr最早提出线粒体呼吸链的缺陷可导致细胞去分化,并因此发生致瘤性转化[13]。线粒体比表面是指其表面积与体积之比。假设线粒体表面积不变,体积增大则比表面减小可说明线粒体发生肿胀。线粒体的周长、截表面积增大,表明线粒体体积增大。面数密度增大,表明线粒体数量增多[14]。为了研究甜菜红素对肿瘤细胞超微结构的影响,探讨甜菜红素抑制肿瘤的机制,本试验通过将低浓度62.5 ppm和高浓度500 ppm两种剂量的甜菜红素,作用于人宫颈癌HeLa细胞系、人肝癌HepG2细胞系和人肺腺癌A549细胞系。在透射电子显微镜下观察HeLa细胞、HepG2细胞和A549细胞的线粒体数量、形态、截表面积、以及所产生的特有细胞病变结构特征,以了解甜菜红素对肿瘤细胞的作用机制。
1 材料与方法 1.1 试剂与仪器甜菜红素由实验室自行制备[15]。HeLa、HepG-2和A549细胞分别购自中国武汉典型培养物保藏中心(CCTCC)。胎牛血清、DMEM培养液购自美国Hyclone公司。戊二醛、锇酸、812树脂包埋剂购自上海达昱公司。无水乙醇、丙酮、柠檬酸铅、醋酸铀、细胞培养板购自北京鼎国生物公司。
仪器:Shellab型医用二氧化碳培养箱(美国希尔顿公司)、SW-CJ-2FD型双人单面净化工作台(中国苏州净化设备有限公司)、AE-31数码倒置显微镜(中国厦门麦克奥迪公司)、超薄切片机(德国徕卡公司)、H-600型透射电子显微镜(日本日立公司)等。
1.2 实验设计与细胞培养参照雒秋江等药物细胞感作方法[15],在6孔培养板中用含10%胎牛血清DMEM培养液分别培养HeLa、HepG2和A549细胞,培养液体积10 ml,培养细胞初始密度为7.4×104个每毫升。培养2 h细胞贴壁后分别加入终浓度为0 ppm、低浓度62.5 ppm和高浓度500 ppm的甜菜红素,培养36 h后收获细胞。
收获的细胞经离心固定后,用8 000~30 000倍电子显微镜定性或定量观察细胞核、线粒体等变化。
1.3 培养细胞样品的处理与透射电镜观察细胞培养36 h后弃培养液,PBS洗涤2遍,刮取收集细胞于1.5 ml离心管中,1 000 r/min离心10 min,弃上清液。加入1 ml 2.5%的戊二醛固定液固定24 h。细胞固定后,弃固定液加入1 ml 0.1 mol/L磷酸盐缓冲液(pH7.2),每次15 min冲洗浸泡1次,连续冲洗5次。1%锇酸固定细胞1.5 h,0.1 mol/L磷酸盐缓冲液冲洗5次。依次用30%、50%、70%、80%、90%、100%浓度乙醇逐级脱水,无水乙醇/丙酮(1:1)、无水乙醇/丙酮(1:4)、纯丙酮进行置换,EPon812包埋剂/丙酮(1:1)、EPon812包埋剂/丙酮(4:1)、纯EPon812包埋剂对细胞进行渗透,EPon812包埋剂对细胞进行包埋,分别在37℃、42℃、60℃温度下聚合72 h,100 nm厚度切片,并用铜网捞取切片,进行醋酸铀和柠檬酸铅双重染色,电镜观察。
透射电子显微镜下对各样品进行观察。HeLa、HepG2和A549细胞线粒体放大30 000倍,细胞核、凋亡小体、自噬体放大8 000倍观察。观察线粒体时选取3张独立的切片,统一在8 000倍下对每张切片随机取20个视野。计数每个视野中的线粒体数,Image-proplus6.0照片图像数据分析软件计算视野中线粒体的截表面积[16-17]。
1.4 统计学方法数据均用平均数±标准差表示。用SPSS17.0版统计软件进行统计分析,数据采用独立样本多重比较t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 甜菜红素对肿瘤细胞线粒体数量和截表面积的影响与0 ppm浓度组比较,加入62.5、500 ppm甜菜红素,HeLa细胞的线粒体计数分别增加10.9%(P < 0.05)和15.2%(P < 0.01);HepG2细胞分别增加25.0%(P < 0.05)和79.7%(P < 0.01);A549细胞线粒体计数分别增加12.6%(P < 0.05)和40.0%(P < 0.01),表明甜菜红素增加肿瘤细胞的线粒体数量与甜菜红素的浓度相关,并且在高浓度时增加更显著,见表 1。
加入62.5、500 ppm甜菜红素,与0 ppm浓度组比较,HepG2细胞的线粒体截表面积分别减小38.9%(P < 0.05)和67.8%(P < 0.01);HepG2细胞的线粒体截表面积分别减小70.1%(P < 0.05)和77.6%(P < 0.01);A549细胞分别减少65.3%(P < 0.05)和81.9%(P < 0.01),表明加入甜菜红素可减小肿瘤细胞线粒体的体积,且与甜菜红素的浓度相关,浓度越高减小越多,见表 1。
|
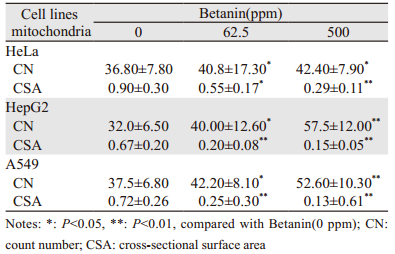
不同浓度甜菜红素作用于细胞后,肿瘤细胞线粒体均体积增大、肿胀,多呈空泡化,线粒体脊膜结构被破坏、断裂、脊膜消失等,HeLa肿瘤细胞核周围线粒体数量较多,线粒体呈椭圆形,多数呈空泡变化,肿胀显著,线粒体脊膜断裂、结构消失,见图 1A。加入62.5 ppm甜菜红素时,细胞的线粒体体积变小,内膜趋于完整、形态结构开始变得规则,但仍有部分线粒体略呈肿胀状态,见图 1B。加入500 ppm甜菜红素浓度时,HeLa细胞线粒体无肿胀现象,无空泡形成,内膜结构较为完整,并且体积进一步变小,见图 1C。表明甜菜红素可促进HeLa细胞线粒体结构的完整性,并随甜菜红素的浓度增加而增加,在高浓度时线粒体结构更加完整。
|
| A: HeLa mitochondria; B: the effect of Betanin (62.5 ppm) on HeLa mitochondrial structure; C: the effect of Betanin (500 ppm) on HeLa mitochondrial structure; D: HepG2 cell mitochondria; E: the effect of Betanin (62.5 ppm) on HepG2 cell mitochondria structure; F: the effect of Betanin (500 ppm) on HepG2 cell mitochondria structure; G: A549 cell mitochondria; H: the effect of Betanin(62.5 ppm) on A549 cell mitochondria structure; I: the effect of Betanin (500 ppm) on A549 cell mitochondria structure 图 1 甜菜红素对HeLa、HepG2和A549肿瘤细胞线粒体结构的影响(×30 000)d Figure 1 Effect of betanin on mitochondria structure of HeLa, HepG2 and A549 cells (×30 000) |
HepG2肿瘤细胞线粒体数量显著增多,聚集排列,线粒体肿胀,多数呈空泡状,无内膜结构,见图 1D。加入62.5 ppm甜菜红素时,线粒体形态恢复,内部脊膜结构已明显可见,但仍有部分线粒体略显肿胀, 见图 1E。在加入500 ppm甜菜红素时,细胞线粒体的截表面积变小,数量增多,内膜结构完整,无空泡,见图 1F。表明甜菜红素也可促进HepG2细胞线粒体结构的完整性,并随甜菜红素的浓度作用增加,高浓度时更加完整。
A549肿瘤细胞线粒体肿胀,内基膜断裂呈空泡状,边缘可以见残存的线粒体基膜,见图 1G。加入62.5 ppm甜菜红素时,线粒体体积变小,部分线粒体内部脊膜结构已明显可见,线粒体数量相对增多,见图 1H。在加入500 ppm甜菜红素时,细胞线粒体的截表面积变小,数量增多,无空泡现象,内膜结构完整;内质网排列整齐,由核膜围绕线粒体延伸至细胞膜,见图 1I。表明甜菜红素对A549细胞的线粒体有修复功能,并随甜菜红素的浓度增加而增加,高浓度时修复作用更强。
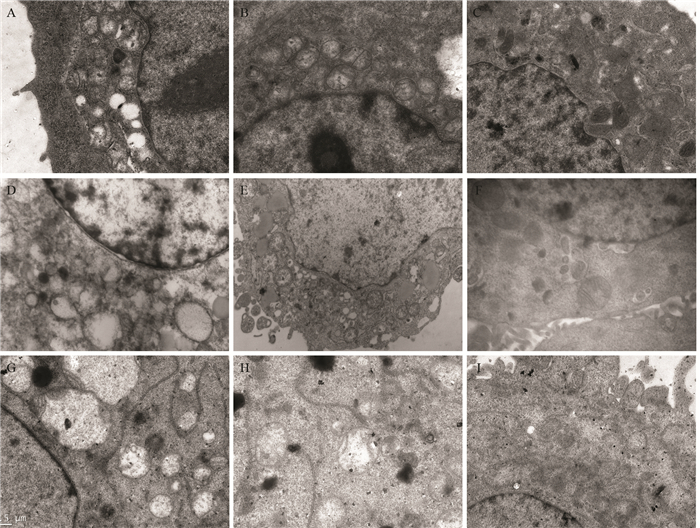
2.3 甜菜红素对肿瘤细胞核结构的影响HeLa肿瘤细胞核体积较大,占满整个细胞,核仁偏移,具有肿瘤细胞核的典型特征,即多核、巨核[16, 18],见图 2A。加入62.5 ppm甜菜红素后,细胞核出现明显的裂解、破碎,形态不规则呈分叶状,且已分裂的细胞核内无核仁,见图 2B。在加入500 ppm甜菜红素时,细胞核出现固缩、核分裂和溶解等核坏死相,见图 2C。表明甜菜红素可促使HeLa细胞核破裂、坏死,并随甜菜红素浓度增加作用增大,高浓度时作用更强。
|
| A: HeLa cell nucleus; B: the effect of Betanin (62.5 ppm) on HeLa nucleus structure; C: the effect of Betanin (500 ppm) on HeLa nucleus structure; D: HepG2 nucleus; E: the effect of Betanin (62.5 ppm) on HepG2 nucleus structure; F: the effect of Betanin(500 ppm) on HepG2 nucleus structure; G: A549 nucleus; H: the effect of Betanin (62.5 ppm) on A549 nucleus structure; I: the effect of Betanin(500 ppm) on A549 nucleus structure 图 2 甜菜红素对HeLa、HepG2和A549肿瘤细胞核结构的影响(× 8 000) Figure 2 Effect of betanin on nucleus structure of HeLa, HepG2 and A549 cells (× 8 000) |
HepG2肿瘤细胞核体积较大,核染色质着色较深,呈巨核相特征,见图 2D。加入62.5 ppm甜菜红素后,细胞核的体积变小,形态不规则,核仁产生固缩,且呈多核相,见图 2E。加入500 ppm甜菜红素后,细胞核萎缩,体积变小更加明显,形态不规则,核内染色质着色较浅,见图 2F。表明甜菜红素同样影响HepG2细胞核的形态,出现核固缩、溶解的核坏死特征。
A549肿瘤细胞核为多核性,核仁位于膜两侧,核仁染色质较为丰富、着色较深,见图 2G。加入62.5 ppm甜菜红素后,细胞核开始出现不对称性分裂,核仁偏于核膜一侧,细胞核形态不规则,细胞内出现空泡变化,见图 2H。加入500 ppm甜菜红素后,细胞核固缩,形态极不规则,核仁分解、消失,核内染色质着色较浅,细胞内空泡数量增多,见图 2I。表明甜菜红素对A549细胞核的周期分裂产生影响,干扰细胞核的正常分裂,使细胞核的形态发生改变,出现核固缩、溶解的坏死特征,导致细胞的周期分化出现异常。
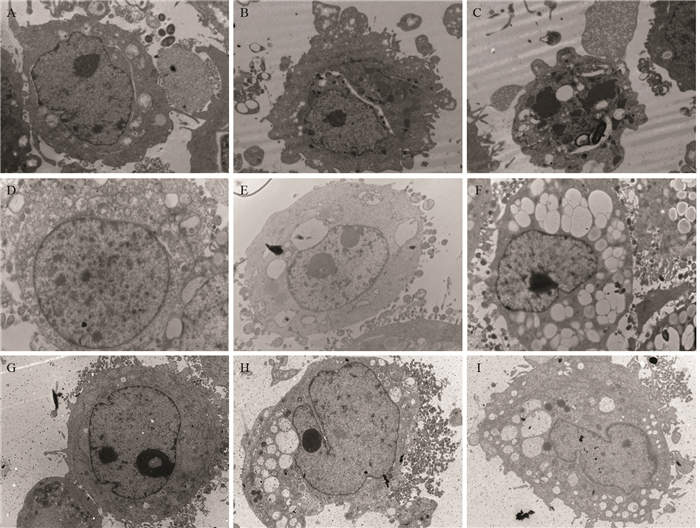
2.4 甜菜红素对HeLa和A549细胞凋亡小体形成的影响加入500 ppm甜菜红素时,HeLa和A549细胞均出现以细胞核为中心的细胞固缩成团,并出现解体现象,细胞膜围绕包裹细胞分解的内部成分,形成多个不规则相互聚集的凋亡小体,使细胞的整体结构消失,凋亡小体呈放射状分散。表明较高浓度甜菜红素可促使HeLa细胞进入程序性死亡,见图 3。
|
| A: the effect of betanin(500 ppm) on HeLa cells apoptosis structure formation (×8000); B: the effect of betanin(500 ppm) on A549 cells apoptotic structure formation (×8000) 图 3 甜菜红素对HeLa和A549细胞凋亡小体形成的影响 Figure 3 Effect of betanin on apoptotic bodies of HeLa and A549 cells |
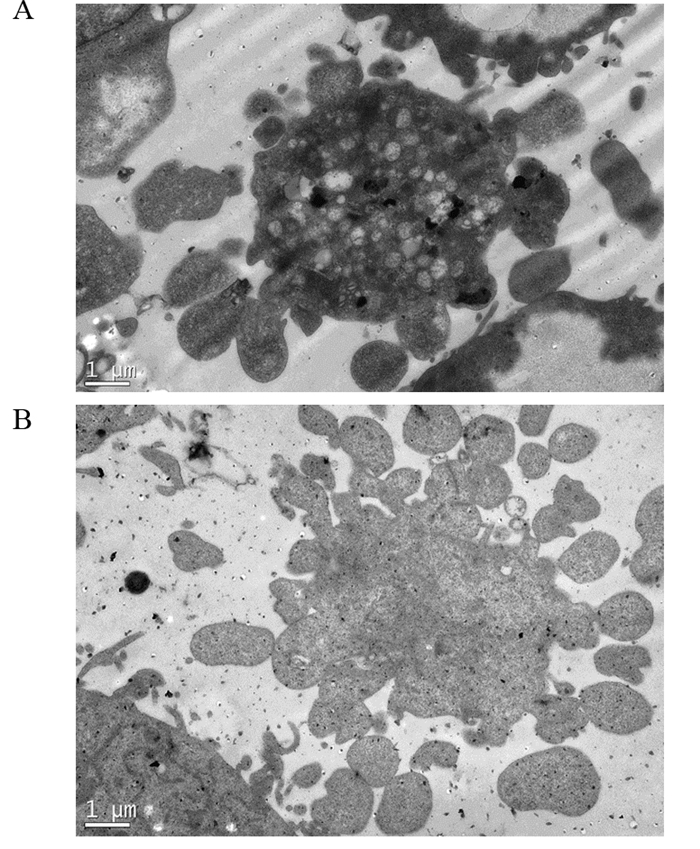
加入62.5 ppm甜菜红素时,HepG2和A549细胞的胞质内均可见空泡状结构小体,并且空泡内有膜状小泡向内突起,形成多个空泡聚集的自噬小体结构,见图 4A、4B;在加入500 ppm甜菜红素时,HepG2细胞和A549细胞内所产生自噬体的数量明显增多,体积较大,占满整个细胞,见图 4C、4D。表明甜菜红素使HepG2细胞和A549细胞产生自噬体,且随甜菜红素浓度的增加而增加,并且在甜菜红素浓度较高时,自噬体变化加剧。
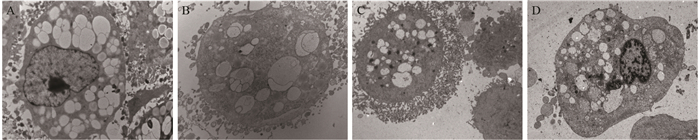
|
| A: the effect of Betanin (62.5 ppm) on HepG2 cell autophagy structure formation; B: the effect of Betanin (62.5 ppm) on A549 cell autophagy structure formation; C: the effect of Betanin (500 ppm) on HepG2 cell autophagy structure; D: the effect of Betanin (500 ppm) on A549 cell autophagy structure formation 图 4 甜菜红素对HepG2和A549细胞自噬体形成的影响(×8 000) Figure 4 Effect of betanin on autophagy formation of HepG2 and A549 cells (×8 000) |
线粒体是真核细胞内的一种特殊的细胞器,通过呼吸复合体的电子传递过程,为细胞活动提供能量。与正常细胞相比,肿瘤细胞代谢方式是以有氧糖酵解为主,可能是由于肿瘤细胞线粒体功能不可逆转的损伤,或肿瘤细胞中线粒体数量的减少所致[16]。然而,也有研究认为并不是所有的肿瘤细胞都靠无氧糖酵解来获得能量[19],有的肿瘤细胞靠氧化磷酸化提供能量,甚至可产生细胞所需能量的80%[20]。由于肿瘤细胞的过度生长,肿瘤细胞中糖酵解的增强,以致肿瘤细胞线粒体出现功能缺陷、低氧以及某些代谢酶的异常表达,使肿瘤细胞中线粒体数量比正常细胞减少[21-22]。在生物组织中,不少生物结构往往分布在各种膜性或膜样结构上并占据一定的面积,线粒体的截表面积是描述线粒体结构体积的重要参数,也是形态定量的基本指标[23]。
本研究中HeLa、HepG2和A549细胞的线粒体都呈现出体积增大、肿胀,截表面积增大。线粒体多呈空泡化,脊膜结构被破坏、断裂、脊膜消失等,表明肿瘤细胞线粒体形态结构是异常的,从而推测其功能也可能是异常的,而这种异常对于肿瘤细胞的代谢与存活可能又是必需的,这与一般肿瘤细胞的线粒体功能是有损伤的看法一致。甜菜红素对肿瘤细胞线粒体形态结构作用的报道较少,当本实验分别加入62.5 ppm、500 ppm浓度甜菜红素时,HeLa、HepG2和A549细胞线粒体内膜结构趋于完整,表明甜菜红素具有修复肿瘤细胞线粒体结构的作用,使肿瘤细胞线粒体的代谢功能趋于正常,从而可能影响肿瘤细胞赖以生存的代谢途径。
3.2 甜菜红素对肿瘤细胞核特征的影响恶性肿瘤细胞多为不成熟细胞,常见细胞核大而胞质少,核形态各异,呈巨核、双核和多核,并且形态多畸形,细胞核透明度增强,核仁体积增大、数目增多[24-26]。本实验观察肿瘤细胞核的特征与上述报道一致。然而,加入甜菜红素后HeLa、HepG2和A549细胞核均出现明显的核浓缩和核分裂相,表明甜菜红素导致了肿瘤细胞核的破裂和坏死。
3.3 甜菜红素对肿瘤细胞凋亡小体和自噬体形成的作用细胞凋亡是生物体细胞的主动消亡过程, 是多细胞有机体调控机体发育、控制细胞衰老、维持内环境稳定的重要机制[27]。自噬是细胞对营养缺乏、氧化应激、感染等外源性刺激产生的有效反应,可以作为一种防御机制清除胞质内受损的细胞器和大分子物质,保护受损的细胞,同时它作为一种细胞死亡程序诱导细胞主动性死亡(Ⅱ型程序性死亡)[18]。
在本研究中,加入500 ppm甜菜红素时,在HeLa细胞和A549细胞都有凋亡小体形成,表明甜菜红素影响了HeLa细胞和A549细胞的基因控制,使细胞分解加剧而进入程序性死亡[28]。而在HepG2细胞和A549细胞,在胞质内形成了大量的“自噬体”空泡,表明甜菜红素对细胞已造成了损伤,会影响到细胞的存活[29-30]。凋亡小体和自噬体都是细胞的退行性病理变化,都会导致细胞进入死亡程序,本实验肿瘤细胞凋亡小体和自噬体的出现,表明了甜菜红素对肿瘤细胞的伤害。
综上所述,加入0、62.5和500 ppm甜菜红素培养HeLa、HepG2和A549细胞,通过透射电子显微镜观察,甜菜红素可使HeLa、HepG2和A549细胞线粒体数量明显增加,截表面积和体积显著变小;线粒体趋于内膜完整、形态结构恢复;细胞核破裂、固缩和坏死;肿瘤细胞出现凋亡小体或自噬体,可促进肿瘤细胞核的坏死和细胞死亡。
| [1] | Gasztonyi MN, Daood H, Hájos MT, et al. Comparison of red beet (Beta vulgaris var conditiva) varieties on the basis of their pigment components[J]. J Sci Food Agri, 2001, 81 (9) : 932–3. DOI:10.1002/jsfa.v81:9 |
| [2] | Wu ZD, Zhang WB, Wu YM. Special Function and Application of Red Beet[J]. Zhongguo Tang Ke, 2015, 37 (2) : 70–2. [ 吴则东, 张文彬, 吴玉梅. 红甜菜的特殊功效及应用[J]. 中国糖科, 2015, 37 (2) : 70–2. ] |
| [3] | Kapadia GJ, Tokuda H, Konoshima T, et al. Chemoprevention of lung and skin cancer by Beta vulgaris(beet)root extract[J]. Cancer Lett, 1996, 100 (1-2) : 211–4. DOI:10.1016/0304-3835(95)04087-0 |
| [4] | Wybraniec S. Formation of decarboxylated bctacyanins in heated Purified betaeyanin Fractions from red beetroot(Beta vulgaris L)monitored by LC-MS/MS[J]. J Agric Food Chem, 2005, 53 (9) : 3483–7. DOI:10.1021/jf048088d |
| [5] | Wang YF, Chen LJ, Zhang LM, et al. Red Beet Characteristics Research and Use Values of Health Care[J]. Zhongguo Tang Ke, 2008, 30 (1) : 52–4. [ 王燕飞, 陈丽君, 张立明, 等. 食用红甜菜的性状调查及保健利用价值[J]. 中国糖科, 2008, 30 (1) : 52–4. ] |
| [6] | Huang H, Hu HX, Jiang LH, et al. Research progress of plant sugar beet pigment[J]. Sheng Wu Xue Tong Bao, 2014, 49 (8) : 5–8. [ 黄欢, 胡慧霞, 姜联合, 等. 植物甜菜色素的研究进展[J]. 生物学通报, 2014, 49 (8) : 5–8. ] |
| [7] | Strack D, Voget T, Sehiiemarm W. Recent advances in betalain research[J]. Phytoehemistry, 2003, 62 (3) : 247–69. DOI:10.1016/S0031-9422(02)00564-2 |
| [8] | Tesoriere L, Butera D, Allegra M, et al. Distribution of betalain pigments in red blood cells after consumption of cactus pear fruits and increased resistance of the cells to ex vivo induced oxidative hemolysis in humans[J]. J Agric Food Chem, 2005, 53 (4) : 1266–70. DOI:10.1021/jf048134+ |
| [9] | Lechner JF, Wang LS, Rocha CM, et al. Drinking water with red beetroot food color antagonizes esophageal carcinogenesis in N-nitrosomethylbenzylamine-Treated rats[J]. J Med Food, 2010, 13 (3) : 733–9. DOI:10.1089/jmf.2008.0280 |
| [10] | Zhang Q, Pan J, Wang Y, et al. Beetroot red (betanin) inhibits vinyl carbamate-and benzo(a)pyrene-induced lung tumorigenesis through apoptosis[J]. Mol Carcinog, 2013, 52 (9) : 686–91. DOI:10.1002/mc.v52.9 |
| [11] | Sotgia F, Martinez-Outschoorn UE, Pavlides S, et al. Understanding the Warburg effect and the prognostic value of stromal caveolin-1 as a marker of a lethal tumor microenvironment[J]. Breast Cancer Res, 2011, 13 (4) : 213. DOI:10.1186/bcr2892 |
| [12] | Luo QJ. Red beet extract and compositions, methods for their preparation and use in the preparation of medicaments for inhibiting tumor growth:ZL200910301197.1[P]. 2011. 4. 13 [ 雒秋江.红甜菜提取物和组合物及其制备方法和应用在制备抑制肿瘤生长的药物: ZL200910301197.1[P]. 2011. 4. 13. ] |
| [13] | Isidoro A, Martinez M, Fernadez PL, et al. Alteration of the biotnergetic phenotype of mitochondria is a hallmark of breast, gastric, lung and oesophageal cancer[J]. Biochem J, 2004, 378 (Pt1) : 17–20. |
| [14] | Zhao YM, Wang DX, Wu LJ, et al. Morphometrlc studies of muscle mitochondria in lipid storage myopathy[J]. Nao Yu Shen Jing Ji Bing Za Zhi, 2005, 13 (4) : 270–2. [ 赵亚明, 王得新, 吴丽娟, 等. 脂肪累积性肌肉病线粒体形态计量分析[J]. 脑与神经疾病杂志, 2005, 13 (4) : 270–2. ] |
| [15] | Luo QJ, Bao XW, Zhang ZQ, et al. Effects of red beet extract on HeLa cell proliferation in vitro and tumor growth of tumor-bearing mice[J]. Yao Wu Ping Jia Jan Jiu, 2012, 35 (1) : 10–3. [ 雒秋江, 包晓玮, 张志泉, 等. 红甜菜提取物对HeLa细胞增殖和荷瘤鼠瘤体生长的影响[J]. 药物评价研究, 2012, 35 (1) : 10–3. ] |
| [16] | Li YR, Peng L, et al. Study on the changes of myocardial ultrastructure and mitochondrial morphology of NEG inducing aging mice[J]. Dian Zi Xian Wei Xue Bao, 2002, 21 (5) : 529–30. [ 李艳茹, 彭力, 马海英, 等. 非酶糖基化致衰老小鼠心肌超微结构和线粒体形态计量改变的研究[J]. 电子显微学报, 2002, 21 (5) : 529–30. ] |
| [17] | Zha YM, Wang DX, et al. Morphometrlc studies of muscle mitochondria in lipid storage myopathy[J]. Nao Yu Shen Jing Ji Bing Za Zhi, 13(4): 270-2. [ 赵亚明, 王得新, 吴丽娟, 等.脂肪累积性肌肉病线粒体形态计量分析[J].脑与神经疾病杂志, 13(4): 270-2. ] http://www.cqvip.com/qk/98269x/2005004/18053846.html |
| [18] | Yang SJ, Meng JP, Qu Y. The progress on the signal transduction pathway of apoptosis[J]. Zhongguo Bi Jiao Yi Xue Za Zhi, 2007, 17 (5) : 297–301. [ 杨绍杰, 孟金萍, 屈祎. 细胞凋亡信号传导通路的研究进展[J]. 中国比较医学杂志, 2007, 17 (5) : 297–301. ] |
| [19] | Zheng J. Tumor metabolism: glycolysis or oxidative phosphorylation[J]. Sheng Ming Ke Xue, 2012, 24 (4) : 310–5. [ 郑杰. 肿瘤能量代谢:糖酵解还是氧化磷酸化[J]. 生命科学, 2012, 24 (4) : 310–5. ] |
| [20] | Newsholme EA, Crabtree B, Ardawi MS. The role of high rates of glycolysis and glutamine utilization in rapidly dividing cells[J]. Biosci Rep, 1985, 5 (5) : 393–400. DOI:10.1007/BF01116556 |
| [21] | Moreno-Sánchez R, Rodríguez-Enríquez S, Marín-Hernández A, et al. Energy metabolism in tumor cells[J]. FEBS J, 2007, 274 (6) : 1393–418. DOI:10.1111/j.1742-4658.2007.05686.x |
| [22] | Bellance N, Benard G, Furt F, et al. Bioenergetics of lung tumors: alteration of mitochondrial biogenesis and respiratory capacity[J]. Int J Biochem Cell Biol, 2009, 41 (12) : 2566–77. DOI:10.1016/j.biocel.2009.08.012 |
| [23] | Wu ZR, Shen H. Quantitative ultrastructure of mitochondria in colorectal carcinoma[J]. Shi Jie Hua Ren Xiao Hua Za Zhi, 2003, 11 (9) : 1372–4. [ 吴正蓉, 申洪. 大肠肿瘤组织线粒体线粒体形态结构定量研究[J]. 世界华人消化杂志, 2003, 11 (9) : 1372–4. ] |
| [24] | Lu G, Shen JG, You WL, et al. Relationship between apoptosis and ultrastructure of mitochondria of colorectal cancer[J]. Zhongguo Wu Zhen Xue Za Zhi, 2006, 6 (17) : 3277–9. [ 鲁刚, 沈剑刚, 游文龙, 等. 直结肠癌细胞线粒体超微结构与细胞凋亡的关系[J]. 中国误诊学杂志, 2006, 6 (17) : 3277–9. ] |
| [25] | Pedersen PL. Tumor mitochondria and the bioenergetics of cancer cells[J]. Prog Exp Tumor Res, 1978, 15 (22) : 190–274. |
| [26] | Deng PH. Animal Cell Pathology[M]. Beijing: China Agriculture Press, 1995 : 144 -7. [ 邓普辉. 动物细胞病理学[M]. 北京: 中国农业出版社, 1995 : 144-7.] ] |
| [27] | Sreekanth Devalraju, Alunasree M.K., KarnatiR.Roy T, et al. Betanin a betaeyanin Pigment purified from fruits of Opuntia ficus-indica induces apoptosis in human chronie myeloid leukemia Cell line-K562[J]. Phytomedicine, 2007, 14 (11) : 739–46. DOI:10.1016/j.phymed.2007.03.017 |
| [28] | Li D. The regulatory mechanism of autophagy in tumorigenesis and development[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2013, 18 (6) : 561–4. [ 李丹. 自噬在肿瘤发生与发展中的调控机制[J]. 临床肿瘤学杂志, 2013, 18 (6) : 561–4. ] |
| [29] | Xu B, Zhu GH, Xia JT, et al. Influence of Chinese herb aitongke on the proliferation, apoptosis and Rb gene expression of hepatoma carcinoma cells HepG-2[J]. Zhongguo Zu Zhi Gong Cheng Yan Jiu Yu Lin Chuang Kang Fu, 2007, 11 (12) : 2253–6. [ 徐波, 朱光辉, 夏金堂, 等. 中药癌痛克对人肝癌细胞HepG2增殖、凋亡及Rb基因表达的影响[J]. 中国组织工程研究与临床康复, 2007, 11 (12) : 2253–6. ] |
| [30] | Guo DY, Shun HQ. Progression in the study of autophagy and its relation to cancer[J]. Xian Dai Zhong Liu Yi Xue, 2010, 18 (6) : 1247–50. [ 郭德玉, 孙慧勤. 自噬及其与肿瘤关系的研究进展[J]. 现代肿瘤医学, 2010, 18 (6) : 1247–50. ] |
 2016, Vol. 43
2016, Vol. 43


