文章信息
- UGCG通过调控MDR1/P-gp参与人结肠癌奥沙利铂耐药的初步研究
- UGCG is Involved in Oxaliplatin Resistance Mechanism of Human Colon Cancer Through Regulating MDR1/P-gp Expression
- 肿瘤防治研究, 2016, 43(9): 743-747
- Cancer Research on Prevention and Treatment, 2016, 43(9): 743-747
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.09.003
- 收稿日期: 2015-12-30
- 修回日期: 2016-03-18
2. 214062 无锡,江南大学附属医院肿瘤外科
2. Department of Oncological Surgery, The Affiliated Hospital of Jiangnan University, Wuxi 214062, China
奥沙利铂(oxaliplatin,L-OHP)是铂类化疗药物之一,临床应用范围广,是治疗结直肠癌(colorectal cancer,CRC)的一线药物[1]。多药耐药(multidrug resistance,MDR)的产生仍是导致结直肠癌临床化疗失败的主要原因之一[2]。
UDP-葡萄糖神经酰胺糖基转移酶(UDP-glucose ceramide glucosyltransferase,UGCG)可以降低体内神经酰胺的水平,导致细胞逃避神经酰胺诱导的凋亡过程,报道显示UGCG的这一作用与MDR的产生具有一定相关性[3]。我们前期研究[3]表明,在白血病耐药细胞中UGCG通过一定的信号通路参与对多药耐药基因1(MDR1)及其编码的P-糖蛋白(P-glycoprotein,P-gp)的调节,从而参与耐药机制的调控。UGCG在L-OHP耐药的结直肠癌细胞中及其对P-gp调控作用未见报道,因此本研究以L-OHP为诱导剂,通过逐步增加作用于亲代细胞的药物浓度建立人结肠癌L-OHP耐药细胞模型,并初步探讨UGCG在耐药机制形成过程中发挥的作用。
1 材料与方法 1.1 材料及试剂人结肠癌HCT-116细胞购自中科院上海细胞库。UGCG抗体购自英国Abcam公司,P-gp、GAPDH抗体购自美国Santa Cruz公司,羊抗鼠以及羊抗兔二抗购自北京康为世纪生物有限公司。RPMI 1640培养液购自美国Hyclone公司,转染试剂LipofectamineTM2000购自美国Invitrogen公司,引物由上海生工生物公司合成,siRNA由广州锐博生物公司合成。PCR相关试剂购自日本TOBOYO公司。奥沙利铂(L-OHP)、顺铂(DDP)、5-氟尿嘧啶(5-Fu)分别由江苏恒瑞医药股份有限公司、江苏豪森药业股份有限公司、天津金耀集团有限公司生产。
1.2 细胞培养及HCT-116/L-OHP的建立人结肠癌细胞株HCT-116培养于含10%胎牛血清的DMEM完全培养液中。取对数生长期细胞,调整细胞密度为2×105每毫升,加入终浓度为0.1 μg/ml(约1/10 IC50)的L-OHP培养液连续作用48 h,弃上清液,加入不含L-OHP的新鲜培养液继续培养,待细胞恢复正常生长后,消化传代;重复上述步骤,若细胞生长状态良好,则将浓度倍增提高到0.2 μg/ml。逐步提高L-OHP的浓度,分别按0.4、0.8、1.6、3.2、6.4、12.5 μg/ml浓度倍增,最终获得耐药细胞株HCT116/L-OHP,并维持培养在含2 μg/ml的L-OHP培养液中,于实验前1周停用L-OHP处理。对应的野生细胞进行同样的传代不加药处理。
1.3 CCK8检测HCT116和HCT116/L-OHP细胞的半数抑制浓度(IC50)取对数生长期的HCT116和HCT116/L-OHP细胞,稀释为5×104每毫升,每孔100 μl接种于96孔板。培养24 h后,以50 μg/ml药物为起始浓度,倍比稀释9个浓度,空白对照组不加药物,背景组加入不含细胞的培养液,每组设置5个复孔,培养48 h后,每孔加入CCK-8溶液10 μl,继续培养2 h后,在570 nm处测定OD值。计算药物在HCT116 和HCT116/L-OHP细胞中的IC50。
1.4 UGCG siRNA转染 HCT116/L-OHP细胞取对数生长期的细胞调整为2×105每毫升,接种2 ml于6孔板中,培养过夜。按照LipofectamineTM2000转染试剂说明书进行转染,并重新置于CO2培养箱中培养48 h,收集细胞,进行实时荧光定量PCR和Western blot检测。
1.5 实时荧光定量PCR检测UGCG和MDR1 mRNA的表达TRIzol法提取各组总RNA,取1 μg RNA反转录为cDNA,反转录条件为:37℃ 15 min,98℃ 5 min。产物进行荧光定量PCR扩增,反应条件如下:95℃ 60 s,1个循环;95℃ 15 s,60℃ 15s,72℃ 45 s,40个循环。引物序列见表 1。
采用ΔΔCt相对定量法分析结果,差异水平用2-ΔΔCt±S表示,ΔCt标准差计算公式S=
细胞加入裂解液RIPA(100 微升/106细胞)和1 μl蛋白酶抑制物PMSF,吹打冰浴30 min,4℃高速离心15 min,收集上清液。
以20~40 μg蛋白上样量进行SDS-聚丙烯酰胺凝胶电泳,蛋白转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,TBST洗3次,每次10 min。分别加入UGCG(1:1000)、P-gp(1:500)、GAPDH(1:500)一抗,4℃孵育过夜。TBST洗膜后加入羊抗鼠或羊抗兔二抗(1:2 500),室温孵育1~1.5 h。用BIO-RAD凝胶成像仪显影后,Quantity one软件扫描分析,以目的基因与GAPDH比值作为其相对表达量。
1.7 统计学方法应用SPSS17.0统计进行软件分析,通过线性回归法计算IC50值。数据采用均数±标准差(x±s)表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果 2.1 成功建立人结肠癌耐药细胞株HCT116/L-OHP12月后获得生长良好的、能耐受5 μg/ml L-OHP的耐药细胞HCT116/L-OHP,细胞在含2 μg/ml L-OHP的培养液中维持培养。CCK8法检测结果显示,L-OHP对HCT116及HCT116/L-OHP细胞均具有明显的生长抑制作用,且在0~50 μg/ml范围内具有明显的剂量依赖性,见图 1A。根据浓度效应曲线,确定L-OHP作用48 h后HCT116及HCT116/L-OHP的IC50分别为0.868和9.108 μg/ml,耐药指数RI为10.5,与亲本细胞HCT116相比,HCT116/L-OHP表现出较高的耐药性 。 HCT116/L-OHP细胞对铂类药物家族另一种药物DDP也有一定程度的耐受,耐药指数为4.61,见图 1B,但对5-Fu并不耐受,见图 1C。

|
| * : P<0.05,compared with HCT116 group 图 1 不同浓度L-OHP、DDP和5-Fu对HCT116、HCT116/L-OHP细胞的生长抑制作用 Figure 1 Inhibitory effect of different concentrations of L-OHP,DDP and 5-Fu on HCT116 and HCT116/L-OHP cells |
实时荧光定量PCR检测显示,与不加药的对照组HCT116细胞相比,耐药组HCT116/L-OHP细胞UGCG及MDR1 mRNA均相对高表达,UGCG mRNA高表达2.96倍,MDR1 mRNA高表达4.87倍(P<0.05),见图 2。
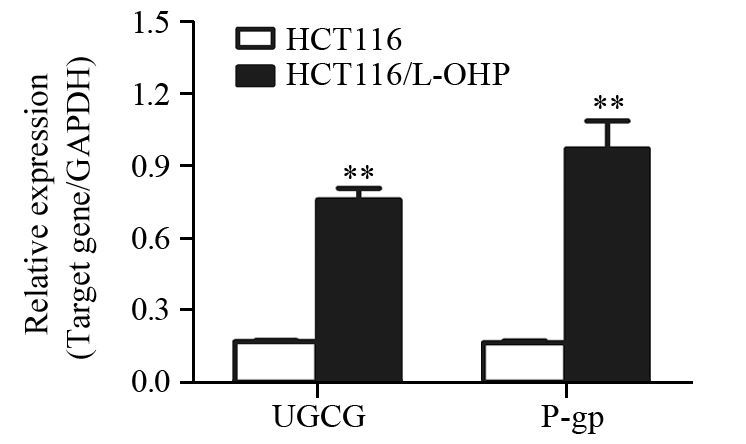
|
| **: P<0.01,compared with HCT116 group 图 2 HCT116和HCT116/L-OHP中UGCG和MDR1 mRNA表达水平 Figure 2 Expression of UGCG and MDR1 mRNA in HCT116 and HCT116/L-OHP cells |
Western blot检测结果显示,耐药组HCT116/L-OHP细胞UGCG及P-gp蛋白均呈现相对高表达,与不加药的对照组HCT116细胞相比,差异具有统计学意义(均P<0.01),见图 3。
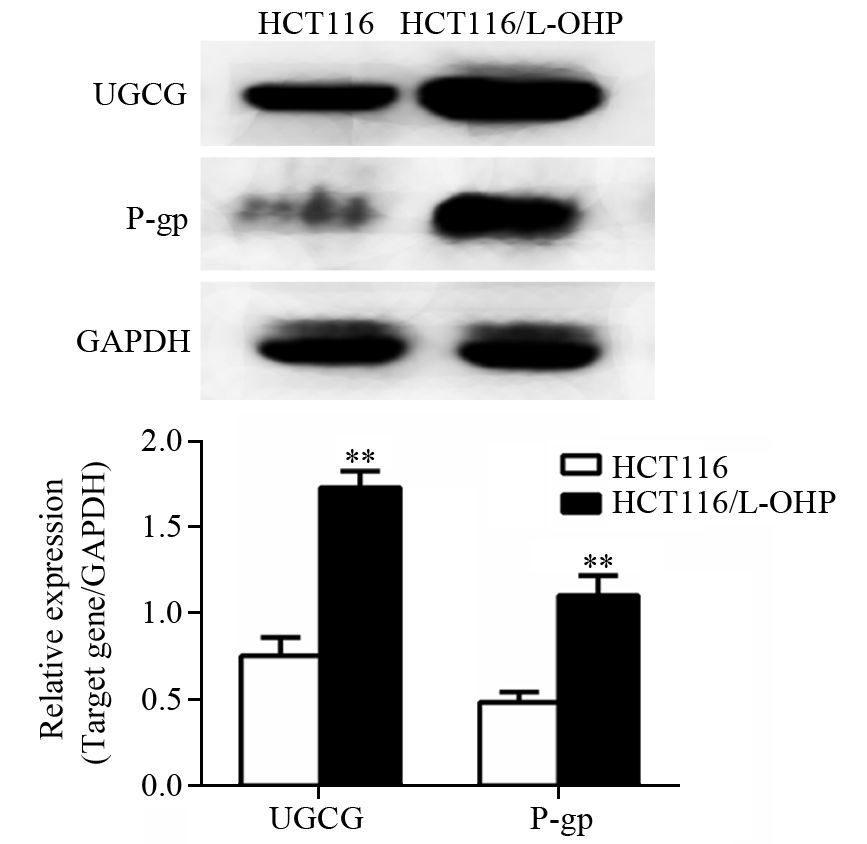
|
| **: P<0.01,compared with HCT116 group 图 3 HCT116和HCT116/L-OHP细胞中UGCG、P-gp蛋白的表达 Figure 3 Expression of UGCG and P-gp protein in HCT116 and HCT116/L-OHP cells |
为探讨UGCG与MDR1在耐药细胞中的相关性,本研究合成三条UGCG siRNA,转染HCT116/L-OHP细胞48 h后,实时荧光定量PCR检测UGCG mRNA的抑制率,发现合成的三条siRNA均有一定的干扰效果,最大抑制率可达63%;对MDR1 mRNA的最大抑制率为56%,上述结果与阴性干扰对照组(NC)比较,差异均具有统计学意义,见图 4。
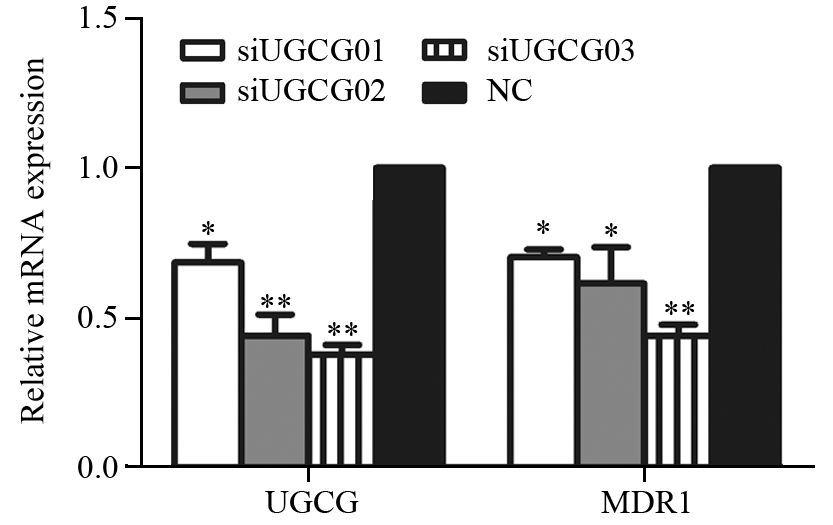
|
| *: P<0.05,compared with NC group,**: P<0.01,compared with NC group 图 4 UGCG siRNA转染后HCT116/L-OHP细胞中UGCG和MDR1 mRNA的表达 Figure 4 Expression of UGCG and MDR1 mRNA in HCT116/L-OHP cells after UGCG siRNA transfection |
三条UGCG siRNA分别转染HCT116/L-OHP细胞72 h后,Western blot检测结果显示,UGCG siRNA转染的三组细胞UGCG、P-gp蛋白的表达显著减少,与NC组相比,差异有统计学意义(P<0.05)。表明UGCG siRNA干扰可显著抑制UGCG蛋白并进而抑制P-gp蛋白的表达,见图 5。

|
| *: P<0.05,compared with NC group; **:P<0.01 compared with NC group 图 5 UGCG siRNA转染后HCT116/L-OHP细胞中UGCG、P-gp蛋白的表达 Figure 5 Expression of UGCG and P-gp protein in HCT116/L-OHP after UGCG siRNA transfection |
结直肠癌是发病率及死亡率均较高的恶性肿瘤[4-5],严重威胁人类健康。化疗是结直肠癌治疗的主要方法之一,而MDR的产生是导致结直肠癌化疗失败的主要原因。MDR的产生和形成过程及机制较为复杂[6-7],而体外诱导建立耐药细胞株为探究肿瘤细胞分子生物学变化、耐药发生发展机制提供良好的研究工具[8]。我们通过前期的筛选,选出对L-OHP较为敏感的HCT116作为亲本细胞,通过逐渐提高L-OHP的浓度,历时12月,成功建立了耐L-OHP细胞株HCT116/L-OHP。HCT116/L-OHP耐药株不仅对L-OHP耐药,且对DDP交叉耐药,而本研究多次测定5-Fu对HCT116/L-OHP的吸光度值并进行IC50的计算,均未发现有交叉耐药现象。
神经酰胺在细胞的凋亡过程中发挥重要作用,许多抗肿瘤药物通过诱导内源性神经酰胺的产生促进肿瘤细胞的凋亡[9-10]。UGCG又称葡萄糖神经酰胺合成酶(glucosylceramide synthase,GCS),催化鞘糖脂形成过程中的第一步糖基化过程,可以将神经酰胺糖基化为葡萄糖神经酰胺,使胞内神经酰胺水平降低,进而影响神经酰胺介导的细胞凋亡过程[11]。
肿瘤细胞产生多药耐药的关键步骤是使胞内药物摄取减少或外排增多。ABC结合盒转运蛋白超家族编码多种膜蛋白,可将进入胞内的抗肿瘤药物泵出到胞外,在多药耐药的形成过程中发挥着重要作用[12]。MDR1基因编码的P-gp,是ABC结合盒转运蛋白超家族一员,在多种肿瘤中高表达,介导了肿瘤细胞的经典耐药途径[12-13]。P-gp的调节机制较为复杂,涉及多种因子、多条信号通路[14-17]。我们前期研究表明,UGCG在白血病耐药细胞中与P-gp呈现共同高表达,且对P-gp具有一定的调节作用[3]。我们建立结肠癌耐药细胞株HCT116/L-OHP中,经检测发现相比于不耐药的野生HCT116细胞,UGCG与P-gp均呈高表达趋势,使用siRNA干扰UGCG后,P-gp的表达也会相应下调,且下调程度与UGCG受干扰程度呈一定相关性。
综上所述,我们所建立的耐奥沙利铂细胞株具有多药耐药的特性,其耐药机制的形成可能与高表达UGCG基因及MDR1/P-gp有关,且UGCG对MDR1/P-gp具有一定的调控作用,而其具体的调控作用机制还有待于进一步的研究。
| [1] | Raymond E, Chaney SG, Taamma A, et al. Oxaliplatin: a review of preclinical and clinical studies[J]. Ann Oncol, 1998, 9 (10) : 1053–71. DOI:10.1023/A:1008213732429 |
| [2] | Patwardhan G, Gupta V, Huang J, et al. Direct assessment of P-glycoprotein efflux to determine tumor response to chemotherapy[J]. Biochem Pharmacol, 2010, 80 (1) : 72–9. DOI:10.1016/j.bcp.2010.03.010 |
| [3] | Zhang XF, Xie KM, Zou J, et al. NF-κB the effect of glucosylceramide synthase on P-glycoprotein modulation in a drug-resistance leukemia cell line[J]. Zhonghua Yi Xue Yi Chuan Xue Za Zhi, 2014, 31 (1) : 34–8. [ 张秀芬, 谢可鸣, 邹健, 等. NS-κB介导白血病多药耐药细胞中葡萄糖神经酰胺合成酶对P-糖蛋白的调节作用[J]. 中华医学遗传学杂志, 2014, 31 (1) : 34–8. ] |
| [4] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65 (1) : 5–29. DOI:10.3322/caac.21254 |
| [5] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65 (2) : 87–108. DOI:10.3322/caac.21262 |
| [6] | Szakacs G, Paterson JK, Ludwig JA, et al. Targeting multidrug resistance in cancer[J]. Nat Rev Drug Discov, 2006, 5 (3) : 219–34. DOI:10.1038/nrd1984 |
| [7] | Wilson TR, Johnston PG, Longley DB. Anti-apoptotic mechanisms of drug resistance in cancer[J]. Curr Cancer Drug Targets, 2009, 9 (3) : 307–19. DOI:10.2174/156800909788166547 |
| [8] | Dallas NA, Xia L, Fan F, et al. Chemoresistant colorectal cancer cells, the cancer stem cell phenotype, and increased sensitivity to insulin-like growth factor-I receptor inhibition[J]. Cancer Res, 2009, 69 (5) : 1951–7. DOI:10.1158/0008-5472.CAN-08-2023 |
| [9] | Dimanche-Boitrel MT, Rebillard A, Gulbins E. Ceramide in chemotherapy of tumors[J]. Recent Pat Anticancer Drug Discov, 2011, 6 (3) : 284–93. DOI:10.2174/157489211796957838 |
| [10] | Dumitru CA, Weller M, Gulbins E. Ceramide metabolism determines glioma cell resistance to chemotherapy[J]. J Cell Physiol, 2009, 221 (3) : 688–95. DOI:10.1002/jcp.21907 |
| [11] | Liu YY, Yu JY, Yin D, et al. A role for ceramide in driving cancer cell resistance to doxorubicin[J]. FASEB J, 2008, 22 (7) : 2541–51. DOI:10.1096/fj.07-092981 |
| [12] | Wu CP, Calcagno AM, Ambudkar SV. Reversal of ABC drug transporter-mediated multidrug resistance in cancer cells: evaluation of current strategies[J]. Curr Mol Pharmacol, 2008, 1 (2) : 93–105. DOI:10.2174/1874467210801020093 |
| [13] | Cole SP. Targeting multidrug resistance protein 1 (MRP1, ABCC1): past, present, and future[J]. Annu Rev Pharmacol Toxicol, 2014, 54 : 95–117. DOI:10.1146/annurev-pharmtox-011613-135959 |
| [14] | Aldonza MB, Hong JY, Bae SY, et al. Suppression of MAPK Signaling and Reversal of mTOR-Dependent MDR1-Associated Multidrug Resistance by 21α-Methylmelianodiol in Lung Cancer Cells[J]. PLoS One, 2015, 10 (6) : e0127841. DOI:10.1371/journal.pone.0127841 |
| [15] | Xu YT, Sun JJ. NS-398 Reverses Multi-drug Resistance of Colorectal Carcinoma Cells[J]. Zhong Liu Fang Zhi Yan Jiu, 2015, 42 (9) : 877–81. [ 许月天, 孙剑经. NS-398逆转结肠癌细胞多药耐药性的作用[J]. 肿瘤防治研究, 2015, 42 (9) : 877–81. ] |
| [16] | Noratto GD, Jutooru I, Safe S, et al. The drug resistance suppression induced by curcuminoids in colon cancer SW-480 cells is mediated by reactive oxygen species-induced disruption of the microRNA-27a-ZBTB10-Sp axis[J]. Mol Nutr Food Res, 2013, 57 (9) : 1638–48. DOI:10.1002/mnfr.v57.9 |
| [17] | Zhao Q, Li Y, Tan BB, et al. HIF-1α Induces Multidrug Resistance in Gastric Cancer Cells by Inducing MiR-27a[J]. PLoS One, 2015, 10 (8) : e0132746. DOI:10.1371/journal.pone.0132746 |
 2016, Vol. 43
2016, Vol. 43



