文章信息
- 抑制Notch和PI3K/Akt信号通路对食管腺癌细胞增殖、侵袭及迁移的影响
- Effects on Cell Proliferation, Invasion and Migration of Esophageal Adenocarcinoma by Inhibition of Notch and PI3K /Akt Pathway
- 肿瘤防治研究, 2016, 43(8): 653-658
- Cancer Research on Prevention and Treatment, 2016, 43(8): 653-658
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.08.001
- 收稿日期: 2015-08-31
- 修回日期: 2015-11-25
2. 442000 十堰,湖北医药学院基础医学院
2. Faculty of Basic Medicine, Hubei University of Medicine, Shiyan 442000, China
食管癌作为消化道常见的恶性肿瘤,其发病率在所有恶性肿瘤中排第八,死亡率排第六。据统计,仅2012年,就有近456 000例新增患者,约400 000例死于食管癌[1]。食管癌有两种病理类型,即食管鳞癌和食管腺癌。食管腺癌(esophageal adenocarcinoma, EAC)是欧美发达国家和地区主要的食管癌病理类型,而食管鳞癌则占我国食管癌的绝大多数。尽管EAC在亚洲地区的发病率较低,但由于中国人口基数大,全世界新增EAC病例中有18%发生在中国[2]。近年来,虽然食管鳞癌发病率逐渐降低,但EAC的发病率呈明显上升趋势。食管腺癌患者临床确诊时已多属晚期,多数患者已出现侵袭和转移,缺少有效的治疗手段,5年生存率不及20%,中位生存期不足1年[3-4]。因而,侵袭和转移成为EAC患者死亡率高的主要原因,也是EAC治疗中关注的难点和热点。
Notch信号通路参与调控多种细胞的增殖、凋亡、迁移、侵袭以及血管形成等活动,与多种肿瘤的发生、发展、转移有密切关系[5-6]。PI3K/Akt信号通路也已经被证明参与多种人类肿瘤的发生和进展[7-10]。近年来,越来越多的证据提示Notch和PI3K/Akt这两条信号通路在食管腺癌及其癌前病变Barrett食管中均呈现异常活化状态[11-13]。本实验主要通过使用Notch和PI3K/Akt信号通路阻滞剂,以食管腺癌细胞系OE33为研究对象,探讨Notch和PI3K/Akt信号通路对食管腺癌细胞增殖、侵袭和迁移的影响,以及这两条信号通路在食管腺癌细胞中的联系。
1 材料与方法 1.1 材料 1.1.1 细胞食管腺癌细胞系OE33购自美国ATCC公司。
1.1.2 主要试剂RPMI 1640细胞培养液由美国Hyclone公司生产;胎牛血清(FBS)由美国Gibco公司生产;二甲基亚砜(DMSO)、 DAPT、LY294002由美国Sigma公司生产;Transwell小室、Matrigel胶均由美国BD公司生产; p-Akt、NICD、Hesl、PTEN蛋白抗体均购自美国CST公司;β-actin、HRP标记的的羊抗兔IgG抗体及Western blot化学发光工作液均购自美国Santa Cruz公司;cDAN反转录试剂盒购自美国Bio-red;RNA抽提试剂盒、SYBR Green由德国Qiagen公司生产;目的基因和内参基因的引物由上海生工生物工程有限公司设计并合成;Cell Counting Kit-8(CCK-8)由日本Dojindo公司生产。
1.2 方法 1.2.1 细胞培养用含10%FBS、100 u/ml青霉素和0.1 mg/ml链霉素的RPMI 1640培养液培养细胞,在37℃、5%CO2、95%湿度条件下孵育细胞。各组细胞贴壁后分别加入DAPT、LY294002、DAPT+LY294002,使阻滞剂的终浓度为20 μmol/L。
1.2.2 Western blot检测收集DAPT、LY294002或者两种药物联合处理的不同时间点的OE33细胞,加Pierce裂解液裂解细胞,离心取上清液,应用BCA蛋白定量试剂盒测定蛋白浓度,SDA-PAGE电泳分离,每孔上样量为20 μg,PVDF膜转膜,加入5%脱脂牛奶室温封闭非特异性抗原1 h,TBST洗3遍,每遍10 min;加入相应的一抗,4℃条件孵育过夜,TBST洗3遍,每遍洗10 min;加入相应二抗,室温孵育1 h,TBST洗3遍,化学发光法显影,采集图像,使用图像分析软件FluroChem 5500进行灰度值分析比较,每组实验至少重复3次。
1.2.3 Real-time PCR法用RNA提取试剂盒提取各组细胞RNA,Nanaodrop2000检查RNA浓度、凝胶电泳检测RNA的质量,按照cDNA反转录试剂盒说明书把RNA反转录合成cDNA。SYBR Green作为荧光染料,采用两步法进行PCR扩增,反应体系为10 μl,反应条件:50℃ 2 min;95℃ 10 min; 95℃ 15 s、 60℃ 1 min,45次循环,内参为GAPDH,采用2-ΔΔCt法计算各目的mRNA的相对表达水平,各基因引物序列如下,见表 1。
取对数生长期的OE33细胞,每孔100 μl细胞悬液(约3×103个细胞)接种于96孔板内,贴壁后加入浓度为20 μmol/L的DAPT或(和)LY294002,分别培养48和72 h,弃掉培养液,每孔加100 μl新鲜培养液+10 μl CCK8,培养箱孵育2 h,酶标仪检测450 nm处吸光值;对照组不加药物处理,空白组只加培养液+CCK8试剂,每组实验设置5个复孔,每组实验至少重复3次。按照CCK-8说明书提供的公式,计算细胞增殖抑制率。
1.2.5 细胞侵袭实验Matrigel用不含FBS的RPMI 1640培养液1:20比例稀释,每孔50 μl铺于小室上室,37℃培养箱干燥不少于2 h;用无血清的RPMI 1640培养液重悬的细胞,取200 μl约1×104个细胞接种于Transwell小室上室,加入含 DAPT或(和)LY294002,使其终浓度为20 μmol/L,下室加入600 μl含10%FBS的培养液;培养36 h后,弃去培养液,用棉签轻轻擦去小室上层未穿出的细胞,PBS洗2遍,4%多聚甲醛固定30 min;0.1%结晶紫染色30 min,PBS洗3遍以上;200倍倒置显微镜随机选取5个视野拍照,记数细胞;实验至少重复3次。
1.2.6 细胞划痕实验将OE33细胞接种于12孔板,12孔板底面用Marker笔画2条平行标记线,待细胞融合90%以上时,用200 μl枪头在单层细胞表面垂直于标记线划痕,用PBS洗去脱落细胞碎片,重新加入含1%FBS培养液2 ml,加入DAPT或(和)LY294002,使其终浓度为20 μmol/L,孵育24、48 h后,倒置显微镜拍照,Image J软件进行分析,计算抑制率,每组实验重复3次。
1.3 统计学方法所有实验数据均采用STATA统计软件进行分析。计量资料实验数据以均数±标准差(x±s)表示,采用单因素方差分析进行多组间的比较,P<0.05为差异具有统计学意义。
2 结果 2.1 Western blot结果在OE33细胞中使用Notch信号通路阻滞剂DAPT后,Notch信号通路相关蛋白NICD(P=0.004)和Hes1(P=0.005)的表达较对照组下降,而PI3K信号通路相关蛋白p-Akt(P=0.04)的表达上调;与对照组相比,应用PI3K/Akt信号通路阻滞剂LY294002不仅能降低p-Akt(P=0.000)的蛋白表达水平, 同时还能比DAPT处理组更显著的降低Hes1(P=0.030)的蛋白表达水平,但是NICD蛋白(P=0.000)表达水平反而较对照组明显增高;应用DAPT、LY294002联合处理OE33细胞24 h后可使Notch1、p-Akt、Hesl的蛋白表达明显降低(P=0.007, 0.000, 0.000)。各处理中PTEN蛋白表达均较对照组有一定程度升高(均P=0.000),且差异均具有统计学意义,见图 1。
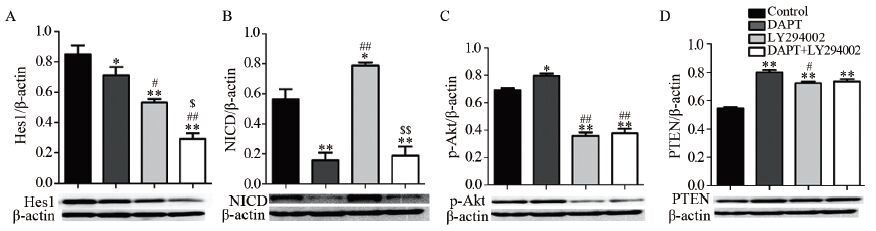
|
| *: P< 0.05, **: P<0.01, compared with control group; #: P<0.05, ##: P<0.01,compared with DAPT group; $: P<0.05, $$: P<0.01,compared with LY294002 group 图 1 不同药物处理OE33细胞后Hes1(A)、NICD(B)、p-Akt(C)、PTEN(D)蛋白的表达情况 Figure 1 Hes1(A), NICD(B), p-Akt(C) and PTEN(D) protein expression in OE33 cells after treated with different drugs |
DAPT处理OE33细胞24 h后,Hes1 mRNA表达水平较对照组明显下降(P=0.036);与之相反,LY294002处理OE33细胞24 h后,Hes1 mRNA表达上调(P=0.000);应用DAPT、LY294002联合处理OE33细胞,Hes1 mRNA表达无明显变化(P=1.000);DAPT、LY294002、DAPT+LY294002处理组的PTEN mRNA表达水平较对照组升高(P=0.043, 0.000, 0.000),但各组间Notch1 mRNA表达水平无明显变化(P均=1.000),差异无统计学意义,见图 2。
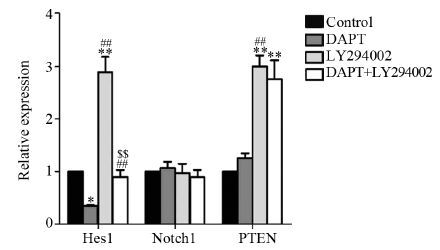
|
| *: P<0.05, **: P<0.01, compared with control group; ##: P<0.01,compared with DAPT group; $$: P<0.01, compared with LY294002 group 图 2 不同药物处理OE33细胞后目的基因的相对表达量 Figure 2 Relative expression of target genes in OE33 cells after treated with different drugs |
两种信号通路阻滞剂DAPT和LY294002单独或者联合处理OE33细胞均可一定程度抑制食管腺癌细胞的增殖,DAPT处理组对细胞增殖的抑制作用最弱,96 h抑制增殖率为(17.35±1.64)%(P=0.042),LY294002处理组次之为(61.62±7.32)%(P=0.000),DAPT、LY294002阻滞剂联合处理组对细胞增殖的抑制作用最明显,抑制率为(82.02±3.45)%(P=0.000),差异具有统计学意义,见图 3。
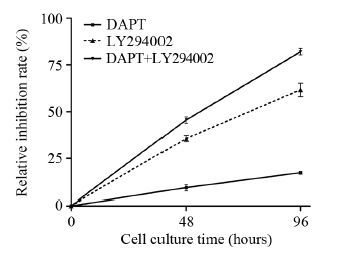
|
| 图 3 不同阻滞剂处理OE33细胞后细胞增殖抑制率的变化 Figure 3 Changes of inhibition rates of OE33 cells proliferation after treated with different drugs |
200倍镜下观察DAPT、LY294002两种信号通路阻滞剂单独或者联合处理OE33细胞36 h后的穿膜细胞数,发现细胞的侵袭能力均有一定程度的减弱。对照组的穿膜细胞数为(53.3±5.26)个/孔。DAPT、LY294002单独处理组与对照组相比,细胞的穿膜数减少,分别为(39.6±2.66)个/孔(P=0.012)、(24.4±2.74)个/孔(P=0.000);两药联合处理组的侵袭细胞数比LY294002处理组更少,为(13.3±3.68)个/孔(P=0.004),差异具有统计学意义,见图 4~5。
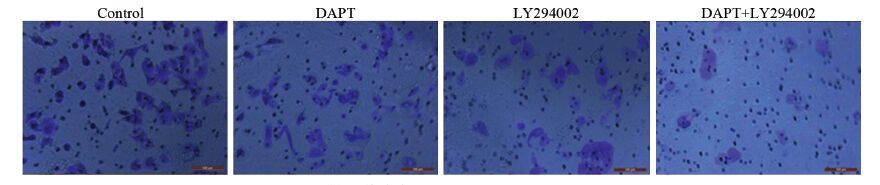
|
| 图 4 不同药物处理OE33细胞后侵袭实验结果 (结晶紫染色 ×200) Figure 4 Transwell invasion assay of OE33 cells after treated with different drugs (Cristal violet staining ×200) |

|
| **: P<0.01, compared with control group; ##: P<0.01, compared with DAPT group; $: P<0.05, compared with LY294002 group 图 5 不同药物处理OE33细胞后侵袭力的比较 Figure 5 Comparison of invasion abilities of OE33 cells after treated with different drugs |
细胞划痕24、48 h后倒置显微镜下观察可见两种信号通路阻滞剂DAPT和LY294002单独或者联合处理OE33后,细胞的划痕愈合能力均可受到抑制。对照组愈合率为(86.61±5.61),DAPT、LY294002两药联合处理组OE33细胞的愈合划痕能力较对照组减弱最明显,48 h愈合率为(40.51±3.10)%(P=0.000);LY29402处理组次之(P=0.000),为(52.88±4.23)%(P=0.006),见图 6。
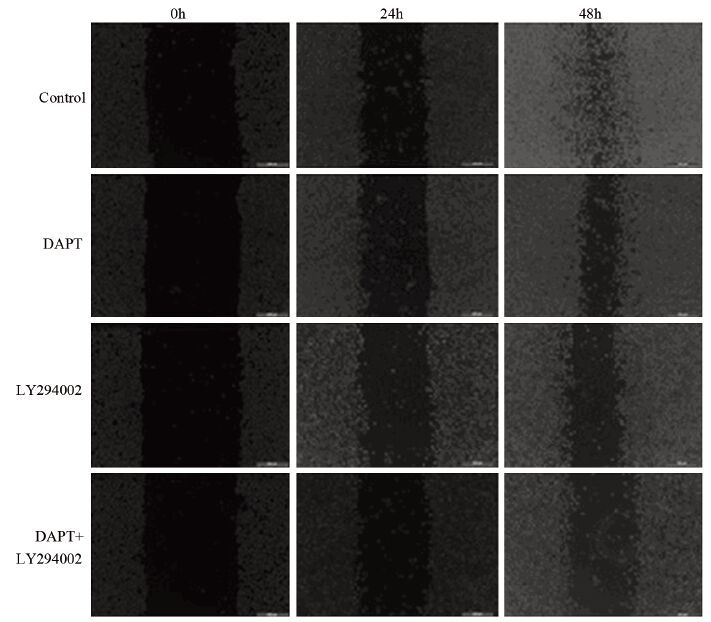
|
| 图 6 不同药物处理OE33细胞后划痕实验结果 Figure 6 Wound healing assay of OE33 cells after treated with different drugs |
Notch信号通路是一条高度保守的通路,参与乳腺癌、结肠癌、胰腺癌等多种肿瘤的发生。近来,该通路已经视为新的肿瘤治疗靶点,广泛用于肿瘤药物方面的研究[14-15]。Notch1信号通路主要有4种受体、相应的配体及下游靶基因组成,该通路下游的关键靶基因主要有发状断裂促进因子1(hairy enhance of split-1, Hes1)、细胞周期蛋白D1(cyclin D1)和MYC[16]。其中,Notch1受体在经过包括γ蛋白水解酶水解在内的两次水解后能够释放其活性成分NICD(notch intracellular domain), 释放后的NICD能够进入核内激活相应靶基因,从而发挥生物学效应。DAPT是一种γ分泌酶抑制剂(gamma-secretase inhibitor, GSI)能够特异性的抑制Notch信号通路γ蛋白水解酶,从而抑制NICD的释放、阻断Notch1信号通路的激活。PI3K/Akt信号通路在细胞代谢、增殖、细胞周期和生存等细胞功能中发挥重要作用,其中磷脂酰肌醇-3-激酶(phosphatidylinositol -3-kinase, PI3k)和同源性磷酸酶-张力蛋白(phosphatase and tensin homolog, PTEN)分别是该信号通路中调节细胞生长、增殖的主要正、负调节因子[17]。PTEN作为PI3K/Akt信号通路的主要抑制因子,能够通过将细胞膜上的磷脂酰肌醇-3-磷酸(PIP3)去磷酸化生成磷脂酰肌醇-2-磷酸(PIP2),从而抑制PI3K对细胞生长、增殖、代谢和存活信号的介导。PI3k和PTEN突变在人类肿瘤中较常见,两者的突变将导致PI3K/Akt信号通路异常活化,诱发肿瘤的发生。PI3K/Akt还可以与细胞内的其他信号通路相互作用,共同参与细胞的生长、增殖、分化的调控[18]。LY294002是一种PI3K/Akt信号通路的阻滞剂,能够抑制PI3K及Akt的磷酸化,从而抑制该信号同路的转导。
之前研究显示:在人类T淋巴细胞白血病(T-cell acute lymphoblastic leukaemia, T-ALL)中,激活的Notch通路能够通过下游靶基因Hes1抑制PTEN的表达从而使PI3K/Akt通路活化[19]。在T淋巴细胞发育的过程中也发现Notch1通路能够通过Hes1抑制抑癌基因PTEN的表达,使PI3K/Akt通路的负性调控减弱,从而调节T细胞的分化、生存和代谢[20]。Hes1作为一种转录抑制因子能够通过抑制抑癌基因PTEN的表达,促使Notch通路的癌基因成瘾性转移至PI3K/Akt通路。本实验研究结果显示,抑制Notch信号通路能引起Notch通路相关蛋白NICD、Hes1的蛋白表达水平下调,而PTEN的表达增加。Hes1蛋白的下调使其对PTEN的抑制作用减弱,而后者作为PI3K/Akt通路的负性调控因子,其表达上调必然引起PI3K/Akt通路的负性调控增加,该通路下游相关分子Akt的磷酸化减弱。但是,与此不同,本实验的Western bolt结果显示:抑制Notch1通路时,p-Akt蛋白反而表达上调。因此,这些结果提示在食管腺癌细胞OE33中,Notch信号通路除了可以直接通过PTEN负性调控PI3K/Akt通路,还可能通过其他的机制间接上调PI3K/Akt信号通路的表达。在神经胶质瘤细胞中的研究也发现,Notch1能正向调控的PI3K/Akt信号通路,调控细胞的增殖和凋亡[21]。
Western bolt结果还显示:PI3K/Akt通路阻滞剂LY294002在抑制p-Akt蛋白表达的同时,还能使活化的NICD释放水平增加,这提示在食管腺癌细胞OE33中LY294002抑制PI3K/Akt通路的同时,还可使Notch1信号通路一定程度的活化。类似的研究结果也在T-ALL中证实:在T-ALL中单独抑制PI3K/Akt通路能引起Notch-MYC信号通路的表达广泛性上调,从而引起细胞的不良反应[22]。除此之外,本研究还发现,LY294002阻断PI3K/Akt通路后能引起Notch1下游靶基因Hes1的蛋白表达明显降低,且其降低幅度大于DAPT处理组,但Hes1 mRNA表达反而升高。进一步提示我们:在OE33细胞中,PI3K/Akt通路还可能参与其下游靶分子Hes1转录翻译过程的调控,增加Hes1蛋白的表达;Hes1蛋白的表达可能同时受两条信号通路的共同调控。但是,PI3K/Akt通路上调Hes1蛋白表达的具体机制还有待进一步证实。
根据细胞增殖、侵袭、迁移实验结果,我们发现抑制Notch通路可一定程度抑制OE33的增殖、侵袭和迁移能力。之前研究也显示,在食管腺癌异种移植模型中应用GSI阻断Notch信号,能有效的抑制EAC的生长并改善对化疗药物的耐药[11]。同样,抑制PI3K/Ak通路也可使食管腺癌细胞OE33的增殖、侵袭和迁移受到抑制。但是,与单一用药相比,当DAPT和LY294002两种信号通路阻滞剂联合处理OE33细胞时,对食管腺癌细胞的增殖、迁移、侵袭能力抑制作用最为明显。目前,抑制Notch和PI3K/Akt信号通路能引起食管腺癌细胞生长及侵袭行为减弱的具体机制还不清楚,需要进一步探索。
综合上述研究结果,发现在食管腺癌细胞OE33中Notch1和PI3K/Akt两条通路的活化与食管腺癌细胞的增殖、侵袭及迁移有关,阻滞两条信号通路能够有效抑制细胞的增殖、侵袭和迁移。多项体内和体外研究显示,在Notch或PI3K/Akt通路异常活化的其他恶性肿瘤中,使用阻滞剂阻滞Notch或PI3K/Akt通路也能够一定程度抑制肿瘤的进展[8, 23-25]。与此同时,我们还发现两条信号通路在食管腺癌细胞中存在相互调控,单一的阻断一条信号通路会引起另一条信号通路一定程度的代偿性表达上调,同时抑制两条信号通路能更好的抑制食管腺癌细胞的增殖、迁移和侵袭。因此,相较于单独抑制一条信号通路,联合阻滞Notch和PI3K/Akt两条通路在未来食管腺癌防治研究中具有更好的前景,有望为食管腺癌的治疗带来新的希望。另外,Hes1作为两条信号通路共同的下游靶分子,在两条信号通路的相互调控中可能具有重要作用。由于两种通路在人类细胞的正常生长过程中也具有重要作用,同时阻断两种信号通路,势必会抑制正常细胞的生长发育[6-7]。因此,将来有望设计针对两条通路下游分子Hes1的临床靶向药物,特异性的阻断Hes1及其下游分子,抑制食管腺癌细胞的侵袭和转移,同时减少不良反应。当然,联合抑制两条信号通路或以Hes1为靶的药物对食管腺癌的治疗效果还有待进一步的动物实验及临床试验研究。如果研究成果能够应用于临床,将有望提高食管腺癌的治疗效果,降低肿瘤的复发率及转移率。
总之,Notch和PI3K/Akt信号通路在食管腺癌细胞中的作用及联系为将来研究双重抑制两种信号通路或联合Hes1靶向药物治疗食管腺癌提供了理论基础;同时,还将为Notch和PI3K/Akt信号异常活化的其他恶性肿瘤的防治提供借鉴。
| [1] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136 (5) : E359–86. DOI:10.1002/ijc.29210 |
| [2] | Arnold M, Soerjomataram I, Ferlay J, et al. Global incidence of oesophageal cancer by histological subtype in 2012[J]. Gut, 2015, 64 (3) : 381–7. DOI:10.1136/gutjnl-2014-308124 |
| [3] | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62 (1) : 10–29. DOI:10.3322/caac.20138 |
| [4] | Rubenstein JH, Shaheen NJ. Epidemiology, Diagnosis, and Management of Esophageal Adenocarcinoma[J]. Gastroenterology, 2015, 149 (2) : 302–17. DOI:10.1053/j.gastro.2015.04.053 |
| [5] | Kim TH, Shivdasani RA. Notch signaling in stomach epithelial stem cell homeostasis[J]. J Exp Med, 2011, 208 (4) : 677–88. DOI:10.1084/jem.20101737 |
| [6] | Penton AL, Leonard LD, Spinner NB. Notch signaling in human development and disease[J]. Seminars Cell Dev Bio, 2012, 23 (4) : 450–7. DOI:10.1016/j.semcdb.2012.01.010 |
| [7] | Vanhaesebroeck B, Guillermet-Guibert J, Graupera M, et al. The emerging mechanisms of isoform-specific PI3K signalling[J]. Nat Rev Mol Cell Biol, 2010, 11 (5) : 329–41. |
| [8] | Li B, Li J, Xu WW, et al. Suppression of esophageal tumor growth and chemoresistance by directly targeting the PI3K/AKT pathway[J]. Oncotarget, 2014, 5 (22) : 11576–87. DOI:10.18632/oncotarget |
| [9] | Davis NM, Sokolosky M, Stadelman K, et al. Deregulation of the EGFR/PI3K/PTEN/Akt/mTORC1 pathway in breast cancer: possibilities for therapeutic intervention[J]. Oncotarget, 2014, 5 (13) : 4603–50. DOI:10.18632/oncotarget |
| [10] | Fruman DA, Rommel C. PI3K and cancer: lessons, challenges and opportunities[J]. Nat Rev Drug Discov, 2014, 13 (2) : 140–56. DOI:10.1038/nrd4204 |
| [11] | Wang Z, Da Silva TG, Jin K, et al. Notch signaling drives stemness and tumorigenicity of esophageal adenocarcinoma[J]. Cancer Res, 2014, 74 (21) : 6364–74. DOI:10.1158/0008-5472.CAN-14-2051 |
| [12] | Mendelson J, Song SM, Li Y, et al. Dysfunctional transforming growth factor-β signaling with constitutively active Notch signaling in Barrett’s esophageal adenocarcinoma[J]. Cancer, 2011, 117 (16) : 3691–702. DOI:10.1002/cncr.25861 |
| [13] | Clemons NJ, Phillips WA, Lord RV. Signaling pathways in the molecular pathogenesis of adenocarcinomas of the esophagus and gastroesophageal junction[J]. Cancer Biol Ther, 2013, 14 (9) : 782–95. DOI:10.4161/cbt.25362 |
| [14] | Ranganathan P, Weaver KL, Capobianco AJ. Notch signalling in solid tumours: a little bit of everything but not all the time[J]. Nat Rev Cancer, 2011, 11 (5) : 338–51. DOI:10.1038/nrc3035 |
| [15] | Yatim A, Benne C, Sobhian B, et al. NOTCH1 nuclear interactome reveals key regulators of its transcriptional activity and oncogenic function[J]. Mol Cell, 2012, 48 (3) : 445–58. DOI:10.1016/j.molcel.2012.08.022 |
| [16] | Capaccione KM, Pine SR. The Notch signaling pathway as a mediator of tumor survival[J]. Carcinogenesis, 2013, 34 (7) : 1420–30. DOI:10.1093/carcin/bgt127 |
| [17] | Chalhoub N, Baker SJ. PTEN and the PI3-Kinase pathway in cancer[J]. Annu Rev Pathol, 2009, 4 : 127–50. DOI:10.1146/annurev.pathol.4.110807.092311 |
| [18] | Wei L, Xu Z. Cross-signaling among phosphinositide-3 kinase, mitogen-activated protein kinase and sonic hedgehog pathways exists in esophageal cancer[J]. Int J Cancer, 2011, 129 (2) : 275–84. DOI:10.1002/ijc.25673 |
| [19] | Palomero T, Dominguez M, Ferrando AA. The role of the PTEN/AKT pathway in NOTCH1-induced leukemia[J]. Cell Cycle, 2008, 7 (8) : 965–70. DOI:10.4161/cc.7.8.5753 |
| [20] | Wong GW, Knowles GC, Mak TW, et al. HES1 opposes a PTEN-dependent check on survival, differentiation, and proliferation of TCRβ-selected mouse thymocytes[J]. Blood, 2012, 120 (7) : 1439–48. DOI:10.1182/blood-2011-12-395319 |
| [21] | Zhao N, Guo Y, Zhang M, et al. Akt-mTOR signaling is involved in Notch-1-mediated glioma cell survival and proliferation[J]. Oncol Rep, 2010, 23 (5) : 1443–7. |
| [22] | Shepherd C, Banerjee L, Cheung CW, et al. PI3K/mTOR inhibition upregulates NOTCH-MYC signalling leading to an impaired cytotoxic response[J]. Leukemia, 2013, 27 (3) : 650–60. DOI:10.1038/leu.2012.285 |
| [23] | Bolós V, Mira E, Martínez-Poveda B, et al. Notch activation stimulates migration of breast cancer cells and promotes tumor growth[J]. Breast Cancer Res, 2013, 15 (4) : R54. DOI:10.1186/bcr3447 |
| [24] | Koduru S, Kumar R, Srinivasan S, et al. Notch-1 inhibition by Withaferin-A: a therapeutic target against colon carcinogenesis[J]. Mol Cancer Ther, 2010, 9 (1) : 202–10. DOI:10.1158/1535-7163.MCT-09-0771 |
| [25] | Bressanin D, Evangelisti C, Ricci F, et al. Harnessing the PI3K/Akt/mTOR pathway in T-cell acute lymphoblastic leukemia: Eliminating activity by targeting at different levels[J]. Oncotarget, 2012, 3 (8) : 811–23. DOI:10.18632/oncotarget |
 2016, Vol. 43
2016, Vol. 43



