文章信息
- 临床分期为ⅢA(N2)期非小细胞肺癌放射治疗的预后分析
- Prognosis of Clinical Stage ⅢA(N2) Non-small Cell Lung Cancer Patients Received Ming, QIAO Xueying
- 肿瘤防治研究, 2016, 43(6): 526-530
- Cancer Research on Prevention and Treatment, 2016, 43(6): 526-530
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.06.018
- 收稿日期: 2015-10-13
- 修回日期: 2016-03-05
肺癌是全球常见的恶性肿瘤之一,也是目前世界范围内发病率和死亡率较高的恶性肿瘤[1],且呈逐年升高的趋势。非小细胞肺癌(non-smallcell lung cancer,NSCLC)约占肺癌的80%,其中ⅢA-N2期约占NSCLC的20%。ⅢA(N2)期NSCLC肿瘤防治研究2016年第43卷第6期 Cancer Res Prev Treat,2016,Vol.43,No.6 ·527·是一组具有高度异质性的群体,其预后较差。目前对于ⅢA(N2)期NSCLC患者的治疗策略仍存在较大争议,缺乏公认的最佳治疗方案[2],尤其是临床诊断为N2期的患者。随着放疗技术地不断改进和更新,三维适形放疗和调强放疗已经广泛应用于临床,这些技术能够在更精确地确保靶区照射剂量的同时充分保护周围的正常组织。因此本研究回顾性分析了2010年1月1日—2011年12月31日于河北医科大学第四医院收治的临床诊断为ⅢA(N2)期非小细胞肺癌患者共113例,旨在探讨放射治疗对ⅢA(N2)期非小细胞肺癌患者的疗效,并分析影响预后的相关因素,为改善该期患者的治疗提供依据。
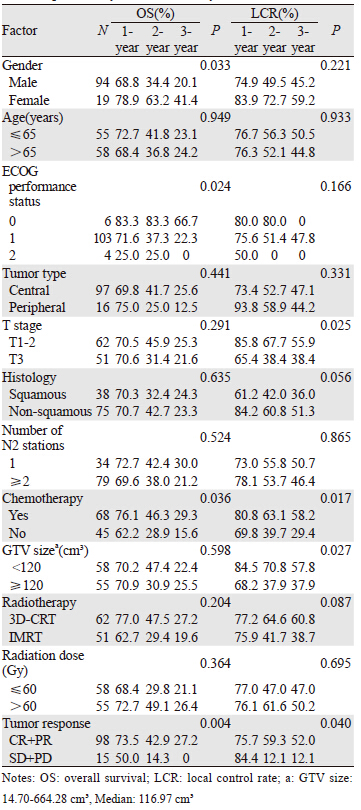
1 资料与方法 1.1 临床资料收集2010年1月1日—2011年12月31日于河北医科大学第四医院放疗科收治的临床诊断为ⅢA(N2)期NSCLC患者共113例,其中男94例,女19例;年龄30~85岁,中位年龄66岁;中央型肺癌97例,周围型肺癌16例;T1期9例,T2期53例,T3期51例;采用三维适形放疗62例,调强放疗51例,见表 1。
|
入组标准:ECOG评分≤2分;经细胞学、组织病理学证实或临床诊断为NSCLC患者;治疗前经过详细的分期检查排除远处转移,根据国际肺癌研究学会2009年第7版TNM分期标准确认为ⅢA(N2)期NSCLC(疗前影像学诊断皆为N2);未行手术切除者(包括手术不能完全切除、合并某些基础疾病不能手术或拒绝手术者)。剔除标准:既往行胸部放疗者;第二原发肿瘤。放疗前检查项目:血常规、肝肾功能、肿瘤标志物、心电图、气管镜或肺穿刺病理学诊断、胸部增强MRI或CT、腹部CT、头颅增强MRI及全身骨扫描。
1.2 治疗方法所有患者均采用体部热塑膜固定,CT模拟机定位增强扫描,层厚为3 mm,范围由上颈部至横膈水平以下(两侧肺全部在扫描范围之内),传输至三维治疗计划系统。全部患者均采用累及野照射。靶区勾画:大体肿瘤体积(GTV),包括影像学肉眼所见的原发肿瘤及纵隔转移淋巴结(淋巴结短径≥1 cm;淋巴结短径<1 cm,但同一个区域内有多个小的淋巴结);临床靶体积(CTV)为GTV均匀外扩6~8 mm,并根据周围解剖结构进行适当修改;计划靶体积(PTV)为CTV外扩5~10 mm。采用三维适形或调强放疗,95%PTV处方剂量为50~71.8 Gy,中位剂量60 Gy,6MV-X线照射,1次/日,5次/周。危及器官的限量:双肺V20≤30%,V30≤20%;脊髓<45 Gy;心脏V40≤30%。全组病例单纯放疗45例,放化疗综合治疗68例,其中同期放化疗27例,序贯放化疗41例。未行化疗的原因包括患者高龄、体质较弱或合并基础疾病不能耐受化疗及患者拒绝。主要采用以铂类为基础的两药联合化疗方案,化疗1~6周期,中位化疗周期为3周期。全组非鳞癌患者中共5例应用靶向治疗,其中3例为局部复发或进展后应用。
1.3 疗效及不良反应评价标准全组患者在放疗结束1月内复查胸部CT,参照RECIST标准评价近期疗效,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),总有效率为(CR+PR)。正常组织急性反应按RTOG标准评价。总生存期(OS):从首诊治疗开始计算至死亡或末次随访为止。无病生存期(DFS):从首诊治疗开始至疾病进展复发、死亡或末次随访时间。
1.4 随访及统计学方法随访时间从治疗第1天开始,末次随访日至2014年10月31日,随访时间为2~55月,中位随访时间19月。运用SPSS13.0统计软件对组间资料比较行t检验、χ2检验;Kaplan-Meier法计算总生存率、局部控制率和无病生存率,并用Log rank法进行差异性检验;Cox回归模型进行多因素分析;P<0.05为差异有统计学意义。
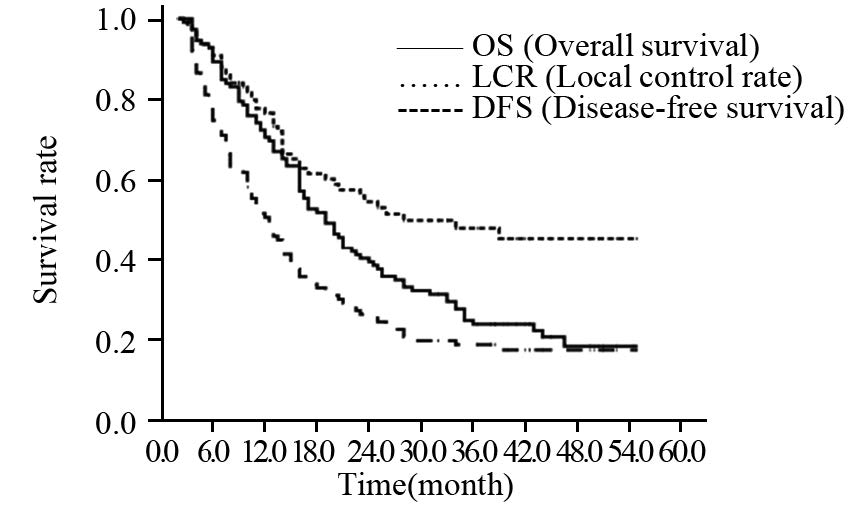
2 结果 2.1 近期疗效及生存全组患者放疗结束1 月内评价近期疗效:CR 3例,PR 95例,SD 14例,PD 1例,总有效率(CR+PR)为86.7%。全组1、2、3年生存率分别为70.5%、39.3%、23.8%,中位生存时间19.0月;1、2、3年局部控制率分别为76.6%、54.5%、47.9%,中位局控时间28.0月;1、2、3年无病生存率分别为50.6%、25.3%、18.7%,中位无病生存时间12.5月,见图 1。
|
| 图 1 全组患者生存情况 Figure 1 OS, LCR and DFS curves of entire patients |
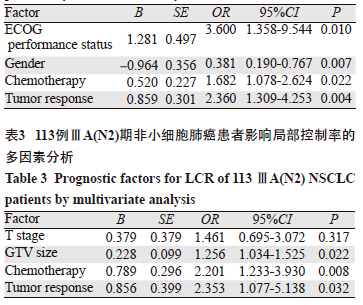
单因素分析显示,性别、ECOG评分、是否化疗和近期疗效是影响ⅢA(N2)期NSCLC患者总生存率的预后因素;T分期、GTV大小、是否化疗和近期疗效是影响局部控制率的预后因素,见表 1。将以上影响预后的单因素纳入Cox回归模型进行多因素分析,结果显示性别、ECOG评分、是否化疗和近期疗效是影响总生存率的独立预后因素,GTV大小、是否化疗和近期疗效是影响局部控制率的独立预后因素,见表 2、3。进一步将化疗方式进行亚组分析,结果显示同期放化疗的1、2、3年生存率为80.8%、50.0%、30.8%,序贯放化疗的1、2、3年生存率为73.2%、43.9%、28.3%,两种放化疗生存率差异无统计学意义(P=0.108)。
|

|
全部患者均顺利完成治疗计划,全组≥2级放射性肺炎发生率为13.3%(15/113),其中单纯放疗组7例,同期放化疗组5例,序贯放化疗组3例,三组患者放射性肺炎发生率差异无统计学意义(χ2=0.716,P=0.699)。≥2级放射性食管炎发生率为5.3% (6/113),无3、4级以上食管毒性损伤,其中单纯放疗组1例,同期放化疗组4例,序贯放化疗组1例,三组患者放射性食管炎发生率差异无统计学意义(χ2=0.000,P=1.000)。≥2级血液学毒性反应20例(17.7%),其中单纯放疗组2例,同期放化疗组13例,序贯放化疗组5例,三组患者血液学毒性发生率差异有统计学意义(χ2=22.298,P=0.000);且同期放化疗组中33.3%(9/27)发生≥3级血液学毒性,序贯放化疗组仅7.3%(3/41)发生≥3级血液学毒性。
2.4 首次失败原因全组共有88例治疗失败,首次失败原因为局部区域复发36例(31.9%),远处转移47例(41.6%),同时出现局部区域复发+远处转移5例(4.4%)。
3 讨论外科治疗是可切除的ⅢA(N2)期NSCLC患者的首选方式,其术后5年生存率为17%~25%,中位生存期为16~26月[3-4]。然而对于部分手术不能完全切除或合并某些基础疾病的ⅢA(N2)期NSCLC患者则首选以放射治疗为主的综合治疗。相关文献[5-7]已报道了三维适形放疗在ⅢA期NSCLC治疗中的优越性。Albain等[5]报道194例ⅢA(N2)期患者接受了放化疗,结果显示中位生存时间为22.2月,中位无疾病生存时间为10.5月。朱向帜等[6]对接受三维适形放疗的113例Ⅲ期NSCLC患者进行报道,显示全组患者的1、2、3年总生存率和中位生存时间分别为60.7%、31.6%、22.4%和17.0月。本研究全组患者1、2、3年的总生存率分别为70.5%、39.3%、23.8%,中位生存时间19.0月,与既往报道的生存率相似。
目前放化联合治疗已成为局部晚期NSCLC的标准治疗方案,既往多数研究结果显示同期放化疗要优于序贯放化疗。Wang等[8]将237例Ⅲ期NSCLC患者分成单纯放疗组、序贯放化疗组和同期放化疗组三组,结果显示三组的中位生存期分别为7.4、14.9和15.8月,5年生存率分别为3.3%、7.5%和19.4%(P<0.001)。急性不良反应方面同期放化疗组较序贯放化疗组增加,但远期不良反应相似。Auperin等[9]发表的关于同期放化疗对比序贯放化疗的一项Meta分析中,也显示了同期放化疗的优势。该研究共收集了1 025例局部晚期NSCLC患者,中位随访时间6年,结果显示同期放化疗组的3年和5年生存率较序贯放化疗组分别提高了5.7%和4.5%。同期放化疗组增加了急性放射性食管炎的发生率,由4.0%提高至18.0%(P<0.01),急性放射性肺炎两组的发生率并未见统计学差异。本研究中放化联合治疗较单纯放疗生存率明显提高,差异具有统计学意义(P=0.036),联合化疗和未联合化疗中位生存时间分别为22.0月和14.5月。提示联合化疗提高了生存期,建议在患者身体状况能耐受的情况下尽量采用放化综合治疗。我们进一步将化疗和放疗联合方式进行分层分析,结果显示同期放化疗和序贯放化疗的1、2、3年生存率分别为80.8%、50.0%、30.8%和73.2%、43.9%、28.3%,P>0.05。原因可能是同期放化疗增加了≥3级血液学毒性发生概率,降低了化疗药物的强度或延长了放疗时间,也可能与本研究中化疗周期的选择及随访时间较短有关。不良反应方面本研究结果显示同期放化疗组增加了血液学毒性发生概率,放射性肺炎、放射性食管炎的发生概率相近。有关影响放射性肺炎的因素很多,其中正常肺组织的受照剂量是放射性肺炎发生的重要因素之一,但本研究并未进行此方面的探讨,有待进一步研究。且本研究的化疗方案采用以铂类为基础的两药联合化疗方案,同期放化疗中在化疗药物的选择上,并无可增加放射性肺炎的吉西他滨等药物。
有关影响ⅢA期NSCLC放射治疗的预后影响因素各报道不尽相同,本研究影响ⅢA(N2)期NSCLC患者的预后因素与多数文献报道相似。McGovern等[10]分析了831例Ⅰ~Ⅲ期NSCLC患者关于性别对放射治疗疗效有无差别,其中男性512例,女性319例,结果显示女性的5年总生存率、无进展生存率和无远处转移生存率均明显高于男性。本研究也得出性别是影响总生存率的独立预后因素,女性的中位生存期29月,明显高于男性的中位生存期18月。Wang等[8]对237例Ⅲ期NSCLC患者的临床资料进行多因素分析显示,体力状况评分是影响生存的独立预后因素。朱向帜等[6]研究也显示卡氏评分是影响患者生存期的独立因素。同样本研究中ECOG评分是影响总生存率的独立预后因素,ECOG评分为0分者的生存期明显高于2分者。一些研究表明[11-13]肿瘤体积是影响行三维适形放疗的NSCLC患者预后的重要因素,肿瘤体积小者其中位生存期要长。Basaki等[11]研究得出肿瘤体积>85 cm3的患者2年生存率明显低于肿瘤体积<85cm3的患者(P=0.0003),两组中位生存时间分别为11月和18月。王静等[13]研究显示大体肿瘤体积≤130 cm3组患者的中位生存期和总生存率显著高于大体肿瘤体积>130 cm3组患者,且为影响患者的独立预后因素。本研究按中位肿瘤体积分为<120cm3和≥120 cm3两组,多因素分析显示GTV是影响局部控制率的独立因素。原因可能是:GTV体积越大,乏氧细胞越多,以致肿瘤对放射线的敏感度减弱;而且肿瘤大小与肿瘤干细胞数目有关,肿瘤体积大者含肿瘤干细胞较多,其增殖较快,瘤负荷较大,放疗后不易控制或容易复发。同时本研究将原发肿瘤分为T1、T2、T3期,考虑到本组T1期患者仅有9例,故与T2期合并分析,单因素结果显示T分期是影响局部控制率的预后因素,但在多因素分析中T分期未见统计学意义。对本研究113例ⅢA(N2)期NSCLC患者放疗结束后1月内进行近期疗效评价,CR 3例,PR 95例,SD 14例,PD 1例,总有效率(CR+PR)为86.7%。多因素分析显示近期疗效是影响总生存率和局部控制率的独立预后因素,这与既往文献[6-7, 14]报道一致。放疗剂量一直以来也是局部晚期NSCLC临床治疗中较受关注的一个问题,然而到目前为止仍缺乏统一的剂量规定。RTOG0617试验[15]结果显示标准剂量(60 Gy)放疗比高剂量(74 Gy)放疗更安全有效。本研究中放疗组的中位放疗剂量为60 Gy,分析显示≤60 Gy组和>60 Gy组在总生存率和局部控制率方面差异均无统计学意义。本研究中还将年龄、肿瘤分型、病理类型、N2淋巴结转移站数、放疗方式等因素纳入分析,结果显示均对ⅢA(N2)期NSCLC的总生存率和局控率无统计学意义。
本研究结果提示,放射治疗是ⅢA(N2)期NSCLC的重要治疗手段,放化综合治疗疗效确切,不良反应可耐受,对于不可手术切除或不愿手术的患者应用放化疗为主的综合治疗是可行的替代选择。女性、ECOG评分良好、肿瘤体积小、近期疗效好者预后较好,联合化疗有生存获益。临床结果还有待于大宗病例随机对照试验进一步研究证实。
| [1] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64 (1) : 9–29. |
| [2] | Aggarwal C, Li L, Borghaei H, et al. Multidisciplinary therapy of stage ⅢA non-small-cell lung cancer: long-term outcome of chemoradiation with or without surgery[J]. Cancer Control, 2014, 21 (1) : 57–62. |
| [3] | Zhang LM, Liu XZ, Zhang ZF, et al. A clinical and prognostic retrospective analysis of ⅢA-N2 non-small cell lung cancer[J]. Zhonghua Wai Ke Za Zhi, 2010, 48 (9) : 690–3. [张连民, 刘喜增, 张真发, 等. ⅢA-N2期非小细胞肺癌切除术后影响预后的因素分析[J]. 中华外科杂志,2010, 48 (9) : 690–3. ] |
| [4] | Ma Q, Liu D, Guo Y, et al. Surgical therapeutic strategy for nonsmall cell lung cancer with mediastinal lymph node metastasis (N2)[J]. Zhongguo Fei Ai Za Zhi, 2010, 13 (4) : 342–8. |
| [5] | Albain KS, Swann RS, Rusch VW, et al. Radiotherapy plus chemotherapy with or without surgical resection for stage Ⅲ nonsmall-cell lung cancer: a phase Ⅲ randomised controlled trial[J]. Lancet, 2009, 374 (9687) : 379–86. |
| [6] | Zhu XZ, Wang LH, Ou GF, et al. Prognosis of locally advanced non small cell lung cancer treated with three dimentional conformal radiotherapy[J]. Zhonghua Zhong Liu Za Zhi, 2007, 29 (10) : 748–53. [朱向帜, 王绿化, 欧广飞, 等. 三维适形放射治疗局部晚期非小细胞肺癌预后因素分析[J]. 中华肿瘤杂志,2007, 29 (10) : 748–53. ] |
| [7] | Laine AM, Westover KD, Choy H, et al. Radiation therapy as a backbone of treatment of locally advanced non-small cell lung cancer[J]. Semin Oncol, 2014, 41 (1) : 57–68. |
| [8] | Wang L, Correa CR, Zhao L, et al. The effect of radiation dose and chemotherapy on overall survival in 237 patients with stage Ⅲ non-small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2009, 73 (5) : 1383–90. |
| [9] | Auperin A, Le Pechoux C, Rolland E, et al. Meta-analysis of concomitant versus sequential radiochemotherapy in locally advanced non-small-cell lung cancer[J]. J Clin Oncol, 2010, 28 (13) : 2181–90. |
| [10] | McGovern SL, Liao Z, Bucci MK, et al. Is sex associated with the outcome of patients treated with radiation for nonsmall cell lung cancer?[J]. Cancer, 2009, 115 (14) : 3233–42. |
| [11] | Basaki K, Abe Y, Kondo H, et al. Prognostic factors for survival in Stage Ⅲ non-small-cell lung cancer treated with definitive radiation therapy: impact of tumor volume[J]. Int J Radiat Oncol Biol Phys, 2006, 64 (2) : 449–54. |
| [12] | Kwan HC, Sung JA, Hong RP, et al. A phase Ⅱ study of synchronous three-dimensional conformal boost to the gross tumor volume for patients with unresectable Stage Ⅲ nonsmall-cell lung cancer: results of Korean Radiation Oncology Group 0301 study[J]. Int J Radiat Oncol Biol Phys, 2009, 74 (5) : 1397–404. |
| [13] | Wang J, Qiao XY, Jia JH, et al. Prognosis of three dimensional conformal radiotherapy of locally advanced non-small cell lung cancer with involved-field[J]. Cancer Res Prev Treat, 2011, 38 (2) : 195–8. [王静, 乔学英, 贾敬好, 等. 局部晚期非小细胞肺癌累及野三维适形放疗的预后分析[J]. 肿瘤防治研究,2011, 38 (2) : 195–8. ] |
| [14] | Lee DS, Kim YS, Kang JH, et al. Clinical responses and prognostic indicators of concurrent chemoradiation for non-small cell lung cancer[J]. Cancer Res Treat, 2011, 43 (1) : 32–41. |
| [15] | Bradley JD, Paulus R, Komaki R, et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage ⅢA or ⅢB non-small-cell lung cancer (RTOG 0617): a randomised, two-by-two factorial phase 3 study[J]. Lancet Oncol, 2015, 16 (2) : 187–99. |
 2016, Vol. 43
2016, Vol. 43


