文章信息
- 肺癌患者外周血中MMP-7 mRNA、sMICA、VEGF的表达及其与侵袭转移的关系
- Expressions of MMP-7 mRNA, sMICA, VEGF in Peripheral Blood of Lung Cancer Patients and Their Relationships with Invasion and Metastasis
- 肿瘤防治研究, 2016, 43(8): 508-512
- Cancer Research on Prevention and Treatment, 2016, 43(8): 508-512
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.06.015
- 收稿日期: 2015-10-14
- 修回日期: 2016-04-09
2. 300111 天津,天津市民政局老年病医院老年医学科;
3. 030001 太原,山西省肿瘤医院呼吸内科
2. Department of Geriatric Medicine, The Geriatric Hospital of Tianjin CivilAdministration Bureau, Tianjin 300111, China;
3. Department of Respiratory Medicine, ShanxiTumor Hospital, Taiyuan 030001, China
肺癌是常见的恶性肿瘤之一,其发病率、病死率高,侵袭转移是它的恶性标志和最本质特征,也是肺癌患者治疗失败的最主要原因。影响肺癌侵袭转移的肿瘤细胞外因素有很多,包括肿瘤血管的形成、细胞外基质重塑、肿瘤转移微环境、机体免疫等。基质金属蛋白酶(matrix metalloproteinases,MMPs)是参与胞外基质降解的重要酶。可溶性主要组织相容性复合体Ⅰ类相关分子A(soluble MHC classⅠ-related chain A,sMICA)通过诱导T细胞表面和NK细胞表面NKG2D发生内化降解,介导肿瘤免疫,同时跟非小细胞肺癌的转移预后密切相关[1]。血管内皮生长因子(vascularendothelial growth factor,VEGF)是肿瘤血管内皮增生主要的生长因子。本研究通过检测肺癌患者外周血中基质金属蛋白酶-7 mRNA(matrixmetalloproteinases-7 mRNA,MMP-7 mRNA)、sMICA、VEGF的表达,分析其与临床病理特征的关系以及彼此之间相关性,探讨它们与肺癌发生发展、浸润转移的关系。
1 资料与方法 1.1 临床资料收集2012年10月—2014年7月期间山西省肿瘤医院收治的肺癌患者110例。全部病例均具有完整的临床、影像学资料,经病理或细胞学证实且首次入院,未接受任何相关治疗,无肺间质性疾病。其中男74例、女36例,年龄37~78岁,中位年龄59岁。根据2009年国际抗癌联盟公布的肺癌国际分期进行临床分期,Ⅰ~ⅢA期肺癌患者35例、ⅢB期肺癌患者23例、Ⅳ期肺癌患者52例。根据组织病理分型,小细胞癌25例、腺癌48例、鳞癌37例。根据世界卫生组织2004年的肺癌组织学分型标准进行肺癌组织学分型,低分化51例、中高分化59例。对所有患者通过电话及复诊进行随访,随访截至2015年9月。40例健康体检职工和部分志愿者作为对照组,其中男24例、女16例,年龄分布在31~72岁,中位年龄56岁。
1.2 仪器和试剂ABIPRISM7000荧光定量PCR分析仪(美国Applied Biosystems公司),BioPhotometer Plus核酸蛋白测定仪(德国Eppendorf公司),全自动酶标仪(奥地利Biocell公司);TRIzol、QuantscriptRT Kit Quant cDNA第一链合成试剂盒、RealMaster Mix(SYBR Green)试剂盒(北京天根生物科技有限公司)。所有引物由上海基康生物技术有限公司合成。MICA ELISA试剂盒(美国RD公司);VEGF试剂盒(深圳晶美公司)。
1.3 外周血MMP-7 mRNA的检测 1.3.1 标本的采集及RNA提取空腹抽取患者外周血3 ml于乙二胺四乙酸(ethylene diamine tetraacetic acide,EDTA)抗凝真空采血管。取抗凝血5 ml加到3 ml淋巴细胞分离液中,1 800 r/min离心15 min。吸取白细胞层到1.5 ml的离心管,5 000 r/min再离心5 min。弃上清液后,PBS缓冲液洗两次,5 000 r/min再离心5min。弃上清液后,加700 μl TRIzol,用吸头抽吸多次,至完全溶解。加200 μl氯仿,剧烈振荡60 s,5 000 r/min再离心5 min取上清液1.5 ml,加入Rnase-free eppenbdorf管中,加等体积异丙醇混匀,静置5 min,12 000 r/min离心5 min,弃上清液,70%~75%乙醇700 μl洗两次,7 500 r/min离心3 min。弃上清液用吸水纸吸干,自然干燥。然后将RNA溶于11 μl焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水中,65℃水浴10 min,提取所得RNA -20℃保存。
1.3.2 引物序列MMP-F 5 ’ -CCAAATAGCCCAAAATGGACTTC-3’;MMP-R 5’-TGTAATATGCGGTAAGTCTCGAGTATATC-3’;GAPDH-R 5’-CATGGGTGGAATCATATTGGAAC-3’;GAPDH-F5’-CCATCAATGACCCCTTCATTG -3’。
1.3.3 RT-PCR检测cDNA的合成:取2 μl/g总RNA在20 μl反应体系中反转录成cDNA。该反应体系组成如下:oligo dT(15)2 μl,10×RTmix 2 μl,dNTP 2 μl,Quant ReverseTranscriptase 1 μl,RNA 2 μg,最后加入DEPC处理水补至20 μl。37℃温育60 min,-20℃保存备用。
荧光定量PCR的扩增:PCR反应体系为25 μl,以无菌纯H2O代替DNA模板作为阴性对照。PCR反应体系包括:2.5×Real Master Mix/20×SYBR solution11.25 μl,上下游引物(10 μmol/L)各1.25 μl,模板5 μl,其余用无菌去离子液补足。每个样品设3个复孔。反应条件:95℃预变性5 min,94℃ 45 s,60℃ 30 s,共40个循环。反应在ABI PRISM7000荧光定量PCR分析仪上进行。
1.3.4 结果判断甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内对照用来归一化MMP-7 mRNA表达水平。所有测定为双管重复。每次实验中系列浓度稀释后用来测定扩增效率。MMP-7 mRNA相对于GAPDH mRNA的相对表达计算公式如下:相对表达比率=2-ΔΔCT(ΔCTsample=CTsample - CTGAPDH)。
1.4 sMICA、VEGF的检测sMICA、VEGF采用酶联免疫吸附实验方法检 测,按照说明书操作。
1.5 统计学方法采用SPSS21.0统计软件进行统计分析。计量资料进行正态性检验,符合正态分布的数据进t检验或One-Way ANOVA,不符合正态分布的数据进行非参数检验Mann-Whitney U检验或Kruskal-Wallis检验。双变量相关性分析采用Pearson相关分析或Spearman相关分析,P<0.05为差异有统计学意义。
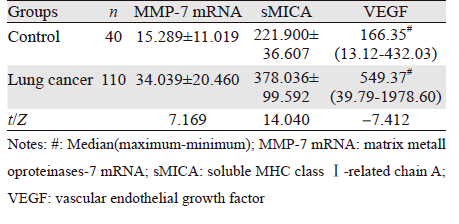
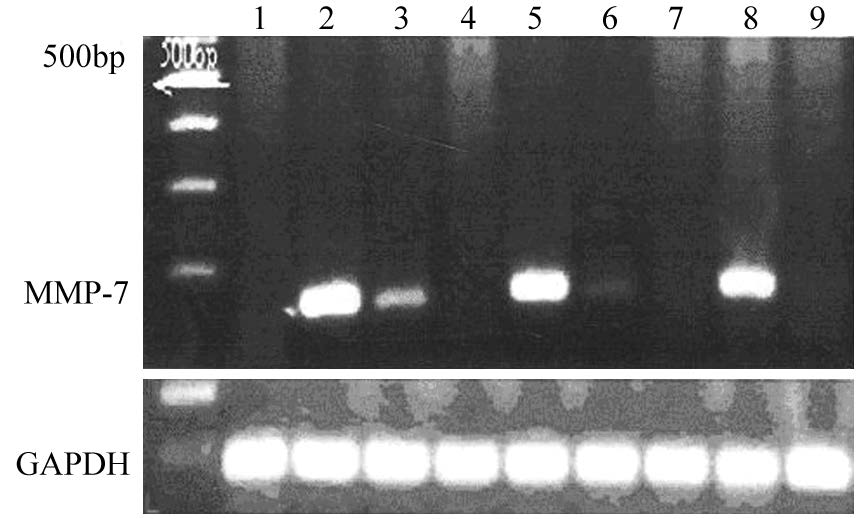
2 结果 2.1 肺癌患者与正常对照组外周血中MMP-7 mRNA、sMICA、VEGF的表达肺癌患者外周血中MMP-7 mRNA、sMICA、VEGF表达水平较正常对照组显著升高(P<0.001),见表 1、图 1。
 |
|
| 1, 4, 9: negative control groups; 2, 3, 5, 8: positive lung cancer groups; 6:positive control groups; 7: negative lung cancer groups 图 1 肺癌患者与正常对照组外周血中MMP-7 mRNA的表达 Figure 1 Expression of MMP-7 mRNA in peripheral blood of lung cancer and healthy control groups |
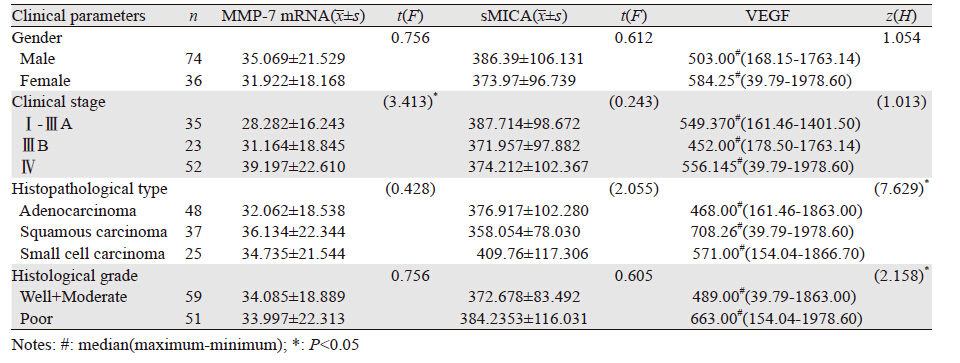
肺癌患者外周血MMP-7 mRNA高表达与临床分期相关(P<0.05),VEGF与病理分型、组织分化程度相关(P<0.05)。sMICA与临床分期、病理分型、组织分化无明显相关(P>0.05),见表 2。
 |
肺癌患者外周血sMICA与MMP-7 mRNA、VEGF的表达呈正相关(r=0.204,P=0.032;r=0.432,P<0.001),MMP-7 mRNA与VEGF的表达呈正相关(r=0.192,P=0.045)。
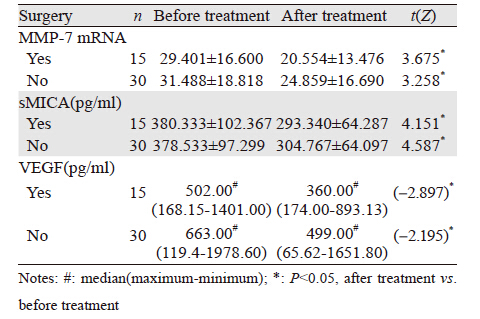
2.4 肺癌患者治疗前后外周血中MMP-7 mRNA、 sMICA、VEGF表达水平的变化本研究对其中45例肺癌治疗有效患者(手术+化疗15例,单纯化疗30例)前后外周血中sMICA与MMP-7 mRNA、VEGF进行跟踪,发现外周血中sMICA 、MMP-7 mRNA、VEGF表达水平较治疗前显著降低(P<0.05),见表 3。
 |
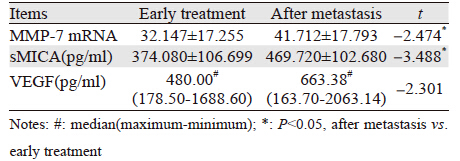
在随访过程中,其中25例肺癌患者跟踪至其出现新远处转移病灶,发现肺癌患者复发转移后外周血sMICA与MMP-7 mRNA、VEGF表达水平显著高于初诊时(P<0.05),见表 4。
 |
基质金属蛋白酶-7是目前所发现的相对分子质量最小的MMPs,在人体正常上皮细胞中表达,但活性较低,在许多上皮来源的肿瘤和间质肿瘤过度表达如:卵巢癌、食管癌、非小细胞癌、胃贲门癌等。研究发现:MMP-7能够分解层粘连蛋白、纤维连接蛋白、弹性蛋白等多种底物,破坏机体防御肿瘤浸润与转移的自然屏障[2-3]。MMP-7通过降解细胞膜上的Fas配体,抑制Fas介导的细胞凋亡,促进肿瘤生长[4]。本研究发现:肺癌患者外周血MMP-7mRNA的表达较正常对照组高,并与临床分期相关,复发转移患者外周血MMP-7 mRNA显著升高,间接反映出MMP-7与肿瘤的发生、发展和浸润转移密切相关。sMICA是由于肿瘤细胞死亡,细胞表面MICA蛋白脱落到外周血里,形成sMICA,在肺癌、胃肠道肿瘤等患者的sMICA值较健康者及相应的良性病患者升高[5]。本研究发现,肺癌患者外周血sMICA表达水平较正常对照组显著升高,复发转移患者外周血MMP-7 mRNA显著升高,与临床分期、病理分型、组织分化无相关性。与其他学者研究结果一致,sMICA可作为一个新的肿瘤标志物。另外,从肿瘤免疫学角度,sMICA可降低肿瘤表面MICA蛋白表达,诱导T细胞表面和NK细胞表面的NKG2D发生内化降解,从而导致CD8+T细胞和NK细胞NKG2D的下调,抑制NK细胞杀伤活性,导致肿瘤逃逸[6]。sMICA还可作为肿瘤免疫监测的参考指标。VEGF是一种重要的促肿瘤生长因子,它通过旁分泌途径刺激肿瘤血管内皮细胞增生、迁移,诱导血管形成而促进肿瘤生长;还具有增强血管通透性,促进单核细胞、成纤维细胞及内皮细胞浸润,有利于肿瘤基质形成,促进肿瘤转移的活性[7-8]。有学者发现:VEGF在肺腺癌组织表达高于肺鳞癌;在低分化癌组织高于高分化癌;血清中VEGF表达与临床分期有关。本研究发现:肺癌患者外周血VEGF表达水平与正常对照组比较显著升高,低分化癌高于高分化癌,复发转移患者外周VEGF表达水平显著升高,跟肺肿瘤组织的研究结果一致。而本研究发现:鳞癌外周血中VEGF表达水平最高,且与临床分期无关,有悖于以往研究,推测可能的原因:(1)肺癌外周血VEGF的表达与其在肺癌组织中表达可能相关,但不可能完全一致;(2)样本量的限制;(3)外周血诊断指标与肿瘤的生物学特性没有直接相关关系。综上所述:外周血sMICA、MMP-7 mRNA、VEGF可作为肺癌临床诊断的辅助指标。本研究发现:治疗有效(包括手术和化疗)肺癌患者外周血MMP-7 mRNA、sMICA、VEGF表达水平显著降低。说明随着疾病的进程,外周血sMICA、MMP-7 mRNA、VEGF动态变化也可作为评价疗效的参考指标。
本研究结果还发现: 肺癌患者外周血sMICA、MMP-7 mRNA、VEGF三个指标,两两之间互呈正相关。sMICA与MMP-7 mRNA、VEGF呈正相关,可能的原因:(1)MMPs介导了MICA蛋白的水解脱落机制[9],VEGF促进肿瘤中血管形成并且增加血管通透性,促使肿瘤细胞及其坏死、凋亡降解产物侵入血流的可能性,进而使外周血sMICA的表达增加;(2)是否MMP-7、VEGF通过某种分子调控机制共同参与了MICA蛋白的脱落,需进一步研究证实。MMPs与VEGF之间的相互作用调节是近年来的一个热点,本研究发现:肺癌患者外周血MMP-7 mRNA、VEGF呈正相关,推测其缘由,一方面MMPs的表达上调可能促进VEGF的表达增加,从而促进肿瘤供给血管形成,使肿瘤往深部浸润生长所需的营养物质得到充足供应,促使肿瘤生长;另一方面,VEGF过表达改变了内皮细胞的活化形式,增加了MMPs的释放,加快基底膜的降解和内皮细胞的迁移,促进了血管形成,另外使原位肿瘤细胞进入血流定植转移靶器官可能性增加。
随着对癌症转移研究的不断深入,研究发现:癌症细胞转移的不同步骤都依赖于癌细胞和周围微环境因素的相互作用,肿瘤周围和转移器官微环境的相互作用。在肿瘤周围和转移器官微环境中,免疫细胞和细胞因子是参与癌症转移的重要因素[10]。MMP-7与VEGF是肺癌侵袭转移的重要参与者,它们是否通过对sMICA的某种作用机制促使sMICA介导了肿瘤免疫逃逸的发生,包括是否通过对肿瘤免疫细胞及细胞因子的调节导致肺癌患者免疫力进一步下降,加速癌的侵袭、转移,待进一步研究。肺癌患者外周血MMP-7mRNA、VEGF、sMICA可作为肺癌诊断、评估疗效、预测疾病发展的辅助参考指标。
| [1] | Wang LP, Niu H, Xia YF, et al. Prognostic significance of serumsMICA levels in non-small cell lung cancer[J]. Eur Rev MedPharmacol Sci, 2015, 19 (12) : 2226–30. |
| [2] | Lu H, Yang Z, Zhang H, et al. The expression and clinicalsignificance of matrix metalloproteinase 7 and tissue inhibitor ofmatrix metalloproteinases 2 in clear cell renal cell carcinoma[J]. Exp Ther Med, 2013, 5 (3) : 890–6. |
| [3] | Deryugina EI, Quigley JP. Matrix metalloproteinases and tumormetastasis[J]. Cancer Metastasis Rev, 2006, 25 (1) : 34. |
| [4] | Almendro V, Ametuer E, Garcia-Recio S, et al. The role ofMMP7 and its cross-talk with the FAS/FASL System during theacquisition of chemoresistance to oxaliplatin[J]. PLoS One, 2009, 4 (3) : e4728. |
| [5] | Holdenrieder S, Stieber P, Peterfi A, et al. Soluble MICA inmalignant diseases[J]. Int J Cancer, 2006, 118 (3) : 684–7. |
| [6] | EI-Gazzar A, Groh V, Spies T. Immunobiology and conflictingroles of the human NKG2D lymphocyte receptor and its ligandsin cancer[J]. J Immunol, 2013, 191 (4) : 1509–15. |
| [7] | Tie J, Desai J. Antiangiogenic therapies targeting the vascularendothelia growth factor signaling system[J]. Crit Rev Oncog, 2012, 17 (1) : 51–67. |
| [8] | Eichmann A, Simons M. VEGF signaling inside vascularendothelial cells and beyond[J]. Cerr Opin Cell Biol, 2012, 24 (2) : 188–93. |
| [9] | Groh V, Wu J, Yee C, et al. Tumor-devived soluble MIC Ligandsimpair expression of NKG2D and T-cell activation[J]. Nature, 2002, 419 (6908) : 734–8. |
| [10] | Zhou HJ, Qin LX. Several questions that deserve our attention inresearch of tumor metastatic mechanism[J]. Fudan Xue Bao(YiXue Ban), 2011, 38 (5) : 377–81. [周海军, 钦伦秀. 肿瘤转移机制研究中几个值得关注的问题[J]. 复旦学报(医学版),2011, 38 (5) : 377–81. ] |
 2016, Vol. 43
2016, Vol. 43
