文章信息
- 热敏脂质体联合微波热疗对HeLa细胞的增殖抑制作用
- Inhibitory Effect of Thermosensitive Liposomes Combined with Microwave Thermotherapy on Human Cervical Carcinoma Cells HeLa
- 肿瘤防治研究, 2016, 43(6): 468-472
- Cancer Research on Prevention and Treatment, 2016, 43(6): 468-472
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.06.007
- 收稿日期: 2015-07-31
- 修回日期: 2016-01-04
宫颈癌是全球女性第四大常见的恶性肿瘤,其死亡率占所有女性癌症死亡率的12%,宫颈癌已严重影响了女性的生殖健康和生命安全[1-2]。传统治疗宫颈癌的手段为手术、放疗及化疗。近年来,热疗逐渐成为基础及临床研究的热点,其可将病灶部位温度提升至42℃~45℃,从而有效杀灭肿瘤细胞[3]。微波热疗作为一种新型的肿瘤辅助疗法逐渐受到人们的关注[4-5]。热敏脂质体(thermosensitiveliposomes,TSLs)可有效利用脂质体和热疗的双重优势:在正常体温下脂质体呈致密胶晶态排列,保证药物不会被释放;当外界温度达到TSLs的变相温度时,脂质体膜发生通透性改变,甚至塌陷、破裂,导致药物迅速释放,在肿瘤部位形成较高的药物浓度[6]。阿霉素(doxrubicin,DOX)是一种强效治疗癌症的化疗药物且具有热疗增敏作用,将DOX化疗与热疗联合治疗肿瘤具有协同作用[7]。本研究即利用目前已在临床使用的微波热疗法与DOX热敏脂质体联合抑制人宫颈癌HeLa细胞的发生和发展。
1 材料与方法 1.1 试剂与仪器盐酸阿霉素(DOX,上海晶纯生化科技股份有限公司)、DMEM培养液(美国Hyclone公司)、胎牛血清(杭州四季青生物工程公司)、二棕榈酰磷脂酰胆碱(DPPC,上海笛柏化学品技术有限公司)、胆固醇及二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000,国药集团化学试剂有限公司)、人宫颈癌HeLa细胞系(上海复祥生物)、UHR-2000(915 MHz)微波热疗机(北京木禾雨电子有限公司)。
1.2 热敏脂质体的制备采用逆向蒸发法制备DOX-TSLs脂质体。按8:2:1质量比准确称量DPPC 16 mg、胆固醇 4 mg、DSPE-PEG2000(2 mg),溶于5 ml氯仿并置于茄形瓶中。将DOX水溶液(1 mg/ml)加入上述脂质溶液中,超声乳化2 h得到w/o乳剂后旋转蒸发,减压除去有机溶剂得到脂质体的水性混悬液。使用孔径为0.1 μm的超滤管离心去除游离DOX,将DOXTSLs脂质体置于4℃备用。
1.3 热敏脂质体的表征 1.3.1 粒径考察取三次制备的DOX-TSLs纳米混悬液各100 μl,用超纯水稀释至2 ml,置于石英杯中,室温下使用激光纳米粒度仪测定其粒径。
1.3.2 包封率的考察使用紫外全波长扫描(200~800 nm)测定DOX的特征峰,使用高效液相(HPLC)制作DOX标准曲线。然后,取适量DOX-TSLs水溶液,使用曲拉通X-100破膜法将脂质体膜破坏,通过HPLC法确定TSLs内DOX的浓度。HPLC条件为:C18柱(4.6×150 mm,5 μm);流动相为:甲醇和10 mmol/L的磷酸二氢钾缓冲液(68:32,v/v);25℃。包封率=(药物总浓度-游离药物浓度)/药物总浓度×100%
1.4 热敏脂质体体外释放情况考察分别将2 ml DOX及DOX-TSLs放于透析袋内,置于30 ml PBS缓冲液(pH7.4)中,在37℃条件下透析。对DOX-TSLs热疗组进行微波热疗处理(43℃)。分别于1、5、10、20、30、60 min时取透析液,使用HPLC法计算出各组的累积释放率,考察单纯DOX、DOX-TSLs及经过微波热疗处理过的DOX-TSLs的体外释放情况。
1.5 细胞培养将HeLa细胞培养于含有10%胎牛血清及1%青链霉素双抗的DMEM培养液中。将细胞培养瓶放置于37℃、5%CO2细胞培养箱中进行常规培养。
1.6 细胞摄取考察将HeLa细胞以每孔1×105个接种于6孔板中培养24 h贴壁后,加入DOX-TSLs(DOX终浓度为IC50值)联合培养,于1、3和6 h时通过荧光显微镜对细胞的摄取情况进行检测。
1.7 MTT法检测细胞增殖抑制率实验组分为空白对照组、TSLs组、DOX组、微波热疗(microwave thermotherapy,MWT)组、DOX-TSLs组、DOX+MWT组及DOX-TSLs+MWT组。取对数生长期的HeLa细胞,以0.5×104个每孔接种到96孔板中。孵育24 h后,空白对照组及MWT组加入新鲜培养液,TSLs组加入含有空白TSLs的新鲜培养液,含有DOX的组别分别加入含有对应制剂的新鲜培养液(DOX终浓度为IC50浓度,7.8 μg/ml),每组设6个复孔。培养6 h后,对热疗组进行微波热疗处理(43℃,30 min)。继续培养48 h后弃去培养液,每孔加入新鲜配制的MTT溶液(0.5 g/L),37℃孵育4 h,加入二甲基亚砜并振荡,通过酶标仪测定每孔490 nm波长处的吸光度(A)值,计算各组HeLa细胞的抑制率。以上过程重复3次。细胞抑制率=(1-实验组A值/对照组A值)×100%。
1.8 流式细胞术检测细胞凋亡将HeLa细胞以每孔1×105个接种于6孔板中,在细胞培养箱中培养24 h后,分为空白对照组、TSLs组、DOX组、MWT组、DOX-TSLs组、DOX+MWT组及DOX-TSLs+MWT组。空白对照组及MWT组加入新鲜培养液,TSLs组加入含有空白TSLs的新鲜培养液,含有DOX的组别分别加入含有对应制剂的新鲜培养液(DOX终浓度为IC50值)。所有组继续培养48 h,消化并收集细胞,Annexin V-FITC/PI双染法在流式细胞仪上检测细胞凋亡情况,并分析凋亡率。
1.9 统计学方法应用SPSS19.0统计软件对数据进行统计学处理,结果采用(x±s)表示,采用单因素方差分析。P<0.05为差异有统计学意义。
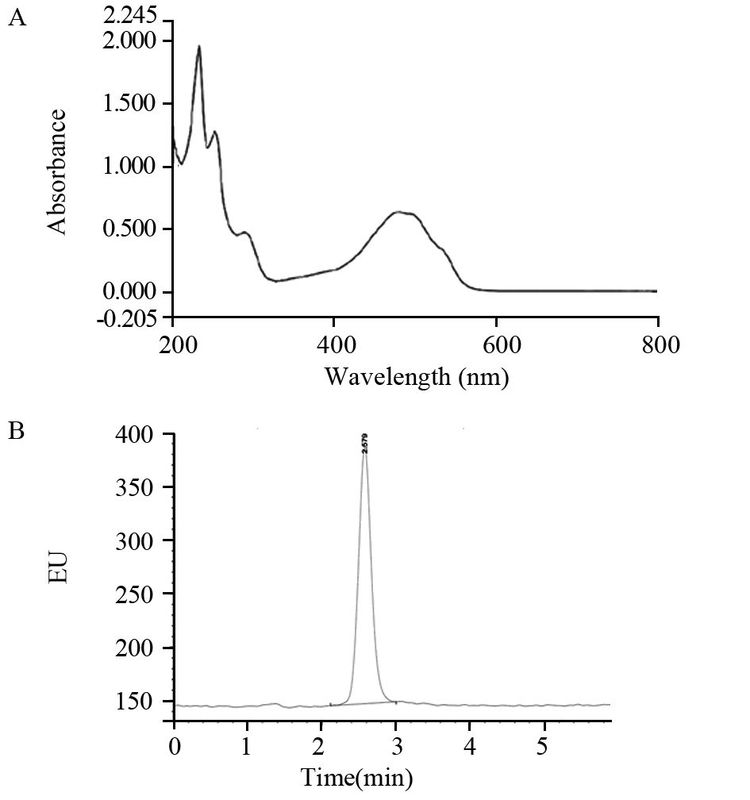
2 结果 2.1 DOX-TSLs的表征经过激光纳米粒度仪检测三批DOX-TSLs样品粒径分别为:185.3、194.6和192.1 nm,平均粒径为(190.7±4.8)nm。DOX的紫外全波长扫描结果表明DOX在481 nm处具有特征吸收峰,此处溶剂干扰小,因此选定481 nm为DOX检测波长,将DOX进行HPLC系统适应性检测,见图 1A。结果表明DOX在指定HPLC色谱条件下,保留时间为2.579 min,峰形良好,见图 1B。以峰面积为Y轴、DOX浓度为X轴进行线性回归,得回归方程Y=26478X+282.42,相关系数r=0.9999,在0.01~10 μg/ml之间,线性关系良好。通过包封率公式计算,DOX-TSLs的包封率为88.5%。
|
| 图 1 DOX紫外全波长扫描图(A)及HPLC图(B) Figure 1 UV wavelength scanning map(A) and(B) HPLC results of DOX |
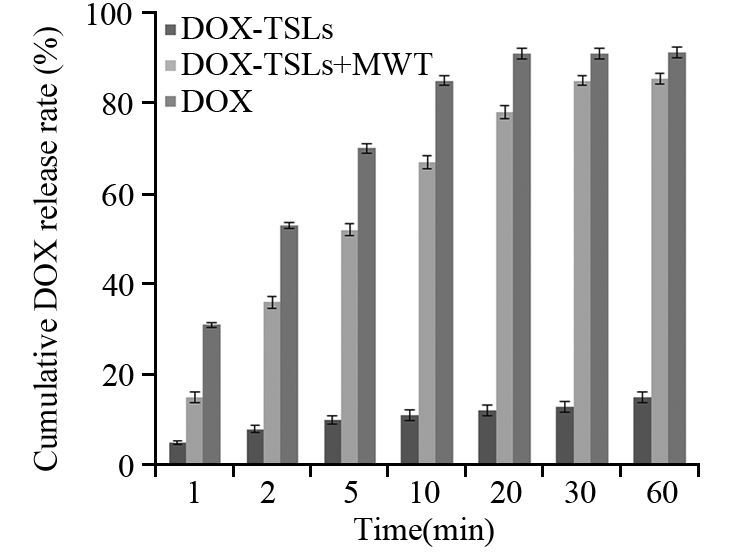
由DOX-TSLs的体外释放图可知,各组DOX的累积释放量具有一定的时间依赖性。单纯DOX在释放20 min时累计释放量达到约90%;DOX-TSLs组在释放实验进行至60 min时,其累积释放量仅为(15.1±1.3)%;当DOX-TSLs组进行热疗处理后,累积释放率发生巨大改变,当热疗时间达到60 min时,DOX的累积释放率达到(85.5±1.2)%(其与30 min时的累积释放率相比差异无统计学意义,因此本研究使用30 min为最终热疗时长),见图 2。
|
| 图 2 DOX-TSLs体外累积释放率 Figure 2 Cumulative release rate of DOX-TSLs in vitro |
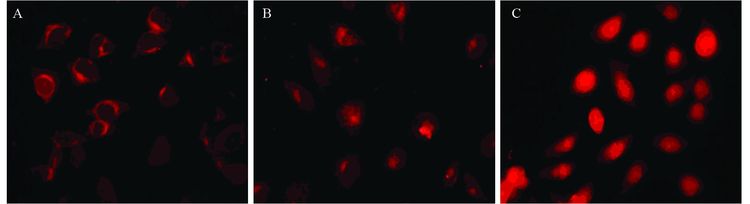
经过荧光显微镜观察发现,HeLa细胞对DOXTSLs的摄取具有明显的时间依赖性。当DOX-TSLs与HeLa细胞共同培养1 h时,DOX的红色荧光基本都还未进入细胞内;3 h时,有一部分DOX开始进入细胞内部;培养时间达到6 h时,DOX可全部进入细胞内部,见图 3。
|
| A:1h; B: 3h; C: 6h 图 3 HeLa细胞荧光显微镜摄取结果 (×400) Figure 3 Fluorescence microscopy results of cellular uptake on HeLa cells (×400) |
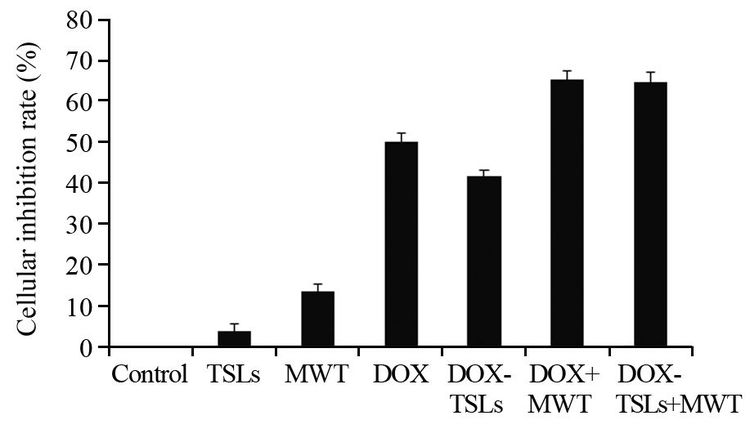
本实验考察了DOX-TSLs和微波联合热疗对HeLa细胞的增殖抑制情况,其中TSLs组与空白对照组相比差异无统计学意义(P=0.061),MWT组与空白对照组相比差异有统计学意义(P=0.006)。细胞MTT实验结果表明,细胞抑制率具有明显的浓度依赖性。在不进行热疗且DOX的终浓度相同的情况下,DOX组的细胞抑制率高于DOX-TSLs组(P=0.046)。但是经过热疗处理后,两组对于HeLa细胞的抑制率差异无统计学意义(P=0.177)。实验结果表明,DOX+MWT组和DOX-TSLs+MWT组均具有化疗—热疗协同抑制HeLa细胞增殖的作用,见图 4。
|
| 图 4 HeLa细胞增殖抑制率 Figure 4 Cellular inhibition rate of HeLa cells |
使用流式细胞仪对HeLa细胞凋亡检测各实验组对凋亡效率的影响。空白对照组、TSLs组、DOX组、MWT组、DOX-TSLs组、DOX+MWT组及DOX-TSLs+MWT组的凋亡率分别为(1.2±0.08)%,(1.6±0.08)%,(45.5±1.6)%,(11.3±0.11)%,(38.6±1.4)%,(62.4±2.1)%及(62.2±2.3)%。结果表明,单纯MWT热疗可促使细胞凋亡,DOX组的凋亡率明显高于DOXTSLs组(P<0.05)。但是,当热疗处理后DOX组和DOX-TSLs组的凋亡率差异未见统计学意义。同时,该实验结果表明DOX及DOX-TSLs与热疗联合治疗具有协同促进细胞凋亡的作用。
3 讨论化疗虽然是一种最常用的临床治疗肿瘤的手段,但其也存在缺点,如生物毒性、在有效剂量下不能快速彻底杀灭肿瘤细胞等。为了解决以上问题,新的给药方法及多途径治疗已逐渐成为治疗肿瘤的新策略[8]。1995年,DOX脂质体Doxil就被美国食品药品监督管理局(FDA)认证用于临床。但普通的脂质体释放药物的性质受到限制,从而影响其最终的治疗效果。本研究使用TSLs包裹DOX对HeLa细胞给药,对其体外治疗效果进行了研究,结果表明DOX-TSLs具有良好的体外抗肿瘤效果。DOX-TSLs的优点表现在以下几个方面:可通过纳米尺度粒子的增强渗透滞留效应(EPR,enhanced permeability and retention effect)富集于肿瘤部位;其本身基本没有生物毒性,可保护正常组织及细胞不受化疗药物的损伤;具有良好的缓控释特性,可在外界热度刺激下,在指定范围迅速释放药物。这些良好的特性,为今后的体内研究奠定了基础。
作为一种新兴的肿瘤治疗辅助手段,热疗及热疗与其他手段联合治疗成为近年来肿瘤治疗的研究热点[9-10]。目前,肿瘤热疗主要采取的手段为外界物理刺激,如近红外热疗[11]、微波热疗[12]及射频热疗[13]等等。本实验采取的微波热疗手段目前已在临床广泛使用,因此研究其与化疗药物之间的联合作用及相关机制具有很强的实际意义。研究表明,由于生长环境的限制,肿瘤周围会出现血液循环差、慢性缺氧等现象,导致其散热性能变差,因此肿瘤对热疗往往十分敏感。研究表明,42℃~45℃便可杀伤肿瘤细胞,而正常组织由于血液循环好、热量被及时带走、耐受温度可达45℃[14]。本研究选用43℃作为肿瘤治疗的工作温度,有利于热疗作用的发挥及对正常组织的保护。本研究实验结果表明,相同浓度的DOX与DOX-TSLs组在不联合热疗的情况下与HeLa细胞联合培养后,DOX-TSLs组的治疗效率低于单纯DOX组(P<0.05),其原因主要是DOX-TSLs未能有效释放DOX。但当热疗介入后两组细胞抑制率差异无统计学意义(P>0.05),说明脂质体膜遭到破坏后可以有效释放内部药物。研究表明,细胞周围温度的上升可以导致细胞周围微环境运动加速,也可有效提高细胞对DOX的摄取作用[15]。本文使用热疗的作用不仅仅是联合治疗,同时可在较短的时间内促进细胞微环境循环,促使更多的DOX-TSLs进入细胞,增强DOX对肿瘤细胞的杀伤效果。
研究表明,DOX和热疗都可以促使细胞产生凋亡现象,但是将二者结合可达到更好的协同促进凋亡的效果[16]。流式细胞凋亡检测实验结果表明,DOX微波热疗组可有效增强细胞凋亡。本研究主要探讨了DOX-TSLs与微波热疗联合抑制肿瘤细胞增殖及促细胞凋亡的作用,通过构建DOXTSLs给药系统,考察其对人HeLa细胞的抑制及凋亡情况,证明联合治疗可以有效抑制细胞增殖、促进细胞的凋亡。本实验从体外验证了DOX和DOX-TSLs与微波热疗联合对HeLa细胞均具有联合抑制作用,DOX-TSLs组在没有MWT联合治疗时并没有完全释放,导致其在DOX相同浓度下抑制率偏低。但是,温度达到TSLs相变温度时,药物迅速大量释放,造成了其在热疗条件下与DOX组相比抑制率没有显著性差异。这个性质有助于DOX-TSLs今后在体内试验中的应用,可有效保证药物在进入靶向组织中再释放,在提高药效的同时还可以保护正常组织不受损害。本实验将DOX-TSLs作为潜在的给药系统在体外进行了实验,可为宫颈癌的有效治疗提供相关的理论及实验依据。
| [1] | Bassal R, Schejter E, Bachar R, et al. Recent trends of cervical cancer and Cervical Intraepithelial Neoplasia 3(CIN3) in Israel[J]. Arch Gynecol Obstet, 2015, 292 (2) : 405–13. |
| [2] | Touboul C, Skalli D, Guillo E, et al. Treatment of cervical cancer[J]. Rev Prat, 2014, 64 (6) : 802–6. |
| [3] | Sato I, Umemura M, Mitsudo K, et al. Hyperthermia generated with ferucarbotran (Resovist(A (R))) in an alternating magnetic field enhances cisplatin-induced apoptosis of cultured human oral cancer cells[J]. J Physiol Sci, 2014, 64 (3) : 177–83. |
| [4] | Shi H, Liu T, Fu C, et al. Insights into a microwave susceptible agent for minimally invasive microwave tumor thermal therapy[J]. Biomaterials, 2015, 44 : 91–102. |
| [5] | Tropea A, Biondi A, Corsaro A, et al. Combined microwave thermal ablation and liver resection for single step treatment of otherwise unresectable colorectal liver metastases; a monoistitutional experiences[J]. Eur Rev Med Pharmacol Sci, 2014, 18 (2 Suppl) : 6–10. |
| [6] | Sun F, Yin LF, Zhou JP. Current advances in study of thermosensitive liposomes[J]. Yao Xue Jin Zhan, 2010, 34 (9) : 399–405. [孙飞, 尹莉芳, 周建平. 热敏脂质体的研究进展[J]. 药学进展,2010, 34 (9) : 399–405. ] |
| [7] | Mohammad F, Yusof NA. Doxorubicin-loaded magnetic gold nanoshells for a combination therapy of hyperthermia and drug delivery[J]. J Colloid Interface Sci, 2014, 434 : 89–97. |
| [8] | Chen YT, Yao HR, Xu LF, et al. Hepatic arterial infusion chemotherapy combined with endogenetic hyperthermia treatment of hilar cholangiocarcinoma[J]. Hepatogastroenterology, 2014, 61 (129) : 151–5. |
| [9] | Lee SM, Kim HJ, Kim SY, et al. Drug-loaded gold plasmonic nanoparticles for treatment of multidrug resistance in cancer[J]. Biomaterials, 2014, 35 (7) : 2272–82. |
| [10] | Zhang Z, Wang J, Nie X, et al. Near infrared laser-induced targeted cancer therapy using thermoresponsive polymer encapsulated gold nanorods[J]. J Am Cheml Soc, 2014, 136 (20) : 7317–26. |
| [11] | You J, Zhang P, Hu F, et al. Near-infrared light-sensitive liposomes for the enhanced photothermal tumor treatment by the combination with chemotherapy[J]. Pharm Res, 2014, 31 (3) : 554–65. |
| [12] | Kouloulias V, Triantopoulou S, Vrouvas J, et al. Combined chemoradiotherapy with local microwave hyperthermia for treatment of T3N0 laryngeal carcinoma: a retrospective study with long-term follow-up[J]. Acta Otorhinolaryngol Ital, 2014, 34 (3) : 167–73. |
| [13] | Zhou Y, Han G, Wang Y, et al. Radiofrequency heat-enhanced chemotherapy for breast cancer: towards interventional molecular image-guided chemotherapy[J]. Theranostics, 2014, 4 (11) : 1145–52. |
| [14] | DeWitt MR, Pekkanen AM, Robertson J, et al. Influence of hyperthermia on efficacy and uptake of carbon nanohorn-cisplatin conjugates[J]. J Biomech Eng, 2014, 136 (2) : 021003. |
| [15] | Wang L, Shi J, Jia X, et al. NIR-/pH-Responsive drug delivery of functionalized single-walled carbon nanotubes for potential application in cancer chemo-photothermal therapy[J]. Pharm Res, 2013, 30 (11) : 2757–71. |
| [16] | Chen WY, Chen Y, Yang R, et al. The preparation of doxorubicinloaded Fe3O4 magnetic nanoparticles modified with PEG and the effect of SKOV-3 cells[J]. Zhongguo Shi Yan Zhen Duan Xue, 2014, 18 (6) : 880–3. [陈万瑛, 陈钰, 杨蕊, 等. 磁性隐形阿霉素脂质体的制备及其对SKOV-3细胞影响初步研究[J]. 中国实验诊断学,2014, 18 (6) : 880–3. ] |
 2016, Vol. 43
2016, Vol. 43
