文章信息
- 容雁,卢燕琼,张洁清,宋红林,李力.
- RONG Yan, LU Yanqiong, ZHANG Jieqing, SONG Honglin, LI Li.
- 雌二醇对子宫内膜癌Ishikawa细胞MAPK通路的激活及增殖的影响
- Estradiol Activates MAPK Signaling Pathway and Its Effects on Proliferation of Endometrial Cancer Ishikawa Cells
- 肿瘤防治研究, 2016, 43(03): 211-215
- Cancer Research on Prevention and Treatment, 2016, 43(03): 211-215
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.03.009
-
文章历史
- 收稿日期: 2015-04-23
- 修回日期: 2015-09-13
子宫内膜癌是女性生殖系统三大恶性肿瘤之一,研究表明近年来其发病率在世界范围内有上升趋势。目前公认的病因是与无孕激素拮抗的雌激素长期刺激有关。但雌激素如何作用于子宫内膜调节细胞增殖的机制尚有争议。丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号转导通路是调控细胞生长、增殖和分化的重要通路,其中细胞外信号调节激酶1/2(extracellular regulated protein kinases,ERKl/2)通路是MAPK系统的主要和经典的信号通路,通过促有丝分裂信号转导核内引起细胞增殖分化[1]。ERK1/2是MAPK信号转导通路的关键分子引起细胞核转录水平改变而引起促分裂和生存延长等改变,与多种肿瘤的发生发展相关[2, 3]。本研究以雌激素及MAPK信号转导通路抑制剂U0126作用于子宫内膜癌Ishikawa细胞,探讨雌激素是否能激活MAPK信号转导通路,以及其对子宫内膜癌细胞增殖能力的影响,为子宫内膜癌的治疗提供新的思路。
1 材料与方法 1.1 细胞株及细胞培养子宫内膜癌细胞Ishikawa来自于人子宫内膜高分化腺癌,ER表达阳性,由北京大学人民医院魏丽惠教授馈赠。细胞置于含10%胎牛血清、100 u/ml青霉素和100 μg/ml链霉素的DMEM培养液中,37℃、5%CO2培养箱中培养及传代。
1.2 主要试剂水溶性雌二醇购自美国Sigma公司;反转录(RT)试剂盒购自美国Fermentas公司;荧光定量PCR技术检测试剂购自德国Roche公司;MAPK激酶(MEK)特异性抑制剂—U0126、MEK1/2和磷酸化MEK1/2(p-MEK1/2)、细胞外信号调节激酶1/2(ERK1/2)和磷酸化ERK1/2(p-ERK1/2)抗体均购自美国Cell Signaling公司;兔抗人远红外二抗DyLight800购自美国LICOR公司。
1.3 方法 1.3.1 实验分组
取对数生长期细胞,分为3组:(1)雌二醇组(E2组):加入浓度为1 μmol/L的雌二醇作用30 min;(2)U0126+E2组:U0126处理1 h后,再加入浓度为1 μmol/L的雌二醇作用30 min;(3)对照组:仅加入无血清DMEM培养液。
1.3.2 荧光定量PCR检测各组细胞中MEK1/2、ERK1/2 mRNA的表达
TRIzol法提取各组细胞总RNA,利用RT试剂盒合成cDNA。MEK1/2基因引物序列:上游引物:5′-CTGGCAATGGCGGTGTGGTGTT-3′,下游引物:5′-TCGCCATCGCTGTAGAACGCAC-3′,扩增产物片段长度为187 bp;ERK1/2基因引物序列:上游引物:5′-AGGCTGTTCCCAAATGCTG-3′,下游引物:5′-CGGGTCGTAATACTGCTCC-3′,扩增产物片段长度为129 bp;以GAPDH基因为内参照,其引物序列:上游引物:5′-GAAGGTGAAGGTCGGAGT-3′,下游引物:5′-GAAGATGGTGATGGGATTTC-3′,扩增产物片段长度为225 bp。PCR反应体系共20 μl,包括DNA荧光染料SYBR Green 10 μl,上、下游引物各0.5 μl,cDNA模板2 μl,加水至20 μl。PCR反应条件:95℃预变性10 min;95℃15 s,55℃~60℃ 60 s,40~45次循环。采用2-ΔΔCt法对数据进行相对定量分析。实验重复3次,取均值。
1.3.3 蛋白印迹法检测各组细胞中p-MEK1/2、p-ERK1/2蛋白活化水平
细胞经蛋白裂解液裂解后,收集各组细胞蛋白。采用二辛可宁酸(BCA)法制作标准蛋白稀释浓度曲线,计算各组细胞蛋白浓度。取50 μg蛋白行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离,将电泳产物转至聚偏二氟乙烯(PVDF)膜上,5%牛血清白蛋白封闭1 h,分别加入一抗MEK1/2、p-MEK1/2、p-ERK1/2(浓度为1:2 000)、ERK1/2(浓度为1:1 000),4℃孵育过夜,再加入兔抗人远红外二抗DyLight800室温孵育1 h,含0.05%吐温(Tween)的枸橼酸盐缓冲液(TBST)洗膜;用红外二抗扫膜仪Odyssey扫膜并分析数据。p-MEK1/2蛋白活化水平以(p-MEK1/2)/(MEK1/2)比值表示,p-ERK1/2蛋白活化水平以(p-ERK1/2)/(ERK1/2)比值表示。实验重复3次,取均值。
1.3.4 流式细胞仪检测各组细胞的细胞周期比例
分别取1×106个对数生长期的Ishikawa细胞接种于6孔板中,按上述分组方法对各组细胞进行加药处理48 h,各组均设3个复孔,然后置流式细胞仪检测各组细胞的细胞周期比例,具体操作按照说明书进行。实验重复3次,取均值。
1.3.5 细胞集落形成实验
按上述分组方法分别对Ishikawa各组细胞进行加药处理后,按照每孔100、200、300个细胞的密度接种于6孔板,置培养箱中培养14天。终止培养后用PBS洗涤2次,4%多聚甲醛固定20 min,姬姆萨染色,显微镜下(×10倍)计集落。以100~500个细胞为1个克隆。克隆形成率=克隆数/接种细胞数×100%。
1.3.6 体外穿膜实验检测各组细胞的迁移能力
各组均以2×105个细胞接种于穿膜(Trans well)小室的上室内,下室内加入含20%胎牛血清的完全培养液,在37℃、5%CO2培养箱中培养24 h。甲醇固定,姬姆萨染色。光学显微镜下(×200)观察任意10个不重复的视野,各组设3个复孔,分别计算每个视野中穿过微孔的Ishikawa细胞数。实验重复3次,取均值。
1.4 统计学方法采用SPSS17.0软件进行统计学处理。所有实验数据均以(x±s)表示,多样本间的两两比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果 2.1 E2对子宫内膜癌Ishikawa细胞中MEK1/2、ERK1/2 mRNA表达的影响与对照组比较,E2在1 μmol/L浓度时可显著增强Ishikawa细胞中MEK1/2、ERK1/2 mRNA的表达(P=0.025,P=0.002);而MEK通路特异性抑制剂U0126能明显阻断并抑制E2对MEK1/2、ERK1/2 mRNA表达的增强作用(P=0.000,P=0.000),见表 1。
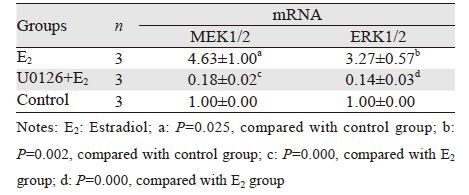 |
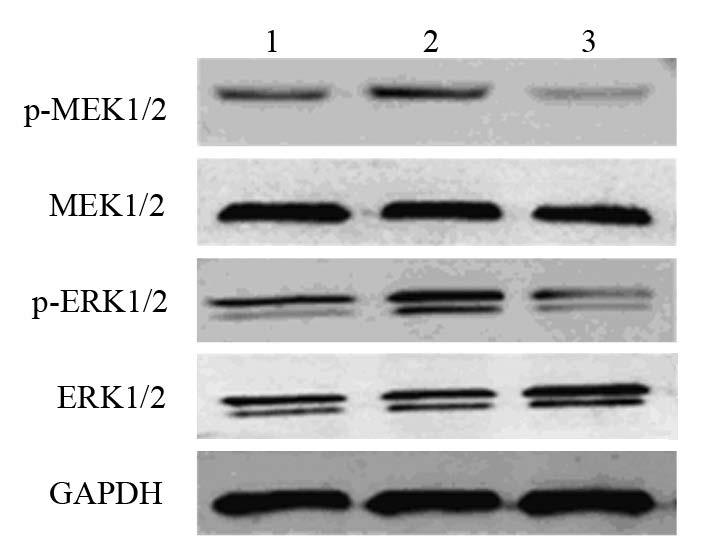
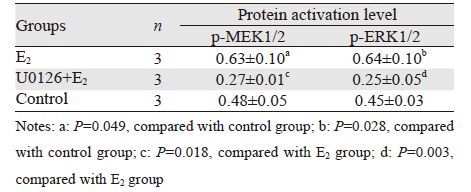
E2及U0126处理后,Ishikawa细胞均有MEK1/2、ERK1/2蛋白表达,但在E2作用下,MEK1/2、ERK1/2蛋白磷酸化明显增加(P=0.049,P=0.028),条带灰度增加,见图 1;U0126可阻断E2对p-MEK1/2、p-ERK1/2蛋白的活化(P=0.018,P=0.003),见表 2。
|
| 1: Control group; 2: E2 group; 3: U0126+E2 group 图 1 Western blot检测Ishikawa细胞p-MEK1/2、 p-ERK1/2蛋白活化水平 Figure 1 Activation of p-MEK1/2, p-ERK1/2 protein in Ishikawa cells detected by Western blot |
 |
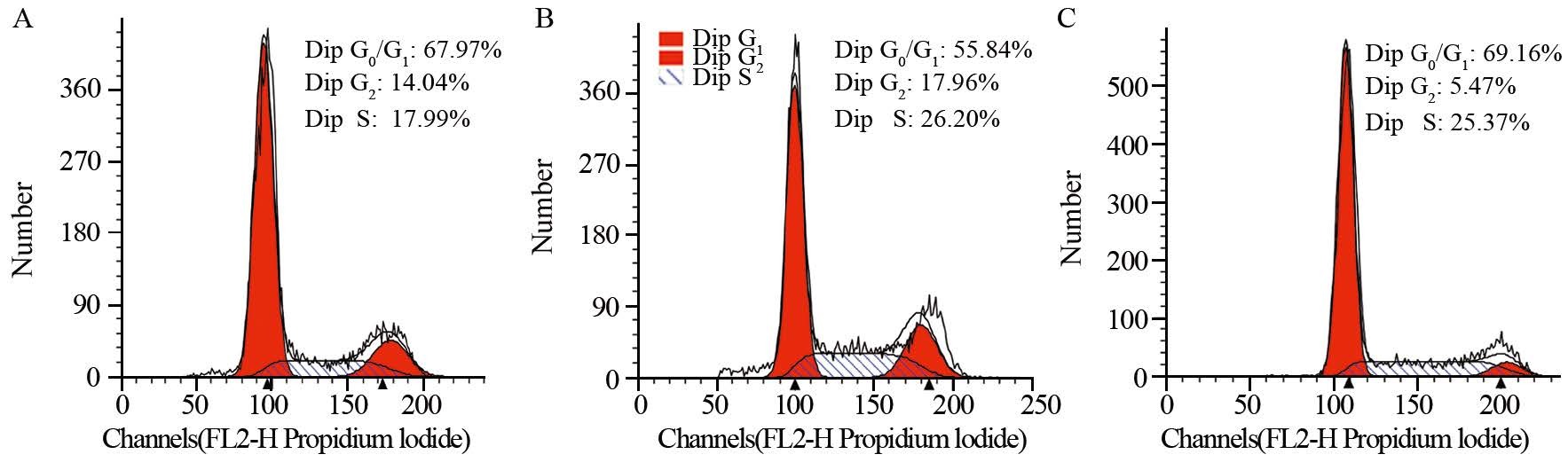
E2作用Ishikawa细胞48 h后,E2组G1期细胞比例为(53.6±3.2)%,与U0126+E2组(66.8±5.6)%和对照组(65.1±2.6)%比较,差异具有统计学意义(P=0.012,P=0.023),见图 2。
|
| groupA: Control group; B: E2 group; C: U0126+E2 图 2 流式细胞术检测各组Ishikawa细胞周期 Figure 2 Ishikawa cell cycle in each group detected by flow cytometry |
E2作用Ishikawa细胞后,细胞集落形成率为(47.1±4.6)%,与U0126+E2组[(30.8±3.2)%]和对照组[(39.1±5.0)%]比较,差异有统计学意义(P=0.000,P=0.010),见图 3。
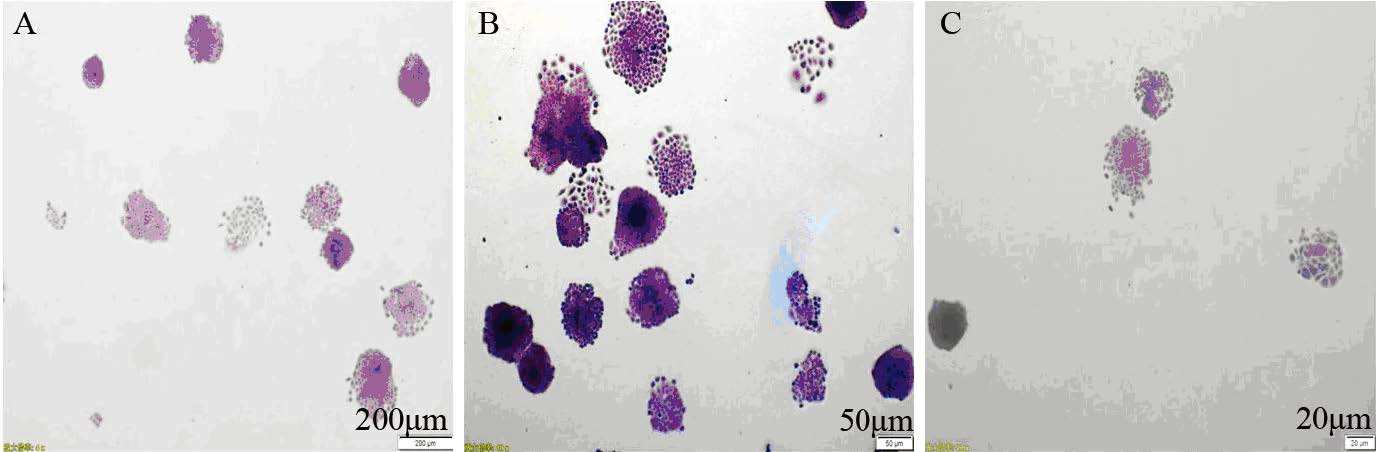
|
| A: Control group; B: E2 group; C: U0126+E2 group 图 3 细胞集落形成实验检测各组Ishikawa细胞集落形成能力 (×10) Figure 3 Colony forming ability of Ishikawa cells in each group detected by colony formation assay (×10) |
体外穿膜实验检测结果显示,E2作用Ishikawa细胞后,穿过微孔的细胞数(110±17)明显高于U0126+E2组(28±4)和对照组(65±8),差异有统计学意义(P =0.000,P=0.004),见图 4。
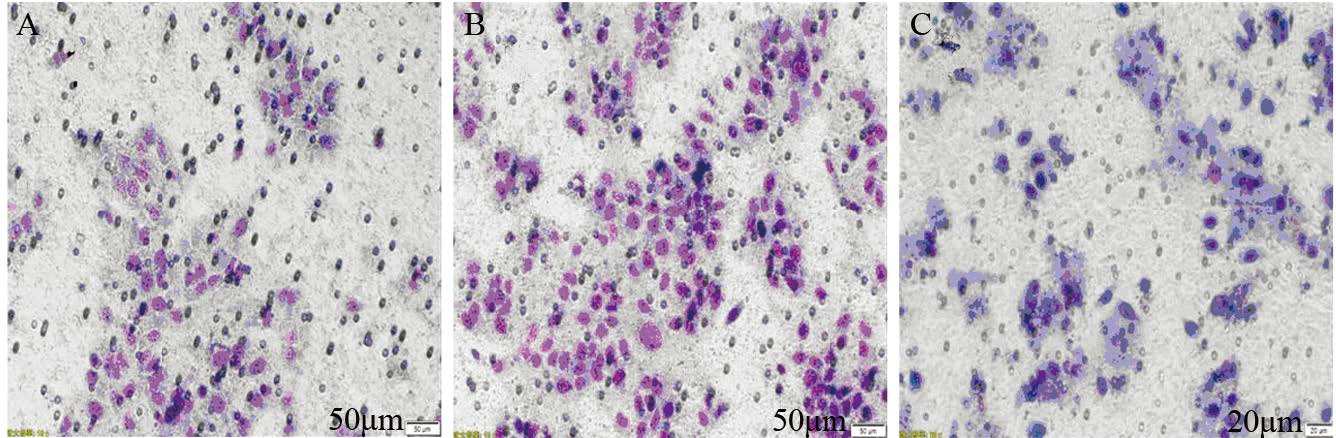
|
| A: Control group; B: E2 group; C: U0126+E2 group 图 4 体外穿膜实验检测各组Ishikawa细胞迁移能力 (×200) Figure 4 Migration of Ishikawa cells in each group detected by transwell assay (×200) |
子宫内膜癌是女性生殖道常见的恶性肿瘤之一,但确切病因尚未清楚。众多研究认为“无孕激素拮抗的雌激素长期刺激”在其发病中起重要作用。雌激素如何作用于子宫内膜调节细胞增殖的机制尚有争议。相关研究表明雌激素可迅速激活细胞内丝裂原活化蛋白激酶(MAPK)等信号转导通路,调控细胞周期,抑制细胞凋亡,促进癌细胞侵袭和迁移。MAPK通路是真核细胞介导胞外信号进入胞内的重要信号转导系统,它能被多种生长因子和细胞因子以磷酸化方式等信号通路激活[4]。ERKl/2通路是最早发现的经典的Ras/Raf/MAPK信号转导通路,其上游激酶为细胞外信号调节蛋白激酶(extracellular regulated protein kinases,MEKl/2),参与雌激素受体非基因组效应的一条重要信号通路。Lecanda等研究发现,雌激素可激活MAPK通路增加P27蛋白的降解,进而促进子宫内膜癌细胞过度增生[5]。Acconcia等研究报道,雌激素和4-羟三苯氧胺(4-OHT)可促进激活ERK1/2、C-Srk、FAK通路,从而引起子宫内膜癌细胞支架改变,促进癌细胞侵袭和迁移[6]。Sun等研究表明,雌激素依赖其受体通过激活AKT和ERK1/2信号转导通路促进子宫内膜癌细胞增殖[7]。
本研究通过用1 μmol/L浓度的雌二醇作用Ishikawa细胞后,MEK1/2、ERK1/2 mRNA表达及p-MEK1/2、p-ERK1/2蛋白活化水平均比对照组明显增加,说明雌激素能够激活MAPKs信号通路的上游环节MEKl/2,再进一步通过磷酸ERKl/2化而激活ERKl/2。使用MEK特异性抑制剂—U0126,特异性抑制MAPK信号通路上游环节的MEKl/2,预处理细胞后,可阻断雌二醇增强细胞中MEKl/2、ERK1/2 mRNA的表达和p-MEK1/2、p-ERK1/2蛋白的活化,进一步说明雌激素可能通过非转录效应激活MEK/ERK信号通路,进而激活MAPK信号通路。
MAPK信号通路可以通过促进细胞增殖、抑制细胞凋亡等促进恶性肿瘤的发生、发展。p-ERK是胞外信号调节激酶(ERK)的活性形式,持续激活的ERK通路可促进正常细胞向肿瘤表型转化[8]。雌激素可以通过ERK1/2信号通路刺激子宫内膜癌细胞的增殖[9],U0l26可抑制MAPK反应级联的磷酸化。从而抑制MAPK活化ERα诱导乳腺癌和子宫内膜癌细胞增殖,U0126和COX-2抑制剂的联合应用可大大减少子宫内膜癌的发生[10]。
为进一步研究雌二醇与MAPK信号通路对子宫内膜癌细胞生物学功能的影响,本研究分别以雌二醇及U0126作用细胞,结果发现,U0126可抑制雌二醇刺激诱导的细胞增殖,使细胞周期中G0/G1期比例增加,S期比例下降,抑制细胞增殖,促进细胞凋亡;并使细胞集落形成增加,细胞迁移能力下降,这些结果提示,雌激素促进子宫内膜癌细胞增殖及迁移,且与MAPK信号通路的激活有关。相关研究结果表明,U0126可使MDM2水平下降,通过上调p53和p21表达抑制肿瘤细胞增殖,MEK抑制剂对肿瘤细胞增殖的抑制作用受ER水平的影响。低剂量MEK抑制剂联合雌激素受体拮抗剂对肿瘤细胞增殖的抑制作用大于单一使用MEK抑制剂或雌激素受体拮抗剂[11]。本研究结果与上述国外报道的结论一致。
综上所述,雌二醇通过非转录效应激活MAPK信号通路,促进子宫内膜癌的发生、发展。阻断MAPK/ER通路有可能成为雌激素依赖性子宫内膜癌的一个全新的分子靶标治疗途径。
| [1] | Kim SK,Novak RF. The role of intracellular signaling in insulin-mediated regulation of drug metabolizing enzyme gene and protein expression[J]. Pharmacol Ther, 2007, 113(1): 88-120. |
| [2] | Song Y, Dai F, Zhai D, et al. Usnic acid inhibits breast tumor angiogenesis and growth by suppressing VEGFR2-mediated AKT and ERK1/2 signaling pathways[J]. Angiogenesis, 2012, 15(3): 421-32. |
| [3] | Dixon KM, Lui GY, Kovacevic Z, et al. Dp44mT targets the AKT, TGF-beta and ERK pathways via the metastasis suppressor NDRG1 in normal prostate epithelial cells and prostate cancer cells[J]. Br J Cancer, 2013, 108(2): 409-19. |
| [4] | Lu YQ, Jiang S, Zhang JQ, et al. Estradiol activates MAPK signaling pathway by estrogen induced VEGF and bFGF in endometrial cancer cells[J]. Zhonghua Fu Chan Ke Za Zhi, 2014, 49(12): 925-31. [ 卢燕琼, 蒋斯, 张洁清, 等. 雌二醇诱导子宫内膜癌细胞产生的VEGF和bFGF对MAPK通路的影响[J]. 中华妇产科杂志, 2014, 49(12): 925-31.] |
| [5] | Lecanda J, Parekh TV, Gama P, et al. Transforming growth factor-beta, estrogen, and progesterone converge on the regulation of p27Kip1 in the normal and malignant endometrium[J]. Cancer Res, 2007, 67(3): 1007-18. |
| [6] | Acconcia F, Barnes CJ, Kumar R. Estrogen and tamoxifen induce cytoskeletal remodeling and migration in endometrial cancer cells[J]. Endocrinology, 2006, 147(3): 1203-12. |
| [7] | Sun Y, Wang C, Yang H, et al. The effect of estrogen on the proliferation of endometrial cancer cells is mediated by ERRgamma through AKT and ERK1/2[J]. Eur J Cancer Prev, 2014, 23(5): 418-24. |
| [8] | Brinkkoetter PT, Olivier P, Wu JS, et al. Cyclin I activates Cdk5 and regulates expression of Bcl-2 and Bcl-XL in postmitotic mouse cells[J]. J Clin Invest, 2009, 119(10): 3089-101. |
| [9] | Treeck O, Diedrich K, Ortmann O. The activation of an extracellular signal-regulated kinase by oestradiol interferes with the effects of trastuzumab on HER2 signalling in endometrial adenocarcinoma cell lines[J]. Eur J Cancer, 2003, 39(9): 1302-9. |
| [10] | Thomas RS, Sarwar N, Phoenix F, et al. Phosphorylation at serines 104 and 106 by Erk1/2 MAPK is important for estrogen receptor-alpha activity[J]. J Mol Endocrinol, 2008, 40(4): 173-84. |
| [11] | Suga S, Kato K, Ohgami T, et al. An inhibitory effect on cell proliferation by blockage of the MAPK/estrogen receptor/MDM2 signal pathway in gynecologic cancer[J]. Gynecol Oncol, 2007, 105(2): 341-50. |
 2016, Vol. 43
2016, Vol. 43


