文章信息
- 周韶梅,曹敏军,盛望,曾毅. 2015.
- CAO Minjun, SHENG Wang, ZENG Yi. 2015.
- miR-100对食管鳞癌细胞株Ec-109的抑制作用
- Tumor Suppressor Roles of miR-100 in Esophageal Squamous Cell Carcinoma Cell Line Ec-109
- 肿瘤防治研究, 2015, 42(02): 121-125
- Cancer Research on Prevention and Treatment, 2015, 42(02): 121-125
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.02.005
-
文章历史
- 收稿日期:2014-06-11
- 修回日期:2014-11-10
研究表明microRNA (miRNA)参与了调控细胞的增殖、凋亡、分化及个体发育等生命活动,在癌症中发挥抑癌基因或癌基因的功能,与肿瘤的形成、发展和预后密切相关[1],在食管癌的早期诊断、治疗和预后判断中具有较好的应用前景[2,3,4]。食管癌是我国8大重点癌症防治对象之一,有明显的地域性分布,以鳞状细胞癌为主,与HPV感染有密切关系[5]。1969年曾毅先生实验室于河南省林县分离、建立了Ec-109细胞株,后经证实为HPV18型阳性细胞株[6],是高恶性度、低分化的食管鳞癌细胞[7]。miR-100在食管鳞状细胞癌中的表达显著降低[8,9,10]。本实验以食管鳞状细胞癌的细胞株Ec-109为研究对象,在转染表达miR-100的质粒后,揭示其在食管鳞状细胞癌中的调控作用。1 材料和方法1.1 材料
克隆用质粒表达载体pcDNA6.2-GW/EmGFPmiR试剂盒、Opti-MEM I Reduced Serum Medium培养液、Lipofectamine2000、RPMI 1640、L-Gln购自Invitrogen公司;FBS购自Gibco公司;细胞迁移细胞培养板购于Corning公司;细胞凋亡、周期检测试剂盒购于BD公司。食管鳞状细胞癌的细胞株Ec-109由中国疾病与预防控制中心病毒病所周玲老师赠送。1.2 构建、转染表达miR-100的载体及qRT-PCR检测
构建miR-100重组质粒,按照试剂盒的要求合成两条miR-100前体单链(上海生工公司合成),退火并连接到pcDNA6.2-GW/ EmGFP-miR载体上,将质粒转化大肠杆菌,进行扩增、测序。用Lipofectamine 2000将重组质粒与空载体分别转染Ec-109细胞。载体带有GFP标签,利用流式细胞仪对转染细胞进行分选(BD FACSAria)。qRT-PCR检测miR-100的表达量。转染重组质粒的实验组为miR-100组,转染空载体为miR-NC组。以下为合成的两条miR-100前体单链序列:5’-ACGATGCTGCAAACCCGTATTGATCCGAACUUGUGGTTTTGGCCACTGACTGACCACAAGCGTTATCTATAGGTATG-3’;3’-ACGACGTTTGGGCATAACTAGGCTTGAACACCAAAACCGGTGACTGACTGGTGTTCGCAATAGATATCCATACCAGG-5’。
检测miR-100的qRT-PCR用品均购自天根生物有限公司,包括合成第一链cDNA所需的miRcute miRNA First-Strand cDNA Synthesis kit试剂盒,进行第二步实时荧光定量PCR检测的miRcute miRNA qRT-PCR Detection Kits(SYBR Green)试剂盒,以及miR-100的引物和内参U6的引物。采用相对定量的2-ΔΔCt 值法表示两组间起始模板量的差异。1.3 细胞凋亡检测
1×105个细胞接种于25 cm2培养瓶。RPMI 1640培养液,10%胎牛血清(FBS),2 mM L-谷氨酰胺(L-Gln),37℃ 、5% CO2的培养箱过夜培养。PBS清洗细胞3次,更换为RPMI 1640无血清培养液,培养4天。适量胰酶消化、收集细胞,PBS清洗。取5万~10万细胞加入195 µl Annexin V-APC结合液重悬,5 µl Annexin V-APC,混匀,室温避光孵育10 min。加入10 µl碘化丙啶(PI)染色液,混匀,随即进行流式细胞仪检测。按以上方法重复实验3次,每次在4~5天间观察其凋亡现象。1.4 细胞周期检测
细胞培养同1.3,在无血清条件下培养4天。胰酶消化、收集细胞,PBS清洗。70%乙醇重悬4℃过夜固定,之后PBS洗涤。染色液:染色结合液3 ml,PI染色液(×20)150 µl,RNase A(×50)60 µl。每管加入500 µl配制的染色液,37℃避光30 min,流式细胞仪检测 (Beckman,USA)。按以上方法重复实验3次。1.5 划痕修复实验
接种约5×105个细胞于6孔板,过夜培养,铺满孔底。用枪头划横线,PBS洗去细胞碎片,加入RPMI 1640无血清培养液,37℃、5% CO2培养箱孵育。每孔于划痕线上任意取4点做好标记,按0、24、48 h在标记处拍照(10倍物镜×10倍目镜)。用划痕修复率公式对伤口愈合的程度进行计算,划痕修复率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。1.6 无胶Transwell实验
2 4孔Transwell细胞培养板(Corning 公司),每孔5×104个细胞,无血清RPMI 1640培养液200 µl铺于上方小室。10% FBS,RPMI 1640培养液750 µl加入下方小室。12、24、36 h后PBS清洗细胞,4%甲醛,4℃过夜固定。擦去上室膜上面层细胞,0.1%结晶紫染色,清水冲洗,显微镜下拍照(10倍物镜×10倍目镜)。12 h时由于难以判断已穿过孔的细胞,几乎为正在穿孔而尚未完全穿过的细胞,而在36 h时,对照组的细胞密度又过大,难以计数,故选择24 h时进行计数比较。每孔随机取5个视野计数,取平均值即每个视野下的细胞平均数量。1.7 统计学方法
采用配对样本t检验双尾检测,取α=0.05水准,进行H0与H1的假设统计学分析,利用SPSS统计软件,P<0.05为差异有统计学意义。2 结果2.1 miR-100对食管鳞癌细胞株Ec-109细胞周期的影响
miR-100在转染细胞中可有效表达,转染24 h后qRT-PCR检测结果显示表达量提高了(6.45 ±0.53)倍(P<0.05)。miR-100对癌细胞凋亡和细胞周期的调节作用,三次重复实验结果,见图 1。G1期的细胞比例miR-NC组为(34.77±3.32),miR-100组为(55.8±2.52)(P<0.05);S期miRNC组为(22.97±7.74),miR-100组为(19.90±6.10)(P=0.088);G2/M期miR-NC组为(34.34±1.76),miR-100组为(18.78±1.67)(P<0.05)。
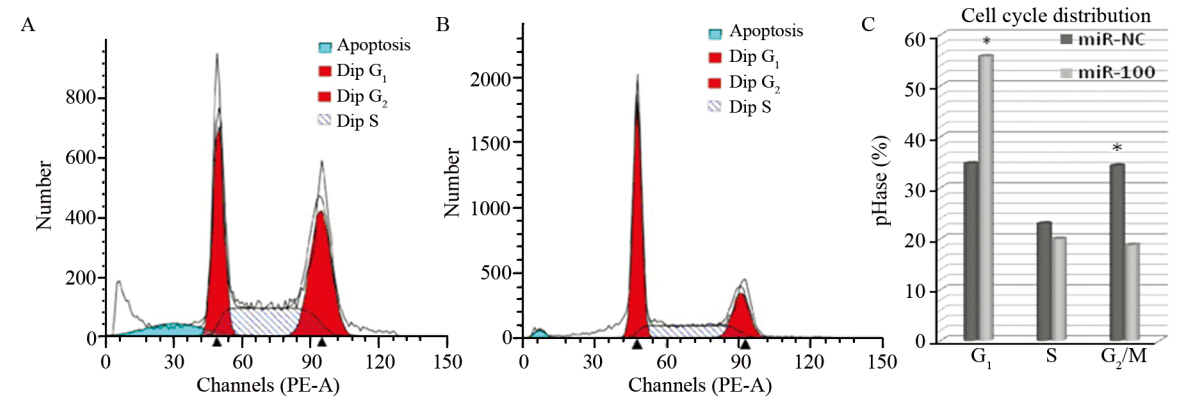 |
| A: miR-NC group; B: miR-100 group; C: comparison chart of cell distribution in stage G1,S,G2/M between two groups,*: P<0.05 图 1 PI染色的Ec-109细胞的流式细胞周期分析 Figure 1 Cell cycle of PI-stained Ec-109 cells analyzed by FACS |
利用流式细胞仪对miR-100在食管癌细胞中的调节作用进行了研究,在无血清培养条件下,miR-100 促进了食管鳞癌细胞株Ec-109的调亡。miR- NC组的早期凋亡比例为(1.44±0.41),miR-100组为(5.93±1.5),凋亡细胞数量miR-100转染组是对照组的4.14倍(P<0.05),见图 2。
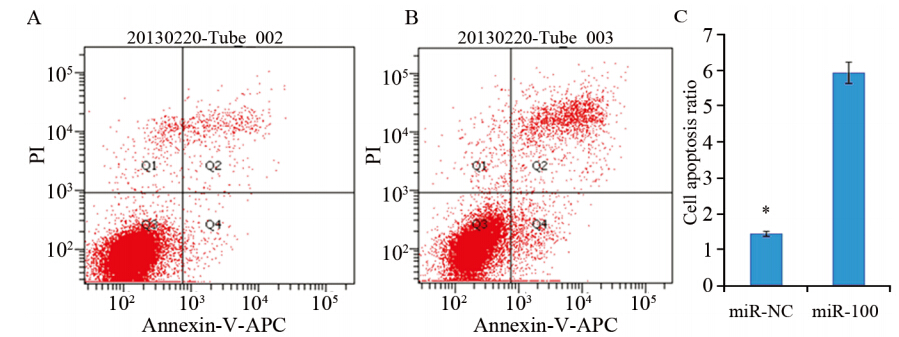 |
| A: miR-NC group; B: miR-100 group; C: compartion of cell apoptosis ratio in Q4 between two groups,*: P<0.05 图 2 流式细胞仪检测Ec-109细胞的凋亡 (Annexin-V-APC/PI) Figure 2 Apoptosis of Ec-109 cells analyzed by FACS (Annexin-V-APC/PI ) |
划痕修复实验结果显示:24 h愈合率miR-NC组为(0.67±0.06),miR-100组为(0.27±0.1),miRNC组的愈合率是miR-100组的2.25倍(P<0.05);48 h愈合率miR-NC组为(0.97±0.03),miR-100组为(0.57±0.09),miR-NC组的愈合率是miR-100组的1.68倍(P<0.05),见图 3。Matrigel胶Transwell实验miR-NC组细胞迁移至小室膜下的细胞数为每视野(218.5±24.17)个,而miR-100组为(49.17±8.38)个(P<0.05),见图 4。
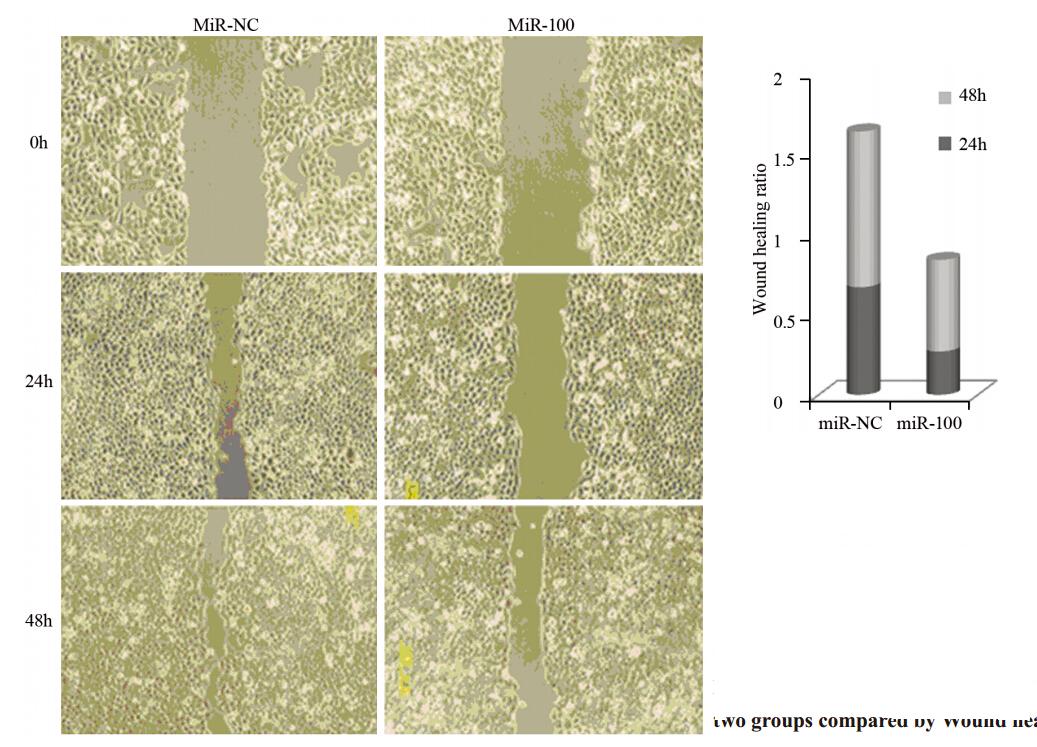 |
| Left: the scratch healing image of the Ec-109 cells in two groups at 0,24 and 48h under microscope; Right: comparison of cells healing rate between two groups at 24 and 48h 图 3 细胞划痕实验比较两组Ec-109细胞划痕愈合率 Figure 3 Healing rates of Ec-109 cells between two groups compared by Wound healing assay |
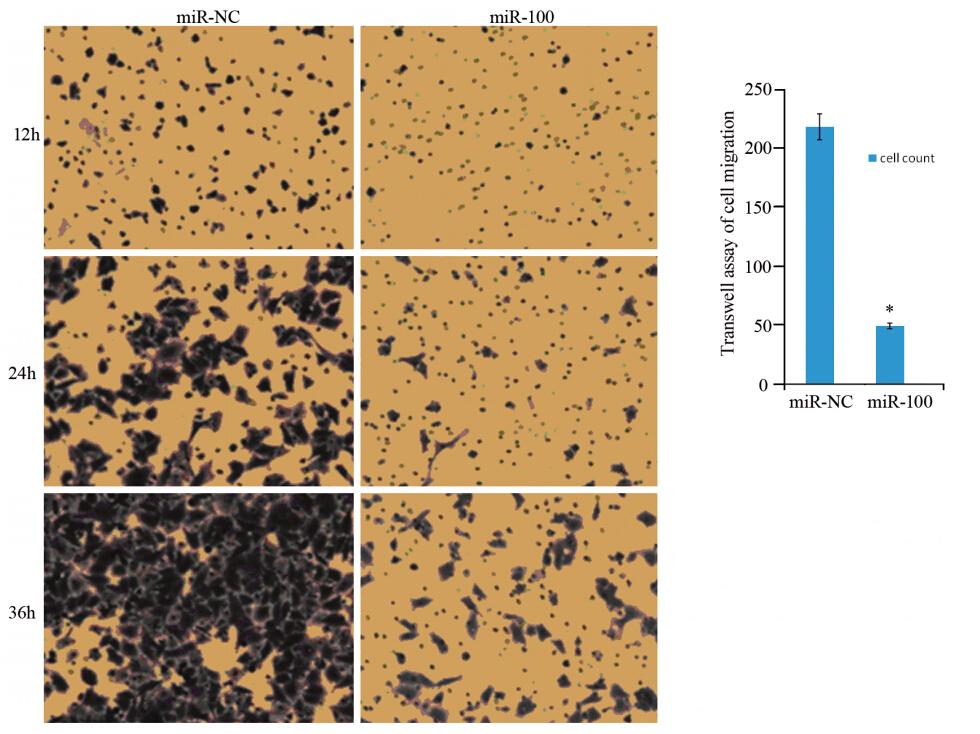 |
| Left: the perforated cells image of the two groups at 12,24,36h after well plating; Right: comparison of the perforated cells number between the two groups at 24 h,*: P< 0.05 图 4 细胞迁移实验比较两组Ec-109细胞的穿孔数目(结晶紫染色) Figure 4 Comparison of perforated Ec-109 cells number between two groups by Transwell assay (crystal violet staining) |
虽然miR-100的报道已有许多,看上去很有应用前景,但基础实验中很重要的促细胞凋亡的比值报道基本都在2倍以下,而对细胞周期的影响报道也存在明显差异。考虑到各检测方法自身的特点,加之不同癌症中miR-100的作用有差别,我们通常认为不同文献数据之间需要相互引证。然而在所有miR-100文献中含有对细胞凋亡和周期的报道并不多,且笔者搜索到的这7篇文献[11,12,13,14,15,16,17]均采用化学合成仿生miR-100(miR-100 mimics)瞬时转染细胞的方法。在细胞中miR-100 mimics会随着时间的推移被不断降解,可能是造成数据不理想的原因,所以本研究采用miR-100表达质粒进行转染,通过流式细胞仪筛选细胞,使miR-100在Ec-109细胞中得到稳定表达,观察其对食管鳞癌细胞的作用。尽管Sun等[11]对miR-100在食管鳞癌中的作用进行了报道,但所采用的是miR-100 mimics 方法,其研究结果促细胞凋亡作用仅以检测图的方式给出,而对细胞周期无影响,这与本研究结果不同。
首先对miR-100的促细胞调亡作用的数据进行观察。Shi等[12]对鼻咽癌的研究中,找到miR-100的靶标Plk1,使用siRNA降解Plk1,进行Caspase 3/7 检测,凋亡数值增加了1.9~2.1倍;Liu等[13]研究非小细胞性肺癌,使用Hoechst染色法,荧光显微镜下计数,凋亡数目增加了(18.3±1.4)%倍。Sun[11]、Feng[14]和Li[15]等均采用的都是Annexin-V/PI染色法流式检测。Feng研究肺腺泡癌,凋亡百分比值由(5.71±0.84)%增加至(8.83±1.20)%;L i研究宫颈癌,将数据与图形外挂于补充文件,凋亡检测结果Siha细胞的对照组为(7.83±0.96)%,实验组为(11.8±1.38)%;Caski细胞的对照组为(4.03±0.60)%,实验组为(7.1±1.12)%。本研究也采用了较为灵敏的早期凋亡检测方法—Annexin-V/PI染色流式检测法,在无血清培养4~5天后,检测细胞发生凋亡的百分比数值是对照组的4.14倍,而本研究的特点是使miR-100稳定表达,所以认为其促进凋亡的能力较弱。
其次对细胞周期的报道存在明显差异。虽然Feng[14]和Li等[15]报道miR-100使癌细胞停留于G2/M期,但Zheng等[16]报道miR-100使急性髓性白血病细胞克服由诺考达唑(nocodazole)引起的G2/M期阻滞,穿过此期,并促使细胞进入S期;Cui等[17]报道miR-99a mimics诱导肾癌细胞停留于G1期(miR-100与miR-99a为同一家族,种子区序列完全相同,其余序列仅一碱基之差)。本研究结果使癌细胞停留于G1期。虽然每篇报道的数据都有统计学意义,但通过查看具体数值也可以发现,其实对照组与实验组之间的数据变化并不大。
在对细胞迁移影响的研究中,虽然细胞划痕实验和未铺Matrigel胶的穿孔实验结果均显示miR-100抑制食管鳞癌细胞的迁移,然而划痕修复实验的结果仅展示出细胞增殖和向外延伸生长的两个方面的作用力,miR-NC组细胞愈合速度虽然快于miR-100组,但并未观察到miR-NC组细胞脱离原出发地的细胞进行迁移-肿瘤细胞所特有的迁移现象,但是通过穿孔实验观察到了这一特点。结合临床报道,并对食管鳞癌细胞的迁移特点进行分析,可知以上两种迁移实验其实也同时展示出Ec-109细胞株所代表的食管鳞癌细胞的迁移特点。有记载[18]食管鳞癌主要为局部侵润和淋巴转移,血行转移较为少见。日本对258例食管鳞癌患者术后生存率的研究结果显示,其生存率与淋巴结转移相关(P<0.0001)[19]。我国报道[20]对243位食管鳞癌患者行单纯性手术切除治疗,术后随访10年,其研究结果发现:发生跳跃性转移的比例为4.9%(12/243),淋巴结转移与肿瘤大小无关,与浸润深度和分化程度相关,统计T1期(侵入食管壁黏膜下层为T1期)出现淋巴结转移的阳性率为12.5%(1/8)。从食管的组织结构可知黏膜下层为疏松结缔组织,富有血管、淋巴管和腺体,毛细淋巴管壁比毛细血管壁的细胞排列疏松许多。那么我们将实验室中细胞的迁移特点与临床转移特点相结合进行分析:癌块大小不影响转移,浸润深度和分化程度影响转移,而在侵入富有毛细血管和毛细淋巴管的黏膜下层时,其发生转移的比例仍然较低,且主要为淋巴转移,并且发生跳跃性转移的比例非常低;结合实验室研究Ec-109细胞株为高恶性度、低分化的食管鳞癌细胞和只有通过穿孔实验才显示出的恶性肿瘤细胞迁移的特点,笔者认为食管鳞癌细胞的主动迁移能力相对其他高转移性的癌症较弱。在Ec-109细胞这种特有的迁移特点之下,我们观察到了miR-100有明显抑制其迁移的作用。目前尚未见有文献对食管鳞癌细胞的迁移特点进行分析研究的报道。
miR-100对食管鳞癌细胞株Ec-109表现出抑癌活性,其中包括抑制细胞迁移、促进细胞调亡、促使细胞停留于G1期。虽然有数篇报道[8,9,10]在食管鳞癌的microRNA芯片筛检中miR-100表达量显著降低,但本研究结果显示其对细胞周期和凋亡的影响较弱,远低于许多抗肿瘤药物,结合其他文献数据,可推测单一miR-100的促凋亡作用和对细胞周期的作用力都较弱。其调控机制及与microRNA的联合应用均有待于进一步研究。
| [1] | Ambros V. The Functions of Animal MicroRNAs [J]. Nature, 2004, 431(7006): 350-5. |
| [2] | Gu J, Wu Xf. microRNAs in Esophageal Cancer[M]// W.C.S. Cho. microRNAs in Cancer Translational Research. Dordrencht, Heidelberg,London,New York:Springer, 2011: 201-21. |
| [3] | Patnaik S-k, Mallick R, Yendamuri S. MicroRNA and Esophagel Cancer[J].J Gastrointest Oncol, 2010, 1(9): 55-63. |
| [4] | Hu Y, Correa AM, Hoque A, et al. Prognostic Significance of Differentially Expressed microRNAs in Esophageal Cancer[J]. Int J Cancer, 2011, 128 (1): 132-43. |
| [5] | Lv LC, Shen ZY. Human papilloma virus infection and infection copy number[J].Zhonghua Bing Li Xue Za Zhi, 1997,26(3): 166-7.[吕丽春, 沈忠英. 人乳头状瘤病毒感染及感染拷贝数与食管癌的关系[J].中华病理学杂志, 1997, 26(3): 166-7.] |
| [6] | Qi ZL, Huo X, Zhang B, et al. Esophageal cancer cell line_EC109 is Confirmed a Human Papillomavirus type 18 positive cell line[J].Shantou Da Xue Yi Xue Yuan Xue Bao, 2006, 19(3):136-8, 153.[齐宗利, 霍霞, 张宝, 等. 食管癌EC109细胞属人类乳头状瘤病毒18型阳性细胞株 [J]. 汕头大学医学院学报, 2006, 19(3): 136-8, 153.] |
| [7] | Han YL, Wei F, Xu X, et al. Establishment and comparative genomic hybridization analysis of human esophageal carcinomas cell line EC9706[J]. Zhonghua Yi Xue Yi Chuan Xue Za Zhi, 2002, 19(6): 455-7.[韩亚玲, 魏芳, 徐昕, 等. 人食管鳞癌细胞系EC9706的建立及其比较基因组杂交分析[J]. 中华医学遗传学杂志, 2002, 19(6): 455-7.] |
| [8] | Feber A, Xi L, Luketich JD, et al. MiRNA expression profile in esophageal cancer[J]. J Thorac Cardiovasc Surg, 2008, 135(2): 255-60. |
| [9] | Guo Y, Chen Z, Zhang L, et al. Distinctive MicroRNA Profiles Relating to Patient Survival in Esophageal Squamous Cell Carcinoma[J]. Cancer Res, 2008, 68(1): 26-33. |
| [10] | Zhou SL, Wang LD. Circulating microRNAs: Novel biomarkers for esophageal Cancer[J]. World J Gastroenterol, 2010, 16(19): 2348-54. |
| [11] | Sun J, Chen Z, Tan X, et al. microRNA -99a/100 Promotes Apoptosis by Targeting mTOR in Human Esophageal Squamous Cell Carcinoma[J]. Med Oncol, 2013, 30(1): 411. |
| [12] | Shi W, Alajez NM, Bastianutto C, et al. Significance of Plk1 regulation by miR-100 in human nasopharyngeal cancer[J]. Int J Cancer, 2010, 126(9): 2036-48. |
| [13] | Liu J, Lu KH, Liu ZL, et al. MicroRNA-100 is a potential molecular marker of non-small cell lung cancer and functions as a tumor suppressor by targeting polo-like kinase 1[J]. BMC cancer, 2012, 12: 519. |
| [14] | Feng B, Wang R, Chen LB. MiR-100 resensitizes docetaxelresistant human lung adenocarcinoma cells (SPC-A1) to docetaxel by targeting Plk1[J]. Cancer Lett, 2012, 317(2): 184-91. |
| [15] | Li BH, Zhou JS, Ye F, et al. Reduced miR-100 expression in cervical cancer and precursors and its carcinogenic effect through targeting PLK1 protein[J]. Eur J Cancer, 2011, 47(14): 2166-74. |
| [16] | Zheng YS, Zhang H, Zhang XJ, et al. MiR-100 regulates cell differentiation and survival by targeting RBSP3, a phosphataselike tumor suppressor in acute myeloid leukemia[J]. Oncogene, 2012, 31(1): 80-92. |
| [17] | Cui L, Zhou H, Zhao H, et al. MicroRNA-99a induces G1-phase cell cycle arrest and suppresses tumorigenicity in renal cell carcinoma[J]. BMC Cancer, 2012, 12: 546. |
| [18] | Xu YY, Yu SC. Comprehensive Cancer Therapeutics[M].Beijing: People’s Military Medical Press, 2001.[徐燮渊, 俞受程. 肿瘤综合治疗学[M]. 北京: 人民军医出版社, 2001.] |
| [19] | Tachibana M, Yoshimura H, Kinugasa S, et al. Clinicopathologic factors correlated with number of metastatic lymph nodes in oesophageal cancer[J]. Dig Liver Dis, 2001, 33(7): 534-8. |
| [20] | Wang YG, Wang LJ, Zhang DC. Characteristics of lymph node metastasis of squamous cell carcinoma of thoracic esophagus and its clinical significance[J]. Zhonghua Zhong Liu Za Zhi, 2000, 22(3): 241.[王永岗, 汪良骏, 张德超. 胸段食管鳞癌淋巴结转移特点及临床意义 [J]. 中华肿瘤杂志, 2000, 22(3): 241.] |
 2014, Vol. 42
2014, Vol. 42
