文章信息
- 2a型腺苷受体在促进肿瘤免疫微环境抑制状态形成中的作用
- Role of Adenosine 2a Receptor in Promoting Immune-suppressive Status in Tumor Microenvironment
- 肿瘤防治研究, 2017, 44(6): 433-436
- Cancer Research on Prevention and Treatment, 2017, 44(6): 433-436
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.16.1400
- 收稿日期: 2016-11-17
- 修回日期: 2017-02-18
2. 100853 北京,解放军总医院普通外科
2. Department of General Surgery, PLA General Hospital, Beijing 100853, China
近年来,多种针对免疫检查点程序性死亡蛋白配体1/程序性死亡蛋白1(programmed death ligand 1/programmed death 1, PDL1/PD1)和细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)的药物陆续进入临床,成为肿瘤免疫治疗发展过程中里程碑式的重大事件,同时也使肿瘤的免疫微环境成为这一领域的研究热点。肿瘤的免疫编辑理论认为,临床上的肿瘤均处于免疫逃逸阶段,具有逃避宿主免疫系统识别和杀伤的能力,因此认识并阐明肿瘤免疫逃逸的各种机制,以对其中的某些环节进行阻断或者控制,最终达到恢复宿主免疫监视功能的目的,是肿瘤免疫治疗非常重要的课题。
2a型腺苷受体(type 2a adenosine receptor, A2aR)广泛存在于各种免疫细胞表面,其在人体内的天然配体是腺嘌呤核苷即腺苷(adenosine, ADO)。随着研究的深入,ADO-A2aR被发现是维持肿瘤微环境中免疫抑制状态的重要因素之一,以A2aR为靶点的某些小分子物质在体外和动物实验中也显示出了可靠的抗肿瘤作用,并且已经有两种靶向A2aR的药物分别于2015年和2016年进入临床试验阶段,因此这一领域的发展前景和潜力不容忽视。现就ADO-A2aR的免疫调节机制及其与肿瘤的关系作一综述。
1 A2aR与嘌呤核苷(酸)通路A2aR是嘌呤核苷(酸)通路的关键节点之一,这一通路始于生物体内最重要的能量分子—三磷酸腺苷(ATP)。在多种情况下,包括损伤、缺血、缺氧、应激、渗透压改变等,ATP可由细胞内释放至细胞外[1],之后又在一系列核苷酸酶作用下依次经二磷酸腺苷(adenosine diphosphate, ADP)、一磷酸腺苷(adenosine monophosphate, AMP)最终生成ADO,在这些酶中,以胞外三磷酸核苷二磷酸水解酶1(ectonucleoside triphosphate diphosphohydrolase 1, E-NTPD1, 即CD39)和5’-核苷酸酶(5'-nucleotidase, 5’-NT, 即CD73)最为重要,分别是ATP转化为ADP和AMP以及AMP转化为ADO的限速酶,在组织缺血缺氧时这两种酶的表达上调[2]。ADO的受体包括A1R、A2aR、A2bR、A3R四种,其中A1R、A2aR与ADO呈高亲和力结合,而A2bR、A3R与ADO的亲和力较低[3]。受体分布方面,除A2aR分布于绝大多数免疫细胞外,其余三种ADO受体主要分布于巨噬细胞、树突状细胞、中性粒细胞或肥大细胞等髓系来源的细胞,在淋巴细胞上仅有少量表达或不表达。
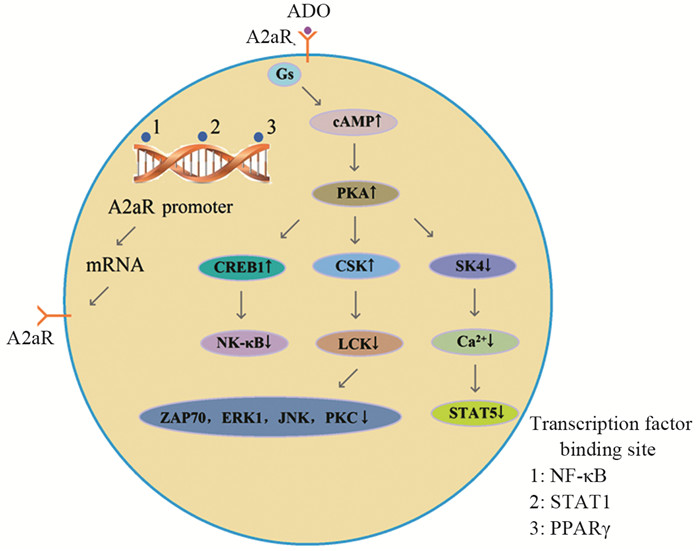
A2aR是一种G蛋白偶联受体,与其偶联的G蛋白主要为Gs蛋白,A2aR与ADO结合后引起细胞内cAMP上升,导致蛋白激酶A(protein kinase A, PKA)磷酸化,PKA进一步产生三方面的效应:一是激活C末端SRC激酶(C-terminal SRC kinase, CSK),继而通过磷酸化第505位酪氨酸残基抑制淋巴细胞特异性蛋白酪氨酸激酶(lymphocyte specific protein tyrosine kinase, LCK)的功能,减少其下游LCK依赖的ζ链相关蛋白-70(zeta-chain-associated protein 70, ZAP70)、细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK1)、c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)和蛋白激酶C(Protein kinase C, PKC)的活化[4];二是激活cAMP反应元件结合蛋白1(cAMP response element binding protein 1, CREB1),后者对主要的促炎转录因子核因子κB(nuclear factor κB, NF-κB)具有抑制作用[5];三是抑制中电导钙激活钾通道蛋白(intermediate-conductance calcium activated potassium channel protein,又称KCa3.1、IKca或SK4)的活性,减少Ca2+内流,减少信号转导子和转录激活子5(signal transducers and activators of transcription 5, STAT5)的活化[6]。相反地,A2aR基因的启动子区域包含了NF-κB、STAT1和过氧化物酶体增殖子激活受体γ(peroxisome proliferator-activated receptor-γ, PPARγ)的结合位点[7-8],这些转录因子激活可诱导A2aR的表达,从而构成了一个复杂的交互作用和反馈调节网络,见图 1。
|
| A2aR: adenosine 2a receptor; ADO: adenosine; PKA: protein kinase A; CSK: C-terminal SRC kinase; LCK: lymphocyte specific protein tyrosine kinase; ZAP70: zeta-chain-associated protein 70; ERK1: extracellular regulated protein kinases; JNK: c-Jun N-terminal kinase; PKC: protein kinase C; CREB1: cAMP response element binding protein 1; NF-κB: nuclear factor κB; SK4: intermediate-conductance calcium activated potassium channel protein; STAT5: signal transducers and activators of transcription 5; PPARγ: peroxisome proliferator-activated receptor-γ 图 1 ADO-A2aR的细胞内信号转导途径 Figure 1 Intracellular signal transduction of ADO-A2aR pathway |
由于肿瘤细胞的快速增殖代谢,多数实体肿瘤均存在血供氧供相对不足的矛盾,造成肿瘤微环境中较高浓度的ADO,进而通过A2aR促进肿瘤组织内免疫抑制状态的形成和维持,若给予荷瘤小鼠高氧呼吸(氧含量60%),则可改善上述机制导致的免疫抑制,表现出明显的抗肿瘤效应,这一成果发表在2015年的Science Translational Medicine(IF: 16.264)上[9]。
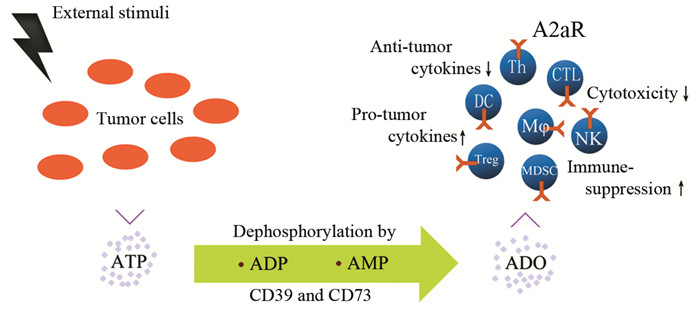
与恶性肿瘤的发生发展和治疗有关的免疫细胞主要包括具有抗原提呈功能的树突状细胞(DC)和巨噬细胞(Mφ),发挥免疫效应的CD4+ Th细胞、CD8+ CTL细胞和NK细胞,以及以Tregs、髓系来源的抑制细胞(myeloid-derived suppressor cells,MDSCs)为代表的调节性免疫细胞,A2aR在这些细胞上均为组成性表达并对其功能产生显著的调控作用,见图 2。
|
| 图 2 ADO的产生过程及其通过A2aR对免疫细胞的作用 Figure 2 ADO production and its actions on immune cells through A2aR |
ADO作用于Mφ表面A2aR可使其向抗炎促肿瘤的M2型分化,特征是高表达IL10、精氨酸酶1(argnase 1, Arg1)和血管内皮生长因子(vascular endothelial growth factor, VEGF),而低表达TNF和IL12[10-11],类似的效应也出现在DC上,未成熟DC高表达A1R和A3R,而成熟DC表面A1R和A3R表达减少,A2aR表达增加[12],A2aR激活可诱导DC分泌Arg1、Arg2和吲哚胺2,3-双加氧酶(indoleamine2.3-dioxygenase, IDO),以及对Th17细胞形成具有重要作用的转化生长因子β(transforming growth factor-β, TGFβ)和IL6[13],由此可见髓系来源免疫细胞上A2aR的作用主要是抑制抗肿瘤免疫反应,促进血管生成和组织修复重构。
2.2 免疫效应细胞对于效应T细胞,ADO与A2aR结合导致的最终结果是IL2、IFNγ和TNFα等促炎抗肿瘤细胞因子分泌减少,细胞增殖能力下降,CTL的细胞毒性作用减弱,IL2减少可继发性引起T细胞上CD28和CD2等共刺激分子表达下调从而降低其对共刺激信号的反应[5]。A2aR激活还可使NK细胞的杀伤活性显著下降,IFNγ和巨噬细胞炎性反应蛋白1α(macrophage inflammatory protein 1α, MIP1α)等细胞因子产生减少,并削弱在IL12和IL18刺激下NK细胞表达CD69以及CD27的能力,而这些效应可被选择性A2aR拮抗剂SCH58261逆转,在A2aR-/-NK细胞上也未能发现[14]。因此对免疫效应细胞而言A2aR的作用是降低其杀伤肿瘤细胞的能力。
2.3 免疫调节细胞Treg细胞表面高表达CD39和CD73,将细胞间质中的ATP转化为ADO,ADO作用于A2aR可使更多的初始T细胞转化为Treg细胞,而反过来A2aR信号对于维持CD73和PD1在Treg细胞表面的表达又是必须的,A2aR基因敲除导致的Treg细胞免疫抑制功能减弱可被CD73敲除或阻断PD1所复制[15]。此外Treg细胞能够分泌含CD39和CD73的外泌体,通过A2aR抑制效应T细胞的增殖和IL2产生[16]。A2aR激活还可使肿瘤微环境中另外一种主要的免疫调节细胞—MDSC的数量增加,免疫抑制活性提高[17]。
3 A2aR作为肿瘤免疫治疗靶点的价值及相关药物研究进展A2aR作为肿瘤免疫的重要调节因素在近年来受到持续关注,部分学者专注于此领域的研究并取得高水平的成果,而以A2aR为靶点的相关药物也已处于商品化阶段,有望在数年内上市进入临床。
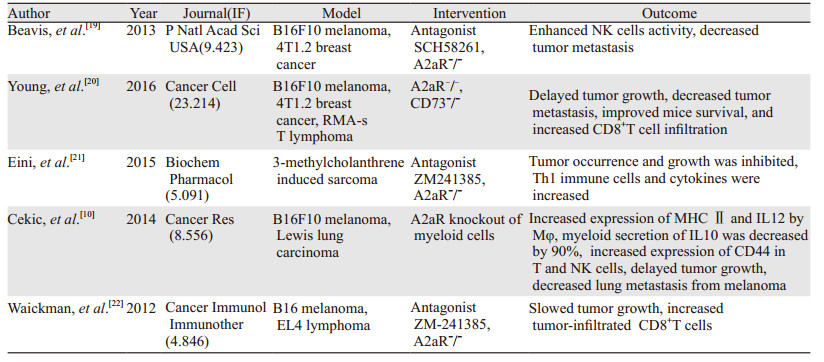
3.1 临床前研究体外和动物实验提示A2aR在肿瘤的进展和转移过程中均发挥了重要作用,而针对A2aR的干预措施包括小分子拮抗剂和基因沉默或敲除则显示出了可靠的抗肿瘤效果。本文列举了近几年有代表性的部分论文,基于这些研究A2aR及其所在的嘌呤核苷(酸)通路被认为是极具前景的肿瘤免疫治疗靶点,而其中A2aR甚至被某些学者称为一种全新的代谢性免疫检查点[17-18],但略显遗憾的是这些研究多在美国、加拿大、澳大利亚等少数欧美国家开展,尤其是Sitkovsky[9, 14]、Ceick[10]、Bevis[19]等所在的实验室,尚未检索到有国内机构参与或进行了相关工作,见表 1。
迄今尚无以A2aR为靶点的药物用于肿瘤患者的报道,但目前已有两种A2aR拮抗剂完成了Ⅰ/Ⅰb期临床试验注册并处于患者招募阶段(ClinicalTrials.gov),一是西班牙Palobiofarma公司推出的PBF-509单药或联合PDR001(一种PD1单抗)治疗非小细胞肺癌的单中心临床试验(NCT02403193,2015年注册),值得注意的是该项目直接促成了其与瑞士Novartis公司的合作,后者已为此投入了至少1500万美元的前期资金;二是美国CORVUS公司开发的CPI444,以其单药或联合Atezolizumab(一种PDL1单抗)治疗多种实体肿瘤的多中心临床试验(NCT02655822,2016年注册)[23]。此外包括Istradefylline、Preladenant、Tozadenant和Vipadenant等在内的多种A2aR拮抗剂在针对帕金森病的临床试验中已经显示出了良好的安全性和耐受性[23-25],预计在不久的将来会有越来越多与肿瘤相关的临床研究见诸报道。
4 总结综上所述,A2aR对免疫系统的作用可以归纳为抑制免疫反应、抗炎和促进肿瘤生长,而肿瘤组织内广泛存在且含量增加的ADO,使得A2aR成为肿瘤细胞逃避免疫监视的关键因素之一,靶向这一位点的免疫治疗手段目前正处于稳步发展中,其制剂为小分子物质的特点,使之理论上与单克隆抗体相比具有给药方式多样、价格更加低廉和组织穿透力强的优势,相信一定能够在今后的肿瘤治疗中占有一席之地。
| [1] | Zimmermann H. Extracellular ATP and other nucleotides-ubiquitous triggers of intercellular messenger release[J].Purinergic Signal, 2016, 12(1): 25–57. DOI:10.1007/s11302-015-9483-2 |
| [2] | Cekic C, Linden J. Purinergic regulation of the immune system[J].Nat Rev Immunol, 2016, 16(3): 177–92. DOI:10.1038/nri.2016.4 |
| [3] | Fredholm BB, IJzerman AP, Jacobson KA, et al. International union of basic and clinical pharmacology. LXXXI. nomenclature and classification of adenosine receptors-an update[J].Pharmacol Rev, 2011, 63(1): 1–34. DOI:10.1124/pr.110.003285 |
| [4] | Linnemann C, Schildberg FA, Schurich A, et al. Adenosine regulates CD8 T cell priming by inhibition of membrane-proximal T cell receptor signalling[J].Immunology, 2009, 128(1 Suppl): E728–737. |
| [5] | Su Y, Jackson EK, Gorelik E. Receptor desensitization and blockade of the suppressive effects of prostaglandin E(2) and adenosine on the cytotoxic activity of human melanoma-infiltrating T lymphocytes[J].Cancer Immunol Immunother, 2011, 60(1): 111–22. DOI:10.1007/s00262-010-0924-z |
| [6] | Chimote AA, Hajdu P, Kucher V, et al. Selective inhibition of KCa3.1 channels mediates adenosine regulation of the motility of human T cells[J].J Immunol, 2013, 191(12): 6273–80. DOI:10.4049/jimmunol.1300702 |
| [7] | Elson G, Eisenberg M, Garg C, et al. Induction of murine adenosine A(2A) receptor expression by LPS: analysis of the 5' upstream promoter[J].Genes Immun, 2013, 14(3): 147–53. DOI:10.1038/gene.2012.60 |
| [8] | He X, Hu JL, Li J, et al. A feedback loop in PPARγ-adenosine A2A receptor signaling inhibits inflammation and attenuates lung damages in a mouse model of LPS-induced acute lung injury[J].Cell Signal, 2013, 25(9): 1913–23. DOI:10.1016/j.cellsig.2013.05.024 |
| [9] | Hatfield SM, Kjaergaard J, Lukashev D, et al. Immunological mechanisms of the antitumor effects of supplemental oxygenation[J].Sci Transl Med, 2015, 7(277): 277ra30. DOI:10.1126/scitranslmed.aaa1260 |
| [10] | Cekic C, Day YJ, Sag D, et al. Myeloid expression of adenosine A2A receptor suppresses T and NK cell responses in the solid tumor microenvironment[J].Cancer Res, 2014, 74(24): 7250–9. DOI:10.1158/0008-5472.CAN-13-3583 |
| [11] | Ferrante CJ, Pinhal-Enfield G, Elson G, et al. The adenosine-dependent angiogenic switch of macrophages to an M2 like phenotype is independent of interleukin 4 receptor α (IL 4Rα) signaling[J].Inflammation, 2013, 36(4): 921–31. DOI:10.1007/s10753-013-9621-3 |
| [12] | Li L, Huang L, Ye H, et al. Dendritic cells tolerized with adenosine A2AR agonist attenuate acute kidney injury[J].J Clin Invest, 2012, 122(11): 3931–42. DOI:10.1172/JCI63170 |
| [13] | Liu C, Shang Q, Bai Y, et al. Adenosine A2A receptor, a potential valuable target for controlling reoxygenated DCs-triggered inflammation[J].Mol Immunol, 2015, 63(2): 559–65. DOI:10.1016/j.molimm.2014.10.012 |
| [14] | Sitkovsky MV, Hatfield S, Abbott R, et al. Hostile, hypoxia-A2-adenosinergic tumor biology as the next barrier to overcome for tumor immunologists[J].Cancer Immunol Res, 2014, 2(7): 598–605. DOI:10.1158/2326-6066.CIR-14-0075 |
| [15] | Ohta A, Sitkovsky M. Extracellular adenosine-mediated modulation of regulatory T cells[J].Front Immunol, 2014, 5: 304. |
| [16] | Smyth LA, Ratnasothy K, Tsang JY, et al. CD73 expression on extracellular vesicles derived from CD4+CD25+Foxp3+ T cells contributes to their regulatory function[J].Eur J Immunol, 2013, 43(9): 2430–40. DOI:10.1002/eji.201242909 |
| [17] | Leone RD, Lo YC, Powell JD. A2aR antagonists: Next generation checkpoint blockade for cancer immunotherapy[J].Comput Struct Biotechnol J, 2015, 13: 265–72. DOI:10.1016/j.csbj.2015.03.008 |
| [18] | Ohta A. A metabolic immune checkpoint: adenosine in tumor microenvironment[J].Front Immunol, 2016, 7: 109. |
| [19] | Beavis PA, Divisekera U, Paget C, et al. Blockade of A2A receptors potently suppresses the metastasis of CD73+ tumors[J].Proc Natl Acad Sci U S A, 2013, 110(36): 14711–6. DOI:10.1073/pnas.1308209110 |
| [20] | Young A, Ngiow SF, Barkauskas DS, et al. Co-inhibition of CD73 and A2AR Adenosine Signaling Improves Anti-tumor Immune Responses[J].Cancer Cell, 2016, 30(3): 391–403. DOI:10.1016/j.ccell.2016.06.025 |
| [21] | Eini H, Frishman V, Yulzari R, et al. Caffeine promotes anti-tumor immune response during tumor initiation: Involvement of the adenosine A 2A receptor[J].Biochem Pharmacol, 2015, 98(1): 110–8. DOI:10.1016/j.bcp.2015.08.092 |
| [22] | Waickman AT, Alme A, Senaldi L, et al. Enhancement of tumor immunotherapy by deletion of the A2A adenosine receptor[J].Cancer Immunol Immunother, 2012, 61(6): 917–26. DOI:10.1007/s00262-011-1155-7 |
| [23] | Allard D, Turcotte M, Stagg J. Targeting A2 adenosine receptors in cancer[J].Immunol Cell Biol, 2017, 95(4): 333–9. DOI:10.1038/icb.2017.8 |
| [24] | Park A, Stacy M. Istradefylline for the treatment of Parkinson's disease[J].Expert Opin Pharmacother, 2012, 13(1): 111–4. DOI:10.1517/14656566.2012.643869 |
| [25] | Hauser RA, Olanow CW, Kieburtz KD, et al. Tozadenant (SYN115) in patients with Parkinson's disease who have motor fluctuations on levodopa: a phase 2b, double-blind, randomised trial[J].Lancet Neurol, 2014, 13(8): 767–76. DOI:10.1016/S1474-4422(14)70148-6 |
 2017, Vol. 44
2017, Vol. 44