自噬是细胞通过溶酶体降解长寿命蛋白和细胞器的过程[1]。研究结果表明,自噬具有选择性,如细胞通过自噬选择性清除线粒体的过程,即线粒体自噬就是一种重要的选择性自噬[2]。线粒体自噬清除损伤线粒体是细胞实现线粒体质量控制的主要途径,对维持细胞稳态至关重要。
目前广泛认可的介导线粒体自噬的通路主要包括:① 酵母菌中Atg32介导的线粒体自噬;② 在多种后生动物细胞中Parkin和PTEN诱导假定激酶1(PTEN-induced putative kinase protein 1,PINK1) 共同介导的线粒体自噬;③ 哺乳动物中Nix、FUNDC1等线粒体自噬受体介导的线粒体自噬[3]。PINK1/Parkin通路已成为近年研究的热点。简单说来,受损线粒体的膜电位降低,使PINK1在线粒体外膜上累积,继而招募细胞质中的Parkin泛素化标记线粒体[4-5]并招募自噬泡包被这些线粒体。最近的研究表明,PINK1/Parkin通路还参与了其非自噬依赖的线粒体清除过程[6]。同时Parkin缺失的细胞株如HeLa同样存在线粒体自噬的现象[7-8],提示线粒体自噬发生机制的复杂性。
近年来的研究显示,Nix是介导线粒体自噬的重要蛋白,对哺乳动物网织红细胞成熟过程中线粒体的清除至关重要[9],然而其作用机制尚未完全阐明。本文将重点综述Nix介导的线粒体自噬机制的研究进展。
1 Nix的发现及其功能Nix又被称为Bnip3L,即B-cell leukemia/lymphoma 2 (Bcl-2)/adenovirus E1B 19 kDa interacting protein 3-like。其中E1B 19 K是腺病毒基因组中编码的一种Bcl-2同源蛋白[10]。Nix是通过以E1B 19 K为诱饵蛋白的酵母双杂交筛选[11]和高通量cDNA文库筛选[12]被发现的。因此,最初Nix就被归为Bcl-2家族成员。后续研究进一步发现,Nix只含有凋亡效应结构域 (Bcl-2 homologue 3,BH3) 和跨膜结构域,属于BH3-only蛋白,可与Bcl-2和Bcl-XL相互作用,改变线粒体膜通透性,增加细胞色素c的释放,从而引起细胞凋亡[13]。
但是,随着对Nix功能研究的深入,人们发现Nix不同于其他典型的BH3-only蛋白。首先,与典型的BH3-only蛋白相比,Nix诱导凋亡的能力较弱[14];其次,典型的BH3-only蛋白主要依赖自身BH3结构域发挥作用[15],而Nix却主要依赖其跨膜区发挥促凋亡作用[13]。这些实验结果提示,促凋亡可能不是Nix主要的功能。2007年Mclelland等[6]研究发现,在网织红细胞成熟的过程中,线粒体的程序性清除依赖于Nix。至此,人们才逐渐关注到Nix另一重要的生理功能——介导线粒体自噬。
Nix介导的线粒体自噬除了在生理状态下发挥重要作用,与许多疾病也相关。Nix在多种肿瘤中发挥的抑癌作用[16-18]不仅与它介导凋亡的功能相关[19],也与其介导的线粒体自噬相关;新型抗癌药物KP46能够特异性地激动Nix依赖的线粒体自噬而发挥抑癌作用[20]。Nix与其同源蛋白Bnip3对于病毒感染后自然杀伤细胞的存活是必需的,其介导线粒体自噬清除自然杀伤细胞中受损的线粒体,参与免疫应答[21];Nix与帕金森病重要蛋白Parkin发生相互作用,可能也参与了帕金森病的病理进程[22]。鉴于Nix介导的线粒体自噬在多种疾病中都发挥着重要作用,其介导线粒体自噬的具体机制及与不同疾病的关系都有待进一步研究。
2 Nix通过与Parkin相互作用介导线粒体自噬线粒体膜电位降低是Parkin介导的线粒体自噬过程中的重要一环[23]。早期的研究发现,线粒体膜电位与Nix介导线粒体自噬之间存在密切关系。线粒体去耦联试剂FCCP可诱导线粒体的膜电位降低,进而逆转网织红细胞中Nix缺失对线粒体自噬的抑制作用[24]。此外,在HeLa细胞中,Nix对于线粒体去耦联试剂CCCP诱导的线粒体膜电位降低是必需的[25],而高表达Nix也可以引起线粒体膜电位降低[10]。近期研究还发现,Nix可调控Parkin向线粒体转移,激活Parkin-Ubiquitin-p62介导的线粒体自噬[25]。然而,Nix调控Parkin转位的具体机制还不明确,很有可能是通过调控线粒体膜电位的改变从而影响Parkin介导线粒体自噬 (图 1)。
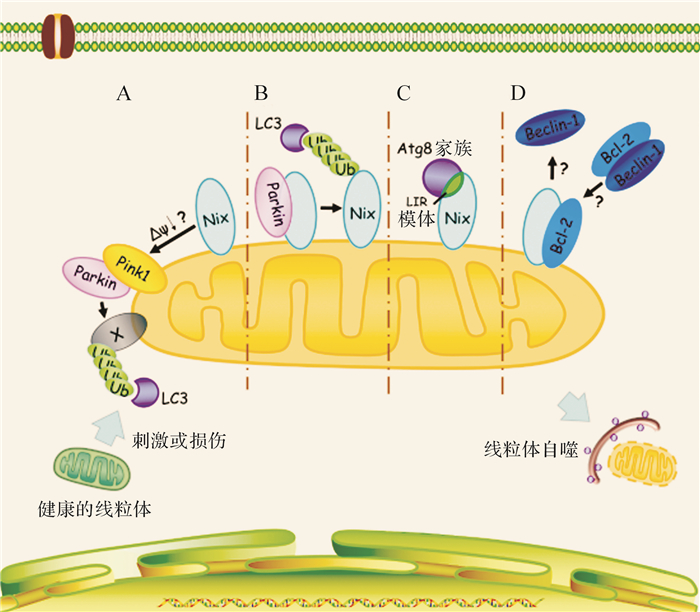
|
| A:Nix可能通过诱导膜电势降低激活PINK1/Parkin通路,介导线粒体自噬,其中,蛋白X表示Parkin的泛素化底物,如Mfn2、VDAC1等;B:Nix作为Parkin的泛素化底物,被Parkin泛素化后特异性被LC3识别,进而介导线粒体自噬;C:Nix直接通过其LIR模体与Atg8家族成员结合,介导线粒体自噬;D:Nix可能与Beclin-1竞争结合Bcl-2,释放Beclin-1,增强自噬流. 图 1 Nix介导线粒体自噬的四种可能模式 Fig. 1 Four possible working models of Nix-mediated mitophagy |
目前,Nix调控线粒体膜电位的机制尚不清楚。一般情况下,BH3-only蛋白需要依赖促凋亡蛋白以及线粒体通透转运孔道 (mitochondrial permeability transitionpore,MPTP) 来诱导线粒体去极化,如Nix的同源蛋白Bnip3引发线粒体膜电位降低依赖于促凋亡蛋白Bax和Bak诱导的MPTP开放[26]。此外,抗凋亡蛋白Bcl-XL也可抑制Nix诱导的线粒体膜电位降低[13]。但也存在一些矛盾的现象,如在哺乳动物网织红细胞中,Nix的缺失不会引起线粒体膜电位显著改变,且Nix介导的线粒体自噬并不依赖Bax和Bak[6]。因此,Nix与线粒体膜电位的关系及其对于Parkin介导的线粒体自噬的作用还有待进一步明确。
Nix不仅可以影响Parkin的功能,Parkin亦可调控Nix。有研究发现,Parkin可以泛素化Nix,进而促进其被自噬受体识别,最终导致线粒体自噬性清除[22](图 1)。这条通路可能与帕金森病的发病密切相关。已有的研究结果提示,Nix与Parkin可以相互影响,但它们之间是否存在功能上的相关性尚不完全清楚,这可能成为下一阶段该领域的研究重点。
3 Nix作为自噬受体招募Atg8蛋白家族启动线粒体自噬目前已知的大多数自噬受体都是通过与Atg8家族成员相互作用而发挥介导自噬的功能,而Atg8家族相互作用模体 (Atg8-family interacting motif,AIM,在哺乳动物中为LC3 interacting region,LIR) 是这些受体与Atg8家族成员结合的重要结构域[27]。Novak等[28]研究表明,Nix有两个LIR序列,一个位于Nix的近氨基端,另一个则临近BH3结构域;Nix通过LIR与Atg8蛋白家族成员 (包括LC3A、GABARAP、GABARAP-L1、GABARAP-L2) 发生相互作用,进而诱导线粒体自噬。这提示,Nix可以作为一个受体蛋白,招募自噬机制包被线粒体,进而清除线粒体 (图 1)。对Nix-/-网织红细胞线粒体自噬情况的研究也显示,Nix-/-网织红细胞中线粒体的清除停留在线粒体被自噬体吞噬前的阶段,Nix缺失并不影响自噬体的形成[11]。这些结果提示,Nix可能作为受体招募自噬机制清除线粒体。除了LIR之外,也有研究发现,Nix 74位的亮氨酸对其诱导线粒体自噬也发挥了关键作用,该位点参与了Nix与其他蛋白的相互作用[29]。
鉴于Nix在所有线粒体外膜均有表达,Atg8家族成员精确识别受损线粒体上Nix的具体机制也是近期的研究热点。对Nix同源蛋白Bnip3的研究发现,其17与24位的色氨酸残基的磷酸化可促进其与LC3B的相互作用[30]。另一线粒体外膜蛋白FUNDC1在18位酪氨酸残基的去磷酸化可促进其与LC3的相互作用[31]。而在酵母菌中,Atg32的磷酸化,尤其是114位丝氨酸残基的磷酸化,介导了Atg32与Atg11的相互作用并诱导线粒体自噬[32]。因此,目标线粒体上Nix的磷酸化调节可能是该线粒体被自噬清除的机制之一。而已知蛋白激酶PINK1能在去极化的线粒体的外膜上稳定存在[33]。因此,PINK1和Nix之间可能存在一定联系,但仍需要进一步研究证明。
4 Nix增加细胞质中游离的Beclin-1进而诱导自噬在这个模型中另一关键蛋白是Beclin-1。Beclin-1是Atg6的同源蛋白[34],是class Ⅲ PtdIns 3-kinase复合物的组分之一,参与诱导自噬发生与自噬泡的形成[35]。Bcl-2可以与Beclin-1结合,从而抑制自噬[36]。而Maiuri等[37]研究发现,BH3-only蛋白或其类似物可以与Beclin-1竞争结合Bcl-2或Bcl-XL,从而释放出游离的Beclin-1,进而诱导自噬发生 (图 1)。因此,作为BH3-only蛋白的Nix也可能通过这一机制诱导自噬。但也存在一些矛盾的现象,如Nix-/-网织红细胞中自噬泡的形成不受影响[6],提示在某些细胞中Nix可能不影响Beclin-1的功能。因此,在不同细胞中,Nix与Beclin-1的相互作用及其功能仍需要进一步研究。
5 结语作为细胞对线粒体实行质量控制的重要手段,线粒体自噬对细胞的生存尤为重要。Nix被证明是调控线粒体自噬的重要蛋白,参与许多重要的生理、病理过程中,但其机制尚未完全阐明。本文综述了Nix介导的线粒体自噬机制的研究进展,总结了三种可能的分子生物学机制,但其中仍有许多问题尚需解决,例如:① 在介导线粒体自噬的过程中,Nix与Parkin是否以及如何分工合作;② 作为自噬受体,Nix如何特异性标记受损伤的线粒体实现选择性线粒体自噬;③ Nix如何决定细胞走向凋亡或自噬,等等。Nix介导的线粒体自噬的进一步阐明,将为Nix作为一种药物新靶点而治疗相关疾病提供新的策略。
| [1] | LEVINE B, KLIONSKY D J. Development by self-digestion:molecular mechanisms and biological functions of autophagy[J]. Dev Cell, 2004, 6(4): 463–477. doi:10.1016/S1534-5807(04)00099-1 |
| [2] | KIM I, RODRIGUEZ-ENRIQUEZ S, LEMASTERS J J. Selective degradation of mitochondria by mitophagy[J]. Arch Biochem Biophys, 2007, 462(2): 245–253. doi:10.1016/j.abb.2007.03.034 |
| [3] | YOULE R J, NARENDRA D P. Mechanisms of mitophagy[J]. Nat Rev Mol Cell Biol, 2011, 12(1): 9–14. |
| [4] | CHEN Y, DORN G W. PINK1-phosphorylated mitofusin 2 is a Parkin receptor for culling damaged mitochondria[J]. Science, 2013, 340(6131): 471–475. doi:10.1126/science.1231031 |
| [5] | GEISLER S, HOLMSTRÖM K M, SKUJAT D, et al. PINK1/Parkin-mediated mitophagy is dependent on VDAC1 and p62/SQSTM1[J]. Nat Cell Biol, 2010, 12(2): 119–131. doi:10.1038/ncb2012 |
| [6] | MCLELLAND G L, SOUBANNIER V, CHEN C X, et al. Parkin and PINK1 function in a vesicular trafficking pathway regulating mitochondrial quality control[J]. EMBO J, 2014, 33(4): 282–295. |
| [7] | DENISON M S, NAGY S R. Activation of the aryl hydrocarbon receptor by structurally diverse exogenous and endogenous chemicals[J]. Annu Rev Pharmacol Toxicol, 2003, 43: 309–334. doi:10.1146/annurev.pharmtox.43.100901.135828 |
| [8] | PAWLYK A C, GIASSON B I, SAMPATHU D M, et al. Novel monoclonal antibodies demonstrate biochemical variation of brain parkin with age[J]. J Biol Chem, 2003, 278(48): 48120–48128. doi:10.1074/jbc.M306889200 |
| [9] | SCHWEERS R L, ZHANG J, RANDALL M S, et al. NIX is required for programmed mitochondrial clearance during reticulocyte maturation[J]. Proc Natl Acad Sci U S A, 2007, 104(49): 19500–19505. doi:10.1073/pnas.0708818104 |
| [10] | CUCONATI A, WHITE E. Viral homologs of BCL-2:role of apoptosis in the regulation of virus infection[J]. Genes Dev, 2002, 16(19): 2465–2478. doi:10.1101/gad.1012702 |
| [11] | OHI N, TOKUNAGA A, TSUNODA H, et al. A novel adenovirus E1B19K-binding protein B5 inhibits apoptosis induced by Nip3 by forming a heterodimer through the C-terminal hydrophobic region[J]. Cell Death Differ, 1999, 6(4): 314–325. doi:10.1038/sj.cdd.4400493 |
| [12] | MATSUSHIMA M, FUJIWARA T, TAKAHASHI E, et al. Isolation, mapping, and functional analysis of a novel human cDNA (BNIP3L) encoding a protein homologous to human NIP3[J]. Genes Chromosomes Cancer, 1998, 21(3): 230–235. doi:10.1002/(ISSN)1098-2264 |
| [13] | IMAZU T, SHIMIZU S, TAGAMI S, et al. Bcl-2/E1B 19 kDa-interacting protein 3-like protein (Bnip3L) interacts with bcl-2/Bcl-xL and induces apoptosis by altering mitochondrial membrane permeability[J]. Oncogene, 1999, 18(32): 4523–4529. doi:10.1038/sj.onc.1202722 |
| [14] | KIM H, RAFIUDDIN-SHAH M, TU H C, et al. Hierarchical regulation of mitochondrion-dependent apoptosis by BCL-2 subfamilies[J]. Nat Cell Biol, 2006, 8(12): 1348–1358. doi:10.1038/ncb1499 |
| [15] | KELEKAR A, THOMPSON C B. Bcl-2-family proteins:the role of the BH3 domain in apoptosis[J]. Trends Cell Biol, 1998, 8(8): 324–330. doi:10.1016/S0962-8924(98)01321-X |
| [16] | LAI J, FLANAGAN J, PHILLIPS W A, et al. Analysis of the candidate 8p21 tumour suppressor, BNIP3L, in breast and ovarian cancer[J]. Br J Cancer, 2003, 88(2): 270–276. doi:10.1038/sj.bjc.6600674 |
| [17] | UNOKI M, NAKAMURA Y. EGR2 induces apoptosis in various cancer cell lines by direct transactivation of BNIP3L and BAK[J]. Oncogene, 2003, 22(14): 2172–2185. doi:10.1038/sj.onc.1206222 |
| [18] | REAL P J, BENITO A, CUEVAS J, et al. Blockade of epidermal growth factor receptors chemosensitizes breast cancer cells through up-regulation of Bnip3L[J]. Cancer Res, 2005, 65(18): 8151–8157. doi:10.1158/0008-5472.CAN-05-1134 |
| [19] | FEI P, WANG W, KIM S H, et al. Bnip3L is induced by p53 under hypoxia, and its knockdown promotes tumor growth[J]. Cancer Cell, 2004, 6(6): 597–609. doi:10.1016/j.ccr.2004.10.012 |
| [20] | WILFINGER N, AUSTIN S, SCHEIBER-MOJDEHKAR B, et al. Novel p53-dependent anticancer strategy by targeting iron signaling and BNIP3L-induced mitophagy[J]. Oncotarget, 2016, 7(2): 1242–1261. |
| [21] | O'SULLIVAN T E, JOHNSON L R, KANG H H, et al. BNIP3-and BNIP3L-mediated mitophagy promotes the generation of natural killer cell memory[J]. Immunity, 2015, 43(2): 331–342. doi:10.1016/j.immuni.2015.07.012 |
| [22] | GAO F, CHEN D, SI J, et al. The mitochondrial protein BNIP3L is the substrate of PARK2 and mediates mitophagy in PINK1/PARK2 pathway[J]. Hum Mol Genet, 2015, 24(9): 2528–2538. doi:10.1093/hmg/ddv017 |
| [23] | MATSUDA N, SATO S, SHIBA K, et al. PINK1 stabilized by mitochondrial depolarization recruits Parkin to damaged mitochondria and activates latent Parkin for mitophagy[J]. J Cell Biol, 2010, 189(2): 211–221. doi:10.1083/jcb.200910140 |
| [24] | SANDOVAL H, THIAGARAJAN P, DASGUPTA S K, et al. Essential role for Nix in autophagic maturation of erythroid cells[J]. Nature, 2008, 454(7201): 232–235. doi:10.1038/nature07006 |
| [25] | DING W X, NI H M, LI M, et al. Nix is critical to two distinct phases of mitophagy, reactive oxygen species-mediated autophagy induction and Parkin-ubiquitin-p62-mediated mitochondrial priming[J]. J Biol Chem, 2010, 285(36): 27879–27890. doi:10.1074/jbc.M110.119537 |
| [26] | KUBLI D A, YCAZA J E, GUSTAFSSON A B. Bnip3 mediates mitochondrial dysfunction and cell death through Bax and Bak[J]. Biochem J, 2007, 405(3): 407–415. doi:10.1042/BJ20070319 |
| [27] | KIRKIN V, MCEWAN D G, NOVAK I, et al. A role for ubiquitin in selective autophagy[J]. Mol Cell, 2009, 34(3): 259–269. doi:10.1016/j.molcel.2009.04.026 |
| [28] | NOVAK I, KIRKIN V, MCEWAN D G, et al. Nix is a selective autophagy receptor for mitochondrial clearance[J]. EMBO Rep, 2010, 11(1): 45–51. doi:10.1038/embor.2009.256 |
| [29] | ZHANG J, LOYD M R, RANDALL M S, et al. A short linear motif in BNIP3L (NIX) mediates mitochondrial clearance in reticulocytes[J]. Autophagy, 2012, 8(9): 1325–1332. doi:10.4161/auto.20764 |
| [30] | ZHU Y, MASSEN S, TERENZIO M, et al. Modulation of serines 17 and 24 in the LC3-interacting region of Bnip3 determines pro-survival mitophagy versus apoptosis[J]. J Biol Chem, 2013, 288(2): 1099–1113. doi:10.1074/jbc.M112.399345 |
| [31] | LIU L, FENG D, CHEN G, et al. Mitochondrial outer-membrane protein FUNDC1 mediates hypoxia-induced mitophagy in mammalian cells[J]. Nat Cell Biol, 2012, 14(2): 177–185. doi:10.1038/ncb2422 |
| [32] | AOKI Y, KANKI T, HIROTA Y, et al. Phosphorylation of Serine 114 on Atg32 mediates mitophagy[J]. Mol Biol Cell, 2011, 22(17): 3206–3217. doi:10.1091/mbc.E11-02-0145 |
| [33] | NARENDRA D P, JIN S M, TANAKA A, et al. PINK1 is selectively stabilized on impaired mitochondria to activate Parkin[J]. PLoS Biol, 2010, 8(1): e1000298. doi:10.1371/journal.pbio.1000298 |
| [34] | CAO Y, KLIONSKY D J. Physiological functions of Atg6/Beclin 1:a unique autophagy-related protein[J]. Cell Res, 2007, 17(10): 839–849. doi:10.1038/cr.2007.78 |
| [35] | YORIMITSU T, KLIONSKY D J. Autophagy:molecular machinery for self-eating[J]. Cell Death Differ, 2005, 12(Suppl 2): 1542–1552. |
| [36] | PATTINGRE S, TASSA A, QU X, et al. Bcl-2 antiapoptotic proteins inhibit Beclin 1-dependent autophagy[J]. Cell, 2005, 122(6): 927–939. doi:10.1016/j.cell.2005.07.002 |
| [37] | MAIURI M C, LE T G, CRIOLLO A, et al. Functional and physical interaction between Bcl-X (L) and a BH3-like domain in Beclin-1[J]. EMBO J, 2007, 26(10): 2527–2539. doi:10.1038/sj.emboj.7601689 |




