2. 宁波市中医院放射科, 浙江 宁波 315010
2. Department of Radiology, Traditional Chinese Medicine Hospital of Ningbo, Ningbo 315010, China
在全世界范围内,原发性肝癌是肿瘤患者的常见死亡原因,患者5年存活率仅为10%~15%[1-2]。诸如肝移植、外科切除术、射频消融术这些治疗手段仅适用于一小部分患者[2],还有一部分患者可用经导管动脉化疗栓塞 (transcatheter arterial chemoembolization, TACE)[3-4]。然而,TACE患者的存活率仍不尽如人意,而且与TACE相关的并发症不少[5]。载药微球经动脉化疗栓塞 (transarterial chemoembolization with drug-eluting beads,DEB-TACE) 作为一种新型载药栓塞系统,可以向瘤体内输入高剂量的化疗药物,延长药物释放时间,并且可以减少因化疗药物进入全身血液循环系统而导致的不良反应[6-8]。Ⅱ期临床研究结果显示,DEB-TACE相比传统经动脉化疗栓塞 (conventional transarterial chemoembolization,cTACE) 毒性较低,能减少严重不良事件发生[7-8]。但DEB-TACE相对于cTACE患者的存活率优势尚不明确,一些随机对照试验和回顾性研究结果显示均不一致[8]。CalliSpheres® DEB-TACE系国产的新型载药栓塞系统,本文就CalliSpheres® DEB-TACE临床治疗不可切除原发性肝癌患者与cTACE进行对比,以分析其近期疗效和安全性。
1 对象与方法 1.1 对象回顾性分析2015年11月至2016年4月浙江大学医学院附属第一医院收治的42例经临床、影像或病理学明确诊断的不可切除肝癌患者资料,患者符合以下条件:① 具有外科手术不能切除的原发病灶;② 肝功能分级属Child-Pugh A、B级,病情评分 (performance status test)0~1分;③ 患者门静脉主干未完全阻塞,或虽门静脉主干完全阻塞,但肝门部有较多侧支循环形成;④ 肿瘤肝脏取代率小于50%。不包括以下情况的患者:① 肝功能分级属Child-Pugh C级;② 患者凝血功能严重减退,且无法纠正;③ 血清胆红素超过51 μmol/L,ALT或AST超过正常值的5倍;④ 患者存在门体静脉分流;⑤ 患者心脏左室射血分数小于50%。其中有9例患者 (cTACE组4例,DEB-TACE组5例) 由于入组时间较晚,未纳入肿瘤反应及肿瘤复发情况统计。
本研究获得浙江大学医学院附属第一医院伦理委员会的批准,所有患者均签署知情同意书。
1.2 TACE治疗方法常规准备后,采用Seldinger技术行股动脉穿刺[9-10]。首先,进行腹腔动脉及肠系膜上动脉造影以评估肝动脉解剖、肿瘤供血血管及门静脉通畅情况。根据肿瘤的大小和分布,将化疗药物超选择注入肿瘤的供血动脉、选择性注入一个肝叶或整个肝脏。cTACE组用表阿霉素与碘油混悬液进行肿瘤栓塞化疗,而DEB-TACE组用CalliSpheres®载药微球搭载表阿霉素治疗,药物剂量根据患者体表面积和肿瘤大小换算。在cTACE和DEB-TACE介入治疗后均进行微球栓塞,以确保肿瘤供血动脉栓塞比较彻底。
采用cTACE或DEB-TACE由临床医师和放射科医师根据患者的肿瘤负荷、肝功能Child-Pugh分级、巴塞罗那肝癌分期、门脉癌栓和转移情况以及患者的经济状况等,在患者知情同意的情况下选择。
1.3 术后处理介入治疗后进行护肝、镇痛等对症治疗和支持治疗3~5 d;酌情使用抗生素, 静脉应用制酸药3 d。
1.4 MRI检查及疗效标准MRI采用3.0 Tesla GE HDx磁共振扫描仪。MRI结果由两名有经验的放射科医师在患者临床数据和TACE类型未知的情况下进行评估。根据国际通用的改良实体瘤评价标准 (modified response evaluation criteria in solid tumors, mRECIST) 评价,分为完全缓解 (CR)、部分缓解 (PR)、疾病稳定 (SD) 和疾病进展 (PD),根据CR+PR计算疾病缓解率,根据CR+PR+SD计算疾病控制率,两者用以表征肿瘤反应。
1.5 随访时间及观察指标随访6个月,患者每次治疗前与治疗后3 d、1个月检测肝功能指标,包括白蛋白、ALT、AST、总胆红素、胆碱酯酶和凝血酶原时间;统计患者术后住院时间;根据 (美) 国家癌症研究所 (National Cancer Institute) 制定的常见不良反应事件评价标准 (common terminology criteria for adverse events, CTCAE)4.0版本评价患者术后不良反应及并发症 (包括发热、腹痛、恶心、呕吐、乏力、胆道损伤等)。TACE治疗前1周内行MRI检查,测量肿瘤基线数据,治疗后1个月、3个月、6个月再行MRI检查,评估肿瘤反应和局部复发、新发病灶或肝外转移。
1.6 统计学方法采用SPSS 22.0统计分析软件。计量资料采用均数±标准差 (x±s) 表示,cTACE组与DEB-TACE组的临床特征、不良反应和并发症发生率,疾病缓解率、疾病控制率及介入治疗后复发率的比较采用χ2检验或Fisher精确概率法,治疗后检验指标及住院时间的比较采用Wilcoxon符号秩和检验,P<0.05为差异有统计学意义。
2 结果 2.1 两组患者临床特征比较42例进行TACE介入治疗患者的临床特征见表 1。行DEB-TACE治疗22例 (52.4%),行cTACE治疗20例 (47.6%),两组患者在性别构成、肿瘤负荷、肝癌Okuda分期、肝功能Child-Pugh分级、巴塞罗那肝癌分期及门脉癌栓或转移方面差异无统计学意义 (均P>0.05)。患者治疗前后均未服用索拉菲尼。
| [n(%)] | |||
| 相关指标 | cTACE组 | DEB-TACE组 | 合计 |
| 性别 男性 | 17(85.0) | 19(86.4) | 36(85.7) |
| 女性 | 3(15.0) | 3(13.6) | 6(14.3) |
| 肿瘤负荷 | |||
| 单叶 | 8(40.0) | 12(54.5) | 20(47.6) |
| 双叶 | 12(60.0) | 10(45.5) | 22(52.4) |
| 多发结节 (≥4个病灶) | 9(45.0) | 13(59.1) | 22(52.4) |
| Okuda分期 Ⅰ | 10(50.0) | 12(54.5) | 22(52.4) |
| Ⅱ | 10(50.0) | 10(45.5) | 20(47.6) |
| Child-Pugh分级 A | 17(85.0) | 15(68.2) | 32(76.2) |
| B | 3(15.0) | 7(31.8) | 10(23.8) |
| 巴塞罗那肝癌分期 A | 2(10.0) | 5(22.7) | 7(16.7) |
| B | 12(60.0) | 9(40.9) | 21(50.0) |
| C | 6(30.0) | 8(36.4) | 14(33.3) |
| 门脉癌栓或转移 有 | 5(25.0) | 7(31.8) | 12(28.6) |
| 无 | 15(75.0) | 15(68.2) | 30(71.4) |
| cTACE:常规经动脉化疗栓塞;DEB-TACE:载药微球经动脉化疗栓塞. | |||
根据mRECIST标准, 从表 2可见,DEB-TACE组与cTACE组治疗后1个月疾病缓解率分别为70.6%与56.3%(P=0.481),疾病控制率分别为94.1%与81.2%(P=0.335);3个月疾病缓解率分别为58.8%与43.8%(P=0.494),疾病控制率分别为76.5%与75.0%(P=1.000);6个月疾病缓解率分别为23.5%与25.0%(P=1.000),疾病控制率分别为58.8%与62.5%(P=1.000),差异均无统计学意义 (均P>0.05)。治疗后3个月及6个月的肿瘤复发率两组差异亦无统计学意义 (均P>0.05),见表 3。
| [n(%)] | ||||||||
| 组别 | 随访时间 | n | CR | PR | SD | PD | CR+PR | CR+PR+SD |
| cTACE组 | 1个月 | 16 | 2(12.5) | 7(43.8) | 4(25.0) | 3(18.8) | 9(56.3) | 13(81.2) |
| 3个月 | 16 | 0(0.0) | 7(43.8) | 5(31.3) | 4(25.0) | 7(43.8) | 12(75.0) | |
| 6个月 | 16 | 0(0.0) | 4(25.0) | 6(37.5) | 6(37.5) | 4(25.0) | 10(62.5) | |
| DEB-TACE组 | 1个月 | 17 | 3(17.6) | 9(52.9) | 4(23.5) | 1(5.9) | 12(70.6) | 16(94.1) |
| 3个月 | 17 | 3(17.6) | 7(41.2) | 3(17.6) | 4(23.5) | 10(58.8) | 13(76.5) | |
| 6个月 | 17 | 2(11.8) | 2(11.8) | 6(35.3) | 7(41.2) | 4(23.5) | 10(58.8) | |
| cTACE:常规经动脉化疗栓塞;DEB-TACE:载药微球经动脉化疗栓塞;CR:完全缓解;PR:部分缓解;SD:疾病稳定;PD:疾病进展. | ||||||||
| [n(%)] | ||||
| 组别 | 随访时间 | n | 局部复发 | 新发病灶或肝外转移 |
| cTACE组 | 3个月 | 16 | 2(12.5) | 2(12.5) |
| 6个月 | 16 | 4(25.0) | 5(31.2) | |
| DEB-TACE组 | 3个月 | 17 | 0(0.0) | 4(23.5) |
| 6个月 | 17 | 2(11.8) | 7(41.2) | |
| cTACE:常规经动脉化疗栓塞;DEB-TACE:载药微球经动脉化疗栓塞. | ||||
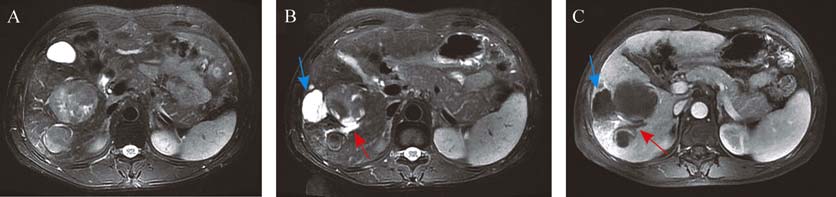
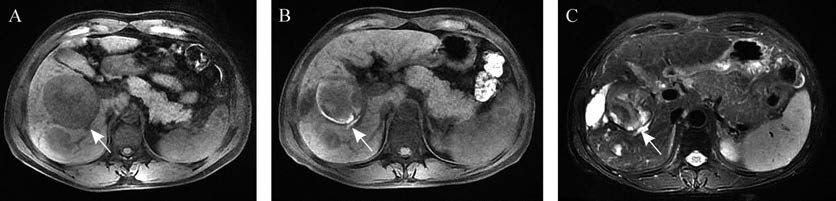
两组患者治疗后不良反应如发热、恶心、呕吐、乏力和局部胆道损伤发生及术后住院天数[cTACE组 (4.8±2.0) d,DEB-TACE组 (7.4±7.0) d, P=0.273]差异无统计学意义 (表 4)。DEB-TACE组与cTACE组治疗后使用止痛药物患者分别占22.7%和15.0%,差异无统计学意义,但DEB-TACE组有一例患者腹痛较重,视觉模拟评分大于7分,经使用氢吗啡酮后止痛。DEB-TACE组和cTACE组患者治疗前转氨酶、总胆红素及凝血酶原时间在正常范围内或轻度升高,胆碱酯酶在正常范围内或有所降低,甲胎蛋白在正常范围内或升高。DEB-TACE组和cTACE组患者治疗后3 d均表现出转氨酶、总胆红素及凝血酶原时间升高和胆碱酯酶及甲胎蛋白下降的趋势,但两组差异均无统计学意义 (表 4)。DEB-TACE组有两例患者治疗后3个月左右开始出现局部胆道损伤,包括胆道铸型、胆管扩张及胆汁瘤形成。胆道铸型在MRI图像上表现为扩张胆管的近端条状异常信号,T1WI呈高信号,T2WI呈低信号 (图 1)。胆汁瘤在MRI图像上表现为囊性肿瘤样结构,T1WI呈低信号,T2WI呈高信号,增强扫描无强化 (图 2)。
| [n(%) 或 (x±s)] | |||||||||
| 组别 | n | 不良反应及并发症 | |||||||
| 体温大于38° | 腹痛 | 使用止痛药 | 使用吗啡 | 恶心 | 呕吐 | 乏力 | 局部胆道损伤 | ||
| cTACE组 | 20 | 9(45.0) | 11(55.0) | 3(15.0) | 0(0.0) | 5(25.0) | 4(20.0) | 7(35.0) | 0(0.0) |
| DEB-TACE组 | 22 | 8(36.4) | 8(36.4) | 5(22.7) | 1(4.5) | 3(13.6) | 3(13.6) | 3(13.6) | 2(9.1) |
| P值 | 0.569 | 0.226 | 0.808 | 1.000 | 0.587 | 0.890 | 0.207 | 0.489 | |
| 组别 | n | 肝功能指标 | |||||||
| 白蛋白 (g/L) | ALT (U/L) | AST (U/L) | 总胆红素 (μmol/L) | 胆碱酯酶 (U/L) | 凝血酶原 时间 (s) | 甲胎蛋白 (ng/mL) | |||
| cTACE组 | 20 | 37.2±3.7 | 130.0±51.1 | 167.0±118.7 | 22.0±3.5 | 5171.2±1181.1 | 12.0±0.7 | 96.6(42.2~7277.6) | |
| DEB-TACE组 | 22 | 36.6±7.4 | 91.1±76.5 | 104.5±89.3 | 24.5±13.9 | 4914.1±2031.5 | 13.0±2.0 | 66.1(15.1~4894.9) | |
| P值 | 0.749 | 0.102 | 0.248 | 0.545 | 0.823 | 0.339 | 0.507 | ||
| cTACE:常规经动脉化疗栓塞;DEB-TACE:载药微球经动脉化疗栓塞. | |||||||||
|
| 患者男性,54岁,乙型病毒性肝炎.患者治疗前T1WI (A) 显示胆管右后支未见异常 (箭头所示),首次DEB-TACE治疗后3个月T1WI (B) 呈高信号 (箭头所示),T2WI (C) 呈低信号 (箭头所示). 图 1 一例患者胆道铸型的MRI表现 Fig. 1 MR image of biliary cast |
目前手术切除仍是治疗原发性肝癌的首选方法,对于不能手术切除的中间阶段的肝癌患者推荐TACE治疗[11]。常规TACE常用碘油加阿霉素、顺铂或其他化疗药物混合给药,这种传统乳剂可导致化疗药物进入全身循环系统,增加全身的不良反应发生率并且降低局部治疗效果。几年前,在尝试提高TACE治疗效果和减少其不良反应时,引进DEB-TACE作为一种新的局部治疗方法。几个临床前及临床研究结果显示,载药微球可以加载化疗药物在肿瘤组织内达到较高的浓度以及延长化疗药物与肿瘤细胞的作用时间,并且可以减少化疗药物进入全身循环系统,降低血药浓度[12-14],具有较好的治疗安全性及较高的肿瘤反应率[15-16]。但是相关前瞻性随机对照临床试验结果并未提示这种差异[17-18]。另有研究结果显示, cTACE治疗后的肿瘤反应率更高[19]。而DEB-TACE治疗后药物不良反应较cTACE少,如肝毒性事件、心脏毒性事件和脱发等。
本研究结果显示,治疗后3个月及6个月随访MRI,观察到DEB-TACE组的肿瘤复发与cTACE组相似,这与Baur等[20]的研究结果一致。其中肿瘤的复发类型方面,DEB-TACE组新发病灶百分率稍大于cTACE组,但差异无统计学意义。根据Scartozzi等[21]研究,DEB-TACE治疗后瘤灶内化疗药物浓度较高、释放时间较长,抑制了瘤体本身的复发,因此短时期内显示局部较好的肿瘤反应,但是残余未坏死肿瘤组织可能因缺氧导致释放TNF增加,从而可能增加肿瘤局部和远处的复发风险, 引起患者总体存活率下降。这可以解释DEB-TACE治疗后部分患者MRI提示瘤体局部坏死十分理想,但是远处已经出现多处新发病灶的现象。
既往研究显示,DEB-TACE的不良反应发生率低于cTACE[17, 22],但本研究中DEB-TACE组不良反应发生情况与cTACE组类似。意大利的一项包括177例患者的研究结果显示,DEB-TACE与cTACE治疗比较,患者在发热、恶心、转氨酶升高及肝功能恶化方面相似,在治疗后腹痛改善方面DEB-TACE明显[23]。我们的研究中DEB-TACE组与cTACE组治疗后因腹痛使用止痛药物的患者分别占22.7%与15%,差异无统计学意义;其中DEB-TACE组有一例患者腹痛较重,视觉模拟评分大于7分,需使用氢吗啡酮止痛。Baur等[20]的研究也显示,使用止痛药DEB-TACE治疗患者比cTACE治疗患者多,两者差异有统计学意义。
本研究中未观察到严重的并发症如胆汁漏并发感染、肝脓肿、腹腔出血、肿瘤破裂出血、消化道出血、肝肾功能衰竭、骨髓抑制及心脏毒性表现等。DEB-TACE组两例患者局部胆道损伤MRI表现为胆管扩张、胆汁瘤及少见的胆道铸型。胆汁瘤是由于胆管壁的缺血坏死,胆汁从肝胆管腔内渗出到肝实质内、肝包膜下或腹腔小网膜囊内形成包裹性胆汁淤积。“胆道铸型”最早由美国Waldram在1975年提出[24],胆道铸型由坏死的胆管壁、胆红素及胆盐组成,与缺血性胆管病有关,特别容易发生在肝移植或危重病患者接受儿茶酚胺治疗后[25-29]。胆道铸型填充于胆管使胆管阻塞,从而导致远端胆管扩张以及梗阻性胆管炎。本研究DEB-TACE组两例患者胆道铸型的形成可能由于载药微球加载化疗药物在肝脏局部区域浓度较高、药物释放时间较长以及较好的栓塞效果,从而导致胆管壁直接损伤和缺血性损伤。缺血性胆道损伤最直接的病理变化就是胆管壁的坏死、小动脉坏死、血管壁损害 (如血管内膜下水肿)、胆管内壁出血等,进而导致胆道微血管病变,最终促进胆道铸型形成。Monier等[30]研究评估了151例原发性肝癌患者DEB-TACE与cTACE治疗后肝脏和胆道损伤之间的差异,其结果显示,DEB-TACE相对于cTACE更容易导致肝脏局部区域的并发症发生,因此建议肝硬化早期阶段患者采用cTACE更为合适。
本研究属于回顾性研究,患者例数较少,研究结果不可避免存在抽样偏差;根据欧洲肝脏研究学会 (EASL) 与欧洲癌症治疗研究组织 (EORTC) 联合发布的肝癌诊疗指南,不推荐TACE作为巴塞罗那临床肝癌A期和C期患者的一线治疗,本研究有部分这些患者可能会影响结果的判断。另外,由于随访时间短,本研究没有对患者TACE术后存活率进行评估,而Facciorusso等[31]对包含1449例患者的四个随机对照研究和八个回顾性研究进行的荟萃分析结果显示,DEB-TACE治疗患者与cTACE治疗患者1年、2年、3年存活率均相似。因此,DEB-TACE治疗与cTACE治疗对不可切除原发性肝癌效果的优劣还需要进一步扩大样本量、延长患者随访时间后进行统计分析,以期得出更为客观和准确的评价结果。
| [1] | PARKIN D M, BRAY F, FERLAY J, et al. Global cancer statistics, 2002[J]. CA Cancer J Clin, 2005, 55(2): 74–108. doi:10.3322/canjclin.55.2.74 |
| [2] | CUCCHETTI A, TREVISANI F, CESCON M, et al. Cost-effectiveness of semi-annual surveillance for hepatocellular carcinoma in cirrhotic patients of the Italian Liver Cancer population[J]. J Hepatol, 2012, 56(5): 1089–1096. doi:10.1016/j.jhep.2011.11.022 |
| [3] | BRUIX J, SHERMAN M. Management of hepatocellular carcinoma[J]. Hepatology, 2005, 42(5): 1208–1236. doi:10.1002/hep.v42:5 |
| [4] | European Association for the Study of the Liver, European Organisation for Research and Treatment of Cancer. EASL-EORTC clinical practice guidelines:management of hepatocellular carcinoma[J]. J Hepatol, 2012, 56(4): 908–943. doi:10.1016/j.jhep.2011.12.001 |
| [5] | MARELLI L, STIGLIANO R, TRIANTOS C, et al. Transarterial therapy for hepatocellular carcinoma:which technique is more effective? a systematic review of cohort and randomized studies[J]. Cardiovasc Intervent Radiol, 2007, 30(1): 6–25. doi:10.1007/s00270-006-0062-3 |
| [6] | VARELA M, REAL M I, BURREL M, et al. Chemoembolization of hepatocellular carcinoma with drug eluting beads:efficacy and doxorubicin pharmacokinetics[J]. J Hepatol, 2007, 46(3): 474–481. doi:10.1016/j.jhep.2006.10.020 |
| [7] | POON R T, TSO W K, PANG R W, et al. A phase Ⅰ/Ⅱ trial of chemoembolization for hepatocellular carcinoma using a novel intra-arterial drug-eluting bead[J]. Clin Gastroenterol Hepatol, 2007, 5(9): 1100–1108. doi:10.1016/j.cgh.2007.04.021 |
| [8] | LENCIONI R, PETRUZZI P, CROCETTI L. Chemoembolization of hepatocellular carcinoma[J]. Semin Intervent Radiol, 2013, 30(1): 3–11. doi:10.1055/s-00000068 |
| [9] | DHANASEKARAN R, KOOBY D A, STALEY C A, et al. Comparison of conventional transarterial chemoembolization (TACE) and chemoembolization with doxorubicin drug eluting beads (DEB) for unresectable hepatocelluar carcinoma (HCC)[J]. J Surg Oncol, 2010, 101(6): 476–480. |
| [10] | VOGL T J, LAMMER J, LENCIONI R, et al. Liver, gastrointestinal, and cardiac toxicity in intermediate hepatocellular carcinoma treated with PRECISION TACE with drug-eluting beads:results from the PRECISION V randomized trial[J]. AJR Am J Roentgenol, 2011, 197(4): W562–W570. doi:10.2214/AJR.10.4379 |
| [11] | FORNER A, REIG M E, DE LOPE C R, et al. Current strategy for staging and treatment:the BCLC update and future prospects[J]. Semin Liver Dis, 2010, 30(1): 61–74. doi:10.1055/s-0030-1247133 |
| [12] | LEWIS A L, TAYLOR R R, HALL B, et al. Pharmacokinetic and safety study of doxorubicin-eluting beads in a porcine model of hepatic arterial embolization[J]. J Vasc Interv Radiol, 2006, 17(8): 1335–1343. doi:10.1097/01.RVI.0000228416.21560.7F |
| [13] | HONG K, KHWAJA A, LIAPI E, et al. New intra-arterial drug delivery system for the treatment of liver cancer:preclinical assessment in a rabbit model of liver cancer[J]. Clin Cancer Res, 2006, 12(8): 2563–2567. doi:10.1158/1078-0432.CCR-05-2225 |
| [14] | Varela M, Real M I, Burrel M, et al. Chemoembolization of hepatocellular carcinoma with drug eluting beads:efficacy and doxorubicin pharmacokinetics[J]. J Hepatol, 2007, 46(3): 474–481. doi:10.1016/j.jhep.2006.10.020 |
| [15] | MALAGARI K, ALEXOPOULOU E, CHATZIMICHAIL K, et al. Transcatheter chemoembolization in the treatment of HCC in patients not eligible for curative treatments:midterm results of doxorubicin-loaded DC bead[J]. Abdom Imaging, 2008, 33(5): 512–519. doi:10.1007/s00261-007-9334-x |
| [16] | SONG M J, PARK C H, KIM J D, et al. Drug-eluting bead loaded with doxorubicin versus conventional Lipiodol-based transarterial chemoembolization in the treatment of hepatocellular carcinoma:a case-control study of Asian patients[J]. Eur J Gastroenterol Hepatol, 2011, 23(6): 521–527. doi:10.1097/MEG.0b013e328346d505 |
| [17] | LAMMER J, MALAGARI K, VOGL T, et al. Prospective randomized study of doxorubicin-eluting-bead embolization in the treatment of hepatocellular carcinoma:results of the PRECISION V study[J]. Cardiovasc Intervent Radiol, 2010, 33(1): 41–52. doi:10.1007/s00270-009-9711-7 |
| [18] | GOLFIERI R, GIAMPALMA E, RENZULLI M, et al. Randomised controlled trial of doxorubicin-eluting beads vs conventional chemoembolisation for hepatocellular carcinoma[J]. Br J Cancer, 2014, 111(2): 255–264. doi:10.1038/bjc.2014.199 |
| [19] | FACCIORUSSO A, MARIANI L, SPOSITO C, et al. Drug-eluting beads versus conventional chemoembolization for the treatment of unresectable hepatocellular carcinoma[J]. J Gastroenterol Hepatol, 2016, 31(3): 645–653. doi:10.1111/jgh.2016.31.issue-3 |
| [20] | BAUR J, RITTER C O, GERMER C T, et al. Transarterial chemoembolization with drug-eluting beads versus conventional transarterial chemoembolization in locally advanced hepatocellular carcinoma[J]. Hepat Med, 2016, 8: 69–74. |
| [21] | SCARTOZZI M, BARONI G S, FALOPPI L, et al. Trans-arterial chemo-embolization (TACE), with either lipiodol (traditional TACE) or drug-eluting microspheres (precision TACE, pTACE) in the treatment of hepatocellular carcinoma:efficacy and safety results from a large mono-institutional analysis[J]. J Exp Clin Cancer Res, 2010, 29: 164. doi:10.1186/1756-9966-29-164 |
| [22] | VOGL T J, LAMMER J, LENCIONI R, et al. Liver, gastrointestinal, and cardiac toxicity in intermediate hepatocellular carcinoma treated with PRECISION TACE with drug-eluting beads:results from the PRECISION V randomized trial[J]. AJR Am J Roentgenol, 2011, 197(4): W562–W570. doi:10.2214/AJR.10.4379 |
| [23] | GOLFIERI R, GIAMPALMA E, RENZULLI M, et al. Randomised controlled trial of doxorubicin-eluting beads vs conventional chemoembolisation for hepatocellular carcinoma[J]. Br J Cancer, 2014, 111(2): 255–264. doi:10.1038/bjc.2014.199 |
| [24] | WALDRAM R, WILLIAMS R, CALNE R Y. Bile composition and bile cast formation after transplantation of the liver in man[J]. Transplantation, 1975, 19(5): 382–387. doi:10.1097/00007890-197505000-00004 |
| [25] | BRANDSAETER B, SCHRUMPF E, CLAUSEN O P, et al. Recurrent sclerosing cholangitis or ischemic bile duct lesions-a diagnostic challenge?[J]. Liver Transpl, 2004, 10(8): 1073–1074. doi:10.1002/lt.20192 |
| [26] | PFAU P R, KOCHMAN M L, LEWIS J D, et al. Endoscopic management of postoperative biliary complications in orthotopic liver transplantation[J]. Gastrointest Endosc, 2000, 52(1): 55–63. doi:10.1067/mge.2000.106687 |
| [27] | CLERMONTS S H, VAN DAM R M. Obstructive putty-like cast of the biliary tree[J]. Hepatobiliary Surg Nutr, 2014, 3(1): 47–49. |
| [28] | BENNINGER J, GROBHOLZ R, OEZTUERK Y, et al. Sclerosing cholangitis following severe trauma:description of a remarkable disease entity with emphasis on possible pathophysiologic mechanisms[J]. World J Gastroenterol, 2005, 11(27): 4199–4205. doi:10.3748/wjg.v11.i27.4199 |
| [29] | GELBMANN C M, RUMMELE P, WIMMER M, et al. Ischemic-like cholangiopathy with secondary sclerosing cholangitis in critically ill patients[J]. Am J Gastroenterol, 2007, 102(6): 1221–1229. doi:10.1111/ajg.2007.102.issue-6 |
| [30] | MONIER A, GUIU B, DURAN R, et al. Liver and biliary damages following transarterial chemoembolization of hepatocellular carcinoma:comparison between drug-eluting beads and lipiodol emulsion[J]. Eur Radiol, 2017, 27(4): 1431–1439. doi:10.1007/s00330-016-4488-y |
| [31] | FACCIORUSSO A, DI MASO M, MUSCATIELLO, N. Drug-eluting beads versus conventional chemoembolization for the treatment of unresectable hepatocellular carcinoma:a meta-analysis[J]. Dig Liver Dis, 2016, 48(6): 571–577. doi:10.1016/j.dld.2016.02.005 |