癫痫是一种由多种病因引起的严重的慢性脑部疾病,以脑神经元过度异常放电导致的反复性、发作性和短暂性发作为特征。目前,临床上对于癫痫治疗的首选方式依然是药物治疗,但仍有约三分之一的患者使用抗癫痫药物无效,甚至在某些情况下出现癫痫症状加重或严重不良反应[1-3]。起源于海马或者其他颞叶结构的颞叶癫痫是临床上最为常见的难治性癫痫,对抗癫痫药物反应性极差,通常只能通过手术切除癫痫灶点组织的方式控制,但手术治疗存在适应证少、不良反应多等缺陷。因此,颞叶癫痫的病理机制、治疗手段等始终是癫痫研究的热门领域。
成体神经再生指的是在成年的中枢神经系统中新神经元的产生。它只发生于哺乳动物的海马齿状回的颗粒下层 (subgranular zone) 和侧脑室的室下区 (subventricular zone) 两个特定区域[4]。成体再生的神经元的成熟需要经历大约五个主要阶段:① 干细胞维持、激活和分化方向的决定;② 神经前体细胞增殖;③ 迁移和初步向颗粒细胞分化;④ 成熟和功能整合;⑤ 成为成熟的神经元。有研究发现,成体神经再生与海马或者嗅球依赖的学习记忆等生理功能密切相关,且成体神经再生水平异常与各类神经系统疾病相关,如重度抑郁、阿尔茨海默病、脑卒中等[5-6]。
关于癫痫的发生机制,尤其是兴奋抑制失衡、异常兴奋性环路的形成机制等的研究始终受到广泛关注。由于海马是癫痫发生的主要灶点,因此海马在癫痫中的病理性变化,如苔藓纤维出芽、中间神经元的丢失等自20世纪80年代开始就受到了关注并推测其在癫痫形成过程中可能起到重要作用。海马齿状回在癫痫持续状态 (status epilepticus, SE) 后出现的成体神经再生现象也从20世纪90年代起就成为神经科学家们解密癫痫发病机制的热门研究方向:即癫痫后海马的成体神经再生出现短期内迅速增加而后慢性期减少的现象。癫痫后海马颗粒细胞的丢失及其再生水平的上调在空间和时间并存,进一步激发了对癫痫后成体神经再生现象的研究。与此同时,癫痫后产生的颗粒细胞还存在基底树突和迁移至门区和CA3区交界的异常形态和位置。基于这些异常现象已经有很多不同的解释和假说,如再生神经元的形态[7]、位置[8]和电生理特性[9-10]的异常可能与癫痫异常兴奋环路的形成 (epileptogenesis) 有关。但也有报道表明,成体再生的不成熟颗粒细胞可能通过激活海马齿状回区的中间神经元,起到抑制环路兴奋性的作用[11-12]。然而,这些成体再生神经元在海马中的功能到底是什么,它们的形成机制以及通过它们来调控癫痫发作的可行性等仍然备受争议。
本文系统地综述癫痫后再生神经元数量、形态及功能的研究进展,以期对癫痫的形成过程、病理机制有进一步了解,为以成体神经元再生水平为干预靶点的新型癫痫疾病治疗手段提供理论基础。
1 癫痫引起的成体神经元再生改变 1.1 SE后急性期成体再生神经元数量的变化及特征大量研究表明,在颞叶癫痫动物模型SE后,通过BrdU或者Ki67染色可见海马齿状回的神经元增殖水平明显上调。1997年,Parent等[13]在大鼠匹罗卡品颞叶癫痫模型中,使用BrdU标记直接证明了癫痫后再生神经元迅速增加。类似发现也在单侧海马注射海人藻酸 (kainic acid) 引起的颞叶癫痫模型中得到验证,研究人员还进一步发现了该模型下癫痫后双侧海马齿状回颗粒细胞再生水平都有明显提升,且在海人藻酸注射这一侧增加更明显[14]。此外,神经元再生增加的程度与癫痫的严重程度呈正相关,即SE越严重,神经元再生越多[15-16]。之后的研究陆续在不同的癫痫模型中 (MES、kindling等) 发现了癫痫后神经元异常增多这一现象[17]。后续还有研究表明,癫痫后表达双皮质素的神经细胞也出现了相应的增加[18]。在这一研究中,研究者们提出了这种现象可能是作为癫痫病理状态下颗粒细胞层颗粒细胞弥散的一种补偿机制的设想。另外,他们还发现癫痫后表达巢蛋白 (nestin) 的早期神经前体细胞 (neural progenitor) 无增加,增加的是表达双皮质素的晚期神经前体细胞 (neuroblast),因此提出了癫痫作为一种病理性刺激可以激活生理刺激无法激活的晚期神经前体细胞分裂,从而使得表达双皮质素的细胞明显增加的设想。
同时,临床上的颞叶癫痫患者也可观察到存在海马齿状回神经前体细胞的增加[19]。但这种SE后的成体神经元再生增加可能存在年龄阶段依赖,因为Wasterlain等[20]发现幼年期 (出生后的第一周) 经历SE表现为再生神经元减少,后续大量研究都证实了这一发现[21-22],而这一变化与成年动物发生癫痫后的神经再生改变正好相反。
1.2 SE后慢性期成体再生神经元数量的变化在颞叶癫痫模型的后期 (SE后3~4周后),即颞叶癫痫的慢性期,成体再生神经元增殖恢复正常水平甚至逐渐低于正常水平。Hattiangady等[23]利用脑室注射和腹腔注射海人藻酸的不同给药方式构建海人藻酸慢性自发颞叶癫痫模型,并发现在注射海人藻酸的5个月后,表达双皮质素的不成熟神经元数量显著减少,甚至低于正常水平。
1.3 影响成体神经再生水平的可能因素及机制Hattiangady等[23]研究发现,在癫痫自发次数更多的动物中,成体再生神经元也减少得更多,提示癫痫发作频率与成体神经再生水平有关。最近发表的一篇文章中[24],研究者们提供了进一步的证据:他们通过减少用于构建内侧颞叶癫痫的海人藻酸用量,构建了一种只有癫痫样脑电活动而没有癫痫发作行为的中间状态的实验组,并与内侧颞叶癫痫对比,揭示了它们在成体神经再生水平上的不同表现。虽然上述发现都提示癫痫后成体神经再生水平的改变可能与癫痫的发作强度有关,但仍然缺乏更为直接和确切的证据,有待进一步探究。
为了解释癫痫后神经元数量的变化,大量研究聚焦于海马齿状回神经元再生的机制,且已取得了初步的成果。新神经元的产生主要来源于齿状回分布的一类表达神经胶质纤维酸性蛋白、其形态与星形胶质细胞相似的放射状胶质细胞样前体细胞 (radial glia-like neural progenitor cell,rNSC)[25-26]。早期研究表明,诱发癫痫的因素比如电刺激和化学致痫剂可以增加rNSC的激活[13, 27-28]。rNSC在通常状态下保持静止,一旦被激活,大部分会进行不对称分裂,最终分裂成一个神经元 (颗粒细胞) 和一个星形胶质细胞;产生的神经元也可能在逐渐分化成熟的过程中凋亡或被小胶质细胞清除掉[29]。rNSC激活的水平不仅决定了SE后成体神经再生的水平,也决定了rNSC减少的速率。Sierra等[29]通过比较不同剂量的海人藻酸构建的两种不同的癫痫模型 (一种没有行为学发作只有癫痫样脑电活动,另一种是有明显的持续癫痫发作并在后期转变为反复自发的慢性癫痫),发现这两种模型在慢性期成体再生神经元的数量上有明显的差异:前者给予海人藻酸的50 d中前体细胞减少了40%,而后者前体细胞减少了90%以上。造成这种差异的原因是rNSC被激活后由不对称分裂的方式转变成了对称的产生反应性星形胶质细胞的方式。这种内侧颞叶癫痫模型中不对称的分裂方式也为模型后期成体神经再生减少提供了进一步的证据。总的来说,尽管神经干细胞胶质细胞样前体细胞可以进行自我更新,但它们被激活后最终都会不可逆地分化成熟,再加上胶质细胞样前体细胞的数量是有限的,癫痫早期的胶质细胞样前体细胞的激活在表现为癫痫急性期成体神经再生水平上调的同时将会导致胶质细胞样前体细胞的耗竭,并进一步导致慢性期成体神经再生水平降低。另有研究表明,即使在没有诱发癫痫的情况下,脑内进行调控影响局部电活动和神经系统兴奋性的操作也足以影响成体神经再生[13, 30-35]。目前,影响齿状回区成体神经再生的机制研究主要聚焦在齿状回的细胞环境:如内皮细胞、星形胶质细胞可能通过释放可溶性分子如Wnt3a、γ-氨基丁酸 (GABA) 影响海马齿状回区成体神经再生[32-34];小胶质细胞或者神经元通过直接与rNSC接触影响海马齿状回区的成体神经再生[29, 35]。
总之,这些证据都表明,癫痫发作可能通过异常放电来影响神经系统的兴奋性,影响海马齿状回区不同类型细胞组成的微环境,调控神经干细胞的状态,从而改变成体神经再生水平。
2 颞叶癫痫后再生的神经前体细胞的分化、成熟和整合 2.1 癫痫对于成体再生神经元形态和位置的影响及可能机制据报道,癫痫后成年大鼠海马齿状回区75%~90%的成体再生神经细胞会在产生四周左右表达颗粒细胞的标记[15]。此外,癫痫后产生的成体再生神经元——成年再生颗粒细胞 (adult-born granule cells, abGC) 在形态和空间位置等方面的改变也引起了广泛的关注。在正常状态下,abGC是高度极化的神经元[36-37],它们有一个单极的树突伸向颗粒细胞层和分子层,而基底树突只会瞬时存在[38]。由于基底树突出现于成体再生的神经细胞从颗粒下层迁移到颗粒细胞层的过程中,提示了它们可能与迁移相关。基底树突上没有观察到突触也与它们只是瞬时存在的结构的观点一致[39]。然而,癫痫后再生的颗粒细胞却可能形成持久存在的异常的门区基底树突 (hilar basal dendrites) 并最终整合进海马相关环路[40]。这些门区基底树突在神经元表达双皮质素的未成熟的发育阶段 (早在匹罗卡品癫痫模型SE后4 d) 就能与苔藓纤维形成不成熟的突触联系[41-42],在后期这些基底树突会形成树突棘和成熟的突触[40],并且苔藓纤维与这些异常的基底树突形成的突触要多于与正常的颗粒细胞形成的突触[43-44]。值得注意的是,癫痫后再生的神经元分化的异常与其异常再生的时间有关,且存在异源性特征[45-46](图 1)。
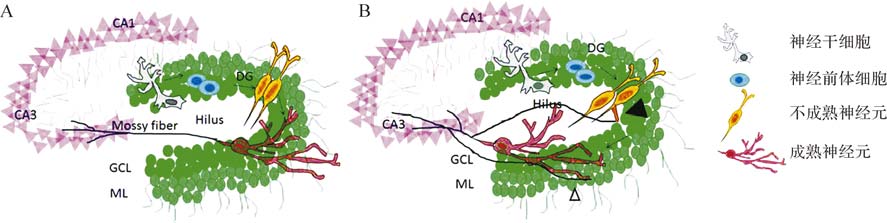
|
| A:正常状态下海马齿状回区的放射状胶质细胞样前体细胞 (rNSC) 被激活后产生神经前体细胞,再分化成为不成熟神经元初步形成树突,然后成熟,树突延伸进入分子层,轴突经过门区延伸到CA3;B:癫痫持续状态后海马齿状回区rNSC被激活产生神经前体细胞,再分化成为不成熟神经元时不仅更早形成了正常的树突还在胞体底部形成了基底树突 (▲)。成熟后,神经元异常迁移离开颗粒细胞层在门区内向CA3迁移,部分轴突会反向伸展到达分子层,发生癫痫后常见的病理现象——苔藓纤维出芽 (△),从而形成异常的兴奋性环路.DG:海马齿状回区;GCL:颗粒细胞层;ML:分子层. 图 1 海马内正常状态的成体神经再生和癫痫状态下的成体再生神经元发育成熟和功能整合 Fig. 1 Normal adult neurogenesis in the hippocampus and aberrant integration of adult-born neurons after status epilepticus |
另外,正常的成熟海马中产生的颗粒细胞在颗粒下层产生后只会迁移一小段到颗粒细胞层,然后整合进环路中发挥它们的功能,只有极少数的颗粒细胞会错误地到达门区。在癫痫发作后,再生的门区异位神经元 (hilar ectopic granule cells, hEGC) 会明显增加[47]。同时,这些hEGC只会移动到门区和CA3区的边界而不会进入CA3区,提示可能存在一个结构上的或者化学上的“屏障”阻止它们迁移进入CA3区。尽管研究表明这些位置异常的颗粒细胞与正常状态下产生的颗粒细胞在电生理特点 (膜静息电位、输入阻抗、动作电位发放模式等) 方面极为相似[48],但它们在与周围的突触联系和神经网络方面却有明显差异。比如,它们虽然与颗粒细胞层的正常颗粒细胞一样可以接收来自于穿通纤维的正常突触输入,但它们会表现出相对于颗粒细胞层的颗粒细胞的发放推迟[48]。这种延迟被推测为兴奋的输入是经过颗粒细胞层的颗粒细胞后跨突触再传递给hEGC的。同时研究表明,癫痫后可以在hEGC和门区的其他细胞中检测到即刻早期基因c-fos的表达,而在正常颗粒细胞分布的颗粒细胞层却基本未见c-fos表达[49]。并且,hEGC会与CA3区锥体细胞有同步化的簇状放电,这一点是它们与颗粒细胞层的颗粒细胞的最大差异[50]。这些研究结果都提示,处于门区的异位颗粒细胞在环路功能方面与它的“邻居”门区的细胞更为接近,而与颗粒细胞层的颗粒细胞存在较大区别。总的来说,基底树突和hEGC在门区被观察到形成树突棘在一定程度上证明了癫痫后产生的abGC参与了异常环路形成的假说。
关于癫痫后再生神经元的形态和位置异常的分子机制目前也有了初步的研究。比如,根据Reelin表达在门区某些特定的中间神经元上且在SE后很容易被损伤的特性,人们猜测abGC的异常迁移可能与Reelin相关。Gong等[51]的体外实验也证明了Reelin表达下调可以产生与体内SE后再生颗粒细胞迁移异常类似的现象。另外,由于在脑内另一个相似的神经再生区域——室下区的研究中已经证实了GABA可以减少未成熟的神经元向嗅球迁移[52],抑制性递质GABA本身的减少也可能是导致hEGC产生的机制之一。还有研究者提出,脑源性神经营养因子也可能是一种促进SE后hEGC形成的机制[53]。上述机制有可能是以一种相互协调的方式共同调节癫痫后abGC的分化成熟和迁移整合。具体机制仍然有待进一步的研究和探索。
2.2 癫痫可以加速成体再生神经元的分化和环路整合除了在abGC分化、迁移、成熟的过程中产生影响从而最终影响它们的形态和位置外,有报道指出,癫痫发作还可以加速abGC的功能成熟和环路的整合[36, 54]。利用转基因动物POMC-EGFP (体内绿色荧光标记大约12 d的再生颗粒细胞),Overstreet-wadiche等[54]发现在匹罗卡品诱导的癫痫模型中,癫痫发作两周后,标记的abGC的树突已经出现在中分子层和外分子层,而正常动物的树突依然只延伸到内分子层。同时,癫痫后,脑片电生理检测结果显示,被标记的abGC已经可以接收来自内嗅皮层的兴奋性输入,表现为刺激穿通纤维后可以在abGC记录到兴奋性突触后电位,而正常动物在此阶段还不能记录到。但是,癫痫后abGC成熟和环路整合的加快对整个海马网络的功能影响尚不明确。
3 成体再生神经元在颞叶癫痫中的作用颞叶癫痫后产生的abGC究竟是疾病的一部分,还是机体自我修复的一种尝试,目前尚无定论。
一部分研究认为,癫痫后产生的abGC会参与癫痫的形成过程,因此对机体是有害的。研究者们采用药理学手段抑制癫痫后的成体神经再生,发现可以减弱慢性癫痫反复发作。在实验中,Jung等[55]采用分裂抑制剂阿糖胞苷抑制匹罗卡品诱导的癫痫后的神经再生,并采用连续脑电记录的方式记录并分析发作次数的变化,发现实验组的自发频率低于对照组。Morgan等[56]的研究提示,少量成体再生的与周围广泛联系的颗粒细胞可能可以增加神经系统的兴奋性,从而导致癫痫易感环路的形成。更令人吃惊的是,Pun等[57]发现异常的成体神经再生 (只有9%的abGC由于mTOR的激活错误连接) 足以使其他方面完全正常的动物反复自发癫痫。之后,Cho等[58]则采用更为特异性的手段,证明在海人藻酸慢性自发癫痫模型中,用Nestin-TK转基因小鼠注射更昔洛韦特异性地杀灭癫痫后的神经元再生,可以显著减少癫痫的自发频率。
然而,abGC会促进颞叶癫痫形成的观点在某些方面也遭到了质疑。例如,2007年,Raedt等[59]的研究结果表明,在海马快速点燃的进程中,使用射线抑制成体神经再生的大鼠在癫痫形成过程中有迅速的兴奋性上调;而根据2011年Pekcec等[60]研究报道,使用射线可以抑制癫痫后成体神经再生并减少门区基底树突的产生,但是不影响大鼠点燃模型的癫痫进程。应用小鼠海人藻酸模型的研究也发现,抑制成体神经再生增加了小鼠的癫痫易感性[61]。另外,Lacefield等[12]采用细胞外记录的方法发现,海马齿状回区的颗粒细胞层成体神经元再生水平下调后,颗粒细胞放电更猛烈,提示abGC对局部神经系统有抑制作用。2016年,Drew等[11]的文章更是从abGC作用于海马齿状回区的成熟颗粒细胞的角度,阐释了abGC在局部环路发挥抑制作用的机制,即通过兴奋门区的中间神经元,增加它们的抑制性递质GABA的释放,从而抑制成熟的颗粒细胞的功能而发挥抑制海马兴奋性的作用。
综上所述,关于癫痫后再生神经元的功能目前依然存在很大争议。首先,上文提到的通过药理学手段或放射手段来调节成体神经再生水平本身缺乏选择性和特异性,可能导致炎症反应、海马齿状回区微环境以及一系列信号通路的代偿性改变,以致其中变化难以解释。另外,调控癫痫后成体神经元再生水平对癫痫形成过程影响不同也可能是由于模型的不同导致。因此,后续利用更加特异的方式调控癫痫后再生神经元的功能,从而进一步解析其在癫痫中的具体机制势在必行。
4 结语在颞叶癫痫SE后,成体神经再生数量短时间内显著增多,分化产生树突形成突触明显加快,并且还出现了基底树突和异常迁移的现象。然而,这些改变对于癫痫后的神经环路有什么影响,通过什么方式来影响尚不清楚。只有找到更多更为特异性的手段选择性地调控这些成体再生神经元,甚至在不同阶段调控它们的数量、形态、位置等,并找到更可靠的方法在个体水平、局部环路水平和整体水平调控它们带来的功能变化,才能更清楚地了解它们在颞叶癫痫中扮演的角色,为癫痫治疗提供新的思路。
| [1] | WOLF P. Pharmacoresistance in epilepsy[J]. Zh Nevrol Psikhiatr Im S S Korsakova, 2005, 105(12): 55–56. |
| [2] | SUN Y, WANG X, WANG Z, et al. Expression of microRNA-129-2-3p and microRNA-935 in plasma and brain tissue of human refractory epilepsy[J]. Epilepsy Res, 2016, 127: 276–283. doi:10.1016/j.eplepsyres.2016.09.016 |
| [3] | SON A Y, BIAGIONI M C, KAMINSKI D, et al. Parkinson's disease and cryptogenic epilepsy[J]. Case Rep Neurol Med, 2016, 2016: 3745631. |
| [4] | ALTMAN J. Are new neurons formed in the brains of adult mammals?[J]. Science, 1962, 135(3509): 1127–1128. doi:10.1126/science.135.3509.1127 |
| [5] | CHRISTIAN K M, SONG H, MING G L. Functions and dysfunctions of adult hippocampal neurogenesis[J]. Annu Rev Neurosci, 2014, 37: 243–262. doi:10.1146/annurev-neuro-071013-014134 |
| [6] | DENG W, AIMONE J B, GAGE F H. New neurons and new memories:how does adult hippocampal neurogenesis affect learning and memory?[J]. Nat Rev Neurosci, 2010, 11(5): 339–350. doi:10.1038/nrn2822 |
| [7] | SHAPIRO L A, KORN M J, RIBAK C E. Newly generated dentate granule cells from epileptic rats exhibit elongated hilar basal dendrites that align along GFAP-immunolabeled processes[J]. Neuroscience, 2005, 136(3): 823–831. doi:10.1016/j.neuroscience.2005.03.059 |
| [8] | MYERS C E, BERMUDEZ-HERNANDEZ K, SCHARFMAN H E. The influence of ectopic migration of granule cells into the hilus on dentate gyrus-CA3 function[J/OL]. PLoS One, 2013, 8(6):e68208. |
| [9] | SCHMIDT-HIEBER C, JONAS P, BISCHOFBERGER J. Enhanced synaptic plasticity in newly generated granule cells of the adult hippocampus[J]. Nature, 2004, 429(6988): 184–187. doi:10.1038/nature02553 |
| [10] | ESPÓSITO M S, PIATTI V C, LAPLAGNE D A, et al. Neuronal differentiation in the adult hippocampus recapitulates embryonic development[J]. J Neurosci, 2005, 25(44): 10074–10086. doi:10.1523/JNEUROSCI.3114-05.2005 |
| [11] | DREW L J, KHEIRBEK M A, LUNA V M, et al. Activation of local inhibitory circuits in the dentate gyrus by adult-born neurons[J]. Hippocampus, 2016, 26(6): 763–778. doi:10.1002/hipo.22557 |
| [12] | LACEFIELD C O, ITSKOV V, REARDON T, et al. Effects of adult-generated granule cells on coordinated network activity in the dentate gyrus[J]. Hippocampus, 2012, 22(1): 106–116. doi:10.1002/hipo.v22.1 |
| [13] | PARENT J M, YU T W, LEIBOWITZ R T, et al. Dentate granule cell neurogenesis is increased by seizures and contributes to aberrant network reorganization in the adult rat hippocampus[J]. J Neurosci, 1997, 17(10): 3727–3738. |
| [14] | GRAY W P, SUNDSTROM L E. Kainic acid increases the proliferation of granule cell progenitors in the dentate gyrus of the adult rat[J]. Brain Res, 1998, 790(1-2): 52–59. doi:10.1016/S0006-8993(98)00030-4 |
| [15] | MOHAPEL P, EKDAHL C T, LINDVALL O. Status epilepticus severity influences the long-term outcome of neurogenesis in the adult dentate gyrus[J]. Neurobiol Dis, 2004, 15(2): 196–205. doi:10.1016/j.nbd.2003.11.010 |
| [16] | YANG F, WANG J C, HAN J L, et al. Different effects of mild and severe seizures on hippocampal neurogenesis in adult rats[J]. Hippocampus, 2008, 18(5): 460–468. doi:10.1002/(ISSN)1098-1063 |
| [17] | BOTTERILL J J, BRYMER K J, CARUNCHO H J, et al. Aberrant hippocampal neurogenesis after limbic kindling:relationship to BDNF and hippocampal-dependent memory[J]. Epilepsy Behav, 2015, 47: 83–92. doi:10.1016/j.yebeh.2015.04.046 |
| [18] | JESSBERGER S, RÖMER B, BABU H, et al. Seizures induce proliferation and dispersion of doublecortin-positive hippocampal progenitor cells[J]. Exp Neurol, 2005, 196(2): 342–351. doi:10.1016/j.expneurol.2005.08.010 |
| [19] | BLÜMCKE I, SCHEWE J C, NORMANN S, et al. Increase of nestin-immunoreactive neural precursor cells in the dentate gyrus of pediatric patients with early-onset temporal lobe epilepsy[J]. Hippocampus, 2001, 11(3): 311–321. doi:10.1002/hipo.v11:3 |
| [20] | WASTERLAIN C G. Developmental brain damage after chemically induced epileptic seizures[J]. Eur Neurol, 1975, 13(6): 495–498. |
| [21] | SHI X Y, SUN R P, WANG J W. Consequences of pilocarpine-induced recurrent seizures in neonatal rats[J]. Brain Dev, 2007, 29(3): 157–163. doi:10.1016/j.braindev.2006.08.009 |
| [22] | LIU H, KAUR J, DASHTIPOUR K, et al. Suppression of hippocampal neurogenesis is associated with developmental stage, number of perinatal seizure episodes, and glucocorticosteroid level[J]. Exp Neurol, 2003, 184(1): 196–213. doi:10.1016/S0014-4886(03)00207-3 |
| [23] | HATTIANGADY B, RAO M S, SHETTY A K. Chronic temporal lobe epilepsy is associated with severely declined dentate neurogenesis in the adult hippocampus[J]. Neurobiol Dis, 2004, 17(3): 473–490. doi:10.1016/j.nbd.2004.08.008 |
| [24] | SIERRA A, MARTÍN-SUÁREZ S, VALCÁRCEL-MARTÍN R, et al. Neuronal hyperactivity accelerates depletion of neural stem cells and impairs hippocampal neurogenesis[J]. Cell Stem Cell, 2015, 16(5): 488–503. doi:10.1016/j.stem.2015.04.003 |
| [25] | FUKUDA S, KATO F, TOZUKA Y, et al. Two distinct subpopulations of nestin-positive cells in adult mouse dentate gyrus[J]. J Neurosci, 2003, 23(28): 9357–9366. |
| [26] | SERI B, GARCÍA-VERDUGO J M, MCEWEN B S, et al. Astrocytes give rise to new neurons in the adult mammalian hippocampus[J]. J Neurosci, 2001, 21(18): 7153–7160. |
| [27] | SEGI-NISHIDA E, WARNER-SCHMIDT J L, DUMAN R S. Electroconvulsive seizure and VEGF increase the proliferation of neural stem-like cells in rat hippocampus[J]. Proc Natl Acad Sci U S A, 2008, 105(32): 11352–11357. doi:10.1073/pnas.0710858105 |
| [28] | BONAGUIDI M A, WHEELER M A, SHAPIRO J S, et al. In vivo clonal analysis reveals self-renewing and multipotent adult neural stem cell characteristics[J]. Cell, 2011, 145(7): 1142–1155. doi:10.1016/j.cell.2011.05.024 |
| [29] | SIERRA A, ENCINAS J M, DEUDERO J J, et al. Microglia shape adult hippocampal neurogenesis through apoptosis-coupled phagocytosis[J]. Cell Stem Cell, 2010, 7(4): 483–495. doi:10.1016/j.stem.2010.08.014 |
| [30] | STONE S S, TEIXEIRA C M, DEVITO L M, et al. Stimulation of entorhinal cortex promotes adult neurogenesis and facilitates spatial memory[J]. J Neurosci, 2011, 31(38): 13469–13484. doi:10.1523/JNEUROSCI.3100-11.2011 |
| [31] | SULTAN S, GEBARA E G, MOULLEC K, et al. D-serine increases adult hippocampal neurogenesis[J]. Front Neurosci, 2013, 7: 155. |
| [32] | PALMER T D, WILLHOITE A R, GAGE F H. Vascular niche for adult hippocampal neurogenesis[J]. J Comp Neurol, 2000, 425(4): 479–494. doi:10.1002/(ISSN)1096-9861 |
| [33] | LIE D C, COLAMARINO S A, SONG H J, et al. Wnt signalling regulates adult hippocampal neurogenesis[J]. Nature, 2005, 437(7063): 1370–1375. doi:10.1038/nature04108 |
| [34] | SONG H, STEVENS C F, GAGE F H. Astroglia induce neurogenesis from adult neural stem cells[J]. Nature, 2002, 417(6884): 39–44. doi:10.1038/417039a |
| [35] | SONG J, ZHONG C, BONAGUIDI M A, et al. Neuronal circuitry mechanism regulating adult quiescent neural stem-cell fate decision[J]. Nature, 2012, 489(7414): 150–154. doi:10.1038/nature11306 |
| [36] | ZHAO C, TENG E M, SUMMERS R G, et al. Distinct morphological stages of dentate granule neuron maturation in the adult mouse hippocampus[J]. J Neurosci, 2006, 26(1): 3–11. doi:10.1523/JNEUROSCI.3648-05.2006 |
| [37] | TONI N, TENG E M, BUSHONG E A, et al. Synapse formation on neurons born in the adult hippocampus[J]. Nat Neurosci, 2007, 10(6): 727–734. doi:10.1038/nn1908 |
| [38] | RAO M S, SHETTY A K. Efficacy of doublecortin as a marker to analyse the absolute number and dendritic growth of newly generated neurons in the adult dentate gyrus[J]. Eur J Neurosci, 2004, 19(2): 234–246. doi:10.1111/ejn.2004.19.issue-2 |
| [39] | SERESS L, RIBAK C E. Postnatal development of the light and electron microscopic features of basket cells in the hippocampal dentate gyrus of the rat[J]. Anat Embryol (Berl), 1990, 181(6): 547–565. |
| [40] | JESSBERGER S, ZHAO C, TONI N, et al. Seizure-associated, aberrant neurogenesis in adult rats characterized with retrovirus-mediated cell labeling[J]. J Neurosci, 2007, 27(35): 9400–9407. doi:10.1523/JNEUROSCI.2002-07.2007 |
| [41] | SHAPIRO L A, RIBAK C E. Newly born dentate granule neurons after pilocarpine-induced epilepsy have hilar basal dendrites with immature synapses[J]. Epilepsy Res, 2006, 69(1): 53–66. doi:10.1016/j.eplepsyres.2005.12.003 |
| [42] | SHAPIRO L A, FIGUEROA-ARAGON S, RIBAK C E. Newly generated granule cells show rapid neuroplastic changes in the adult rat dentate gyrus during the first five days following pilocarpine-induced seizures[J]. Eur J Neurosci, 2007, 26(3): 583–592. doi:10.1111/j.1460-9568.2007.05662.x |
| [43] | DASHTIPOUR K, TRAN P H, OKAZAKI M M, et al. Ultrastructural features and synaptic connections of hilar ectopic granule cells in the rat dentate gyrus are different from those of granule cells in the granule cell layer[J]. Brain Res, 2001, 890(2): 261–271. doi:10.1016/S0006-8993(00)03119-X |
| [44] | PIERCE J P, MELTON J, PUNSONI M, et al. Mossy fibers are the primary source of afferent input to ectopic granule cells that are born after pilocarpine-induced seizures[J]. Exp Neurol, 2005, 196(2): 316–331. doi:10.1016/j.expneurol.2005.08.007 |
| [45] | WALTER C, MURPHY B L, PUN R Y, et al. Pilocarpine-induced seizures cause selective time-dependent changes to adult-generated hippocampal dentate granule cells[J]. J Neurosci, 2007, 27(28): 7541–7552. doi:10.1523/JNEUROSCI.0431-07.2007 |
| [46] | MURPHY B L, PUN R Y, YIN H, et al. Heterogeneous integration of adult-generated granule cells into the epileptic brain[J]. J Neurosci, 2011, 31(1): 105–117. doi:10.1523/JNEUROSCI.2728-10.2011 |
| [47] | PARENT J M, ELLIOTT R C, PLEASURE S J, et al. Aberrant seizure-induced neurogenesis in experimental temporal lobe epilepsy[J]. Ann Neurol, 2006, 59(1): 81–91. doi:10.1002/(ISSN)1531-8249 |
| [48] | SCHARFMAN H E, SOLLAS A E, BERGER R E, et al. Perforant path activation of ectopic granule cells that are born after pilocarpine-induced seizures[J]. Neuroscience, 2003, 121(4): 1017–1029. doi:10.1016/S0306-4522(03)00481-0 |
| [49] | SCHARFMAN H E, SOLLAS A L, GOODMAN J H. Spontaneous recurrent seizures after pilocarpine-induced status epilepticus activate calbindin-immunoreactive hilar cells of the rat dentate gyrus[J]. Neuroscience, 2002, 111(1): 71–81. doi:10.1016/S0306-4522(01)00599-1 |
| [50] | SCHARFMAN H E, GOODMAN J H, SOLLAS A L. Granule-like neurons at the hilar/CA3 border after status epilepticus and their synchrony with area CA3 pyramidal cells:functional implications of seizure-induced neurogenesis[J]. J Neurosci, 2000, 20(16): 6144–6158. |
| [51] | GONG C, WANG T W, HUANG H S, et al. Reelin regulates neuronal progenitor migration in intact and epileptic hippocampus[J]. J Neurosci, 2007, 27(8): 1803–1811. doi:10.1523/JNEUROSCI.3111-06.2007 |
| [52] | LIU X, WANG Q, HAYDART F, et al. Nonsynaptic GABA signaling in postnatal subventricular zone controls proliferation of GFAP-expressing progenitors[J]. Nat Neurosci, 2005, 8(9): 1179–1187. doi:10.1038/nn1522 |
| [53] | SCHARFMAN H, GOODMAN J, MACLEOD A, et al. Increased neurogenesis and the ectopic granule cells after intrahippocampal BDNF infusion in adult rats[J]. Exp Neurol, 2005, 192(2): 348–356. doi:10.1016/j.expneurol.2004.11.016 |
| [54] | OVERSTREET-WADICHE L S, BROMBERG D A, BENSEN A L, et al. Seizures accelerate functional integration of adult-generated granule cells[J]. J Neurosci, 2006, 26(15): 4095–4103. doi:10.1523/JNEUROSCI.5508-05.2006 |
| [55] | JUNG K H, CHU K, KIM M, et al. Continuous cytosine-b-D-arabinofuranoside infusion reduces ectopic granule cells in adult rat hippocampus with attenuation of spontaneous recurrent seizures following pilocarpine-induced status epilepticus[J]. Eur J Neurosci, 2004, 19(12): 3219–3226. doi:10.1111/j.0953-816X.2004.03412.x |
| [56] | MORGAN R J, SOLTESZ I. Nonrandom connectivity of the epileptic dentate gyrus predicts a major role for neuronal hubs in seizures[J]. Proc Natl Acad Sci U S A, 2008, 105(16): 6179–6184. doi:10.1073/pnas.0801372105 |
| [57] | PUN R Y, ROLLE I J, LASARGE C L, et al. Excessive activation of mTOR in postnatally generated granule cells is sufficient to cause epilepsy[J]. Neuron, 2012, 75(6): 1022–1034. doi:10.1016/j.neuron.2012.08.002 |
| [58] | CHO K O, LYBRAND Z R, ITO N, et al. Aberrant hippocampal neurogenesis contributes to epilepsy and associated cognitive decline[J]. Nat Commun, 2015, 6: 6606. doi:10.1038/ncomms7606 |
| [59] | RAEDT R, BOON P, PERSSON A, et al. Radiation of the rat brain suppresses seizure-induced neurogenesis and transiently enhances excitability during kindling acquisition[J]. Epilepsia, 2007, 48(10): 1952–1963. doi:10.1111/epi.2007.48.issue-10 |
| [60] | PEKCEC A, LVPKE M, BAUMANN R, et al. Modulation of neurogenesis by targeted hippocampal irradiation fails to affect kindling progression[J]. Hippocampus, 2011, 21(8): 866–876. |
| [61] | IYENGAR S S, LAFRANCOIS J J, FRIEDMAN D, et al. Suppression of adult neurogenesis increases the acute effects of kainic acid[J]. Exp Neurol, 2015, 264: 135–149. doi:10.1016/j.expneurol.2014.11.009 |




