2. 浙江大学医学院附属第二医院泌尿外科, 浙江 杭州 310009
2. Department of Urology, the Second Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310009, China
膀胱癌是一种常见的泌尿系统恶性肿瘤,其中90%以上的组织学类型是尿路上皮来源的[1]。膀胱癌是美国男性第4位常见的新发恶性肿瘤,在所有肿瘤中约占7%[2]。据报道,2014年,美国约有74 000例新发膀胱癌病例(男性56 320 例和女性17 680例),同时约16 000 例患者死于膀胱癌(男性11 510例和女性4490例)[2]。膀胱癌可以分为非肌层浸润性肿瘤(Ta、Tis、T1期)和肌层浸润性肿瘤(T2期及以上)。非肌层浸润性肿瘤占所有膀胱癌的70%以上,生物学特性主要表现为容易复发,但只有10%~20%的患者出现肿瘤局部进展或者远处转移[3];而肌层浸润性肿瘤即便采取手术、化疗和放疗等综合性的治疗方法,依然有很高的局部进展和远处转移的可能性,严重影响患者的生存时间和生活质量。
糖皮质激素是临床上使用非常广泛的一种药物,但其在发挥治疗作用的同时也会产生骨质疏松、糖尿病、肌肉萎缩等一系列不良反应。糖皮质激素发挥治疗作用以及产生不良反应主要是通过糖皮质激素受体(glucocorticoid receptor,GR)信号通路实现的。当糖皮质激素与GR结合后,GR会向核内转位激活下游基因(转录激活)或者与其他转录因子相互作用,抑制它们的活性(转录抑制),从而发挥不同的生物学活性[4]。糖皮质激素已在血液系统肿瘤如白血病、淋巴瘤和多发性骨髓瘤中被用作细胞毒性药物参与化疗[5]。而在实体肿瘤中,糖皮质激素通常只被用作化疗的协同用药,以减少化疗的不良反应[6]。最近研究发现,在膀胱癌中,糖皮质激素同样可以作用于肿瘤细胞本身[7-9]。本文拟简单介绍GR的结构和功能、GR信号通路在膀胱癌细胞增殖和侵袭中的作用以及新型选择性GR激动剂的作用等。
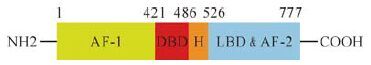
1 GR的结构、功能及作用机制人源性糖皮质激素受体(human glucocorticoid receptor,hGR)属于甾体/甲状腺/维甲酸核受体超家族,国际统一命名为NR3C1(核受体亚家族3C组成员1) [10]。hGR的基因定位在5号染色体长链上的31~32位,由10个外显子组成,最后2个外显子是9α和9β,基因全长110千碱基对[11]。hGR由于在转录和翻译过程中选择性地剪接和启动,以及翻译后修饰机制的存在,有多种多样的mRNA和同工异构体,人类体内最主要的是GRα,其次为GRβ。不同的GR有各自不同的生物学特性。GR同工异构体的种类和比例在不同细胞中的分布不同,是GR信号通路功能多样性和细胞特异性的分子生物学基础[12]。GRα依赖配体的激活才能发挥其活性,GRβ则由于配体结合区的缺失而不能结合配体,不需要配体的结合就可以发挥生物学活性。GRβ的生物学意义目前尚不清楚,有研究认为它能拮抗GRα的活性,与激素抵抗有关[13]。也有研究发现,GRβ的表达水平升高还能提高膀胱癌细胞的迁移能力[14]。GR是一种模块化的受体,每一个结构域都有特定的功能。hGRα包括777个氨基酸,N末端的421个氨基酸组成了非配体依赖的活化功能域(AF-1) ;接下去的65个氨基酸组成了高度保守DNA绑定区(DBD),该区域包含2个锌指结构,同时参与GR的二聚化;486~526位的氨基酸则组成了铰链区(H);C末端的250个氨基酸主要包括了配体绑定区(LBD)和配体依赖的功能活化区域(AF-2) ,同时参与GR二聚化,结合分子伴侣和受体核内转位等功能[15](图 1) 。
|
| AF-1:非配体依赖的活化功能域; DBD:DNA绑定区;H:铰链区;LBD:配体绑定区;AF-2:配体依赖的功能活化区域 图 1 人源性糖皮质激素受体α蛋白结构模式图 Fig. 1 Protein model of human glucocorticoid receptor α |
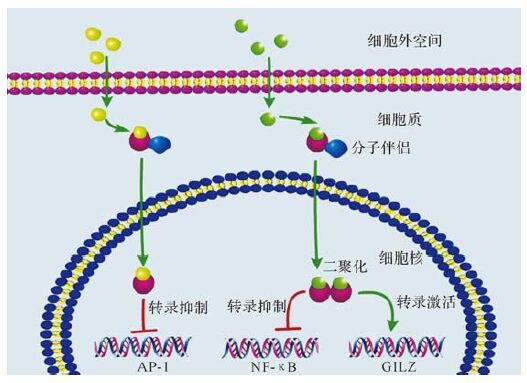
未被配体激活的GRα通常位于细胞质中,与热休克蛋白90、70、50以及免疫嗜素FKBP51和FKBP52等相关蛋白形成蛋白复合体[16-18]。当脂溶性的糖皮质激素穿过细胞膜与GRα结合后,GRα发生构象改变,从蛋白复合体中脱离出来,暴露出向细胞核内转位的结构,在相关蛋白的带领下进入细胞核[19]。GRα进入细胞核之后可以形成同源二聚体,与DNA上的糖皮质激素反应元件(GRE)结合,对下游的基因进行调控,例如可以直接通过绑定GRE增加糖皮质激素诱导的亮氨酸拉链蛋白(GILZ)和FKBP51等的表达[20-22],这种机制称为转录激活。同时,GRα二聚体还可以通过蛋白—蛋白的相互作用抑制某些转录因子,减少相应基因蛋白产物的表达,例如NF-κB[23],这种机制称为转录抑制。GRα的转录抑制作用不仅可以通过蛋白—蛋白的相互作用实现,还可以与负性GRE作用,抑制下游基因的转录,如FasL基因启动子区就有负性GRE[24]。然而,并不是所有的GRα进入细胞核内都形成同源二聚体,在某些GR选择性激动剂的作用下(例如CpdA),GRα以单体的形式进入细胞核,减弱相应转录因子的活性,主要发挥转录抑制的作用,例如激活蛋白-1(AP-1) [25](图 2) 。目前认为,GR信号通路介导的抗炎作用主要与转录抑制有关,而使用糖皮质激素所产生的不良反应则主要由转录激活引起。GR的转录激活作用常常涉及一些在糖和脂质代谢中的关键酶,例如磷酸烯醇式丙酮酸羧基酶和酪氨酸转氨酶等[26-27]。然而,GR的转录激活作用也能增强某些抗炎因子如IL-10和分泌性白细胞蛋白酶抑制剂等的表达增加[28-29]。
|
| AP-1:激活蛋白-1;GILZ:糖皮质激素诱导的亮氨酸拉链蛋白. 图 2 糖皮质激素受体信号通路模式图 Fig. 2 Signaling pathways of glucocorticoid receptor-mediated transcriptional regulation |
对膀胱癌组织和周围正常黏膜的免疫组织化学染色中发现,96%(90/94) 健康人群尿路上皮组织表达GR,而这一比例在膀胱癌患者中仅为87%(129/149) [30]。此外,GR在肌层浸润性肿瘤和高级别肿瘤中的表达率和表达强度明显低于非肌层浸润和低级别的肿瘤,且GR的表达强度对非肌层浸润性肿瘤的复发和肌层浸润性肿瘤的进展都有一定的预测作用[30]。在细胞实验中,地塞米松引起GR信号通路的激活可以使膀胱癌细胞株的细胞周期G1停滞,但同时抑制凋亡尤其是由顺铂引起的凋亡,最终肿瘤细胞的增殖增加[7]。GR信号通路的激活在某些肿瘤细胞中是促进凋亡的,例如白血病、骨肉瘤、小细胞肺癌和前列腺癌;而在另外一些肿瘤细胞中则表现出抑制凋亡的作用,例如乳腺癌、纤维肉瘤等,这种细胞特异性的作用机制目前并不十分清楚[31-34]。分子水平分析发现,细胞周期素(D1/D2/D3) 和周期素依赖激酶(CDK 2/4/6) 都没有改变,而CDK抑制因子P21/P27呈浓度依赖性升高;另一方面,凋亡效应分子cleaved caspase-3则表达下降。GR信号通路的激活同时可以抑制膀胱癌细胞株的侵袭和转移,这一结论已有动物实验验证,参与该过程的相关分子主要有基质金属蛋白酶(matrix metalloproteinase,MMP)-2、MMP-9、IL-6和血管内皮生长因子(vascular endothelial growth factor,VEGF)[7]。当换用其他类型的糖皮质激素后发现,多数糖皮质激素例如氢化可的松和倍他米松等表现出与地塞米松类似的效果,而皮质酮和泼尼松则对GR信号通路激活所引起的凋亡抑制不明显,但依然保留抑制肿瘤侵袭和转移的作用[8]。GR信号通路的激活还可以诱导膀胱癌细胞株间质向上皮转化,除了细胞形态的明显改变外,上皮方向分化的分子标记物E-cardherin和β-catenin表达上升,而间质标记物N-cardherin、vimentin、snail的表达下降[7]。NF-κB是Rel蛋白家族构成的同源或者异源二聚体,以P65/P50最常见。NF-κB一般与其抑制剂IκB紧密结合,以非活性形式存在于细胞质中。多种刺激物质如TNF-α和脂多糖等均能引起细胞内的一系列级联反应,激活细胞质中的IκB激酶,导致IκB的磷酸化和泛素化并被26S蛋白酶降解,从而释放NF-κB。游离的NF-κB转位至细胞核,启动一系列基因的转录,包括IL-6、MMP-2、MMP-9和VEGF等[35-38]。与其他研究结果一致,GR信号通路的激活对膀胱癌细胞中NF-κB的表达本身没有影响,但是上调其拮抗蛋白IκBα的水平,后者可以与NF-κB结合形成复合物。同时GR还可以直接与NF-κB相互作用,引起NF-κB向细胞核外转位,抑制NF-κB的功能[7]。如前文所述,MMP-2、MMP-9、IL-6和VEGF都是NF-κB的下游信号分子,同时它们又是参与肿瘤细胞侵袭和转移的重要分子。因此GR信号通路对于肿瘤侵袭和转移的抑制作用可能是通过它和NF-κB的相互作用实现的。
3 GR调节剂CpdA抑制膀胱癌细胞的机制糖皮质激素在医学上的价值是显而易见的,但是临床应用中的不良反应也非常棘手。近年来,人们一直试图从化合物中筛选GR选择性调节剂,期望在获得糖皮质激素治疗效果的同时尽量避免其不良反应。CpdA就是其中一种值得期待的GR选择性调节剂。CpdA是一种从非洲纳米比亚的灌木中提取出来的非甾体类的化合物,具有与地塞米松类似的GR亲和能力,能够使GR向细胞核内转位。但是与经典的GR激动剂不同的是,尽管CpdA不能使GR在细胞核内形成二聚体,大大减少了基因的转录激活,但依然可以抑制很多具有促增殖和抗凋亡转录因子的活性,例如NF-κB、AP-1、Ets-1、Ets样蛋白1、血清应答因子、活化T细胞核因子等[39-40]。正如我们在膀胱癌细胞中观察到的一样,地塞米松在抗肿瘤的过程中常常会诱导肿瘤产生抗凋亡的自我保护机制。这种机制主要是通过增加MKP1、SGK1、Bcl-2家族抗凋亡基因表达等实现的[41-42]。而CpdA则不会激活肿瘤细胞这种抗凋亡反应。通过对Granta-519淋巴瘤细胞和LNCaP-GR前列腺癌细胞的DNA阵列分析发现,CpdA仅能激活7%~11%地塞米松可以激活的基因表达,基因抑制比例分别达到了31%和66%[25]。最近的研究还发现,CpdA可以抑制前列腺癌、白血病、淋巴瘤、多发性骨髓瘤和黑色素瘤细胞的增殖和侵袭,并且当CpdA和硼替佐米(一种蛋白酶体抑制剂)联合使用后有更好的抗肿瘤效果。其机制可能在于CpdA的使用往往会诱导GR降解,使细胞内GR水平降低,抑制CpdA的功能发挥。而硼替佐米则可以抑制蛋白酶体对GR的降解,从而增强CpdA的抗肿瘤功能[4]。与此同时,CpdA还具有雄激素拮抗剂的作用,在前列腺癌细胞中,它可以介导雄激素受体的核内转位但是抑制雄激素受体与DNA的绑定和转录活性[43]。然而,与前列腺癌细胞中观察到的不同之处在于,CpdA在膀胱癌中作为雄激素受体激动剂的效应很弱,并不能引起雄激素受体的核内转位[9]。在膀胱癌细胞中,CpdA不仅增加了膀胱癌细胞系TCCSUP和UMUC3的G1期停滞,同时还能够剂量依赖性地诱导TCCSUP和UMUC3系的凋亡。同时,体外和体内实验均证实CpdA可以减少膀胱癌细胞的侵袭和转移能力。检测荧光素酶的活性和GRE下游基因GILZ和FKBP51的表达结果发现,地塞米松可以引起GR信号通路的转录激活;相反地,CpdA则基本没有这种作用。在地塞米松/CpdA与NF-κB/AP-1相互作用的研究中发现,地塞米松和CpdA都可以抑制NF-κB或AP-1的转录活性。同时,NF-κB的下游基因MMP-2、MMP-9、IL-6、VEGF也受到明显抑制。通过免疫共沉淀结果表明,地塞米松和CpdA都可以介导GR和NF-κB相互作用[9]。
4 结语随着对GR信号通路研究的深入,人们越来越认识到,糖皮质激素本身对实体肿瘤也有一定的治疗意义。GR选择性激动剂的出现大大减少了糖皮质激素治疗过程中出现的不良反应,同时有更明确的抗肿瘤效应。GR信号通路介导的抗肿瘤效应的研究成果有可能为肿瘤的治疗带来新希望。
| [1] | CHALASANI V, CHIN J L, IZAWA J I. Histologic variants of urothelial bladder cancer and nonurothelial histology in bladder cancer[J]. Can Urol Assoc J, 2009, 3(6 Suppl 4): S193–S198. |
| [2] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1): 5–29. doi:10.3322/caac.21254 |
| [3] | SUN M, TRINH Q D. Diagnosis and staging of bladder cancer[J]. Hematol Oncol Clin North Am, 2015, 29(2): 205–218. doi:10.1016/j.hoc.2014.10.013 |
| [4] | LESOVAYA E, YEMELYANOV A, SWART A C, et al. Discovery of compound A-a selective activator of the glucocorticoid receptor with anti-inflammatory and anti-cancer activity[J]. Oncotarget, 2015, 6(31): 30730–30744. |
| [5] | SIONOV R V, SPOKOINI R, KFIR-ERENFELD S, et al. Chapter 6 Mechanisms regulating the susceptibility of hematopoietic malignancies to glucocorticoid-induced apoptosis[M]//Advances in cancer research (volume 101). New York:Academic Press, 2008:127-248. |
| [6] | BASCH E, PRESTRUD A A, HESKETH P J, et al. Antiemetics:American Society of Clinical Oncology clinical practice guideline update[J]. J Clin Oncol, 2011, 29(31): 4189–4198. doi:10.1200/JCO.2010.34.4614 |
| [7] | ZHENG Y, IZUMI K, LI Y, et al. Contrary regulation of bladder cancer cell proliferation and invasion by dexamethasone-mediated glucocorticoid receptor signals[J]. Mol Cancer Ther, 2012, 11(12): 2621–2632. doi:10.1158/1535-7163.MCT-12-0621 |
| [8] | ISHIGURO H, KAWAHARA T, ZHENG Y, et al. Differential regulation of bladder cancer growth by various glucocorticoids:corticosterone and prednisone inhibit cell invasion without promoting cell proliferation or reducing cisplatin cytotoxicity[J]. Cancer Chemother Pharmacol, 2014, 74(2): 249–255. doi:10.1007/s00280-014-2496-7 |
| [9] | ZHENG Y, ISHIGURO H, IDE H, et al. Compound A inhibits bladder cancer growth predominantly via glucocorticoid receptor transrepression[J]. Mol Endocrinol, 2015, 29(10): 1486–1497. doi:10.1210/me.2015-1128 |
| [10] | NICOLAIDES N C, CHARMANDARI E, CHROUSOS G P, et al. Recent advances in the molecular mechanisms determining tissue sensitivity to glucocorticoids:novel mutations, circadian rhythm and ligand-induced repression of the human glucocorticoid receptor[J]. BMC Endocr Disord, 2014, 14: 71. doi:10.1186/1472-6823-14-71 |
| [11] | ENCÍO I J, DETERA-WADLEIGH S D. The genomic structure of the human glucocorticoid receptor[J]. J Biol Chem, 1991, 266(11): 7182–7188. |
| [12] | ZHOU J, CIDLOWSKI J A. The human glucocorticoid receptor:one gene, multiple proteins and diverse responses[J]. Steroids, 2005, 70(5-7): 407–417. doi:10.1016/j.steroids.2005.02.006 |
| [13] | MCBETH L, GRABNAR M, SELMAN S, et al. Involvement of the androgen and glucocorticoid receptors in bladder cancer[J]. Int J Endocrinol, 2015, 2015: 384860. |
| [14] | MCBETH L, NWANERI A C, GRABNAR M, et al. Glucocorticoid receptor beta increases migration of human bladder cancer cells[J]. Oncotarget, 2016, 7(19): 27313–27324. |
| [15] | GIGUÉRE V, HOLLENBERG S M, ROSENFELD M G, et al. Functional domains of the human glucocorticoid receptor[J]. Cell, 1986, 46(5): 645–652. doi:10.1016/0092-8674(86)90339-9 |
| [16] | DAVIES T H, NING Y M, SÁNCHEZ E R. A new first step in activation of steroid receptors:hormone-induced switching of FKBP51 and FKBP52 immunophilins[J]. J Biol Chem, 2002, 277(7): 4597–4600. doi:10.1074/jbc.C100531200 |
| [17] | PRATT W B, GALIGNIANA M D, MORISHIMA Y, et al. Role of molecular chaperones in steroid receptor action[J]. Essays Biochem, 2004, 40: 41–58. doi:10.1042/bse0400041 |
| [18] | GRAD I, PICARD D. The glucocorticoid responses are shaped by molecular chaperones[J]. Mol Cell Endocrinol, 2007, 275(1-2): 2–12. doi:10.1016/j.mce.2007.05.018 |
| [19] | SMOAK K A, CIDLOWSKI J A. Mechanisms of glucocorticoid receptor signaling during inflammation[J]. Mech Ageing Dev, 2004, 125(10-11): 697–706. doi:10.1016/j.mad.2004.06.010 |
| [20] | AUPHAN N, DIDONATO J A, ROSETTE C, et al. Immunosuppression by glucocorticoids:inhibition of NF-kappa B activity through induction of I kappa B synthesis[J]. Science, 1995, 270(5234): 286–290. doi:10.1126/science.270.5234.286 |
| [21] | AYROLDI E, RICCARDI C. Glucocorticoid-induced leucine zipper (GILZ):a new important mediator of glucocorticoid action[J]. FASEB J, 2009, 23(11): 3649–3658. doi:10.1096/fj.09-134684 |
| [22] | LESOVAYA E A, YEMELYANOV A Y, KIRSANOV K I, et al. Antitumor effect of non-steroid glucocorticoid receptor ligand CpdA on leukemia cell lines CEM and K562[J]. Biochemistry (Mosc), 2011, 76(11): 1242–1252. doi:10.1134/S000629791111006X |
| [23] | MCKAY L I, CIDLOWSKI J A. Molecular control of immune/inflammatory responses:interactions between nuclear factor-kappa B and steroid receptor-signaling pathways[J]. Endocr Rev, 1999, 20(4): 435–459. |
| [24] | NOVAC N, BAUS D, DOSTERT A, et al. Competition between glucocorticoid receptor and NFkappaB for control of the human FasL promoter[J]. FASEB J, 2006, 20(8): 1074–1081. doi:10.1096/fj.05-5457com |
| [25] | DE BOSSCHER K, BECK I M, DEJAGER L, et al. Selective modulation of the glucocorticoid receptor can distinguish between transrepression of NF-κB and AP-1[J]. Cell Mol Life Sci, 2014, 71(1): 143–163. doi:10.1007/s00018-013-1367-4 |
| [26] | JAFFUEL D, ROUMESTAN C, BALAGUER P, et al. Correlation between different gene expression assays designed to measure trans-activation potencies of systemic glucocorticoids[J]. Steroids, 2001, 66(7): 597–604. doi:10.1016/S0039-128X(00)00235-X |
| [27] | WANG X L, HERZOG B, WALTNER-LAW M, et al. The synergistic effect of dexamethasone and all-trans-retinoic acid on hepatic phosphoenolpyruvate carboxykinase gene expression involves the coactivator p300[J]. J Biol Chem, 2004, 279(33): 34191–34200. doi:10.1074/jbc.M403455200 |
| [28] | ABBINANTE-NISSEN J M, SIMPSON L G, LEIKAUF G D. Corticosteroids increase secretory leukocyte protease inhibitor transcript levels in airway epithelial cells[J]. Am J Physiol, 1995, 268(4 Pt 1): L601–L606. |
| [29] | EHRCHEN J, STEINMVLLER L, BARCZYK K, et al. Glucocorticoids induce differentiation of a specifically activated, anti-inflammatory subtype of human monocytes[J]. Blood, 2007, 109(3): 1265–1274. |
| [30] | ISHIGURO H, KAWAHARA T, ZHENG Y, et al. Reduced glucocorticoid receptor expression predicts bladder tumor recurrence and progression[J]. Am J Clin Pathol, 2014, 142(2): 157–164. doi:10.1309/AJCPU8UCEZYG4WTV |
| [31] | NISHIMURA K, NONOMURA N, SATOH E, et al. Potential mechanism for the effects of dexamethasone on growth of androgen-independent prostate cancer[J]. J Natl Cancer Inst, 2001, 93(22): 1739–1746. doi:10.1093/jnci/93.22.1739 |
| [32] | SCHLOSSMACHER G, STEVENS A, WHITE A. Glucocorticoid receptor-mediated apoptosis:mechanisms of resistance in cancer cells[J]. J Endocrinol, 2011, 211(1): 17–25. doi:10.1530/JOE-11-0135 |
| [33] | AZIZ M H, SHEN H, MAKI C G. Glucocorticoid receptor activation inhibits p53-induced apoptosis of MCF10Amyc cells via induction of protein kinase Cε[J]. J Biol Chem, 2012, 287(35): 29825–29836. doi:10.1074/jbc.M112.393256 |
| [34] | GASCOYNE D M, KYPTA R M, MD V. Glucocorticoids inhibit apoptosis during fibrosarcoma development by transcriptionally activating Bcl-xL[J]. J Biol Chem, 2003, 278(20): 18022–18029. doi:10.1074/jbc.M301812200 |
| [35] | HATFIELD K J, REIKVAM H, BRUSERUD Ø. The crosstalk between the matrix metalloprotease system and the chemokine network in acute myeloid leukemia[J]. Curr Med Chem, 2010, 17(36): 4448–4461. doi:10.2174/092986710794183033 |
| [36] | HE G, KARIN M. NF-κB and STAT3-key players in liver inflammation and cancer[J]. Cell Res, 2011, 21(1): 159–168. doi:10.1038/cr.2010.183 |
| [37] | LING J, KUMAR R. Crosstalk between NF-κB and glucocorticoid signaling:a potential target of breast cancer therapy[J]. Cancer Lett, 2012, 322(2): 119–126. doi:10.1016/j.canlet.2012.02.033 |
| [38] | GHOSH S, KARIN M. Missing pieces in the NF-kappaB puzzle[J]. Cell, 2002, 109(Suppl): S81–S96. |
| [39] | YEMELYANOV A, CZWORNOG J, GERA L, et al. Novel steroid receptor phyto-modulator compound a inhibits growth and survival of prostate cancer cells[J]. Cancer Res, 2008, 68(12): 4763–4773. doi:10.1158/0008-5472.CAN-07-6104 |
| [40] | LESOVAYA E, YEMELYANOV A, KIRSANOV K, et al. Combination of a selective activator of the glucocorticoid receptor compound A with a proteasome inhibitor as a novel strategy for chemotherapy of hematologic malignancies[J]. Cell Cycle, 2013, 12(1): 133–144. doi:10.4161/cc.23048 |
| [41] | ZHANG L, INSEL P A. Bcl-2 protects lymphoma cells from apoptosis but not growth arrest promoted by cAMP and dexamethasone[J]. Am J Physiol Cell Physiol, 2001, 281(5): C1642–C1647. |
| [42] | MELHEM A, YAMADA S D, FLEMING G F, et al. Administration of glucocorticoids to ovarian cancer patients is associated with expression of the anti-apoptotic genes SGK1 and MKP1/DUSP1 in ovarian tissues[J]. Clin Cancer Res, 2009, 15(9): 3196–3204. doi:10.1158/1078-0432.CCR-08-2131 |
| [43] | YEMELYANOV A, BHALLA P, YANG X, et al. Differential targeting of androgen and glucocorticoid receptors induces ER stress and apoptosis in prostate cancer cells:a novel therapeutic modality[J]. Cell Cycle, 2012, 11(2): 395–406. doi:10.4161/cc.11.2.18945 |




