高能量损伤所致的股骨干粉碎性骨折术后易发生感染,清创后常合并不同程度的骨缺损,治疗上需解决感染控制及骨缺损修复两方面问题,临床处理非常棘手,易导致感染性骨不连。2012至2015年,兰州军区兰州总医院对8例股骨创伤术后骨髓炎患者,彻底清创后Ⅰ期采用非接触锁定钢板固定骨折端,同时应用自体颗粒状松质骨植骨填充骨缺损,取得良好的临床疗效。
1 临床资料 1.1 一般资料2012年7月至2015年7月兰州军区兰州总医院共收治股骨创伤术后骨髓炎患者8例,其中男性5例、女性3例;年龄21~60 岁,平均(38±16) 岁。8例患者中,交通伤7例,重物砸伤1例,均为闭合性骨折。6例于3~7 d后出现感染,其中2例属低毒性感染,无明显红肿及窦道形成,临床主要表现为局部轻度疼痛及肿胀,X线摄片显示为骨不连及死骨形成,再次手术发现骨折端周围有明显的脓液及炎性肉芽组织。所有患者均为外院手术后转来我院,之前手术1~4次。患者术中测量骨缺损长度为2~4 cm。
1.2 术前准备入院后有窦道形成者,术前常规作局部分泌物细菌培养及药敏试验。细菌培养结果显示,甲氧西林耐药金黄色葡萄球菌感染3例、甲氧西林敏感金黄色葡萄球菌感染2例、表皮葡萄球菌感染1例、铜绿假单胞菌感染1例、肠杆菌感染1例。X线摄片检查了解骨折、内固定的类型及骨缺损的长度。术前MRI检查判断骨感染的范围。术前未予抗菌药物治疗。
1.3 手术治疗持续硬膜外麻醉或全身麻醉。患者取仰卧位,常规消毒铺单,避开窦道,近病灶部位沿原切口进入,直达骨表面,取出全部内固定物,彻底清创,切除窦道,去除死骨,刮除髓腔内外炎性肉芽组织。钢板内固定者,清除钢板周围的坏死组织和残留的纤维结缔组织,螺丝钉道作扩大清创。髓内针固定者,需用髓腔扩大器将髓腔扩大清创2~4 mm。取脓液、炎性肉芽组织或死骨作细菌培养。打通髓腔,咬除骨折断端部分骨质,直至骨面毛糙,有点状出血。清创范围较MRI显示病灶大1~2 cm。用等渗氯化钠溶液、稀释的双氧水反复冲洗创面,0.05%碘伏浸泡伤口5 min。其后再用脉冲冲洗系统冲洗伤口。更换手术器械、手套及手术衣。根据骨缺损大小,于髂骨处切取不带皮质骨自体松质骨,剪成0.5 cm×0.5 cm×0.5 cm大小备用。将骨折远端对近端,避免成角及旋转,维持肢体长度,锁定钢板置于皮下、股外侧肌的外侧,一一钻孔并旋入螺丝钉固定。锁定钢板宜长,近远端至少3~4枚螺丝钉,6~8层皮质,部分骨质疏松患者可适当增加螺丝钉数。靠近骨折端螺丝钉以远离骨端3 cm为好。将所取松质骨植于骨折端之间及周围。病灶处放置一根负压引流管,分层关闭切口。透视确定骨折及内固定位置良好,结束手术。
1.4 术后处理8例患者均顺利完成手术,手术时间为120~150 min,平均(130±10) min。术中出血量为350~800 mL,平均(600±186) mL。术后根据药敏试验结果常规静脉给予抗菌药物2周,后改口服抗菌药物4周。鼓励患者床上行功能锻炼,1周内避免下床,以防所植松质骨移位。注意避免负压引流管堵塞,24 h连续引流量小于5 mL考虑拔除引流管。引流时间为8 d左右。
1.5 随访及转归8例患者随访12~48个月,平均(19±7) 个月。其中7例获得骨愈合,愈合时间为12~25周,平均(16±5) 周;1例感染复发,术后1周切口出现红肿,有脓性分泌物流出,再次清创后改行骨搬移术。所有患者均未发生钢板及螺丝钉断裂、松动。典型病例手术前后X线摄片见图 1。
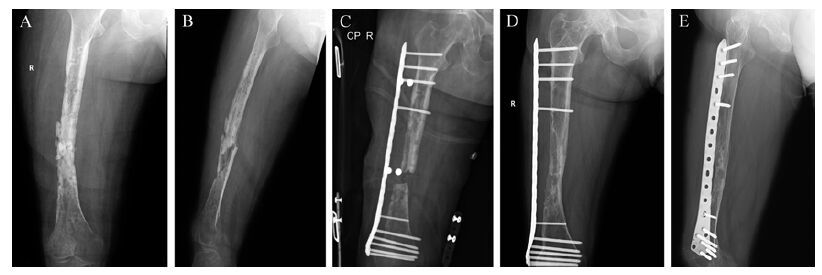
|
| A、B:术前股骨正、侧位片显示骨不连及死骨形成;C:非接触钢板技术治疗后正位片显示骨缺损2 cm;D、E:术后48个月正、侧位片显示骨折完全愈合. 图 1 一例60岁女性右股骨干骨折术后感染性骨不连和死骨形成患者手术前后X线摄片 Fig. 1 X-ray examination of a patient with postoperative infected nonunion and sequestrum before and after treatment |
四肢长骨干创伤后一旦并发感染,局部骨质吸收、坏死,常合并皮肤与骨骼缺损,单纯应用抗菌药物无法解决,常需要手术治疗。外科治疗首先面对的问题是如何彻底清创控制感染。对于创伤后或术后骨髓炎,治疗原则是尽可能彻底清创,清除炎性肉芽组织、窦道和内固定钉道,切除死骨及不可能重建血供的缺血硬化骨,消灭死腔,改善局部血液循环,为愈合创造条件[1-2]。骨髓炎清创需要注意以下几点: ①软组织腔壁在前述彻底清创的基础上,再采用锐性“卷地毯式”切除2 mm左右。②对于内固定物取除后的钉道,需要予以超扩。髓内针固定后出现的感染常涉及全骨干,彻底清除髓腔内炎性肉芽组织是成功治疗全骨干骨髓炎的关键。取出髓内针后,因髓腔壁内层有松质骨覆盖,肉芽组织附着并嵌入其缝隙中,故清创后需采用磨钻或髓腔扩大器继续超扩髓腔2~4 mm。螺丝钉取出后的钉道也常会有炎性肉芽组织粘附其中,需用刮匙或大号的钻头扩大钉道。③缺血硬化骨的彻底切除。因机体免疫力及抗菌药物无法到达,缺血硬化骨成为细菌生长繁殖的“基地”,是清创术后骨髓炎复发的重要原因。因此,骨髓炎的清创必须彻底切除缺血硬化骨,直至所有的骨端及骨腔壁均有良好的点状渗血为止。
2.2 骨髓炎清创后Ⅰ期松质骨植骨的可行性骨髓炎清创后常出现不同程度的骨缺损,目前公认的治疗方案是清创后3~6个月Ⅱ期自体松质骨移植重建骨缺损[3-4]。这种方式的缺点是需多次手术,增加了患者的痛苦及治疗费用,治疗周期长。另外,感染是否根治,临床尚难以确定,故清创后何时行Ⅱ期植骨相对安全尚无确定的时间,部分患者半年后植骨依然有感染复发的风险。骨髓炎清创后Ⅰ期带血管骨移植因血供良好,抗感染能力强,骨愈合过程类似骨折[5],患者预后良好;其不足之处在于手术操作复杂,创伤大、手术时间长,同时受制于受区的血管条件,临床应用受限。
清创后Ⅰ期植骨属带菌植骨,需要植入骨能尽快重建血运,避免成为死骨致感染复发。这一方面要求病灶清除彻底,另一方面需要抗菌药物和机体免疫力能够确保杀灭残留细菌。自体松质骨来源有限,Ⅰ期松质骨移植术后炎症复发,势必会造成不必要的浪费。有学者认为直径小于5 mm的松质骨颗粒表面的成骨细胞可从其周围的组织液中获得营养,加上松质骨骨结构的特点,新生血管易长入骨组织得以成活;植入的自体松质骨在7 d时可完全再血管化[6]。陆维举等[7]报道38例骨髓炎清创后Ⅰ期颗粒状自体松质骨植骨治疗感染性骨不连,结果33例获得骨愈合、感染控制,一次手术成功率达86.8%。喻胜鹏等[4]报道18例胫骨骨髓炎患者,Ⅰ期颗粒状自体松质骨移植,其中15例获得骨愈合,骨愈合率为83.8%,3例感染复发。本文资料8例股骨创伤后骨髓炎,清创后采用锁定钢板非接触钢板技术固定骨折端,切取不带皮质髂骨松质骨,剪成约0.5 cm×0.5 cm×0.5 cm的颗粒,植在血运良好的骨缺损部位、骨不连端四周,7例骨愈合良好,成功率与上述报道相近。
因此,只要清创彻底,所有骨面均有良好的渗血,在敏感抗菌药物的辅助下,行Ⅰ期松质骨植骨是安全的,临床效果与分期手术相近[8]。
2.3 非接触钢板技术的优势、不足和技术操作要点无论是非感染性还是感染性骨不连,获得良好骨愈合的前提是可靠的固定。在局部感染的情况下,因钢板或髓内针易被细菌附着,导致感染无法控制,故不适用于感染性骨不连的固定。而外固定架应用至今,因其在病灶区域外固定穿针,对病灶的血运干扰小,并且不会在病灶区留下异物而增加感染的机会,几乎成为复杂开放粉碎性骨折及术后感染的首选办法[4, 9]。但外固定架本身也存在较多的局限性,如体积大、笨重,佩戴极不舒适,阻碍个人卫生,冬季穿衣穿裤困难,给患者日常生活带来诸多不便,还严重影响对侧肢体;此外,外固定架的应用易发生针道感染,稳定性较差,二期固定丢失、骨折不愈合的概率较高,故多作为临时固定,患者往往需二期改行内固定术[10]。另外,对于骨质疏松患者来说,普通外固定不能提供足够的把持力,易因螺钉松动导致骨折再移位。
为避免以上不足,已有专家探讨将锁定钢板作为外固定架使用。锁定钢板通过锁定螺钉的螺帽与钢板咬合形成稳定结构,固定骨折的原理是依赖于钢板与锁定螺钉的角稳定性及螺钉与骨皮质之间的把持力。这种固定方式类似于外固定架的固定方式,被称为“内置的外固定架”。其在刚度、稳定性、弯曲度上均优于外固定架,从生物力学方面完全可以满足外固定治疗的使用需求[11]。1984年Marti和Besselaar[12]报道将AO钢板用作外固定架治疗开放性骨折、感染性骨不连等。随着锁定钢板技术的出现,Apivatthakakul和Sananpanich等[13]报道将锁定钢板外置用作外固定架治疗胫骨开放性骨折。国内史天林等[14]将锁定加压钢板外置应用于软组织条件较差的胫腓骨骨折治疗,获得良好效果。本文资料8例股骨创伤后骨髓炎患者清创后采用锁定钢板非接触钢板技术固定骨折端,结合颗粒状松质骨植骨,7例取得了满意的效果。
非接触钢板技术具有以下优点:①安装操作简单;②彻底克服了外固定支架给患者生活带来的不便,患者容易接受;③避免了针眼感染的并发症;④固定可靠(本文资料无一例发生钢板及螺丝钉断裂、松动及固定失败);⑤无需像外固定架一样跨关节固定,减少了对关节功能的影响;不足在于从股外侧肌穿针致肌肉固定或损伤,会导致不同程度的膝关节功能障碍。操作时需注意以下几点:①钢板需置于大腿外侧皮下,股外侧肌的外侧。②固定股骨骨折的过程中因股外侧肌的遮挡,无法充分看清骨折对位情况并维持对位,故要求固定前将骨折端先行良好复位,克氏针临时固定。③锁定螺钉的单向轨迹特性决定了置入2个或2个以上螺钉后钢板位置即无法改变,一旦螺钉置入不佳,无法弥补。一般将钢板置好后,先拧入近、远端各一枚螺丝钉,透视下确认骨折对位良好,钢板位置正确后,再拧入其它螺丝钉。④钢板宜长。简单骨折,钢板跨度应高于8~10;对于粉碎性骨折,这一比值应超过2~3,螺钉密度应为0.4~0.5,两端至少各使用4枚螺钉固定,以分散钢板承受的应力[11]。
综上所述,对于股骨创伤后的骨髓炎,清创后应用锁定钢板非接触钢板技术固定骨折端,为骨折感染性疾病提供了一种外固定架以外的替代方法,避免了外固定架给患者生活带来的不便,患者更易于接受。经临床初步应用证实该项技术是可行的。本研究不足之处是病例数量有限,且缺乏随机对照研究。下一步需进一步积累病例,并进行相关生物力学方面的深入研究,以期为Ⅰ期植骨联合非接触钢板技术治疗感染性骨缺损提供充分的理论依据。
| [1] | 陆维举, 钱宏波, 李斌, 等. 清创后Ⅰ期改良开放式松质骨移植治疗慢性骨髓炎[J]. 中华创伤杂志, 2004, 20(5): 126–129. LU Weiju, QIAN Hongbo, LI Bin, et al. Treatment of chronic osteomyelitis by modifiedⅠ-stage open cancellous bone grafting post debridement[J]. Chinese Journal of Trauma, 2004, 20(5): 126–129. (in Chinese) |
| [2] | LAXXARINI L, DE LALLAl F, MADER J T. Long bone osteomyelitis[J]. Curr Infect Dis Rep, 2002, 4: 439–445. doi:10.1007/s11908-002-0012-4 |
| [3] | SCHUSTER J M, AVELLINO A M, MANN F A, et al. Use of structural allografts in spinal osteomyelitis:a review of 47 cases[J]. J Neurosurg, 2000, 93(1 Suppl): 8–14. |
| [4] | 喻胜鹏, 杨子洋, 傅景曙, 等. Ⅰ期自体松质骨移植修复胫骨创伤后骨髓炎骨缺损的临床研究[J]. 第三军医大学学报, 2012, 36(7): 700–703. YU Shengpeng, YANG Ziyang, FU Jingshu, et al. Single stage treatment of tibial post-traumatic osteomyelitis bone defects with auto-logous cancellous bone grafting[J]. Acta Academiae Medicinae Militaris Tertiae, 2012, 36(7): 700–703. (in Chinese) |
| [5] | 刘兴炎, 葛宝丰, 甄平, 等. 采用带血管腓骨移植一期修复慢性骨髓炎大段骨缺损[J]. 中华显微外科杂志, 2000, 23(3): 165–167. LIU Xingyan, GE Baofeng, ZHEN Ping, et al. The repairation of long bone defect after getting rid of free bone in chronic osteomylitis pations with vascularized fibula graft[J]. Chinese Journal of Microsurgery, 2000, 23(3): 165–167. (in Chinese) |
| [6] | 刘德全, 张伯松, 刘洪波, 等. 一期开放松质骨植骨治疗感染性骨缺损的实验研究[J]. 中华创伤骨科杂志, 2014, 6(12): 1370–1373. LIU Dequan, ZHANG Bosong, LIU Hongbo, et al. Experimental observation of open cancellous bone graft in treatment of infected fracture nonunion[J]. Chinese Journal of Orthopaedic Trauma, 2014, 6(12): 1370–1373. (in Chinese) |
| [7] | 陆维举, 李斌, 钱宏波, 等. 清创后Ⅰ期颗粒状自体松质骨移植治疗感染性骨不连[J]. 中华医学杂志, 2010, 90(23): 1609–1611. LU Weiju, LI Bin, QIAN Hongbo, et al. One-stage management of infected of infected nonunion using granulated cancellous bone autografting after debridement[J]. National Medical Journal of China, 2010, 90(23): 1609–1611. (in Chinese) |
| [8] | CIERNY G 3rd. Infected tibial nonunions (1981-1995). The evolution of change[J]. Clin Orthop Relat Res, 1999(360): 97–105. |
| [9] | 张宇鹏, 杨润功, 朱加亮, 等. 胫后动脉穿支皮瓣结合比目鱼肌肌瓣治疗胫骨干内固定术后感染[J]. 中华创伤骨科杂志, 2012, 14(6): 488–492. ZHANG Yupeng, YANG Rungong, ZHU Jialiang, et al. Posterior tibial artery perforator flap plus soleus muscular flap for treatment of postoperative infectious bone and soft-tissue defects following internal fixation of tibial shaft fractures[J]. Chinese Journal of Orthopaedic Trauma, 2012, 14(6): 488–492. (in Chinese) |
| [10] | 陈卫, 丁真奇, 练克俭, 等. 锁定钢板外置治疗胫骨骨折内固定术后感染12例[J]. 中国中医骨伤科杂志, 2014, 22(3): 57–58. CHEN Wei, DING Zhenqi, LIAN Kejian, et al. Locking plate external fixation treatment of tibia fracture postoperative infection in 12 cases[J]. Chinese Journal of Traditional Medical Traumatology & Orthopedics, 2014, 22(3): 57–58. (in Chinese) |
| [11] | 李乔, 谭进红, 马小明, 等. 锁定钢板外置与外固定支架固定骨折的生物力学研究[J]. 组织工程与重建外科杂志, 2015, 11(5): 320–322. LI Qiao, TAN Jinhong, MA Xiaoming, et al. Biomechanical research on the fixation of fractures by external locking plate and external fixator[J]. Journal of Tissue Engineering and Reconstructive Surgery, 2015, 11(5): 320–322. (in Chinese) |
| [12] | MARTI R K, BESSELAAR P P. Die anwendung der AO-plate als fixateur externe[J]. Z Orthop, 1984, 122(2): 225–232. doi:10.1055/s-2008-1044613 |
| [13] | APIVATTHAKAKUL T, SANANPANICH K. The locking compression plate as an external fixator for bone transport in the treatment of a large distal tibial defect:a case report[J]. Injury, 2007, 38(11): 1318–1325. doi:10.1016/j.injury.2007.05.005 |
| [14] | 史天林, 高占良, 宋小龙. 锁定加压钢板外置在胫腓骨骨折治疗中的应用[J]. 中国骨与关节损伤杂志, 2014, 29(6): 33–34. SHI Tianlin, GAO Zhanliang, SONG Xiaolong. External locking compression plate in treatment of tibia and fibula fracture[J]. Chinese Journal of Bone and Joint Injury, 2014, 29(6): 33–34. (in Chinese) |



