2. 贵州医科大学组织工程与干细胞实验中心, 贵州 贵阳 550004;
3. 贵州医科大学临床医学研究中心, 贵州 贵阳 550004;
4. 贵州医科大学儿童医学中心, 贵州 贵阳 550004;
5. 贵州医科大学实验动物中心, 贵州 贵阳 550004
2. Tissue Engineering and Stem Cell Research Center, Guizhou Medical University, Guiyang 550004, China;
3. Clinical Medical Research Center, Guizhou Medical University, Guiyang 550004, China;
4. Children Medical Center, Guizhou Medical University, Guiyang 550004, China;
5. Laboratory Animal Center, Guizhou Medical University, Guiyang 550004, China
A型核纤层蛋白是位于染色质和细胞内层核膜之间的细丝状蛋白,能够维持细胞核的机械性能,保持核形态,为周围的异染色质提供分子锚定位点[1-2]。lmna基因异常在人类主要引起间充质干细胞来源的组织疾病[3-4],包括脂肪组织[5]、肌肉组织[6]、皮肤组织[7]等。此外,有研究表明,在乳腺癌中有A型核纤层蛋白的表达下降[8];而神经母细胞瘤中A型核纤层蛋白的下调会引发肿瘤启动细胞的扩张[9],提示A型核纤层蛋白表达异常与肿瘤的发生密切相关。还有研究表明,A型核纤层蛋白可加强T淋巴细胞的免疫应答,在免疫细胞的活化和功能中发挥重要作用[2, 10];另外,lmna(-/-)的小鼠存在严重的淋巴细胞发育缺陷[11],说明lmna基因及其编码的A型核纤层蛋白与造血干细胞发育有关。目前有研究提示,lmna基因缺陷可能导致白血病发生,lmna基因参与造血系统的发育和调控[12]。但既往未见lmna基因对造血系统调控作用的报道,故其导致白血病发病的具体机制仍不清楚。
本实验选用在造血干细胞发育研究方面具有优势的新型模式生物斑马鱼作为研究对象[13],采用吗啉代反义寡核苷酸(phosphorodi-amidate morpholino oligomer,PMO)技术下调斑马鱼lmna基因表达水平,研究lmna基因下调对斑马鱼早期造血干细胞发育——髓系和红系造血干细胞的影响,为进一步研究核纤层蛋白对造血干细胞发育的影响做好基础工作。
1 材料与方法 1.1 试剂与仪器吗啉代反义寡核苷酸(美国Gene tools公司);总RNA提取试剂、地高辛标记的RNA混合物、mirVanaTM PARISTM试剂盒(美国Ambion公司);高保真性聚合酶、DNA纯化试剂盒、Tris平衡酚(日本东洋纺生物科技有限公司);第一链cDNA合成试剂盒,限制性核酸内切酶BamHⅠ、XbaⅡ(美国Thermo Fisher Scientific公司);质粒DNA小量试剂盒(美国Axygen公司);iQTM SYBR Green 超混液、实时荧光定量PCR仪、凝胶成像系统(美国Bio-Rad公司);PCR仪、低温离心机(德国艾本德股份公司);体视显微镜(日本尼康公司);杂交炉(美国思博明科学器材公司);生化培养箱(上海一恒科学仪器有限公司)。
1.2 实验动物、菌株及质粒斑马鱼为本实验室饲养繁殖的野生型图宾根。根据文献[14]方法养殖,以12 h/12 h的光照和黑暗比例与成年雌雄斑马鱼分开饲养。大肠杆菌(E.coli) DH5α、pu.1-pCS2+和gata1-pBSK质粒由本课题组保存。
1.3 实验分组及胚胎收集和处理实验前一天雌性和雄性斑马鱼以1:2或1:1的比例放入产卵缸中,用隔板将雌雄斑马鱼分开,第二天早上将隔板取出,待雌雄斑马鱼追逐30 min后收集胚胎进行显微注射。实验组:显微注射lmna基因mRNA的吗啉代反义寡核苷酸(5′-GTTGTCTGGAACTACTGATACTGGT-3′)的斑马鱼胚胎;对照组:显微注射无意义的吗啉代寡核苷酸(5′-CCTCTTACCTCAGTTACAATTTATA-3′)的斑马鱼胚胎,显微注射后细渔网收集受精卵将受精卵放入消毒的一次性培养皿中,并使用配制完成的斑马鱼胚胎养殖水洗净,于28 ℃恒温培养箱中培育。待胚胎发育至受精后18、24、30、36 hpf时(胚胎发育分期依据Kimmel等[15]所描述),细渔网收集两组胚胎。在实时荧光定量PCR实验中,斑马鱼胚胎养殖水中不用添加2-苯基硫,收集胚胎TRIzol后保存。在原位杂交试验中,胚胎发育至18 hpf后,斑马鱼胚胎养殖水中需添加2-苯基硫脲以抑制色素形成,收集胚胎后,用4%多聚甲醛固定液进行固定。
1.4 实时荧光定量PCR检测pu.1和gata1基因表达分别收集实验组和对照组18、24、30、36 hpf时相的斑马鱼胚胎置于1.5 mL EP管中,100个/管,加入1 mL TRIzol吹吸成匀浆状。4 ℃,13 400×g离心10 min,将上清液吸入1.5 mL EP管中,室温放置5 min。经氯仿、异丙醇、75%的无水乙醇沉淀晾干后,加入适量DEPC水溶解RNA。将提取的总RNA用第一链cDNA合成试剂盒试剂在PCR仪中逆转录合成cDNA。反应结束后,用DEPC水三倍稀释。按照iQTM SYBR Green 超混液说明制备反应体系,用实时荧光定量PCR仪进行扩增,扩增条件为94 ℃ 30 s,94 ℃ 5 s,58.3 ℃ 30 s,40个循环。熔解曲线分析:每5 s升高0.5 ℃,从60 ℃升高到95 ℃。以β-actin、GAPDH作为内参基因,对pu.1和gata1基因进行相对定量分析。引物根据斑马鱼pu.1、gata1基因的mRNA序列(表 1) ,经Primer Premier 6.0软件设计,并由北京奥维森基因科技有限公司合成。基因相对表达量采用2-ΔΔCt值计算。
| 基因名称 | 序列号 | 引物序列(5′-3′) | 扩增产物长度(bp) |
| pu.1 | NM_198062 | 正向:CGATGAGGAGTGTATGAGAG 反向:CAGAAGGTCAAGCAGGAA | 100 |
| gata1 | NM_131234 | 正向:TTAACTACACAACAGACTC 反向:GAATAATACGATGGCAGTA | 97 |
| β-actin | NM_703909 | 正向:ATGCCCCTCGTGCTGTTTT 反向:TCTGTCCATGCCAACCAT | 87 |
| GAPDH | NM_001115114 | 正向:ACCCGTGCTGCTTTCTTGAC 反向:GACCAGTTTGCCGCCTTCT | 91 |
将pu.1-pCS2+重组质粒用BamHI,gata1-pBSK重组质粒用XbalI进行单酶切。条件为37 ℃温箱,酶切2~16 h。经10 g/L琼脂糖凝胶电泳鉴定后割胶回收得到线性化的pu.1-pCS2+、gata1-pBSK探针重组质粒。利用T3/T7 RNA体外转录体系以线性化的pu.1-pCS2+、gata1-pBSK探针重组质粒DNA为模板,以地高辛标记的脱氧核糖核苷三磷酸(dNTP)为原料转录得到地高辛标记的pu.1、gata1 反义mRNA探针后,用NucAway Spin Columns纯化柱收集RNA,取1 μL纯化的RNA用于电泳检测产物质量,定量,分装,-70 ℃保存待用。
1.6 原位杂交实验检测pu.1和gata1的表达选取各实验组及对照组18、24、30、36 hpf四个时相的斑马鱼胚胎进行原位杂交。使用4%多聚甲醛固定液固定各时相胚胎,再用100%甲醇脱水4 h以上。1×磷酸盐吐温缓冲液洗净胚胎后再将其置于65 ℃杂交炉中,用Hybe-杂交液预杂交1 h后,加入制备好的地高辛标记的pu.1、gata1 反义mRNA探针于65 ℃杂交炉中过夜。用不同浓度的标准柠檬酸盐溶液将多余的探针洗去,而后加入地高辛抗体过夜。用加吐温的马来酸缓冲液将多余的抗体洗掉,加入5-溴-4-氯-3-吲哚—磷酸盐/四唑氮蓝碱性磷酸酶染液对杂交胚胎进行染色,在体视显微镜下观察并记录结果后,用固定液对杂交胚胎进行再固定并拍照。
1.7 统计学方法采用SPSS 17.0软件进行统计学分析。计量资料首先进行正态性检验,样本呈正态分布时,采用均数±标准差(x±s)表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果 2.1 两组pu.1和gata1 mRNA表达水平比较实验组18、24、30、36 hpf 四个时相斑马鱼胚胎的pu.1和gata1 mRNA表达水平比对照组低,差异有统计学意义(均P<0.05) ,见表 2和表 3。提示lmna基因的下调影响了斑马鱼胚胎髓系和红系造血干细胞发育相关的转录调控因子pu.1和gata1基因的表达。
| (x±s) | |||||
| 组别 | 18 hpf | 24 hpf | 30 hpf | 36 hpf | |
| 实验组 | 0.41±0.22* | 0.48±0.13* | 0.35±0.10* | 0.26±0.12* | |
| 对照组 | 1.00±0.00 | 1.25±0.21 | 1.24±0.30 | 1.24±0.22 | |
| 与对照组比较,*P<0.05. | |||||
| (x±s) | |||||
| 组别 | 18 hpf | 24 hpf | 30 hpf | 36 hpf | |
| 实验组 | 0.21±0.05* | 0.47±0.10* | 0.34±0.10* | 0.23±0.06* | |
| 对照组 | 1.00±0.00 | 1.04±0.15 | 0.88±0.17 | 0.68±0.14 | |
| 与对照组比较,*P<0.05. | |||||
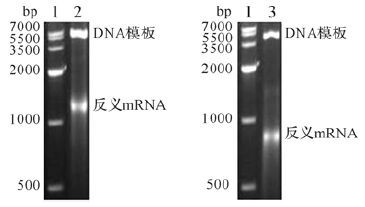
斑马鱼pu.1、gata1基因mRNA的反义探针制备良好,降解少,符合斑马鱼全胚胎原位杂交所需探针要求,见图 1。
|
| 1:marker Ⅳ;2:pu.1 反义 mRNA;3:gata1 反义 mRNA. 图 1 转录因子pu.1和gata1的反义mRNA电泳图 Fig. 1 Electrophoresis results that reverse mRNA of transcription factor pu.1 and gata1 |
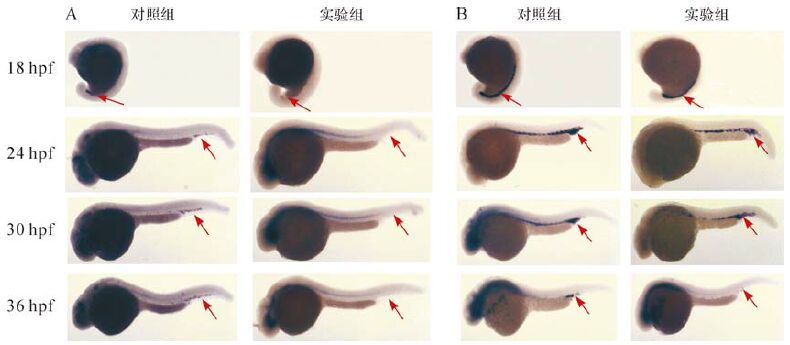
pu.1 在两组18 hpf时均有表达,在 24、30、36 hpf时实验组蓝黑色阳性杂交信号不明显,对照组表达持续减弱,但仍有表达(图 2A,红色箭头)。gata1在两组18、24、30、36 hpf四个时相的斑马鱼胚胎中均可见蓝黑色阳性杂交信号,24 hpf后随着时间的增加,对照组蓝黑色阳性杂交信号强弱基本不变,而实验组蓝黑色阳性杂交信号逐渐减弱,但对照组各时相胚胎蓝黑色阳性杂交信号均较实验组蓝黑色阳性杂交信号强(图 2B,红色箭头)。提示lmna基因下调影响了不同时相的斑马鱼胚胎髓系和红系造血干细胞发育相关的转录调控因子pu.1和gata1的表达。
|
| A:pu.1 基因原位杂交结果; B:gata1基因原位杂交结果. 红色箭头所示为蓝黑色杂交信号. 图 2 不同时相的斑马鱼胚胎pu.1、gata1基因全胚胎原位杂交结果 Fig. 2 Whole embryo in situ hybridization of pu.1 and gata1 at different time phases of zebrafish embryos |
本实验使用新型模式生物斑马鱼为研究对象,其优势在于成鱼体型较小(体长为4 cm),胚胎透明且体外发育,易于活体观察;此外,斑马鱼生长发育快,生殖周期短,繁殖能力强且易饲养;更重要的是,测序证实斑马鱼的基因与人类基因的一致性约有87%,且研究发现斑马鱼的造血转录调控与哺乳动物高度一致。目前科学家普遍认为斑马鱼是研究血液系统相关疾病的理想的模式生物[16-18]。
吗啉代寡核苷酸是一种反义技术,是对天然核苷酸结构重新设计获得的合成分子,长度约25 bp。它能够以标准核苷酸碱基配对的方式与RNA互补结合,阻碍其他分子与特定核酸序列的结合,阻挡RNA上约25 bp的区域,从而阻止相应RNA的功能。又因其具有良好的稳定性、溶解度和速效性,目前被广泛运用于斑马鱼等模式生物的研究。本研究发现该技术用于lmna基因修饰更为有效和简洁,能有效保证对目的基因进行下调和沉默。本实验使用针对斑马鱼lmna基因5’UTR区的翻译阻断吗啉代反义寡核苷酸序列下调斑马鱼lmna基因的表达。通过显微注射的方法,将lmna基因mRNA的吗啉代反义寡核苷酸注入斑马鱼胚胎,lmna基因mRNA的吗啉代反义寡核苷酸通过占据斑马鱼体内lmna基因转录形成的mRNA与其他分子的作用位点来发挥下调lmna基因表达的作用,从而研究lmna基因下调对斑马鱼早期造血系统发育的影响。
pu.1 为转录因子ETS家族成员之一,与其他转录调控因子相互作用,调控髓系造血干细胞的发育,同时可以自主调控自身的表达,且与gata1相互作用,使原始造血过程中的红系和髓系造血更趋合理。pu.1 为早期造血干细胞从定向向髓系分化所必需的,是髓系前体细胞特异性的转录调控因子[19-20]。gata1为红系特异性的转录调控因子,与其他转录调控因子相互作用,调控红系造血干细胞的发育,同时可以抑制中间细胞群中髓系的表达,在早期红细胞形成过程中起关键作用[21-22]。本次研究结果提示,下调lmna基因表达后,斑马鱼胚胎髓系和红系造血干细胞发育相关的转录调控因子pu.1和gata1的表达下调。其作用机制可能是lmna基因下调后,支撑细胞核的骨架结构——A型核纤层蛋白表达降低,从而导致对髓系造血干细胞发育相关的转录调控因子pu.1和红系造血干细胞发育相关的转录调控因子gata1的mRNA剪接、转录调控等过程受阻。但是,本次实验仅检测了pu.1和gata1的mRNA表达水平,并没有检测pu.1和gata1的蛋白水平,因此,我们将对lmna基因对斑马鱼早期造血干细胞发育的影响作进一步研究,从而探索lmna基因对人类早期造血干细胞发育的影响。
综上所述,lmna基因的下调会阻碍斑马鱼胚胎髓系和红系造血干细胞的发育,lmna基因缺陷或者下调可能是导致白血病发生的机制之一。但是lmna基因与相关造血转录调控因子的相互作用机制仍需进行进一步研究。
| [1] | WU D, FLANNERY A R, CAI H, et al. Nuclear localization signal deletion mutants of lamin A and progerin reveal insights into lamin A processing and emerin targeting[J]. Nucleus, 2014, 5(1): 66–74. doi:10.4161/nucl.28068 |
| [2] | ROCHA-PERUGINI V, GONZÁLEZ-GRANADO J M. Nuclear envelope lamin-A as a coordinator of T cell activation[J]. Nucleus, 2014, 5(5): 396–401. doi:10.4161/nucl.36361 |
| [3] | KOSHIMIZU E, IMAMURA S, QI J, et al. Embryonic senescence and laminopathies in a progeroid zebrafish model[J/OL]. PLoS One, 2011, 6(3):e17688. |
| [4] | MALASHICHEVA A B, ZABIRNIK A S, SMOLINA N A, et al. Lamin A/C mutations change differentiation potential of mesenchymal stem cells[J]. Tsitologiia, 2013, 55(5): 313–317. |
| [5] | MORY P B, CRISPIM F, FREIRE M B, et al. Phenotypic diversity in patients with lipodystrophy associated with LMNA mutations[J]. Eur J Endocrinol, 2012, 167(3): 423–431. doi:10.1530/EJE-12-0268 |
| [6] | ZHANG L, SHEN H, ZHAO Z, et al. Cardiac effects of the c, 1583 C->G LMNA mutation in two families with Emery-Dreifuss muscular dystrophy[J]. Mol Med Rep, 2015, 12(4): 5065–5071. |
| [7] | MCKENNA T, ROSENGARDTEN Y, VICECONTE N, et al. Embryonic expression of the common progeroid lamin A splice mutation arrests postnatal skin development[J]. Aging Cell, 2014, 13(2): 292–302. doi:10.1111/acel.12173 |
| [8] | MATSUMOTO A, HIEDA M, YOKOYAMA Y, et al. Global loss of a nuclear lamina component, lamin A/C, and LINC complex components SUN1, SUN2, and nesprin-2 in breast cancer[J]. Cancer Med, 2015, 4(10): 1547–1557. doi:10.1002/cam4.2015.4.issue-10 |
| [9] | NARDELLA M, GUGLIELMI L, MUSA C, et al. Down-regulation of the Lamin A/C in neuroblastoma triggers the expansion of tumor initiating cells[J]. Oncotarget, 2015, 6(32): 32821–32840. |
| [10] | GUILLY M N, KOLB J P, GOSTI F, et al. Lamins A and C are not expressed at early stages of human lymphocyte differentiation[J]. Exp Cell Res, 1990, 189(1): 145–147. doi:10.1016/0014-4827(90)90267-E |
| [11] | HALE J S, FROCK R L, MAMMAN S A, et al. Cell-extrinsic defective lymphocyte development in Lmna(-/-) mice[J/OL]. PLoS One, 2010, 5(4):e10127. |
| [12] | AGRELO R, SETIEN F, ESPADA J, et al. Inactivation of the lamin A/C gene by CpG island promoter hypermethylation in hematologic malignancies, and its association with poor survival in nodal diffuse large B-cell lymphoma[J]. J Clin Oncol, 2005, 23(17): 3940–3947. doi:10.1200/JCO.2005.11.650 |
| [13] | SHU L P, ZHOU Z W, ZHOU T, et al. Ectopic expression of Hoxb4a in hemangioblasts promotes hematopoietic development in early embryogenesis of zebrafish[J]. Clin Exp Pharmacol Physiol, 2015, 42(12): 1275–1286. doi:10.1111/1440-1681.12483 |
| [14] | WESTERFIELD M. The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio)[M]. 4th ed. Eugene (Oregon):University of Oregon Press, 2000:2-26. |
| [15] | KIMMEL C B, BALLARD W W, KIMMEL S R, et al. Stages of embryonic development of the zebrafish[J]. Dev Dyn, 1995, 203(3): 253–310. doi:10.1002/aja.1002030302 |
| [16] | AVAGYAN S, ZON L I. Fish to learn:insights into blood development and blood disorders from zebrafish hematopoiesis[J]. Hum Gene Ther, 2016, 27(4): 287–294. doi:10.1089/hum.2016.024 |
| [17] | HESS I, BOEHM T. Stable multilineage xenogeneic replacement of definitive hematopoiesis in adult zebrafish[J]. Sci Rep, 2016, 6: 19634. doi:10.1038/srep19634 |
| [18] | RAJAN V, DELLAIRE G, BERMAN J N. Modeling Leukemogenesis in the zebrafish using genetic and xenograft models[J]. Methods Mol Biol, 2016, 1451: 171–189. doi:10.1007/978-1-4939-3771-4 |
| [19] | AMANATIADOU E P, PAPADOPOULOS G L, STROUBOULIS J, et al. GATA1 and PU.1 bind to ribosomal protein genes in erythroid cells:implications for ribosomopathies[J/OL]. PLoS One, 2015, 10(10):e0140077. |
| [20] | QIAN M, JIN W, ZHU X, et al. Structurally differentiated cis-elements that interact with PU.1 are functionally distinguishable in acute promyelocytic leukemia[J]. J Hematol Oncol, 2013, 6: 25. doi:10.1186/1756-8722-6-25 |
| [21] | SHIMIZU R, YAMAMOTO M. GATA-related hematologic disorders[J]. Exp Hematol, 2016, 44(8): 696–705. doi:10.1016/j.exphem.2016.05.010 |
| [22] | MEINDERS M, HOOGENBOEZEM M, SCHEENSTRA M R, et al. Repercussion of megakaryocyte-specific Gata1 loss on megakaryopoiesis and the hematopoietic precursor compartment[J/OL]. PLoS One, 2016, 11(5):e0154342. |




