2. 嘉兴市妇幼保健院乳腺科, 浙江 嘉兴 314000
2. Department of Breast Surgery, Jiaxing Maternity and Child Health Care Hospital, Jiaxing 314000, China
在我国,乳腺癌的发病率逐年升高,已严重威胁女性的健康。乳腺癌是激素依赖性肿瘤,其发生、发展与激素受体的表达密切相关。雌激素受体(estrogen receptor,ER)及孕激素受体(progesterone receptor,PR)是指导乳腺癌内分泌治疗及评估预后的重要临床指标。目前,新辅助化疗在乳腺癌的综合治疗中具有重要作用。有研究报道,在乳腺癌新辅助化疗过程中,部分患者会存在ER及PR状态的改变[1-4];但迄今仍无资料表明新辅助化疗后激素受体阳性转为阴性的患者是否可以从辅助内分泌治疗中获益。因此,本研究通过观察106例激素受体由阳性转阴性患者是否接受辅助内分泌治疗后的不同结果,初步探讨这部分患者辅助内分泌治疗的疗效。
1 对象与方法 1.1 研究对象纳入2000年12月至2013年12月在嘉兴市妇幼保健院住院接受新辅助化疗后激素受体(ER和PR)由阳性转变为阴性的乳腺癌患者106例。纳入条件为女性浸润性乳腺癌患者,接受至少三个疗程新辅助化疗,并具有完整的临床资料,包括:年龄、月经情况、初诊临床分期、人表皮生长因子受体(HER)-2状态、术后腋窝淋巴结状态及随访信息。新辅助化疗方案包括CEF(环磷酰胺+表柔比星+氟尿嘧啶)、EC(表柔比星+环磷酰胺)、EC-T(多西他赛)、EC-P(紫杉醇)、TEC(多西他赛+表柔比星+环磷酰胺)、ET(表柔比星+多西他赛)及CMF(环磷酰胺+甲氨蝶呤+氟尿嘧啶)。所有患者均接受根治性手术治疗并且术后接受共6~8个疗程的辅助化疗;辅助化疗结束后予以辅助放疗,然后根据主诊医师及患者意见共同决定是否接受辅助内分泌治疗,一例患者接受曲妥珠单抗治疗。在完成手术治疗、新辅助化疗及放射治疗后,按照是否接受辅助内分泌治疗分组,观察组:接受辅助内分泌治疗的患者(n=61) ;对照组:未接受辅助内分泌治疗的患者(n=45) 。本研究获得医院医学伦理委员会的批准,并由患者签署知情同意书。
1.2 检测试剂ER、PR、HER-2单克隆抗体及二抗广谱型PV-6000均购于北京中杉金桥生物技术有限公司。
1.3 新辅助化疗疗效评估患者的随访资料从以下几方面获得:患者的门诊就诊记录,电话及信件联系随访。无病生存期(disease-free survival,DFS)定义为自首次诊断至任何局部区域复发、远处转移、第二原发肿瘤、对侧乳腺癌及任何原因引起死亡的时间。总生存期(overall survival,OS)定义为自首次诊断至任何原因引起死亡的时间。新辅助化疗的临床疗效根据RECIST 1.1标准[5]进行评估。完全缓解:乳腺原发病灶消失;部分缓解:基线病灶最大径之和至少缩小30%;疾病进展:基线病灶最大径之和至少增加20%或出现新病灶;疾病稳定:基线病灶最大径之和有缩小但未达部分缓解或有增加但未达疾病进展。病理完全缓解定义为乳房及腋窝无浸润性病灶残留,术后病理完全缓解患者由于无法进行激素受体检测,故排除。
1.4 免疫组织化学检测ER、PR及HER-2表达所有患者在新辅助化疗前均接受粗针穿刺活检。穿刺及手术标本的ER、PR及HER-2表达均通过常规的免疫组织化学检测方法测定(石蜡标本切成4 mm切片,一抗浓度为1:100,以SP法行免疫组织化学染色,二抗工作浓度严格按照SP试剂盒说明,抗原修复采用高压热修复法。每次实验均设阳性对照和阴性对照,以PBS代替一抗作为阴性对照),ER及PR阳性定义为至少10%细胞核着色,ER和(或)PR阳性为激素受体阳性;HER-2阳性定义为免疫组织化学检测结果+++和/或荧光原位杂交阳性。所有检测结果均至少经过两位高年资病理医师共同判断。
1.5 统计学方法采用SPSS 22.0软件进行统计学分析,使用Kaplan-Meier法进行单因素生存分析并使用log-rank检验比较不同亚组患者的生存差异,使用Cox模型对患者进行多因素生存分析并计算风险比(hazard ratio,HR)及95% CI。P<0.05为差异有统计学意义。
2 结果 2.1 两组一般资料比较两组患者年龄、月经状态、新辅助化疗前HER-2状态、新辅助化疗疗程、术后腋窝淋巴结状态、辅助化疗和辅助放疗分布差异均无统计学意义(均P>0.05) 。80例(75.5%)患者接受了仅含蒽环类药物的新辅助化疗方案,15例(14.2%)接受了蒽环类联合紫杉类化疗,11例使用了非蒽环及紫杉化疗方案,两组间新辅助化疗方案分布差异无统计学意义(P>0.05) 。根据美国癌症联合委员会(AJCC)第七版乳腺癌TNM分期标准,初次诊断时Ⅱb期患者32例(30.2%),Ⅲa期患者41例(38.7%),Ⅲb~Ⅲc期患者33例(31.1%),两组间临床分期分布差异无统计学意义(P>0.05) 。根据RECIST 1.1标准,新辅助化疗治疗后临床疗效评估为完全缓解、部分缓解及疾病稳定或疾病进展的患者各有23例(21.7%)、58例(54.7%)及25例(23.6%),两组间临床疗效分布差异无统计学意义(P>0.05) 。61例接受内分泌治疗的患者中,36例(59.0%)仅使用三苯氧胺,16例(26.2%)接受了芳香化酶抑制剂治疗,9例(14.8%)使用了三苯氧胺联合芳香化酶抑制剂治疗。详见表 1。
| [n(%)] | |||
| 指标 | 观察组(n=61) | 对照组(n=45) | |
| 年龄(岁) | ≤50 | 29(47.5) | 22(48.9) |
| >50 | 32(52.5) | 23(51.1) | |
| 月经状态 | 绝经前 | 33(54.3) | 27(60.0) |
| 绝经后 | 28(45.9) | 18(40.0) | |
| 新辅助化疗前HER-2状态 | |||
| 阳性 | 4(6.6) | 7(15.6) | |
| 阴性 | 57(93.4) | 38(84.4) | |
| 新辅助化疗方案 | |||
| 蒽环类 | 47(77.0) | 33(73.3) | |
| 蒽环联合紫杉 | 8(13.1) | 7(15.6) | |
| 其他 | 6(9.8) | 5(11.1) | |
| 新辅助化疗疗程 (次) | |||
| 3~4 | 51(83.6) | 36(80.0) | |
| 5~6 | 10(16.4) | 9(20.0) | |
| 临床分期 | Ⅱb | 20(32.8) | 12(26.7) |
| Ⅲa | 24(39.3) | 17(37.8) | |
| Ⅲb~Ⅲc | 17(27.9) | 16(35.6) | |
| 新辅助化疗临床疗效 | |||
| 完全缓解 | 16(26.2) | 7(15.6) | |
| 部分缓解 | 30(49.2) | 28(62.2) | |
| 疾病稳定+疾病进展 | 15(24.6) | 10(22.2) | |
| 术后腋窝淋巴结状态 | |||
| 阳性 | 16(26.2) | 16(35.6) | |
| 阴性 | 45(73.8) | 29(64.4) | |
| 辅助化疗 | 是 | 54(88.5) | 42(93.3) |
| 否 | 7(11.5) | 3(6.7) | |
| 辅助放疗 | 是 | 48(78.7) | 36(80.0) |
| 否 | 13(21.3) | 9(20.0) | |
| HER-2:人表皮生长因子受体2. | |||
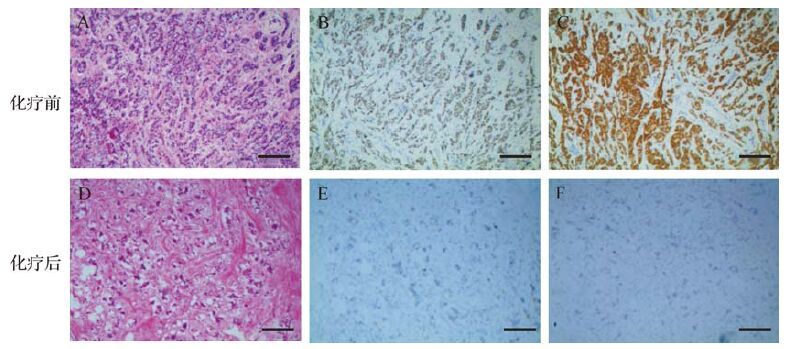
新辅助化疗治疗前84 例(79.2%)为ER及PR阳性,15例(14.2%)ER阳性、PR阴性,7例(6.6%)ER阴性、PR阳性。新辅助化疗治疗后HER-2状态由阳性转变为阴性1例,由阴性转变为阳性2例。新辅助化疗治疗前不同ER、PR状态患者治疗前与治疗后HER-2状态分布见表 2。患者新辅助化疗前后活检组织ER、PR表达情况见图 1。
| 新辅助化疗前ER/PR | 阳性→阳性 | 阳性→阴性 | 阴性→阳性 | 阴性→阴性 |
| 阳性/阳性 | 7 | 0 | 2 | 75 |
| 阳性/阴性 | 3 | 0 | 0 | 12 |
| 阴性/阳性 | 0 | 1 | 0 | 6 |
| ER:雌激素受体;PR:孕激素受体;HER-2:人表皮生长因子受体2. | ||||
|
| A:化疗前癌细胞在纤维性间质内浸润(小叶结构消失,肿瘤细胞单一,核异型,肌上皮消失);B:化疗前至少10%细胞核ER着棕黄色;C:化疗前至少10%细胞核PR着棕黄色;D:化疗后癌细胞呈退行性变(癌细胞散在、单个,核轮廓模糊,间质胶原化或被脂肪组织替代);E:化疗后ER着棕黄色细胞核减少;F:化疗后PR着棕黄色细胞核减少. 标尺=100 μm.A、D为HE染色,B、C、E、F为SP法免疫组织化学染色. 图 1 同一病例在新辅助化疗前后ER、PR表达情况 Fig. 1 The expression of ER and PR before and after neoadjuvant chemotherapy in one patient |
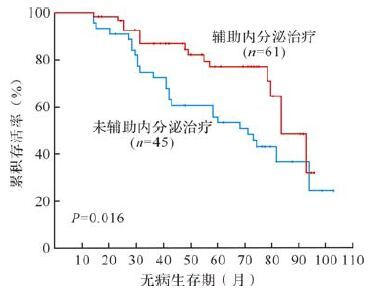
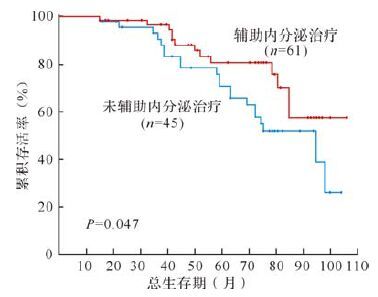
研究中位随访时间为68(14~103) 个月,患者无病存活率为60.4%,总存活率为67.9%。接受辅助内分泌治疗的患者5年无病存活率高于未接受辅助内分泌治疗者(77.1%与53.5%,P<0.05) ,5年总存活率也高于未接受辅助内分泌治疗者(80.9%与71.0%,P<0.05) ,见图 2~3。
|
| 图 2 是否接受辅助内分泌治疗患者5年无病存活率比较 Fig. 2 Five-year disease free survival rates in patients receiving/not receiving adjuvant endocrine therapy |
|
| 图 3 是否接受辅助内分泌治疗患者5年总存活率比较 Fig. 3 Five-year overall survival rates in patients receiving/not receiving adjuvant endocrine therapy |
Kaplan-Meier单因素生存分析及log-rank检验发现,HER-2状态、临床分期、术后腋窝淋巴结状态及是否接受辅助内分泌治疗与患者5年无病存活率、总存活率显著相关(均P<0.05) ,见表 3。对单因素分析中有统计学意义的四个因素采用Cox 比例风险模型进行多因素回归分析。调整HER-2状态、临床分期、术后腋窝淋巴结状态等已知影响无病存活率、总存活率的因素,是否接受辅助内分泌治疗仍是患者5年无病存活率的独立预测指标(HR=2.096,95%CI:1.081~4.065,P<0.05) 。接受辅助内分泌治疗患者的5年总存活率优于未接受辅助内分泌治疗者,但差异无统计学意义(HR=1.927,95%CI:0.902~4.115,P>0.05) 。
| 患者特征 | 无病存活率 | 总存活率 |
| 年龄(岁) | 0.780 | 0.556 |
| 月经状态 | 0.763 | 0.909 |
| 新辅助化疗前HER-2状态 | 0.004 | 0.137 |
| 新辅助化疗方案 | 0.064 | 0.097 |
| 新辅助化疗疗程 | 0.531 | 0.555 |
| 临床分期 | 0.001 | 0.001 |
| 新辅助化疗临床疗效 | 0.301 | 0.606 |
| 术后腋窝淋巴结状态 | 0.001 | <0.001 |
| 辅助内分泌治疗 | 0.016 | 0.047 |
| 辅助化疗 | 0.976 | 0.915 |
| 辅助放疗 | 0.325 | 0.049 |
既往回顾性研究表明,粗针穿刺活检和手术切除标本间激素受体和HER-2的表达存在差异[6-8]。meta分析结果显示,对于没有使用新辅助化疗的乳腺癌患者,粗针穿刺活检和手术切除标本间激素受体和HER-2状态具有较高的一致性;但在新辅助化疗前后激素受体状态存在明显改变,新辅助化疗后需重新评估激素受体的表达情况[9-10]。鉴于粗针穿刺活检标本对激素受体检测准确性较高,导致新辅助化疗前后激素受体和HER-2表达发生改变的主要原因还在于新辅助化疗的使用。
研究发现,乳腺癌患者新辅助化疗前后其激素受体状态发生改变的概率为8%~33%,且以阳性转阴性为主[1-4]。本研究旨在探讨此类患者是否可以从辅助内分泌治疗中获益。研究结果表明,对新辅助化疗后激素受体由阳性转为阴性的患者,辅助内分泌治疗可显著改善患者的5年无病存活率(77.1%与53.5%)和5年总存活率(80.9%与71.0%)。Hirata等[2]回顾性研究59例新辅助化疗后激素受体状态发生改变的患者,发现47例接受辅助内分泌治疗患者的无病存活率明显高于12例未接受治疗者,然而该研究只包含30例激素受体由阳性转为阴性的患者,样本量较小使得研究结论依据不足。
根据2013年St Gallen乳腺癌专家共识,乳腺癌可按照ER、PR、HER-2和Ki67表达情况分为四种不同的分子亚型[11]。不同分子亚型的患者对系统性治疗的反应性及预后均不相同[12-14]。本研究中所有患者在新辅助化疗前是luminal-like型,而化疗后转变为basal-like型或HER-2阳性型。研究结果表明,对于新辅助化疗前为luminal-like型而化疗后转变为basal-like型或HER-2阳性型患者,给予辅助内分泌治疗可以获得较好的预后(单因素分析结果辅助内分泌治疗患者5年无病存活率及总存活率P值分别为0.016、0.047,均较高)外,多因素分析结果表明,辅助内分泌治疗的疗效独立于患者的HER-2状态,HER-2阳性及HER-2阴性患者均能获益(HR=2.096,95%CI:1.081~4.065,P<0.05) 。由于本研究入组的病例数仍较少,因此结论仍需将来大样本研究证实。
综上所述,本研究结果显示,对于接受新辅助化疗的乳腺癌患者,化疗前应进行激素受体状态的检测。尽管新辅助化疗后激素受体状态由阳性转为阴性的机制仍不明确,推测这部分患者仍可以从辅助内分泌治疗中获益。
| [1] | BURCOMBE RJ, MAKRIS A, RICHMAN PI, et al. Evaluation of ER, PgR, HER-2 and Ki-67 as predictors of response to neoadjuvant anthracycline chemotherapy for operable breast cancer[J]. Br J Cancer, 2005, 92(1): 147–155. doi:10.1038/sj.bjc.6602256 |
| [2] | HIRATA T, SHIMIZU C, YONEMORI K, et al. Change in the hormone receptor status following administration of neoadjuvant chemotherapy and its impact on the long-term outcome in patients with primary breast cancer[J]. Br J Cancer, 2009, 101(9): 1529–1536. doi:10.1038/sj.bjc.6605360 |
| [3] | JAIN V, LANDRY M, LEVINE EA. The stability of estrogen and progesterone receptors in patients receiving preoperative chemotherapy for locally advanced breast carcinoma[J]. Am Surg, 1996, 62(2): 162–165. |
| [4] | TACCA O, PENAULT-LLORCA F, ABRIAL C, et al. Changes in and prognostic value of hormone receptor status in a series of operable breast cancer patients treated with neoadjuvant chemotherapy[J]. Oncologist, 2007, 12(6): 636–643. doi:10.1634/theoncologist.12-6-636 |
| [5] | EISENHAUER E A, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours:revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228–247. doi:10.1016/j.ejca.2008.10.026 |
| [6] | CONNOR CS, TAWFIK OW, JOYCE AJ, et al. A comparison of prognostic tumor markers obtained on image-guided breast biopsies and final surgical specimens[J]. Am J Surg, 2002, 184(4): 322–324. doi:10.1016/S0002-9610(02)00953-4 |
| [7] | TAUCHER S, RUDAS M, MADER RM, et al. Prognostic markers in breast cancer:the reliability of HER2/neu status in core needle biopsy of 325 patients with primary breast cancer[J]. Wien Klin Wochenschr, 2004, 116(1-2): 26–31. doi:10.1007/BF03040420 |
| [8] | MUELLER-HOLZNER E, FINK V, FREDE T, et al. Immunohistochemical determination of HER2 expression in breast cancer from core biopsy specimens:a reliable predictor of HER2 status of the whole tumor[J]. Breast Cancer Res Treat, 2001, 69(1): 13–19. doi:10.1023/A:1012281221647 |
| [9] | CHEN X, YUAN Y, GU Z, et al. Accuracy of estrogen receptor, progesterone receptor, and HER2 status between core needle and open excision biopsy in breast cancer:a meta-analysis[J]. Breast Cancer Res Treat, 2012, 134(3): 957–967. doi:10.1007/s10549-012-1990-z |
| [10] | ZHANG N, MORAN MS, HUO Q, et al. The hormonal receptor status in breast cancer can be altered by neoadjuvant chemotherapy:a meta-analysis[J]. Cancer Invest, 2011, 29(9): 594–598. doi:10.3109/07357907.2011.621913 |
| [11] | GOLDHIRSCH A, WOOD WC, COATES AS, et al. Strategies for subtypes-dealing with the diversity of breast cancer:highlights of the St. gallen international expert consensus on the primary therapy of early breast cancer 2011[J]. Ann Oncol, 2011, 22(8): 1736–1747. doi:10.1093/annonc/mdr304 |
| [12] | PEROU C M, SØRLIE T, EISEN M B, et al. Molecular portraits of human breast tumours[J]. Nature, 2000, 406(6797): 747–752. doi:10.1038/35021093 |
| [13] | SØRLIE T, PEROU C M, TIBSHIRANI R, et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications[J]. Proc Natl Acad Sci U S A, 2001, 98(19): 10869–10874. doi:10.1073/pnas.191367098 |
| [14] | CHEN X S, WU J Y, HUANG O, et al. Molecular subtype can predict the response and outcome of Chinese locally advanced breast cancer patients treated with preoperative therapy[J]. Oncol Rep, 2010, 23(5): 1213–1220. |




