2. 宁波市泌尿肾病医院肾内科, 浙江 宁波 315192
2. Division of Nephrology, Ningbo Urology and Nephrology Hospital, School of Medicine, Ningbo University, Ningbo 315192, China
腹膜透析是终末期肾病患者行肾脏替代治疗时的一种有效的治疗选择[1]。腹膜作为一种生物半透膜,其结构和功能的稳定是患者进行长期腹膜透析治疗的关键。长期接触非生理性高糖透析液导致腹膜纤维化,使腹膜对小分子物质转运功能减退甚至超滤衰竭,迫使患者退出腹膜透析治疗[2]。
葡萄糖转运蛋白属于细胞膜载体蛋白家族,负责葡萄糖等物质的跨细胞运输,其中最重要的是葡萄糖转运体1(glucose transporter 1,GLUT1) 和钠—葡萄糖转运体1(sodium-glucose cotransporter 1,SGLT1) 。葡萄糖转运蛋白的异常增多或者代谢紊乱,会导致细胞对葡萄糖的摄取以及利用的失衡[3-4]。细胞对葡萄糖的吸收摄取途径有两种:一是载体介导的易化扩散;二是继发性主动转运,通过钠泵的存在,促进葡萄糖逆浓度梯度转运[5-6]。其中易化扩散转运的主要载体是GLUT1,而继发性主动转运主要依靠SGLT1。有研究显示,高糖能引起内皮细胞中GLUT1、SGLT1表达量升高,但具体机制仍不清楚[7-8]。
TGF-β1、结缔组织生长因子(connective tissue growth factor,CTGF)是目前较为明确的促纤维化因子,在腹膜纤维化形成中扮演了重要角色。近年研究发现,CTGF是TGF-β1发挥生物学效应的下游因子,这两种细胞因子可以评估纤维化的程度[9]。目前,GLUT1与SGLT1在各器官纤维化中的作用引起研究人员的关注[10]。本研究为明确GLUT1、SGLT1对腹膜纤维化的影响,拟通过体内及体外实验,探究GULT1、SGLT1对腹膜形态和功能及TGF-β1、CTGF mRNA和蛋白表达的影响,为延缓腹膜纤维化进程提供新的研究思路。
1 材料与方法 1.1 主要材料、仪器和试剂人腹膜微血管内皮细胞(human peritoneal microvascular endothelial cells,HPEC)购自广州吉妮欧生物科技有限公司,无酚红RPMI-1640培养基购自美国HyClone公司,0.25%EDTA-胰蛋白酶、FBS购自美国Gibco公司,2.5%和4.25%腹膜透析液购自广州百特医疗用品有限公司,根皮素(GLUT1拮抗剂)、根皮苷(SGLT1拮抗剂)原粉购自美国Sigma公司,DAB显色试剂盒购自武汉博士德生物工程有限公司,GoTaqTM 两步法RT-qPCR系统、GoScriptTM 逆转录酶系统、GoTaq qPCR Master Mix购自美国Promega公司,TRIzol 试剂购自美国Ambion公司,兔抗人GLUT1抗体、兔抗人SGLT1抗体、兔抗人 TGF-β1抗体、兔抗人CTGF抗体购自美国Santa Cruz公司,荧光标记的羊抗兔二抗购自美国LI-COR Biosciences公司,BCA法蛋白定量试剂盒购自上海捷瑞生物工程有限公司。
1.2 动物模型制备和分组SPF级健康雄性SD大鼠36只,体质量为280~300 g,饲养室温保持在(20±3) ℃。实验前适应性喂养一周,随机分为六组:正常对照组、手术对照组、腹膜透析组(PD组)、腹膜透析+根皮素组(PD+T组)、腹膜透析+根皮苷组(PD+Z组)、腹膜透析+根皮素+根皮苷组(PD+T+Z组),每组6只。其中,手术对照组行双侧肾包膜剥除术;PD组用2.5%腹膜透析液进行透析治疗1个月(10 mL/次,2次/d); PD+T组在PD组处理的基础上,加用根皮素20 mg·kg-1·d-1;PD+Z组在PD组处理的基础上,加用根皮苷20 mg·kg-1·d-1;PD+T+Z组在PD组处理的基础上,加用根皮素和根皮苷各20 mg·kg-1·d-1。除正常对照组和手术对照组外,其余各组大鼠均采用5/6肾脏切除法制作尿毒症大鼠模型,再行后腹膜插管制作尿毒症腹膜透析大鼠模型。24只大鼠在动物造模中全部存活,且均愈合良好,血肌酐值均超过正常对照组和手术对照组2~3倍,造模成功[11]。后行腹膜置管术,均无管腔堵塞,伤口愈合良好,均未出现化脓性感染,腹膜透析进行顺利。所有大鼠腹膜透出液中白细胞计数未超出正常值上限(<1000/mm3),可排除腹膜炎对本研究结果的影响。
1.3 腹膜平衡试验评估大鼠腹膜转运功能大鼠停止透析24 h后行腹膜平衡试验。通过腹膜透析导管向大鼠腹腔注射4.25%腹膜透析液20 mL,120 min后处死大鼠并取血,收集大鼠腹腔内液体,计算超滤量。经下腔静脉采血,取网膜组织保存于-80 ℃冰箱待检。测定初始腹膜透析液葡萄糖浓度(D0) 、透出液葡萄糖浓度(D1) 、透出液肌酐水平(D-cr)、血清肌酐水平(P-cr),并计算D-cr/P-cr和D1/D0。
1.4 组织学检查测量大鼠腹膜厚度取大鼠腹部壁层腹膜,用4%多聚甲醛溶液固定24 h后梯度乙醇脱水,二甲苯透明、浸蜡及石蜡包埋,3 μm切片行HE染色,每张切片盲法随机测量10个高倍镜视野,将肌肉至腹膜垂直距离(含皮下纤维)的平均值作为腹膜组织厚度。
1.5 免疫组织化学检测大鼠网膜组织GLUT1、SGLT1、TGF-β1和CTGF蛋白取网膜组织3 μm切片后行GLUT1、SGLT1、TGF-β1和CTGF免疫组织化学染色,按ABC试剂盒说明书操作。石蜡切片常规二甲苯及梯度乙醇脱蜡脱水,微波热处理修复抗原,一抗均稀释100倍,4 ℃冰箱孵育过夜,阴性对照组以PBS(酸碱度7.4) 代替一抗,DAB显色,苏木素复染核,中性树脂封片,显微镜下观察,染色阳性者呈棕黄色。
1.6 人腹膜微血管内皮细胞的培养及分组将人腹膜微血管内皮细胞株接种在1%明胶包被的25 cm2培养瓶中,置于37 ℃、5%二氧化碳的培养箱中培养,24~36 h后第一次换液,以后每2~3 d换液一次。当细胞生长融合至80%~90%时,用0.25%EDTA-胰蛋白酶消化,以1:3传代培养,取第3、4代用于实验。
将细胞分成五组:正常对照组、腹膜透析组(PD组)、腹膜透析+根皮素组(PD+T组)、腹膜透析+根皮苷组(PD+Z组)和腹膜透析+根皮素+根皮苷组(PD+T+Z组),均用含葡萄糖的无酚红RPMI-1640培养基培养。然后,PD组用2.5%的腹膜透析液培养;PD+T组、PD+Z组、PD+T+Z组分别用含根皮素或(和)根皮苷的2.5%的腹膜透析液培养。根据预实验结果,将实验时间定为 48 h,所用根皮素和根皮苷的浓度分别为50 μg/mL和10 μg/mL,实验重复三次。
1.7 实时定量PCR 检测网膜组织及微血管内皮细胞内GLUT1、SGLT1、TGF-β1和CTGF mRNA表达用TRIzol试剂抽提网膜组织总RNA;当细胞生长融合至90%~95%时,按上述分组要求同步培养细胞48 h,采用TRIzol一步法抽提细胞总RNA。GoScript 逆转录酶系统试剂盒合成cDNA,产物用GoTaq两步法RT-qPCR 系统试剂盒进行PCR扩增。PCR反应条件:95 ℃ 10 s,95 ℃ 30 s,60 ℃ 60 s,72 ℃ 60 s,共40个循环,采用2-△△Ct法分析结果数据。引物序列见表 1。
| 基因 | 引物序列 (5′-3′) |
| GLUT1 | 正向:CGGGCCAAGAGTGTGCTAAA |
| 反向:TGACGATACCGGAGCCAATG | |
| SGLT1 | 正向:CCTCTTCGCCATTTCTTTCATC |
| 反向:ATGCACATCCGGAATGGGT | |
| CTGF | 正向:ACGGCGAGGTCATGAAGAAGAACA |
| 反向:TGGGGCTACAGGCAGGTCAGTG | |
| TGF-β1 | 正向:CCAACTATTGCTTCAGCTCCA |
| 反向:GTGTCCAGGCTCCAAATGT | |
| β-actin | 正向:CTCCATCCTGGCCTCGCTGT |
| 反向:GCTGTCACCTTCACCGTTCC- |
提取各组网膜组织及细胞蛋白用BCA法测定蛋白浓度,配置5%的浓缩胶和12%的分离胶,取50 μg变性蛋白进行SDS-PAGE,并用0.22 μm的硝酸纤维素滤膜进行蛋白质转膜,考马斯亮蓝染胶、丽春红S染液染膜以观察蛋白质是否转移完全。用含5%牛血清白蛋白的封闭液封闭,一抗(1:500) 4 ℃孵育过夜,随后荧光标记的羊抗兔二抗(1:10 000) 室温避光孵育1 h,ECL发光显影试剂反应,采用蛋白质印迹自动成像仪扫描并获得显影图像。
1.9 统计学方法采用SPSS 13.0软件包进行统计学分析。计量资料用均数±标准差(x±s)表示,组间比较采用单因素方差分析,多个样本之间两两比较采用LSD-t检验,相关性分析用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果 2.1 各组大鼠腹膜转运功能比较与手术对照组比较,PD组腹膜超滤量、D1/D0减少,D-cr/P-cr增加(均P<0.05) ;与PD组比较,PD+T组、PD+Z组和PD+T+Z组腹膜超滤量和D1/D0增加,D-cr/P-cr减少(均P<0.05) ;而PD+T组、PD+Z组、PD+T+Z组间超滤量、D1/D0和D-cr/P-cr差异无统计学意义(均P>0.05) ,见表 2。提示抑制GLUT1、SGLT1的表达可以延缓腹膜对葡萄糖的吸收,维持腹膜透析液渗透梯度,增加腹膜超滤量,提高腹膜透析效能。
| (x±s) | ||||
| 组别 | n | 超滤量(mL) | D-cr/P-cr | D1/D0 |
| 正常对照组 | 6 | 22.63±4.11 | 0.24±0.05 | 0.69±0.09 |
| 手术对照组 | 6 | 23.67±1.53 | 0.20±0.04 | 0.68±0.02 |
| PD组 | 6 | 16.00±6.24* | 0.47±0.11* | 0.20±0.05* |
| PD+T组 | 6 | 22.33±2.08# | 0.24±0.06# | 0.45±0.05# |
| PD+Z组 | 6 | 21.75±1.71# | 0.20±0.05# | 0.45±0.06# |
| PD+T+Z组 | 6 | 22.50±0.71# | 0.27±0.06# | 0.49±0.10# |
| PD组:腹膜透析组; PD+T组:腹膜透析+根皮素组;PD+Z组:腹膜透析+根皮苷组;PD+T+Z组:腹膜透析+根皮素+根皮苷组;D-cr/P-cr:透出液肌酐/血清肌酐;D1/D0:腹透液葡萄糖浓度/透出液葡萄糖浓度. 与手术对照组比较,*P<0.05;与PD组比较,#P<0.05. | ||||
各组腹膜HE染色结果见图 1。与正常对照组[(182±28) μm]比较,手术对照组[(220±78) μm]腹膜组织厚度差异无统计学意义(P>0.05) ;与手术对照组比较,PD组[(995±100) μm]腹膜组织厚度增加(均P<0.05) ;与PD组比较,PD+T组[(282±90) μm]、PD+Z组[(419±42) μm]和PD+T+Z组[(283±49) μm]大鼠腹膜组织增厚程度减轻(均P<0.05) ; PD+T组、PD+Z组、PD+T+Z三组之间腹膜组织厚度差异无统计学意义(P>0.05) 。提示腹膜透析液可以增加大鼠的腹膜厚度,而抑制GLUT1、SGLT1的表达可以减轻大鼠在腹膜透析过程中腹膜增厚的程度。
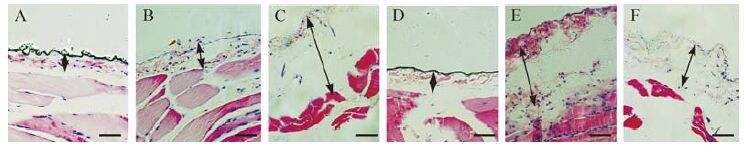
|
| A:正常对照组;B:手术对照组;C:腹膜透析组;D:腹膜透析+根皮素组;E:腹膜透析+根皮苷组;F:腹膜透析+根皮素+根皮苷组. 箭头长度表示腹膜厚度. 标尺=50 μm. 图 1 各组大鼠腹膜组织横切面(HE染色) Fig. 1 HE staining shows peritoneal thickness of rats in each group |
GLUT1、SGLT1 的mRNA和蛋白在各组均有表达(图 2、3) 。与正常对照组比较,手术对照组GLUT1、SGLT1 mRNA和蛋白表达差异无统计学意义(均P>0.05) ;与手术对照组比较,PD组GLUT1、SGLT1 mRNA和蛋白表达水平均升高(均P<0.05) ;与PD组比较,PD+T组、PD+Z组、PD+T+Z组GLUT1、SGLT1 mRNA和蛋白表达水平均降低(均P<0.05) ;但PD+T组、PD+Z组、PD+T+Z三组之间GLUT1、SGLT1 mRNA和蛋白表达水平差异均无统计学意义(均P>0.05) ,见表 3。提示腹膜透析液能上调大鼠腹膜GLUT1和SGLT1 mRNA和蛋白的表达。
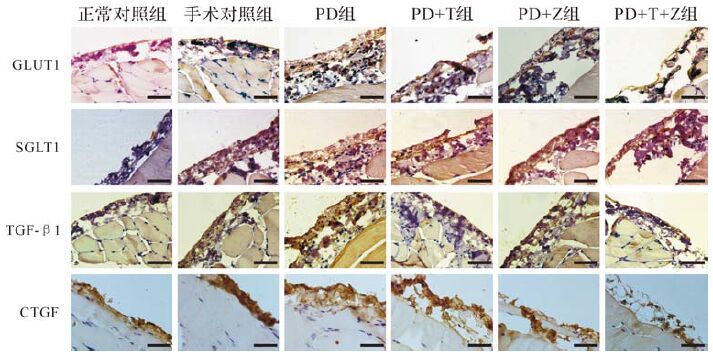
|
| 微血管内皮细胞呈棕黄色系GULT1、SGLT1、TGF-β1、CTGF染色.PD组:腹膜透析组; PD+T组:腹膜透析+根皮素组;PD+Z组:腹膜透析+根皮苷组;PD+T+Z组:腹膜透析+根皮素+根皮苷组;GULT1:葡萄糖转运体1;SGLT1:钠—葡萄糖转运体1;CTGF:结缔组织生长因子.标尺=50 μm. 图 2 免疫组织化学法检测各组大鼠网膜组织中GULT1、SGLT1、TGF-β1和CTGF蛋白表达 Fig. 2 Immunohistochemistry determines the expression of GULT1,SGLT1,TGF-β1 and CTGF in rats |

|
| 1:正常对照组;2:手术对照组;3:腹膜透析组; 4:腹膜透析+根皮素组;5:腹膜透析+根皮苷组;6:腹膜透析+根皮素+根皮苷组;GULT1:葡萄糖转运体1;SGLT1:钠—葡萄糖转运体1. 图 3 大鼠腹膜GULT1和SGLT1蛋白表达的电泳图 Fig. 3 Electrophorogram for protein expression of peritoneal GULT1 and SGLT1 |
| (n=6,x±s) | ||||
| 组别 | mRNA | 蛋白 | ||
| GULT1 | SGLT1 | GULT1 | SGLT1 | |
| 正常对照组 | 1.00±0.00 | 1.00±0.00 | 0.59±0.13 | 0.48±0.11 |
| 手术对照组 | 1.61±0.49 | 1.16±0.57 | 1.00±0.13 | 0.45±0.07 |
| PD组 | 6.00±0.70* | 4.93±0.74* | 2.02±0.11* | 1.53±0.11* |
| PD+T组 | 2.03±1.00# | 1.33±0.18# | 1.03±1.00# | 0.89±0.12# |
| PD+Z组 | 3.00±0.61# | 1.56±0.23# | 0.56±0.23# | 1.06±0.09# |
| PD+T+Z组 | 1.98±0.48# | 1.42±0.56# | 0.25±0.07# | 0.90±0.14# |
| PD组:腹膜透析组;PD+T组:腹膜透析+根皮素组;PD+Z组:腹膜透析+根皮苷组;PD+T+Z组:腹膜透析+根皮素+根皮苷组;GULT1:葡萄糖转运体1;SGLT1:钠—葡萄糖转运体1. 与手术对照组比较,*P<0.05;与PD组比较,#P<0.05. | ||||
TGF-β1和CTGF的mRNA及蛋白在各组均有表达(图 2、4) 。与正常对照组比较,手术对照组TGF-β1、CTGF mRNA和蛋白表达差异无统计学意义(均P>0.05) ;与手术对照组比较,PD组TGF-β1、CTGF mRNA及蛋白表达均增多(均P<0.05) ;与PD组比较,PD+T组、PD+Z组、PD+T+Z组TGF-β1、CTGF mRNA及蛋白表达均减少(均P<0.05) ;PD+T组、PD+Z组、PD+T+Z组之间TGF-β1、CTGF mRNA及蛋白表达差异无统计学意义(均P>0.05) ,见表 4。提示腹膜透析液可上调TGF-β1和 CTGF的表达,而抑制GLUT1和SGLT1可下调TGF-β1和 CTGF的表达。

|
| 1:正常对照组;2:手术对照组;3:腹膜透析组; 4:腹膜透析+根皮素组;5:腹膜透析+根皮苷组;6:腹膜透析+根皮素+根皮苷组;CTGF:结缔组织生长因子. 图 4 各组大鼠腹膜TGF-β1和 CTGF蛋白表达的电泳图 Fig. 4 Electrophorogram for protein expression of peritoneal TGF-β1 and CTGF |
| (n=6,x±s) | ||||
| 组别 | mRNA | 蛋白 | ||
| TGF-β1 | CTGF | TGF-β1 | CTGF | |
| 正常对照组 | 1.00±0.00 | 1.00±0.00 | 0.39±0.01 | 0.57±0.10 |
| 手术对照组 | 1.54±0.67 | 1.65±0.29 | 0.41±0.12 | 0.46±0.08 |
| PD组 | 5.38±0.61* | 5.97±0.71* | 1.22±0.23* | 1.01±0.11* |
| PD+T组 | 2.18±1.36# | 1.10±0.80# | 0.32±0.10# | 0.44±0.09# |
| PD+Z组 | 2.87±1.45# | 2.10±0.66# | 0.45±0.23# | 0.51±0.16# |
| PD+T+Z组 | 2.23±0.72# | 2.28±0.52# | 0.21±0.09# | 0.30±0.08# |
| PD组:腹膜透析组;PD+T组:腹膜透析+根皮素组;PD+Z组:腹膜透析+根皮苷组;PD+T+Z组:腹膜透析+根皮素+根皮苷组;CTGF:结缔组织生长因子. 与手术对照组比较,*P<0.05;与PD组比较,#P<0.05. | ||||
Pearson相关性分析结果显示:大鼠腹膜中GLUT1的mRNA及蛋白表达量与TGF-β1、CTGF的表达量呈正相关(r=0.7732、0.8104、0.8193、0.8805,均P<0.05) ;SGLT1的mRNA及蛋白表达量与TGF-β1、CTGF的表达量呈正相关(r=0.7780、0.7893、0.8062、0.8931,均P<0.05) 。提示大鼠腹膜GULT1、SGLT1表达与TGF-β1、CTGF表达具有相关性。
2.6 各组微血管内皮细胞GLUT1、SGLT1的mRNA及蛋白表达比较与正常对照组比较,PD组GLUT1、SGLT1 mRNA和蛋白表达增多(均P<0.05) ;与PD组比较,PD+Z组、PD+T组和PD+T+Z组GLUT1、SGLT1 mRNA及蛋白表达减少(均P<0.05) ;但PD+Z组、PD+T组和PD+T+Z组之间GLUT1、SGLT1 mRNA及蛋白表达差异无统计学意义(均P>0.05) ,见图 5、表 5。提示腹膜透析可以上调人腹膜微血管内皮细胞GLUT1、SGLT1 mRNA及蛋白的表达。
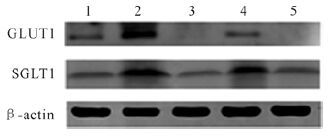
|
| 1:正常对照组;2:腹膜透析组;3:腹膜透析+根皮素组;4:腹膜透析+根皮苷组;5:腹膜透析+根皮素+根皮苷组;GULT1:葡萄糖转运体1;SGLT1:钠—葡萄糖转运体1. 图 5 人腹膜内皮细胞GULT1、SGLT1蛋白表达电泳图 Fig. 5 Electrophorogram for protein expression of GULT1 and SGLT1 in HPECs |
| (n=6,x±s) | ||||
| 组别 | mRNA | 蛋白 | ||
| GULT1 | SGLT1 | GULT1 | SGLT1 | |
| 正常对照组 | 1.00±0.00 | 1.00±0.00 | 0.46±0.04 | 0.73±0.06 |
| PD组 | 6.79±1.01* | 14.41±0.53* | 0.82±0.08* | 1.39±0.13* |
| PD+T组 | 1.38±0.21# | 1.92±0.28# | 0.35±0.03# | 0.67±0.05# |
| PD+Z组 | 1.76±0.10# | 1.16±0.05# | 0.43±0.03# | 0.69±0.05# |
| PD+T+Z组 | 1.54±0.09# | 0.49±0.00# | 0.26±0.02# | 0.61±0.04# |
| PD组:腹膜透析组;PD+T组:腹膜透析+根皮素组;PD+Z组:腹膜透析+根皮苷组;PD+T+Z组:腹膜透析+根皮素+根皮苷组;GULT1:葡萄糖转运体1;SGLT1:钠—葡萄糖转运体1.与正常对照组比较,*P<0.05;与PD组比较,#P<0.05. | ||||
与正常对照组比较,PD组TGF-β1、CTGF mRNA和蛋白表达增多(均P<0.05) ;与PD组比较,PD+T组、PD+Z组和PD+T+Z组TGF-β1、CTGF mRNA及蛋白表达减少(均P<0.05) ;但PD+T组、PD+Z组和PD+T+Z组之间TGF-β1、CTGF mRNA及蛋白表达差异无统计学意义(均P>0.05) ,见图 6、表 6。提示腹膜透析液可以上调人腹膜微血管内皮细胞中TGF-β1、CTGF的表达,而抑制GLUT1、SGLT1可以下调TGF-β1、CTGF的表达。

|
| 1:正常对照组;2:腹膜透析+腹膜透析组;3:腹膜透析+根皮素组;4:腹膜透析+根皮苷组;5:腹膜透析+根皮素+根皮苷组;CTGF:结缔组织生长因子. 图 6 人腹膜内皮细胞TGF-β1、CTGF蛋白表达电泳图 Fig. 6 Electrophorogram for protein expression of TGF-β1 and CTGF in HPECs |
| (n=6,x±s) | ||||
| 组别 | mRNA | 蛋白 | ||
| TGF-β1 | CTGF | TGF-β1 | CTGF | |
| 正常对照组 | 1.00±0.00 | 1.00±0.00 | 0.68±0.06 | 0.31±0.03 |
| PD组 | 8.77±0.16* | 3.66±0.25* | 1.12±0.09* | 0.70±0.07* |
| PD+T组 | 2.78±0.61# | 1.40±0.12# | 0.42±0.03# | 0.29±0.02# |
| PD+Z组 | 0.06±0.00# | 0.41±0.01# | 0.39±0.03# | 0.40±0.03# |
| PD+T+Z组 | 0.93±0.08# | 1.19±0.54# | 0.07±0.00# | 0.18±0.01# |
| PD组:腹膜透析组;PD+T组:腹膜透析+根皮素组;PD+Z组:腹膜透析+根皮苷组;PD+T+Z组:腹膜透析+根皮素+根皮苷组;CTGF:结缔组织生长因子. 与正常对照组比较,*P<0.05;与PD组比较,#P<0.05. | ||||
Pearson相关性分析结果显示:人腹膜微血管内皮细胞中GLUT1的mRNA及蛋白表达量与TGF-β1、CTGF的表达量呈正相关(r=0.8467、0.8015、0.8795、0.9513,均P<0.05) ;SGLT1的mRNA及蛋白表达量与TGF-β1、CTGF的表达量呈正相关(r=0.9439、0.8913、0.6653、0.7742,均P<0.05) 。提示人腹膜微血管内皮细胞GULT1、SGLT1表达与TGF-β1、CTGF表达具有相关性。
3 讨论GLUT1是已知的分布最广泛的转运体,在很多种哺乳动物的胚胎和成体细胞中都有表达,一般与其它组织特异性表达的葡萄糖转运体亚型一起承担细胞的葡萄糖转运。GLUT1负责各种组织与血液间葡萄糖的转运。因此GLUT1在脑、眼、外周神经组织和胎盘的内皮及上皮样屏障细胞中的表达量较高。在高糖环境下,GLUT1的数目及活性都会受到影响而发生改变。已有研究显示,高糖环境下视网膜血管内皮细胞的GLUT1表达上调[12]。
SGLT1是一种高亲和力低效能的转运蛋白,目前研究显示其主要在空肠黏膜上皮细胞刷状缘表达,在肾脏等组织中也有少量表达。肠道SGLT1主要负责膳食葡萄糖的吸收,肾近端小管S3节段的SGLT1则负责肾小球过滤中剩余葡萄糖的重吸收。有研究显示,糖尿病患者肾脏SGLT1表达增加,葡萄糖的吸收随之增加,但是具体的机制还不明确[13]。
本研究中,我们通过免疫组织化学实验证实了GLUT1与SGLT1在腹膜中表达。从腹膜平衡实验中观察到,使用GLUT1拮抗剂和SGLT1拮抗剂后,大鼠的腹膜透析超滤量增加,D1/D0增加,D-cr/P-cr减少,提示抑制GLUT1、SGLT1的表达可以延缓腹膜对葡萄糖的吸收和小分子物质的转运,进而维持腹膜透析液的渗透压梯度。
本研究发现,应用高糖透析液后大鼠腹膜GLUT1、SGLT1的表达增加,使用两种拮抗剂后其表达下降。进一步在体外实验中发现,人腹膜血管内皮细胞在2.5%腹膜透析液的作用下,GLUT1、SGLT1的表达增加,而在使用葡萄糖转运体拮抗剂后,其表达减少,可能由于高糖腹膜透析液刺激了GLUT1、SGLT1的过度表达,进而使人腹膜微血管内皮细胞葡萄糖摄入量增加而致。而葡萄糖转运体拮抗剂可以阻断高糖进入细胞内[14-15],减少腹膜内皮细胞的细胞外基质产物的合成和积聚,从而延缓腹膜纤维化进程。
TGF-β1是多种组织器官重要的促纤维化因子,它可以增加腹膜细胞外基质的合成,减少细胞外基质的降解,并对单核/巨噬细胞具有趋化作用。大量研究发现,TGF-β1在各种组织器官纤维化形成中主要通过其信号蛋白Smad2/3的活化发挥作用[16]。近年来,有研究证实TGF-β1在腹膜纤维化过程中也具有重要作用[17-18]。在腹膜炎模型大鼠腹腔局部不仅有大量炎症细胞浸润并高表达TGF-β1,腹膜间皮细胞也高表达TGF-β1[19-20],提示抑制TGF-β1及受体调控信号蛋白的活性,可能为防治腹膜纤维化提供新的靶点。本研究体内实验发现,抑制GLUT1、SGLT1表达可以下调以上两个纤维化因子的表达,说明高糖腹膜透析液会增加腹膜上葡萄糖转运蛋白的表达,进一步导致腹膜纤维化。体外实验进一步发现,2.5%腹膜透析液环境下,腹膜微血管内皮细胞TGF-β1、CTGF呈高表达,说明腹膜微血管内皮细胞参与了腹膜纤维化的发生和发展。在使用葡萄糖转运体拮抗剂后,人腹膜血管内皮细胞TGF-β1、CTGF的表达量下降,并且GLUT1、SGLT1与TGF-β1、CTGF具有明显的相关性。由此我们推测,下调GLUT1、SGLT1的表达,可以抑制腹膜对葡萄糖的吸收,减轻腹膜的慢性炎症,延缓腹膜纤维化进程,其机制可能是通过调控TGF-β1、CTGF的表达来实现的。
综上所述,腹膜透析液可以上调腹膜GULT1、SGLT1、TGF-β1和CTGF的表达,通过下调GLUT1和SGLT1的表达可以改善腹膜功能,增加超滤量,延缓腹膜纤维化进程。本研究结果为尿毒症腹膜透析患者腹膜纤维化的防治提供了新的靶点。
| [1] | PENG Y M, SHU Z J, XIAO L, et al. A new non-uremic rat model of long-term peritoneal dialysis[J]. Physiol Res, 2011, 60(1): 157–164. |
| [2] | XIN X, LI X H, WU J Z, et al. Pentamethylquercetin ameliorates fibrosis in diabetic Goto-Kakizaki rat kidneys and mesangial cells with suppression of TGF-β/Smads signaling[J]. Eur J Pharmacol, 2013, 713(1-3): 6–15. doi:10.1016/j.ejphar.2013.04.045 |
| [3] | WU N, ZHENG B, SHAYWITZ A, et al. AMPK-dependent degradation of TXNIP upon energy stress leads to enhanced glucose uptake via GLUT1[J]. Mol Cell, 2013, 49(6): 1167–1175. doi:10.1016/j.molcel.2013.01.035 |
| [4] | ALLEN A, MESSIER C. Plastic changes in the astrocyte GLUT1 glucose transporter and beta-tubulin microtubule protein following voluntary exercise in mice[J]. Behav Brain Res, 2013, 240: 95–102. doi:10.1016/j.bbr.2012.11.025 |
| [5] | ZHAO F Q, KEATING A F. Functional properties and genomics of glucose transporters[J]. Curr Genomics, 2007, 8(2): 113–128. doi:10.2174/138920207780368187 |
| [6] | FISCHBARG J, VERA J C. Multifunctional transporter models:lessons from the transport of water, sugars, and ring compounds by GLUTs[J]. Am J Physiol, 1995, 268(5 Pt 1): C1077–C1089. |
| [7] | NISHIZAKI T, MATSUOKA T. Low glucose enhances Na+/glucose transport in bovine brain artery endothelial cells[J]. Stroke, 1998, 29(4): 844–849. doi:10.1161/01.STR.29.4.844 |
| [8] | MANN G E, YUDILEVICH D L, SOBREVIA L. Regulation of amino acid and glucose transporters in endothelial and smooth muscle cells[J]. Physiol Rev, 2003, 83(1): 183–252. doi:10.1152/physrev.00022.2002 |
| [9] | ONISHI A, MORISHITA Y, MUTO S, et al. The mechanism of peritoneal fibrosis in peritoneal dialysis[J]. J Nephrol Therapeutic, 2011(S3)–002. |
| [10] | RIEG T, MASUDA T, GERASIMOVA M, et al. Increase in SGLT1-mediated transport explains renal glucose reabsorption during genetic and pharmacological SGLT2 inhibition in euglycemia[J]. Am J Physiol Renal Physiol, 2014, 306(2): F188–F193. doi:10.1152/ajprenal.00518.2013 |
| [11] | 聂振禹, 陈争跃, 包蓓艳, 等. 一种改良的尿毒症腹膜透析大鼠模型[J]. 中国病理生理杂志, 2013, 29(11): 2109–2112. NIE Zhenyu, CHEN Zhenyue, BAO Beiyan, et al. An improved uremic rat model of peritoneal dialysis[J]. Chinese Journal of Pathophysiology, 2013, 29(11): 2109–2112. (in Chinese) |
| [12] | SANCHEZ R A, SANABRIA H, DE LOS SANTOS C, et al. Incretins and selective renal sodium-glucose co-transporter 2 inhibitors in hypertension and coronary heart disease[J]. World J Diabetes, 2015, 6(11): 1186–1197. |
| [13] | 尚海峰, 刘学政, 李轶, 等. 葡萄糖转运蛋白-1在不同血糖浓度糖尿病大鼠视网膜血管内皮细胞中的表达[J]. 华北煤炭医学院学报, 2007, 9(6): 763–765. SHANG Haifeng, LIU Xuezhen, LI Yi, et al. Expression of glucose transporter 1 protein in retinal vascular endothelial cells of diabetic rats with different blood glucose concentration[J]. Journal of North China Coal Medical College, 2007, 9(6): 763–765. (in Chinese) |
| [14] | SABINO-SILVA R, FREITAS H S, LAMERS M L, et al. Na+-glucose cotransporter SGLT1 protein in salivary glands:potential involvement in the diabetes-induced decrease in salivary flow[J]. J Membr Biol, 2009, 228(2): 63–69. doi:10.1007/s00232-009-9159-3 |
| [15] | KAWANISHI K, HONDA K, TSUKADA M, et al. Neutral solution low in glucose degradation products is associated with less peritoneal fibrosis and vascular sclerosis in patients receiving peritoneal dialysis[J]. Perit Dial Int, 2013, 33(3): 242–251. doi:10.3747/pdi.2011.00270 |
| [16] | KIHM L P, MVLLER-KREBS S, KLEIN J, et al. Benfotiamine protects against peritoneal and kidney damage in peritoneal dialysis[J]. J Am Soc Nephrol, 2011, 22(5): 914–926. doi:10.1681/ASN.2010070750 |
| [17] | WANG X, NIE J, JIA Z, et al. Impaired TGF-beta signalling enhances peritoneal inflammation induced by E. coli in rats[J]. Nephrol Dial Transplant, 2010, 25(2): 399–412. doi:10.1093/ndt/gfp480 |
| [18] | 孙晶, 张虹, 于克洲, 等. 肾素血管紧张素系统抑制剂对长期腹膜透析患者腹膜纤维化和残余肾功能的作用[J]. 中国血液净化, 2010, 9(3): 152–155. SUN Jing, ZHANG Hong, YU Kezhou, et al. Effect of rennin-angiotensin system (RAS) inhibitors on peritoneal fibrosis and residual renal function in peritoneal dialysis patients[J]. Chinese Journal of Blood Purification, 2010, 9(3): 152–155. (in Chinese) |
| [19] | XIN X, LI X H, WU J Z, et al. Pentamethylquercetin ameliorates fibrosis in diabetic Goto-Kakizaki rat kidneys and mesangial cells with suppression of TGF-β/Smads signaling[J]. Eur J Pharmacol, 2013, 713(1-3): 6–15. doi:10.1016/j.ejphar.2013.04.045 |
| [20] | NISHIOKA Y, MIYAZAKI M, ABE K, et al. Regeneration of peritoneal mesothelium in a rat model of peritoneal fibrosis[J]. Ren Fail, 2008, 30(1): 97–105. doi:10.1080/08860220701741619 |




