选择适当的骨修复材料是治疗骨缺损的中心环节。目前,临床上常用的有人工骨移植、自体骨移植和同种异体骨移植。其中,人工骨材料多为磷酸三钙、半水硫酸钙等含有钙和磷的无机矿物材料[1-2],由于不含自体骨组织中的有机大分子Ⅰ型胶原蛋白,其临床疗效远远低于自体骨组织。但是,自体骨移植和同种异体骨移植均来源于人类自身骨组织,数量有限,难以满足临床需要。因此,研发与人类自体骨组织化学成分和分子结构相近的仿生骨材料,成为全世界骨组织工程学者孜孜以求的目标。
由于天然骨组织是Ⅰ型胶原蛋白和羟基磷灰石钙生物矿化的产物,在分子结构上,羟基磷灰石钙晶体是以Ⅰ型胶原纤维为模板,呈片状镶嵌在胶原纤维分子间隙,沿着胶原纤维的长轴纵向矿化生长[3]。本研究仿生天然骨组织的分子结构,酸解提取鼠尾肌腱的Ⅰ型胶原蛋白,重构形成Ⅰ型胶原纤维,然后将Ⅰ型胶原纤维放置在矿化液中模拟人体内骨生物矿化,通过透射电子显微镜(TEM)和电子衍射观察羟基磷灰石钙晶体在胶原纤维内部的骨生物矿化。
1 材料与方法 1.1 主要材料、试剂和仪器鼠尾、盐酸、等渗氯化钠溶液、钙液、磷液均购自上海晶纯生化科技股份有限公司。日立高新TEM HT770(日本日立公司);多功能粉末X射线衍射仪(荷兰PANalytical公司)。
1.2 酸解提取鼠尾Ⅰ型胶原蛋白取大鼠尾巴洗净,用75%的乙醇浸泡5 min。将尾巴剪开,去掉皮毛,并剪成小段,抽出银色的肌腱。将肌键剪断置于平皿中,用无菌等渗氯化钠溶液浸泡。吸去等渗氯化钠溶液,将肌键置于平皿中剪碎,按每克肌键50 mL的比例加入0.1%的醋酸溶液。摇晃,将肌键分散于醋酸溶液中,4 ℃放置一周,然后以2186×g离心20 min。在醋酸溶液的酸解下,肌腱水解成胶冻状凝胶,置于冰箱4 ℃保存。
取胶原蛋白上清液20 μL加入4 mL 6×SDS上样缓冲液,95 ℃静置5 min后,取10 μL进行SDS-PAGE,检测Ⅰ型胶原的相对分子质量,并检测其胶原蛋白浓度。
1.3 Ⅰ型胶原重构组装胶原纤维 1.3.1 组装液的配置50 mmol/L甘氨酸+200 mmol/L氯化钾 100 mL,用1 mol/L 氢氧化钠调节酸碱度至9.2。
1.3.2 胶原纤维的重构吸取胶原10μL至小培养皿中,倒入0.5 mL自组装液,室温放置20 min。予自组装液自组装24 h。吸取0.05%戊二醛2 mL至小培养皿中,将自组装24 h的胶原浸泡在戊二醛中。然后将胶原经去离子水、50%乙醇、100%乙醇依次漂洗后进行TEM观察。
1.4 生物矿化形成仿生骨材料 1.4.1 静滴配置钙磷矿化液将25mL钙液(10 mmol/L 二水氯化钙+150 mmol/L氯化钠+50 mmol/L三羟甲基氨基甲烷+0.02%三氮化钠)倒入烧杯中,滴入聚丙烯酸(PAA)至浓度350 μg/mL;滴加1 mol/L的氯化氢,调节酸碱度至7.4,然后缓慢滴入25 mL磷液(6 mmol/L磷酸氢二钠),约16滴/min。
1.4.2 胶原纤维的生物矿化吸取矿化液倒入小培养皿中,将鼠尾Ⅰ型胶原纤维浸泡在矿化液中。矿化2、6 d后,分别将矿化后的Ⅰ型胶原纤维进行TEM和电子衍射观察。
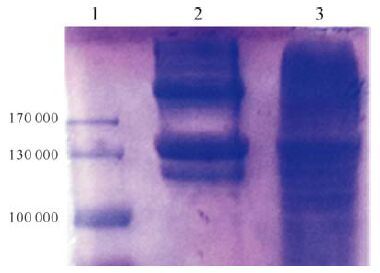
2 结果 2.1 酸解提取鼠尾Ⅰ型胶原及相对分子质量和浓度检测鼠尾肌腱在醋酸溶液的酸解作用下,其腱性组织被水解成胶冻状溶液,从而分解成鼠尾Ⅰ型胶原蛋白分子。抽取鼠尾Ⅰ型胶原150 μL滴在薄膜上,可形成液滴状胶原蛋白凝胶(图 1) ,其生物力学强度极差,一碰即散。将鼠尾胶原蛋白进行SDS-PAGE,结果显示:Ⅰ型胶原蛋白原液在相对分子质量130 000附近有明显条带,另一条带的相对分子质量大于170 000(图 2) 。胶原蛋白浓度为1.8 mg/mL。

|
| 图 1 鼠尾Ⅰ型胶原酸解成胶冻状溶液 Fig. 1 Rat tail tendon collagen type Ⅰ hydrolyzed by acid forms a colloidal solution |
|
| 1:蛋白标记物;2:新鲜胶原蛋白原液;3:室温放置过夜胶原蛋白原液. 图 2 胶原蛋白SDS-PAGE图 Fig. 2 SDS-PAGE result of the collagen |
将酸解提取的鼠尾Ⅰ型胶原进行自组装,Ⅰ型胶原蛋白分子重构成Ⅰ型胶原纤维。在宏观上呈现半透明果冻样胶体,可用镊子夹起(图 3) 。TEM表征显示:Ⅰ型胶原蛋白分子重构成的胶原纤维具有特征性明暗间隔周期性条纹结构,即D-Band结构(图 4) 。胶原染色D-Band结构周期为67 nm,胶原蛋白分子长度为300 nm;螺纹间距为40 nm,重叠长度为27 nm。

|
| 图 3 Ⅰ型胶原蛋白分子经自组装形成半透明果冻样胶体 Fig. 3 Type Ⅰ collagen molecules are self-assembled to form a gel like jelly |

|
| 标尺=200 nm. 图 4 透射电子显微镜下见Ⅰ型胶原蛋白重构成胶原纤维 Fig. 4 Type Ⅰ collagen is composed of collagen fibers |
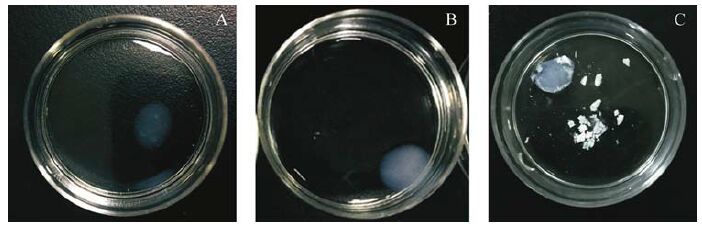
果冻样Ⅰ型胶原蛋白胶体初始浸泡在矿化液中时呈微白色;矿化2 d后,胶体的颜色逐渐加深至乳白色;矿化6 d后,随着羟基磷灰石晶体矿化长入胶原纤维内部,胶体颜色加深至纯白色,并在胶体表面沉积了一层薄薄的羟基磷灰石钙晶体,予镊子夹起,其表层羟基磷灰石钙晶体破碎散落(图 5) 。TEM表征显示:矿化2 d后,Ⅰ型胶原纤维的明暗相隔周期性条纹结构逐渐模糊,羟基磷灰石钙前体渗入胶原纤维内部,胶原纤维部分矿化,沿着胶原纤维生长,忖度变深(图 6A);矿化6 d后,Ⅰ型胶原纤维的明暗相隔D-Band结构完全消失,胶原纤维内部可以看到黑色羟基磷灰石晶体,嵌入胶原纤维纵向生长。当鼠尾Ⅰ型胶原纤维完全矿化时,由于整条胶原纤维都被羟基磷灰石钙晶体占据,胶原纤维呈现黑色,选区衍射斑图符合羟基磷灰石表征(图 6B)。
|
| A:初始胶体呈微白;B:矿化2 d后胶体呈乳白色;C:矿化6 d后,胶体颜色加深至纯白色,并在表面沉积一层羟基磷灰石钙. 图 5 Ⅰ型胶原纤维生物矿化图片 Fig. 5 Biomineralization of type Ⅰ collagen fiber |

|
| A:生物矿化2 d后,Ⅰ型胶原纤维的明暗相隔周期性条纹结构模糊,忖度变深,标尺=100 nm;B:生物矿化6 d后,Ⅰ型胶原纤维的明暗相隔D-Band结构完全消失,有黑色羟基磷灰石晶体,嵌入胶原纤维纵向生长,左上方衍射斑图符合羟基磷灰石表征,标尺=50 nm. 图 6 生物矿化后电子显微镜下Ⅰ型胶原纤维D-Band结构 Fig. 6 Electron microscope shows D-Band structure of type Ⅰ collagen after mineralization |
天然骨组织的生物矿化是以Ⅰ型胶原纤维为模板,然后羟基磷灰石钙在此模板上进行骨生物矿化[4]。因此,Ⅰ型胶原蛋白的分子结构能否自组装成稳定的胶原纤维,对骨生物矿化至关重要。从Ⅰ型胶原蛋白的化学结构来看,其由两条α1链和一条α2链构成,三条肽链呈左手螺旋,每圈3.3个氨基酸,形成三螺旋分子结构。三螺旋结构是Ⅰ型胶原蛋白分子稳定性的基础,决定了胶原蛋白分子能否重构成完整的胶原纤维。只有具有三螺旋结构的胶原蛋白分子才可以通过其α1链在N末端肽第9位置处的醛基与相邻α2链第930位置处的羟赖氨酸残基形成Aldol醇醛键,从而平行重叠自组装成Ⅰ型胶原纤维[5]。自组装成胶原纤维后,胶原蛋白重叠的区域显现成暗区,长度约27 nm,同一水平上胶原蛋白分子首尾之间的间距约40 nm,从而在TEM下形成67 nm具有周期性横纹的胶原纤维,即D-Band结构[6]。所以,D-Band结构是检验胶原蛋白分子是否具有稳定的三螺旋结构、能否自组装成胶原纤维的“金标准”。而胶原蛋白分子的三螺旋结构不稳定,势必会影响到胶原纤维的自组装,从而影响羟基磷灰石在胶原纤维上的生物矿化。这就要求提取胶原蛋白的工艺不能破坏Ⅰ型胶原的三螺旋结构。
目前,国际上对于胶原蛋白的提取有碱法提取、盐法提取和酸解提取。①碱法提取:由于碱容易造成Ⅰ型胶原蛋白三螺旋结构上的肽键水解,因此得到的水解产物相对分子质量较小,甚至是明胶,而非胶原。水解严重时,还会产生D型、L型氨基酸消旋混合物。而有些D型氨基酸是有毒的,有的甚至有致癌、致畸和致突变作用,因此碱法不适合用于生物医用材料的胶原蛋白的提取。②盐法提取:指采用不同浓度的中性盐对提取的胶原蛋白进行盐析,以沉淀出不同类型的胶原蛋白。但是中性盐会降低Ⅰ型胶原蛋白构象的稳定性,因此用盐法提取胶原蛋白也不能保证其三螺旋结构的稳定[7]。③酸解提取:即利用低浓度的酸性条件分解胶原蛋白分子间的席夫碱键和盐键,将失去交联的胶原蛋白分子溶解出来,从而提取胶原。这样提取的胶原蛋白称为酸溶性胶原蛋白。由于鼠尾肌腱本身是以Ⅰ型胶原蛋白为主体,而且又是酸溶性胶原,所以鼠尾肌腱在醋酸的酸解下,腱性固体的胶原纤维可以分解成凝胶状组织。而且醋酸虽然可以水解胶原蛋白分子间的席夫碱键和盐键,但是它不会破坏Ⅰ型胶原蛋白分子的三螺旋结构,保持了Ⅰ型胶原蛋白分子的结构稳定性。只要Ⅰ型胶原蛋白分子的三螺旋结构仍然存在,胶原蛋白分子经过自组装仍然可以形成胶原纤维。本课题组酸解提取的鼠尾Ⅰ型胶原蛋白经过自组装,在TEM下观察到:胶原蛋白分子所形成的胶原纤维具有特有的D-Band结构[6],且条纹结构与文献报道天然胶原纤维染色结构一致。这证明了酸解提取鼠尾Ⅰ型胶原不会影响胶原蛋白分子的三螺旋结构,可保持分子结构的稳定性。
生物矿化除了Ⅰ型胶原蛋白的三螺旋分子结构稳定、是否能够重组成胶原纤维外,矿化液的配置也非常重要。传统观念认为,羟基磷灰石晶体在Ⅰ型胶原蛋白上的矿化依赖于两种因素,即局部因素和体液因素。局部因素需要成骨细胞的代谢活动,形成可供钙化的骨母细胞;体液因素需要由体液供给充分的矿物质离子,其中主要是钙离子和磷酸根离子。以前认为,只要体液中的钙离子和磷酸根离子浓度(mg/dL) 乘积大于40,即可以在胶原蛋白上沉淀羟基磷灰石。曾有学者在模拟体液条件下,直接用钙离子和磷酸根离子与Ⅰ型胶原蛋白进行生物矿化,但是得到的胶原生物矿化效果不佳。例如Deshpande等[8]利用小鼠尾巴肌腱的Ⅰ型胶原蛋白,在模拟体液的环境下,加入 6.68 mmol/L氯化钙和4 mmol/L磷酸氢二铵进行生物矿化,结果显示羟基磷灰石晶体在胶原纤维外部随机分散地无序生长,而并非沿着胶原纤维在其内部有序地进行生物矿化。究其原因,胶原纤维之间的间隙非常狭小,胶原空腔区尚有40 nm的空间,而在胶原重叠区,相邻的两条平行排列原胶原纤维的间距非常小,只有0.24 nm。而直接用钙离子和磷酸根离子形成的磷酸钙晶体体积过大,无法渗入到胶原纤维间隙,所以也无法沿着胶原纤维矿化。所以,矿化液的选择对胶原纤维的矿化极其重要[9]。本实验在矿化液的配置上,并不是直接倒入钙液和磷液进行简单的混合,而是先在25 mL钙液中滴加1 mol/L的氯化氢,调节酸碱度至7.4,然后缓慢滴入磷液。整个过程中溶液的酸碱度都在严密监控下,一旦偏碱,即滴入氯化氢调节,以保证矿化液的配置过程均处于酸碱度为7.4的稳定环境。由于一滴磷液的体积只有0.05 mL,而钙液有25 mL,所以磷液滴入钙液后会被马上稀释分散;在各自分散状态下,钙离子和磷酸根离子不会聚集在有限的空间,团聚成磷酸钙大晶体,而是形成了饱含水分子的无定型磷酸钙。而且矿化液的酸碱度始终处于7.4,钙、磷离子不易矿化合成磷酸钙,而是将钙磷晶体稳定在无定型状态[9]。这种钙磷晶体的无定型状态,恰恰是羟基磷灰石晶体的前体[10-11],而且其体积远小于磷酸钙大晶体[12-13]。再加上无定型磷酸钙饱含水分子,类似于液晶状态,它可以通过毛细血管作用渗入到胶原纤维内部[14]。
由于在Ⅰ型胶原纤维的空腔区,即胶原纤维D-Band结构的明区含有大量的磷酸丝氨酸残基、乳酸根以及谷氨酸残基,而钙的电荷与离子半径之比较大,易与磷酸丝氨酸的磷酸基氧、羧基谷氨酸的羧基氧,以及乳酸根的糖羟基氧结合。因此,在矿化早期,小分子的无定型磷酸钙渗入胶原纤维内部,其所携带的钙离子电荷被磷酸丝氨酸等氨基酸残基所吸引,先在胶原纤维的空腔区形成羟基磷灰石晶核。所以刚刚矿化2 d时,胶原纤维特有的周期性条纹结构模糊,被暗黑色的羟基磷灰石钙前体代替,胶原纤维部分矿化;随着时间的推移,生物矿化继续深入,无定型磷酸钙沿着整条胶原纤维的长轴,横跨空腔区和重叠区轴向生长[3],从而占据整条胶原纤维。当生物矿化第6天时,羟基磷灰石钙前体从无定型状态完全转化为结晶态。羟基磷灰石钙晶体呈片状镶嵌在胶原纤维内部,从而实现了胶原纤维内部的生物矿化。而胶体的颜色随着羟基磷灰石钙晶体的矿化生长,从一开始的半透明,到最后的纯白色,并在表面形成一层矿化结晶,证明了仿骨生物矿化的顺利完成。
综上所述,利用酸解法提取的鼠尾Ⅰ型胶原蛋白具有稳定的三螺旋结构,重构后可以形成具有特征性D-Band结构的胶原纤维。将此胶原纤维放置在静滴制备的钙磷矿化液中,羟基磷灰石钙晶体沿着胶原纤维矿化生长,模拟骨生物矿化,从而形成与人类自体骨组织化学成分和分子结构一致的仿生骨材料。这种仿生骨材料具有良好的组织相容性,且成骨作用优于目前临床应用的磷酸三钙、半水硫酸钙等仅含有钙和磷的无机骨移植材料,有望成为良好的骨移植材料。
| [1] | 李耘, 刘雁鸣, 傅涛, 等. 明胶微粒粒径及含量对明胶微粒与磷酸钙骨水泥复合人工骨材料修复骨缺损的影响[J]. 浙江大学学报(医学版), 2015, 44(3): 293–300. LI Yun, LIU Yanming, FU Tao, et al. Influence of gelatin particle size and gelatin/calcium phosphate cement ratio on repairing potency of composite artificial bone material[J]. Journal of Zhejiang University (Medical Sciences), 2015, 44(3): 293–300. (in Chinese) |
| [2] | 张展, 张春, 郭峭峰, 等. 载万古霉素硫酸钙在骨髓炎治疗中的应用[J]. 中国医学科学院学报, 2013, 35(3): 337–342. ZHANG Zhan, ZHANG Chun, GUO Qiaofeng, et al. Application of vancomycin-loaded calcium sulphate in treatment of osteomyelitis[J]. Acta Academiae Medicinae Sinicae, 2013, 35(3): 337–342. (in Chinese) |
| [3] | OLSZTA M J, CHENG X G, JEE S S, et al. Bone structure and formation:a new perspective[J]. Mat Sci Eng R, 2007, 58(3-5): 77–116. doi:10.1016/j.mser.2007.05.001 |
| [4] | NUDELMAN F, LAUSCH A J, SOMMERDIJK N A, et al. In vitro models of collagen biomineralization[J]. J Struct Biol, 2013, 183(2): 258–269. doi:10.1016/j.jsb.2013.04.003 |
| [5] | NOITUP P, MORRISSEY M T, GARNJANAGOONCHORN W. In vitro self-assembly of silver line grunt type Ⅰ collagen:effect of collagen concentrations, pH and temperatures on collagen self-assembly[J]. J Food Biochem, 2006, 30(5): 547–555. doi:10.1111/jfbc.2006.30.issue-5 |
| [6] | CHAPMAN J A, TZAPHLIDOU M, MEEK K M, et al. The collagen fibril-a model system for studying the staining and fixation of a protein[J]. Electron Microsc Rev, 1990, 3(1): 143–182. doi:10.1016/0892-0354(90)90018-N |
| [7] | ZHANG J J, DUAN R, TIAN Y, et al. Characterisation of acid-soluble collagen from skin of silver carp (hypophthalmichthys molitrix)[J]. Food Chem, 2009, 116(1): 318–322. doi:10.1016/j.foodchem.2009.02.053 |
| [8] | DESHPANDE A S, BENIASH E. Bio-inspired synthesis of mineralized collagen fibrils[J]. Cryst Growth Des, 2008, 8(8): 3084–3090. doi:10.1021/cg800252f |
| [9] | WANG J, CHEN Y, LI L, et al. Remineralization of dentin collagen by meta-stabilized amorphous calcium phosphate[J]. Cryst Eng Comm, 2013, 15(31): 6151–6158. doi:10.1039/c3ce40449h |
| [10] | SANG S J, KASINATH R K, DIMASI E, et al. Oriented hydroxyapatite in turkey tendon mineralized via the polymer-induced liquid-precursor (PILP) process[J]. Cryst Eng Comm, 2011, 13(13): 2077–2083. |
| [11] | CHEN Y, GU W, PAN H, et al. Stabilizing amorphous calcium phosphate phase by citrate adsorption[J]. Cryst Eng Comm, 2014, 16(10): 1864–1867. doi:10.1039/c3ce42274g |
| [12] | JIANG S, CHEN Y, PAN H, et al. Faster nucleation at lower pH:amorphous phase mediated nucleation kinetics[J]. Phys Chem Chem Phys, 2013, 15(30): 12530–12533. doi:10.1039/c3cp51466h |
| [13] | BENIASH E, METZLER R A, LAM R S, et al. Transient amorphous calcium phosphate in forming enamel[J]. J Struct Biol, 2009, 166(2): 133–143. doi:10.1016/j.jsb.2009.02.001 |
| [14] | MAHAMID J, SHARIR A, GUR D, et al. Bone mineralization proceeds through intracellular calcium phosphate loaded vesicles:a cryoelectron microscopy study[J]. J Struct Biol, 2011, 174(3): 527–535. doi:10.1016/j.jsb.2011.03.014 |




