2. 遵义医学院附属口腔医院牙周科, 贵州 遵义 563000;
3. 第四军医大学口腔医院组织工程研究中心 军事口腔医学国家重点实验室, 陕西 西安 710032
2. Department of Periodontics, School of Stomatology, Zunyi Medical College, Zunyi 563000, China;
3. State Key Laboratory of Military Stomatology, Research and Development Center for Tissue Engineering, Fourth Military Medical University, Xi'an 710032, China
微RNA(miRNA,miR-)是一类广泛存在于动物和植物中高度保守的短序列单链小分子RNA,能够以碱基配对的方式与靶基因mRNA 3′-非翻译区结合,通过对其靶基因mRNA翻译抑制或直接降解来发挥其功效,是多种生理及病理过程的关键调控因子[1]。近年来研究发现,miR-133、miR-135、miR-208和miR-141/200a等在MC3T3-E1细胞株骨分化过程中起着关键的调控作用[2-5]。我们在前期实验中发现,绝经后骨质疏松小鼠的骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMMSC)的成骨能力降低,而miR-705在BMMSC和骨组织中异常升高[6]。那么,miR-705是否也参与了BMMSC成骨分化能力的调控呢?本实验通过上调和下调小鼠胚胎成骨细胞前体细胞MC3T3-E1的miR-705表达,在成骨诱导后的早、中、晚期通过不同方法检测其成骨能力的差异,从而探讨miR-705对MC3T3-E1细胞成骨分化的调控作用。
1 材料与方法 1.1 材料α-MEM培养基购自美国Gibco公司;优级FBS购自杭州四季青生物工程材料有限公司;细胞总RNA提取试剂盒、一步法RT-PCR试剂盒购自日本TaKaRa公司;碱性磷酸酶(alkaline phosphates,ALP)染色试剂盒、ALP检测试剂盒购自南京建成生物工程研究所;茜素红购自上海化学试剂采购供应站;IP细胞裂解液、BCA蛋白定量试剂盒购自美国Beyotime公司;miR-705对照物、miR-705模拟物、miR-705抑制物购自广州市锐博生物科技有限公司;siPORTTM NeoFXTM 转染试剂购自美国Ambion公司;MC3T3-E1购自中国科学院上海生科院细胞资源中心;β-actin鼠单克隆抗体、抗小鼠Runt相关转录因子2(runt-related transcription factor 2,Runx2) 、大鼠抗骨钙素(osteocalcin,OCN)抗体购自美国Abcam有限公司。
1.2 MC3T3-E1细胞培养及miR-705转染以1×104个/cm2密度接种,用适量10% FBS α-MEM全培养液培养于37 ℃、5%二氧化碳的孵箱中,2~3 d换液一次,待细胞融合90%,用0.25%胰蛋白酶消化获得细胞,用于后续实验。
于转染前一天将MC3T3-E1更换无血清的培养液,用无双抗的培养液将细胞消化后制备成单细胞悬液,计数后置37 ℃孵育备用。细胞分为三组,分别为对照物组、模拟物组和抑制物组。转染时先稀释siPORTTM NeoFXTM转染试剂(24孔板用量),每孔用量为20 μL培养液(无血清无双抗)+5 μL转染试剂,室温静置10 min;再稀释需要转染的miRNA: miRNA 1.5 μL (10 μmol/L)+20 μL培养基(无血清无双抗),室温静置10 min。将稀释后的转染试剂和miRNA轻轻混匀,室温静置10 min后移至24 孔板。将制备好的细胞悬液以每孔450 μL(4×104)接种于准备好的培养孔中,轻轻晃动培养板使细胞与转染试剂充分接触。置37 ℃孵箱培养,12 h更换完全培养基,72 h后收集细胞,行转染成功与否鉴定。其方法是用总RNA提取试剂盒,一步法提取细胞总RNA,并按照Bulge-LoopTM miRNA qRT-PCR Primer(广州市锐博生物科技有限公司)说明书进行实时定量PCR检测上述MC3T3-E1中miR-705的表达量,miR-705的引物序列均由广州锐博生物科技有限公司合成:miR-705(Product ID: miRQ0003495-1-2) 和 U6(Product ID: MQP-0202) 。实验重复三次。
1.3 ALP/AKP测试盒检测ALP活性及氯化十六烷基吡啶检测矿化结节形成将转染了miR-705模拟物、miR-705抑制物、miR-705对照物的MC3T3-E1加入成骨诱导液(含10 mmol/L β-甘油磷酸钠、10-8mol/L地塞米松、50 μg/mL维生素C的α-MEM培养液)[7]诱导培养7 d后,用ALP试剂盒对各组细胞进行染色,并用ALP测试盒进行定量分析;成骨诱导21 d取各组细胞进行茜素红染色,并用氯化十六烷基吡啶进行定量分析[8]。
1.4 RT-PCR检测Runx2、OCN mRNA表达三组MC3T3-E1细胞成骨诱导培养14 d后收集细胞,按TRIzol说明书抽提各组细胞总RNA,并用逆转录试剂盒合成cDNA。参照基因库,以Primer Premier 5.0软件设计引物;以β-actin为内参照,采用RT-PCR检测,反应体系为:预混合液10 μL、染液0.4 μL、双蒸水(ddH2O) 6.6 μL、上下游引物各0.5 μL、样本模板2 μL;反应条件参照产品说明。实验重复三次,所用引物均由TaKaRa公司合成,各引物基因序列见表 1。
| 基因 | 引物序列 |
| β-actin | 正向:5′-CTGGCACCACACCTTCTACA-3′ |
| 反向:5′-GGTACGACCAGAGGCATACA-3′ | |
| OCN | 正向:5′-CTGACAAAGCCTTCATGTCCAA-3′ |
| 反向:5′-GCGCCGGAGTCTGTTCACTA-3′ | |
| Runx2 | 正向:5′-GACTGTGGTTACCGTCATGGC-3′ |
| 反向:5′-ACTTGGTTTTTCATAACAGCGGA-3′ |
取成骨诱导14 d后的各组细胞,用Western及IP细胞裂解液进行总蛋白提取;用BCA蛋白浓度测定试剂盒进行蛋白定量测定;SDS-PAGE,转膜,封闭,免疫反应;最后进行化学发光反应检测各组Runx2蛋白的表达,用IPP 6.0软件对其灰度值进行定量分析。
1.6 统计学方法采用SPSS 11.0软件进行统计分析。计量资料以均数±标准差(x±s)表示,组间比较采用两独立样本t检验,P<0.05 为差异有统计学意义。
2 结果 2.1 三组细胞表达miR-705功能鉴定模拟物组、对照物组和抑制物组MC3T3-E1细胞miR-705的表达水平分别为47.90±0.07、1.00±0.07和0.22±0.01,转染72 h后,模拟物组中miR-705的表达量较对照物组上调约47倍,抑制物组中miR-705的表达量较对照物组下调了78%。提示通过转染特异性模拟物或抑制物能有效调控MC3T3-E1中miR-705的表达水平,并且在短时间内稳定表达。
2.2 三组细胞 ALP活性比较三组细胞成骨诱导7 d后的ALP染色结果见图 1。三组均有部分细胞呈ALP阳性,细胞质内含有紫色颗粒。定量分析结果显示,模拟物组、对照物组和抑制物组ALP活性(吸光度值)分别为1.00±0.13、5.58±0.44和8.39±0.32,其中,模拟物组的ALP活性低于对照物组和抑制物组(均P<0.05) ,对照物组的ALP活性低于抑制物组(P<0.05) 。
2.3 三组细胞Runx2、OCN mRNA表达比较三组细胞成骨诱导14 d后成骨基因Runx2和OCN mRNA表达水平见表 2。其中,抑制物组Runx2和OCN的mRNA表达量均高于模拟物组(均P<0.05) ,提示miR-705对MC3T3-E1成骨分化中期具有抑制作用。
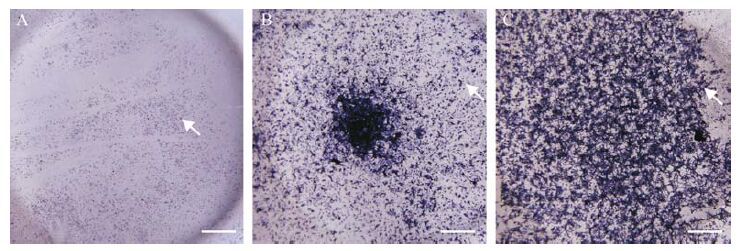
|
| A:模拟物组阳性细胞较少,细胞质内紫色颗粒较小;B:对照物组阳性细胞数目较模拟物组多,紫色颗粒大;C:抑制物组阳性细胞数较多,染色最深,细胞质颗粒大. 白色箭头所示为ALP阳性细胞细胞质内紫色颗粒. 标尺=500 μm. 图 1 三组MC3T3-E1 细胞成骨诱导7 d碱性磷酸酶染色结果 Fig. 1 Alkaline phosphates staining in MC3T3-E1 cells after 7 days of osteogenic induction |
| (x±s) | |||
| 组别 | n | Runx2 | OCN |
| 模拟物组 | 3 | 0.17±0.01 | 0.31±0.02 |
| 对照物组 | 3 | 0.66±0.12* | 0.75±0.14* |
| 抑制物组 | 3 | 1.00±0.17#* | 1.00±0.22#* |
| 与模拟物组比较,*P<0.05;与对照物组比较,#P<0.05. | |||
三组细胞成骨诱导14 d后Runx2和OCN的蛋白表达见图 2。模拟物组、对照物组和抑制物组中Runx2蛋白相对表达量分别为0.83±0.01、1.00±0.21和1.70±0.09,OCN的蛋白相对表达量分别为0.51±0.03、0.81±0.02和2.30±0.04,三组间差异具有统计学意义(均P<0.05) ,其中模拟物组的Runx2和OCN蛋白相对表达量低于抑制物组(均P<0.05) ,提示miR-705在蛋白水平上也对MC3T3-E1成骨分化中期具有抑制作用。
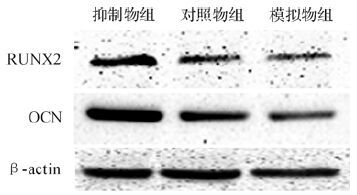
|
| 图 2 三组MC3T3-E1成骨诱导14 d后Runx2和OCN的蛋白表达 Fig. 2 Expression of Runx2 and OCN proteins in MC3T3-E1 cells after 14 days of osteogenic induction |
茜素红染色显示,三组MC3T3-E1细胞都出现大小不等的橘红色团块阳性结节(图 3) 。定量分析结果显示,模拟物组、对照物组、抑制物组茜素红含量(吸光度值)分别为1.00±0.08、2.76±0.28、5.57±0.31,其中模拟物组较对照物组少,抑制物组较对照物组高,差异均有统计学意义(均P<0.05) ,提示miR-705的表达水平与MC3T3-E1细胞矿物质的沉积呈负相关关系。
3 讨论ALP是一种成骨早期标志物,其活性是细胞或者组织发生矿化的前提,影响着矿化组织的形成[9]。ALP活性越高表明细胞向成骨方向分化的程度越高,分泌矿化基质的能力也越强[10]。本研究结果显示,转染了miR-705 模拟物和miR-705 抑制物的MC3T3-E1细胞,经成骨诱导7 d,模拟物组细胞的ALP 染色阳性率和ALP 活性均下降,而转染miR-705 抑制物的结果则相反,提示miR-705在MC3T3-E1细胞成骨分化的早期就参与了对其成骨分化的调控。
成骨相关基因Runx2是调控间充质干细胞向成骨细胞分化过程中的一种骨特异性转录因子,也是成骨细胞分化和功能的中心调控因子,可以调控OCN、ALP、BSP等众多基因的转录[11-12]。而且Runx2在成骨细胞成熟过程中发挥重要作用,可调节骨基质沉积速率[13]。OCN是成骨诱导后晚期分泌的细胞外基质蛋白,其表达量与矿化物质沉积呈正相关,是反映成骨细胞活性的关键指标[14]。本研究结果显示,转染了miR-705模拟物和miR-705抑制物的MC3T3-E1细胞,经成骨诱导14 d,模拟物组细胞的成骨相关基因Runx2和OCN mRNA的表达水平均降低,提示miR-705在基因水平上对MC3T3-E1成骨分化的中期起着抑制作用。为了进一步证实miR-705对MC3T3-E1成骨分化中期的抑制作用,我们从蛋白水平检测了各组细胞中Runx2和OCN的表达量,结果显示,Runx2和OCN 的蛋白表达与mRNA表达变化一致,从而在基因水平和蛋白水平均证明了miR-705在 MC3T3-E1细胞株成骨分化的中期具有抑制成骨分化的作用。
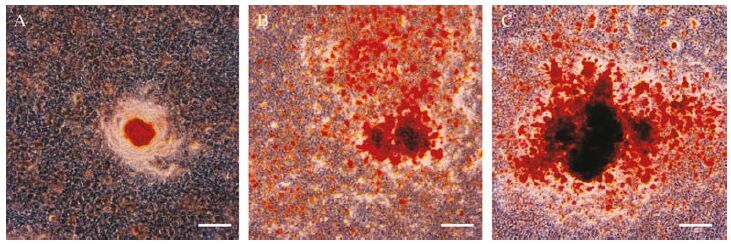
|
| A:模拟物组橘红色阳性钙化结节最小,数量最少,着色浅;B:对照物组橘红色阳性钙化结节较模拟物组大,数量相对较多,着色较深;C:抑制物组橘红色阳性结节最大,数目最多、着色深. 标尺=100 μm. 图 3 三组MC3T3-E1细胞成骨诱导21 d茜素红染色结果 Fig. 3 Alizarin red staining in MC3T3-E1 cells after 21 days of osteogenic induction |
矿化结节是矿化基质形成的特征性指标,是成骨细胞体外成骨表型的最终表达[15],它的形成表明细胞已成骨分化成熟。矿化结节大小、数量及形态反映了细胞的矿化能力。茜素红能选择性地与钙离子结合[16],应用此染色法识别矿化结节较为灵敏,染色后的矿化结节呈红色,肉眼即可观察[17]。本研究抑制物组钙化结节比模拟物组数目多、体积大,进一步说明 miR-705在 MC3T3-E1细胞成骨分化的晚期具有抑制成骨分化的作用。
综上所述,无论是在成骨诱导的早期、中期还是晚期,miR-705均参与了对MC3T3-E1细胞成骨分化的调控。但miR-705通过调控何种成骨转录因子发挥作用还有待进一步研究。同时,我们对miR-705的研究均是体外研究结果,其在体内是否亦能够通过miR-705介导促进干细胞骨缺损修复和再生是后续研究工作的重要内容。
| [1] | LIAN J B, STEIN G S, VAN WIJNEN A J, et al. MicroRNA control of bone formation and homeostasis[J]. Nat Rev Endocrinol, 2012, 8(4): 212–227. doi:10.1038/nrendo.2011.234 |
| [2] | LI Z, HASSAN M Q, VOLINIA S, et al. A microRNA signature for a BMP2-induced osteoblast lineage commitment program[J]. Proc Natl Acad Sci U S A, 2008, 105(37): 13906–13911. doi:10.1073/pnas.0804438105 |
| [3] | LEE K S, KIM H J, LI Q L, et al. Runx2 is a common target of transforming growth factor beta1 and bone morphogenetic protein 2, and cooperation between Runx2 and Smad5 induces osteoblast-specific gene expression in the pluripotent mesenchymal precursor cell line C2C12[J]. Mol Cell Biol, 2000, 20(23): 8783–8792. doi:10.1128/MCB.20.23.8783-8792.2000 |
| [4] | ITOH T, TAKEDA S, AKAO Y. MicroRNA-208 modulates BMP-2-stimulated mouse preosteoblast differentiation by directly targeting V-ets erythroblastosis virus E26 oncogene homolog 1[J]. J Biol Chem, 2010, 285(36): 27745–27752. doi:10.1074/jbc.M110.105080 |
| [5] | ITOH T, NOZAWA Y, AKAO Y. MicroRNA-141 and -200a are involved in bone morphogenetic protein-2-induced mouse pre-osteoblast differentiation by targeting distal-less homeobox 5[J]. J Biol Chem, 2009, 284(29): 19272–19279. doi:10.1074/jbc.M109.014001 |
| [6] | 廖立, 杨晓红, 金岩. 骨质疏松发病过程中骨髓间充质干细胞差异性表达microRNA的筛选及其在干细胞多向分化中的功能[J]. 浙江大学学报(医学版), 2012, 50(41): 75–80. LIAO Li, YANG Xiaohong, JIN Yan. Screening of differentially expressed microRNAs in bone marrow-derived mesenchymal stem cells during osteoporosis and their function in stem cell differentiation[J]. Journal of Zhejiang University (Medical Sciences), 2012, 50(41): 75–80. (in Chinese) |
| [7] | CHANG J, WANG Z, TANG E, et al. Inhibition of osteoblastic bone formation by nuclear factor-kappaB[J]. Nat Med, 2009, 15(6): 682–689. doi:10.1038/nm.1954 |
| [8] | BODINE P V, TRAILSMITH M, KOMM B S. Development and characterization of a conditionally transformed adult human osteoblastic cell line[J]. J Bone Miner Res, 1996, 11(6): 806–819. |
| [9] | SAMMONS J, AHMED N, EL-SHEEMY M, et al. The role of BMP-6, IL-6, and BMP-4 in mesenchymal stem cell-dependent bone development:effects on osteoblastic differentiation induced by parathyroid hormone and vitamin D(3)[J]. Stem Cells Dev, 2004, 13(3): 273–280. doi:10.1089/154732804323099208 |
| [10] | HUGHES F J, TURNER W, BELIBASAKIS G, et al. Effects of growth factors and cytokines on osteoblast differentiation[J]. Periodontol 2000, 2006, 41(1): 48–72. doi:10.1111/prd.2006.41.issue-1 |
| [11] | THIRUNAVUKKARASU K, MAHAJAN M, MCLARREN K W, et al. Two domains unique to osteoblast-specific transcription factor Osf2/Cbfa1 contribute to its transactivation function and its inability to heterodimerize with Cbfbeta[J]. Mol Cell Biol, 1998, 18(7): 4197–4208. doi:10.1128/MCB.18.7.4197 |
| [12] | KIKUCHI K, FUKUDA M, ITO T, et al. Transcripts of unknown function in multiple-signaling pathways involved in human stem cell differentiation[J]. Nucleic Acids Res, 2009, 37(15): 4987–5000. doi:10.1093/nar/gkp426 |
| [13] | WALKER M R, PATEL K K, STAPPENBECK T S. The stem cell niche[J]. Pathol, 2009, 217(1): 169–180. |
| [14] | ENOMOTO H, FURUICHI T, ZANMA A, et al. Runx2 deficiency in chondrocytes causes adipogenic changes in vitro[J]. J Cell Sci, 2004, 117(Pt 3): 417–425. |
| [15] | POZET A, WESTEEL V, BERION P, et al. Rurality and survival differences in lung cancer:a large population-based multivariate analysis[J]. Lung Cancer, 2008, 59(3): 291–300. doi:10.1016/j.lungcan.2007.08.039 |
| [16] | LEE D S, KANG J H, LEE C G, et al. Predicting survival in patients with advanced non-squamous non-small cell lung cancer:validating the extent of metastasis[J]. Cancer Res Treat, 2013, 45(2): 95–102. doi:10.4143/crt.2013.45.2.95 |
| [17] | HOANG T, DAHLBERG S E, SCHILLER J H, et al. Does histology predict survival of advanced non-small cell lung cancer patients treated with platin-based chemotherapy? An analysis of the Eastern Cooperative Oncology Group Study E1594[J]. Lung Cancer, 2013, 81(1): 47–52. doi:10.1016/j.lungcan.2013.03.018 |




