2. 兰州理工大学生命科学与工程学院, 甘肃 兰州 730050
2. College of Life Science and Engineering, Lanzhou University of Technology, Lanzhou 730050, China
骨质疏松症是以骨密度降低、骨微结构破坏为特征,导致骨组织脆性增加和骨折危险性升高的一种常见老年骨病[1]。其在发病初期没有明显的症状,直到引起骨折,因此被称作“悄无声息的杀手”[2]。目前治疗骨质疏松症的方法主要有雌激素替代疗法和双膦酸盐疗法,但是都有一定的副作用[3],因此人们试图寻找一种安全有效的骨质疏松症治疗方法。近年来,骨质疏松症的物理疗法成为一个热门话题,大量文献表明,电磁场可以促进成骨细胞分化成熟[4-6],然而其中作用机制不明。
细胞是一个多层次、非线性、复杂的系统[7],通过各方面的协调感知外界环境的刺激,完成一系列生理生化反应以维持自身的稳态。激素类物质在这个过程中发挥着重要作用,其经被动扩散进入细胞后与受体结合,使受体构象发生变化而暴露核定位序列,进而与激素反应元件结合,启动相关基因的转录,引起相应的生物学效应,被称为基因组效应。此外,其也可以与质膜表面受体结合或与质膜上的其他蛋白相互作用,启动信号级联,引起细胞快速的应激反应,被称为非基因组效应[8]。非基因组效应又分为特异性非基因组效应和非特异性非基因组效应,其中特异性非基因组效应主要通过细胞膜上的膜受体或细胞质中的受体介导,而非特异性非基因组效应主要通过与细胞膜的直接物理化学反应调节基因的表达[9]。在细胞的代谢调节过程中,基因组效应和非基因组效应往往相互重叠,即非基因组效应最终会引起基因转录的改变[10]。那么脉冲电磁场(pulsed electromagnetic fields,PEMF)在促进成骨细胞矿化成熟的过程中是否也存在基因调节和非基因调节?对此本文进行了研究,以期进一步了解电磁场促进骨形成的机制。
1 材料与方法 1.1 低频电磁场细胞处理仪实验所用极低频电磁场细胞处理仪由本课题组自行研制(发明专利号:ZL2011 10423102.0) 。整套装置由电脑控制系统、数模转化装置、信号放大装置、线圈、磁场传感器及温度传感器等组成。其中线圈使用Opera 3D大型磁场工程软件辅助设计完成,长27 cm,由三组相互串联的不同匝数的线圈缠绕内径为10 cm的螺线管而成,可在其内部120 mm×90 mm×90 mm的区域内产生频率为5~200 Hz,强度为0.0~9.0 mT的大范围均匀磁场(均匀偏差值<5%),确保60 mm培养皿内所有细胞受到相同均匀磁场处理。实验过程中,为保证细胞不受除电磁场以外的其他因素影响,线圈置于细胞培养箱中,通过导线与外部装置连接。
1.2 实验动物及材料出生48 h以内的SPF级Wistar大鼠[甘肃省中医药大学动物实验中心,合格证号:SCXK(甘)2004-0006-152];α-MEM培养基(Gibco,美国);胎牛血清(兰州民海生物工程有限公司);胰蛋白酶(西安科昊生物工程有限责任公司);Ⅱ型胶原酶(Gibco,美国);碱性磷酸酶(alkaline phosphates,ALP)试剂盒(南京建成生物工程研究所);RNAiso Plus试剂、PrimeScriptTM试剂盒、PCR扩增试剂盒(大连宝生物工程有限公司);PIRA蛋白裂解液(北京普利莱基因技术有限公司);苯甲基磺酰氟(PMSF)、5×蛋白上样缓冲液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶制备试剂盒、ECL Plus超敏发光液(北京索莱宝科技有限公司);Runt相关转录因子2(Runx2) 抗体、Osterix(OSX)抗体(Abcam,美国);β-actin抗体(BioWorld Technology,美国);辣根过氧化物酶标二抗(上海碧云天生物技术有限公司)。
1.3 大鼠颅骨成骨细胞(rat calvarial osteoblasts,ROB)的分离和培养如文献[11]所述,取出生48 h以内的Wistar大鼠5只,置于75%的乙醇中消毒后处死,取颅骨,剔除血管、结缔组织等,PBS漂洗后剪成约2 mm2的骨碎片置于培养瓶中,加入约3 mL 0.25%的胰蛋白酶37 ℃水浴消化10 min,弃消化液,重复一次,换用0.1%的Ⅱ型胶原酶37 ℃水浴消化10 min,弃消化液,之后用0.1%的Ⅱ型胶原酶37 ℃水浴消化三次,每次20 min,其消化液收集于装有约10 mL含10%胎牛血清的α-MEM培养液的培养瓶中,200目细胞筛过滤除去残余骨片,以相对离心力175.6×g离心10 min,弃上清液,细胞沉淀经重悬后调整密度至3×104 细胞/mL,接种于90 mm培养皿中,置于37 ℃ 5%二氧化碳培养箱中培养,待细胞生长至90%以上融合时,用0.25%的胰蛋白酶消化传代用于实验。
1.4 比色法测定ALP活性P1代ROB生长至完全融合时随机分为对照组、0 h组、3 h组、6 h组、9 h组和12 h组。除对照组不作任何处理外,其余各组经电磁场处理1.5 h后分别于0、3、6、9、12 h后检测其ALP活性。测定方法如试剂盒说明书所述,即弃培养液,PBS漂洗三次后加入基质液和缓冲液各250 μL,轻微振荡混匀后37 ℃孵育15 min,加入显色液750 μL,轻微振荡混匀后于波长520 nm处测定吸光度值,通过换算获得细胞ALP活性值。
1.5 实时荧光定量RT-PCR检测成骨基因表达P1代ROB生长至完全融合时按照1.4所述分组并进行相应处理,之后弃培养液,PBS漂洗三次,加入1 mL RNAiso Plus试剂裂解细胞,收集细胞裂解液,加入200 μL氯仿,振荡混匀后4 ℃ 14 006×g离心15 min,吸取上清液加入等体积的异丙醇,轻微上下颠倒混匀后4 ℃ 14 006×g离心15 min,弃上清液,加入1 mL 75%的乙醇清洗沉淀,4 ℃ 14 006×g离心15 min,弃上清液后加入适量DEPC水溶解沉淀,紫外分光光度计于波长230、260、280、320 nm处检测RNA质量,根据RNA浓度使用PrimeScriptTM试剂盒递转录:37 ℃ 15 min,85 ℃ 5 s,递转录产物cDNA使用PCR扩增试剂盒扩增:95 ℃ 30 s变性,95 ℃ 5 s退火,60 ℃ 31 s延伸,40个循环。引物序列见表 1。数据使用2-△△CT法进行分析。
| 基因 | 引物序列 |
| Gapdh | 正向:5′-GGCACAGTCAAGGCTGAGAATG-3′ 反向:5′-ATGGTGGTGAAGACGCCAGTA-3′ |
| ALP | 正向:5′-CACGTTGACTGTGGTTACTGCTGA-3′ 反向:5′-CCTTGTAACCAGGCCCGTTG-3′ |
| Runx2 | 正向:5′-GCACCCAGCCCATAATAGA-3′ 反向:5′-TTGGAGCAAGGAGAACCC-3′ |
| OSX | 正向:5′-GCCTACTTACCCGTCTGACTTT-3′ 反向:5′-GCCCACTATTGCCAACTGC-3′ |
P1代ROB生长至完全融合时按照1.4所述分组并进行相应处理,之后弃培养液,PBS漂洗三次,加入400 μL(含1% PMSF)PIRA蛋白裂解液裂解细胞,收集细胞裂解液,4 ℃ 14 006×g离心30 min,收集上清液,取25 μL使用BCA蛋白浓度测定试剂盒测定蛋白质浓度,剩余上清液中加入1/4体积的上样缓冲液,沸水浴10 min,取20 μg进行SDS-PAGE,然后电转至PVDF膜上,5%脱脂奶粉室温封闭2 h,一抗4 ℃孵育过夜,TBST清洗(8 min×4) 后二抗室温孵育2 h,TBST清洗(8 min×4) 后使用ECL Plus超敏发光液发光显影,结果条带使用IPP 6.0软件进行量化处理。
1.7 统计学方法所有实验均重复三次,采用SPSS 20.0统计软件分析,结果以均数±标准差(x±s)表示,组间比较采用单因素方差分析(One-way ANOVA),组间多重比较采用LSD方法,以P<0.05为差异有统计学意义。
2 结果 2.1 电磁场处理后不同时间ALP活性的变化P1代ROB经电磁场处理后0、3、6、9和12 h检测ALP活性,结果如图 1所示。ALP活性在电磁场处理后3 h出现峰值,与对照组比较差异有统计学意义(P<0.01) ,而其他各组ALP活性与对照组比较差异均无统计学意义(均P>0.05) ,说明电磁场处理可引起ROB ALP活性的短暂升高。
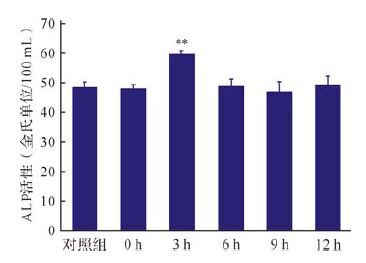
|
| 与对照组比较,**P<0.01. 图 1 电磁场处理后不同时间大鼠颅骨成骨细胞中碱性磷酸酶(ALP)活性的变化 Fig. 1 Alkaline phosphates (ALP) activity in calvarial osteoblasts of rats received pulsed electromagnetic fields treatment |
电磁场处理后0、3、6、9和12 h时ALP基因表达变化如图 2。ALP的表达量在电磁场处理后6 h升高(P<0.05) ,之后继续升高,与ALP活性变化不对应,提示电磁场处理后3 h时ALP活性的短暂升高并非由于ALP基因表达的升高而致。
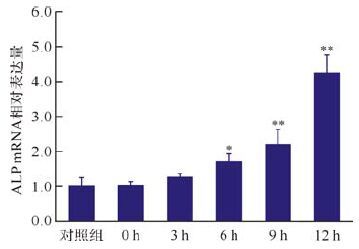
|
| 与对照组比较,*P<0.05,**P<0.01. 图 2 电磁场处理后不同时间大鼠颅骨成骨细胞中碱性磷酸酶(ALP)基因表达的变化 Fig. 2 mRNA expression of ALP in calvarial osteoblasts of rats received pulsed electromagnetic fields treatment |
电磁场处理后不同时间ROB中Runx2和OSX的mRNA表达结果如图 3所示。Runx2的表达量在处理后立即升高(与对照组比较,P<0.05) ,3 h时继续升高,6 h时回归对照组水平(与对照组比较,P>0.05) ,9 h时再次升高,之后继续升高;OSX的表达量在电磁场处理后亦立即升高(P<0.01) ,持续至处理后3 h后下降,至6 h时回归对照组水平(与对照组比较,P>0.05) ,至12 h时低于对照组(与对照组比较,P<0.05) ,提示电磁场处理引起了ROB骨形成相关因子Runx2和OSX基因表达的升高。

|
| 与对照组比较,*P<0.05,**P<0.01. 图 3 电磁场处理后不同时间大鼠颅骨成骨细胞中Runx2和OSX基因表达的变化 Fig. 3 mRNA expression of osteogenic genes in calvarial osteoblasts of rats received pulsed electromagnetic fields treatment |
为了解经电磁场处理后ROB基因与蛋白表达的对应性,检测了Runx2和OSX的蛋白表达水平,结果如图 4、5所示。Runx2的表达量在处理后立即升高 (与对照组比较,P<0.01) ,至9 h时回归对照组水平(与对照组比较,P>0.05) ,12 h时再次升高(与对照组比较,P<0.01) ;OSX的表达量在处理后亦立即升高(与对照组比较,P<0.05) ,之后继续升高(与对照组比较,P<0.01) ,持续至处理后6 h,于9 h时回归对照组水平(与对照组比较,P>0.05) 。上述蛋白表达水平变化与Runx2和OSX基因表达存在一定的对应性,提示电磁场通过影响Runx2和OSX的转录而改变其蛋白的表达水平。

|
| 图 4 电磁场处理后不同时间大鼠颅骨成骨细胞中Runx2和OSX蛋白表达的电泳图 Fig. 4 Electrophoretogram of Runx2 and OSX expression in calvarial osteoblasts of rats received pulsed electromagnetic fields treatment |
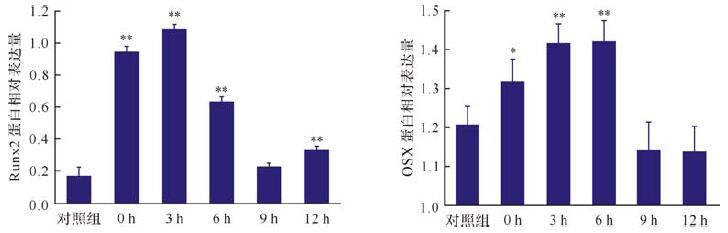
|
| 与对照组比较,*P<0.05,**P<0.01. 图 5 电磁场处理后不同时间大鼠颅骨成骨细胞中Runx2和OSX蛋白表达的变化 Fig. 5 Protein expression of Runx2 and OSX in calvarial osteoblasts of rats received pulsed electromagnetic fields treatment |
PEMF已广泛用于促进骨折愈合及一系列相关骨病的治疗[12-13],但其发挥作用存在“窗效应”[14]。本课题组研究发现,50 Hz 0.6 mT PEMF作用1.5 h能够显著促进大鼠ROB矿化成熟[15-16],但作为一种物理疗法,其具体的作用机制尚不明确。力学载荷在维持生物骨量方面发挥重要作用,研究显示其通过活化雌激素受体α、β,以非配体依赖的方式激活相关信号级联反应,促进骨形成[17-18]。进一步的研究表明,其引起的成骨效应与雌激素所产生的成骨效应属同一途径[19]。而雌激素发挥作用存在基因组效应和非基因组效应,在骨代谢调节方面主要通过非基因组效应起作用[20]。那么同作为物理刺激,电磁场是否与力学载荷作用类似,通过非基因调节促进骨形成?对此本文通过检测电磁场处理后不同时间ROB成骨性基因、蛋白表达的变化以及ALP活性的变化发现,电磁场通过不同机制多角度促进骨形成。
ALP活性与骨组织钙化息息相关[21],是成骨细胞外基质矿化成熟的早期标志。本文通过检测ALP活性及ALP基因的表达发现,ALP活性在电磁场处理后3 h升高,但ALP基因却没有与其相对应,而是在处理后逐渐升高,至6 h时才高于对照组,之后继续升高,表明在电磁场处理后3 h时ALP活性的短暂升高并非由于其基因表达的升高而引起,而是由于其他因素。有研究显示,电磁场可以调节离体酶的活性[22],而ALP属金属酶,活性部位由Asp-Ser-Ala、空间上相互靠近的两个锌离子、镁离子及配体组成[23]。金属离子在酶发挥催化作用时起重要作用,电磁场或许影响了金属离子,进而影响了酶与底物的定向,从而提高了酶活性。同时电磁场也可能通过激活一系列信号级联反应而影响ALP的活性[24]。因此我们推测电磁场在促进骨形成的过程中存在对ALP活性的非基因调节。
Runx2和OSX作为转录因子,可以活化骨钙素、Ⅰ型胶原等的表达,是成骨性分化的重要指标[25],本研究通过检测Runx2和OSX的基因及蛋白表达发现,电磁场处理后Runx2基因的表达迅速升高,延续至处理后6 h时回归对照组水平,之后再次升高,其蛋白的表达与之相对应;OSX基因的表达亦在处理后立即升高,持续至处理后6 h时降至对照组水平,其蛋白表达亦与之对应,表明电磁场通过影响Runx2、OSX基因的表达而影响其蛋白的表达。因此我们推测电磁场在促进骨形成的过程中存在对转录因子Runx2和OSX的基因调节。
自1977年Bassett使用脉冲电磁场成功治愈一例骨折病例以来,电磁场已广泛应用于骨质疏松症等一系列相关骨病的治疗[26]。然而作为一种物理刺激,其不存在直接的、特异性的细胞因子及其靶点,也因此导致其具体的作用机制至今仍不十分明确。本研究通过检测电磁场处理后不同时间ROB的ALP活性、骨形成相关因子基因及蛋白的表达,推测电磁场促进骨形成不仅存在基因调节,而且存在非基因调节。然而电磁场作为一种能量表现形式引起这些效应的机制,有待进一步研究。
| [1] | KANIS J A, MELTON L J, CHRISTIANSEN C, et al. The diagnosis of osteoporosis[J]. J Bone Miner Res, 1994, 9(8): 1137–1141. |
| [2] | KULAR J, TICKNER J, CHIM S M, et al. An overview of the regulation of bone remodelling at the cellular level[J]. Clin Biochem, 2012, 45(12): 863–873. doi:10.1016/j.clinbiochem.2012.03.021 |
| [3] | LI X D, LIU Z Y, CHANG B, et al. Panax notoginseng saponins promote osteogenic differentiation of bone marrow stromal cells through the ERK and p38 MAPK signaling pathways[J]. Cell Physiol Biochem, 2011, 28(2): 367–376. doi:10.1159/000331753 |
| [4] | MARTINO C F, BELCHENKO D, FERGUSON V, et al. The effects of pulsed electromagnetic fields on the cellular activity of SaOS-2 cells[J]. Bioelectromagnetics, 2008, 29(2): 125–132. doi:10.1002/(ISSN)1521-186X |
| [5] | WIESMANN H P, HARTIG M, STRATMANN U, et al. Electrical stimulation influences mineral formation of osteoblast-like cells in vitro[J]. Biochim Biophys Acta, 2001, 1538(1): 28–37. doi:10.1016/S0167-4889(00)00135-X |
| [6] | TAYLOR K F, INOUE N, RAFIEE B, et al. Effect of pulsed electromagnetic fields on maturation of regenerate bone in a rabbit limb lengthening model[J]. J Orthop Res, 2006, 24(1): 2–10. doi:10.1002/(ISSN)1554-527X |
| [7] | 翟中和,王喜忠,丁明孝. 细胞生物学[M]. 2版. 北京:高等教育出版社,2000:19. ZHAI Zhonghe, WANG Xizhong, DING Mingxiao. Cell biology[M]. 2nd ed. Beijing:Higher Education Press, 2000:19. (in Chinese) |
| [8] | 孙大业,崔素娟,孙颖. 细胞信号转导[M]. 4版. 北京:科学出版社,2010:68-69. SUN Daye, CUI Sujuan, SUN Ying. Cellular signal transduction[M]. 4th ed. Beijing:Science Press, 2010:68-69. (in Chinese) |
| [9] | 鞠辉明, 陈星云, 刘宗平, 等. 糖皮质激素非基因组效应的研究[J]. 现代生物医学进展, 2009, 9(14): 2741–2744. JU Huiming, CHEN Xingyun, LIU Zongping, et al. Research on non-genomic glucocorticoid effects[J]. Progress in Modern Biomedicine, 2009, 9(14): 2741–2744. (in Chinese) |
| [10] | DAVIS P J, LIN H Y, MOUSA S A, et al. Overlapping nongenomic and genomic actions of thyroid hormone and steroids[J]. Steroids, 2011, 76(9): 829–833. |
| [11] | ZHOU J, MING L G, GE B F, et al. Effects of 50Hz sinusoidal electromagnetic fields of different intensities on proliferation, differentiation and mineralization potentials of rat osteoblasts[J]. Bone, 2011, 49(4): 753–761. doi:10.1016/j.bone.2011.06.026 |
| [12] | SCHWARTZ Z, FISHER M, LOHMANN C H, et al. Osteoprotegerin (OPG) production by cells in the osteoblast lineage is regulated by pulsed electromagnetic fields in cultures grown on calcium phosphate substrates[J]. Ann Biomed Eng, 2009, 37(3): 437–444. doi:10.1007/s10439-008-9628-3 |
| [13] | LI K, MA S, LI Y, et al. Effects of PEMF exposure at different pulses on osteogenesis of MC3T3-E1 cells[J]. Arch Oral Biol, 2014, 59(9): 921–927. doi:10.1016/j.archoralbio.2014.05.015 |
| [14] | MANNI V, LISI A, RIETI S, et al. Low electromagnetic field (50 Hz) induces differentiation on primary human oral keratinocytes (HOK)[J]. Bioelectromagnetics, 2004, 25(2): 118–126. doi:10.1002/(ISSN)1521-186X |
| [15] | YAN J L, ZHOU J, MA H P, et al. Pulsed electromagnetic fields promote osteoblast mineralization and maturation needing the existence of primary cilia[J]. Mol Cell Endocrinol, 2015, 404: 132–140. doi:10.1016/j.mce.2015.01.031 |
| [16] | 周建, 葛宝丰, 陈克明, 等. 正弦交变电磁场促进体外培养成骨细胞成熟矿化的时间效应[J]. 生物医学工程学杂志, 2011, 28(6): 1085–1088. ZHOU Jian, GE Baofeng, CHEN Keming, et al. Time effect of sinusoidal elctromagnetic on enhanceing the maturation and mineralization of osteoblast in vitro[J]. Journal of Biomedical Engineering, 2011, 28(6): 1085–1088. (in Chinese) |
| [17] | WINDAHL S H, SAXON L, BÖRJESSON A E, et al. Estrogen receptor-α is required for the osteogenic response to mechanical loading in a ligand-independent manner involving its activation function 1 but not 2[J]. J Bone Miner Res, 2013, 28(2): 291–301. doi:10.1002/jbmr.1754 |
| [18] | AGUIRRE J I, PLOTKIN L I, GORTAZAR A R, et al. A novel ligand-independent function of the estrogen receptor is essential for osteocyte and osteoblast mechanotransduction[J]. J Biol Chem, 2007, 282(35): 25501–25508. doi:10.1074/jbc.M702231200 |
| [19] | GALEA G L, PRICE J S, LANYON L E. Estrogen receptors' roles in the control of mechanically adaptive bone (re)modeling[J]. Bonekey Rep, 2013, 2: 413. |
| [20] | KOUSTENI S, CHEN J R, BELLIDO T, et al. Reversal of bone loss in mice by nongenotropic signaling of sex steroids[J]. Science, 2002, 298(5594): 843–846. doi:10.1126/science.1074935 |
| [21] | JI Z, CHENG Y, YUAN P, et al. Panax notoginseng stimulates alkaline phosphatase activity, collagen synthesis, and mineralization in osteoblastic MC3T3-E1 cells[J]. In Vitro Cell Dev Biol Anim, 2015, 51(9): 950–957. doi:10.1007/s11626-015-9915-x |
| [22] | VOJISAVLJEVIC V, PIROGOVA E, COSIC I. Review of studies on modulating enzyme activity by low intensity electromagnetic radiation[J]. Conf Proc IEEE Eng Med Biol Soc, 2010, 2010: 835–838. |
| [23] | 王秋颖. 碱性磷酸酶特性及其应用的研究进展[J]. 中国畜牧兽医, 2011, 38(1): 157–161. WANG Qiuying. Advances on characteristic and application of alkaline phosphatase[J]. China Animal Husbandry & Veterinary Medicine, 2011, 38(1): 157–161. (in Chinese) |
| [24] | TANG J, YUAN Z, YANG L, et al. Exposure to 900MHz electromagnetic fields activates the mkp-1/ERK pathway and causes blood-brain barrier damage and cognitive impairment in rats[J]. Brain Res, 2015, 1601: 92–101. doi:10.1016/j.brainres.2015.01.019 |
| [25] | SOLTANOFF C S, YANG S, CHEN W, et al. Signaling networks that control the lineage commitment and differentiation of bone cells[J]. Crit Rev Eukaryot Gene Expr, 2009, 19(1): 1–46. doi:10.1615/CritRevEukarGeneExpr.v19.i1 |
| [26] | TABRAH F, HOFFMEIER M, GILBERT F, et al. Bone density changes in osteoporosis-prone women exposed to pulsed electromagnetic fields (PEMFs)[J]. J Bone Miner Res, 1990, 5(5): 437–442. doi:10.1002/jbmr.5650050504 |




