2. 浙江大学医学院药理学系, 浙江 杭州 310058
2. Department of Pharmacology, Zhejiang University School of Medicine, Hangzhou 310058, China
卷烟中含大量有害物质, 这些物质能在肺部长期滞留, 从而导致炎症反应, 产生肺部损伤[1-2]。研究发现, 即使没有出现气流受限, 健康吸烟者肺部仍然有轻度炎症。Witschi等[3-4]使用AJ系小鼠成功建立了吸烟导致肺癌的动物模型, 该模型的适用性已被不同的实验室所证实。后续有大量有关吸烟导致实验动物肺部损伤的研究, 但大多采用持续烟气全身暴露或固定烟气浓度暴露的方式进行, 这种方式与人体吸烟方式相距甚远[5-8]。
焦油是卷烟烟气中的主要有害物质, 是烟丝中糖类、蛋白质等有机物质在缺氧条件下不完全燃烧的产物, 由多种烃及烃的氧化物、硫化物和氮化物等复杂化合物组成。虽然卷烟焦油中有害成分含量不高, 但种类众多, 如苯并芘等多环芳烃(PAH)、酚类化合物及其衍生物、各种羟基自由基等。这些有害物质进入人体内会导致肺癌、口腔癌、冠心病、肺部慢性炎症等多种疾病, 严重危害人体健康, 因此世界各国对卷烟中焦油的含量进行了明确的法律限定, 并将其作为衡量卷烟质量和安全性的主要标准之一[9-11]。目前市售卷烟的烟盒上标有的物质含量均指用国际标准抽吸模式(简称“国标抽吸”)测得的主流烟气中焦油、一氧化碳及尼古丁的含量。本研究采用吸烟机结合大鼠口鼻暴露塔的方式, 观察国标抽吸和加拿大深度抽吸模式(简称“深度抽吸”)诱导大鼠肺损伤, 通过对吸烟大鼠体质量变化、肺部炎症细胞浸润、炎症因子分泌及肺组织中氧化应激因子水平等的评估, 判断急性肺损伤的程度, 以期改进吸烟诱导的肺损伤动物模型。
1 材料与方法 1.1 仪器和试剂吸烟机(HRH-SM120)及大鼠口鼻暴露系统(HRH-3025)购自北京慧荣和科技有限公司; 切片机(RM2235)购自徕卡显微系统(上海)贸易有限公司; IL-1β和TNF-α ELISA试剂盒购自杭州联科生物技术股份有限公司; 髓过氧化物酶(MPO)、还原型谷胱甘肽(GSH)、超氧化物歧化酶(SOD)、活性氧、丙二醛检测试剂盒购自南京建成生物科技有限公司; 其它试剂均为国产分析纯。
1.2 卷烟样品卷烟样品为市售的烤烟型卷烟, 焦油含量分别为11、5、1 mg, 实验前在(22±1)℃、相对湿度为(60±2)%的条件下平衡48 h。
1.3 实验动物SD雄性大鼠50只, 体质量为(220±20) g, 购自上海斯莱克实验动物有限公司。吸烟时大鼠均饲养于空气洁净度为十万级的动物房, 室温为(21±1)℃, 湿度为(58±4)%, 昼夜周期为12 h/12 h。分为五组:空白对照组、1 mg深度抽吸组、5 mg深度抽吸组、11 mg深度抽吸组、11 mg国标抽吸组, 每组10只。
1.4 大鼠口鼻吸烟方法采用大鼠口鼻暴露系统, 维持载气流量8 L/min, 抽气流量9.5 L/min, 氧气浓度(20±0.5)%, 温度(24±2)℃, 相对湿度60%~80%。采用单孔道吸烟机, 经深度抽吸或国标抽吸产生的卷烟烟气, 经空气载入口鼻暴露塔后, 经过大鼠口鼻暴露口。在此过程中大鼠吸入烟气, 多余未吸入烟气及大鼠呼出烟气随载气排出, 同时测定大鼠口鼻暴露口卷烟烟雾质量浓度。过程示意见图 1。大鼠每天连续吸烟20支, 共持续28 d; 空白对照组抽吸空气。深度抽吸参数:抽吸体积55 mL, 抽吸间隔时间30 s, 抽吸持续时间2 s; 国标抽吸参数:抽吸体积35 mL, 抽吸间隔60 s, 抽吸时间2 s [12]。1 mg深度抽吸组、5 mg深度抽吸组、11 mg深度抽吸组、11 mg国标抽吸组分别采用含焦油为1、5、11、11 mg的卷烟进行抽吸。
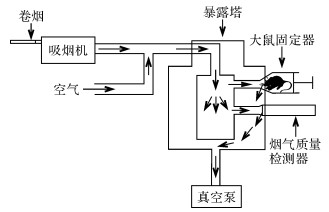
|
| 图 1 吸烟机结合大鼠口鼻暴露塔吸烟示意图 Fig. 1 Schematic diagram of rats smoking by way of smoking machine combined with the nose and mouth expose tower |
最后一次吸烟后18 h麻醉处死大鼠, 左肺采用PBS进行肺泡灌洗, 取回收率大于80%的肺泡灌洗液进行细胞计数, 并离心取上清液。上清液及右上两叶肺组织冻存于-80 ℃; 细胞沉淀涂片后, 进行瑞氏-吉姆萨染色及分类计数。
1.6 HE染色肺组织病理学检测右肺下叶肺组织经10%甲醛固定一周后, 取材, 脱水, 透明, 石蜡包埋, 切片并进行HE染色, 观察肺部炎症细胞浸润。
1.7 ELISA法检测IL-1β及TNF-α含量取冻存于-80 ℃的灌洗液上清液, 冰上融化后, 按照说明书进行ELISA检测。
1.8 MPO、GSH、SOD、活性氧、丙二醛浓度检测取冻存于-80 ℃的右肺上叶肺组织, 精密称重, 匀浆后取上清液, 按检测试剂盒说明书对大鼠右肺上叶肺组织中的MPO、GSH、SOD、活性氧、丙二醛浓度进行检测。
1.9 统计学方法采用SPSS 16.0软件包进行统计分析。实验数据采用均数±标准差(x±s)表示, 比较采用单因素方差分析(one-way ANOVA), 多个样本均数间比较采用Student-Newman-Keuls (SNK)检验; 统计检验水平α=0.05(双侧)。P < 0.05为差异有统计学意义。
2 结果 2.1 不同抽吸模式的口鼻暴露口的烟雾中焦油、一氧化碳、尼古丁含量比较采用深度抽吸和国标抽吸, 抽吸口数统一为六口的主流烟气中焦油、一氧化碳、尼古丁检测结果见表 1。国标抽吸组三种物质的含量经折算后与盒标基本一致, 而深度抽吸时主流烟气中三种物质的含量均高于盒标值。提示卷烟主流烟气有害物质的释放与吸烟方式有关, 同一卷烟采用更为剧烈的方式抽吸其主流烟气中的有害物质含量会显著上升。
| (x±s, mg/支) | |||||
| 组别 | n | 抽吸口数 | 焦油 | 一氧化碳 | 尼古丁 |
| 1 mg深度抽吸组 | 10 | 6 | 3.54±2.47(1) | 6.84±3.60(3) | 0.36±0.38(0.2) |
| 5 mg深度抽吸组 | 10 | 6 | 7.26±3.13(5) ** | 10.86±3.60(5) * | 0.98±0.76(0.5) ** |
| 11 mg深度抽吸组 | 10 | 6 | 13.8±4.93(11) * | 16.86±1.20(11) ** | 1.56±0.95(1.1) ** |
| 11 mg国标抽吸组 | 10 | 6 | 11.58±5.50(11) # | 10.24±4.55(11) ## | 1.02±1.06(1.1) # |
| 括号中为盒标值; 与1 mg深度抽吸组比较, *P < 0.05, **P < 0.01;与11 mg深度抽吸组比较, #P < 0.05, ## P < 0.01. | |||||
深度抽吸或国标抽吸模式经空气载入口鼻暴露塔后, 在口鼻暴露口检测卷烟烟气浓度。烟气浓度呈现典型的倒U型曲线峰, 与实际吸烟过程中烟气浓度变化相似(图 2)。在深度抽吸模式下, 各组烟气质量浓度峰值与卷烟焦油含量呈现正比关系, 且5、11 mg深度抽吸组的峰值[(6278±980) mg/m3和(8800±1187) mg/m3]明显高于1 mg深度抽吸组[(2589±345) mg/m3, 均P < 0.01]。对于同一焦油含量(11 mg)的卷烟, 深度抽吸模式下的卷烟烟气质量浓度峰值显著高于国标抽吸模式[(4867±957) mg/m3, P < 0.01]。以上结果提示, 同等抽吸模式下, 卷烟烟气质量浓度与卷烟标注的焦油含量成正比关系; 同一卷烟在更为剧烈的深度抽吸模式下的卷烟烟气质量浓度明显高于国标抽吸模式。

|
| 图 2 各组烟雾质量浓度比较 Fig. 2 The concentration of smoke detected at the nose and mouse exposing spot |
吸烟7 d后, 与空白对照组比较, 各吸烟组大鼠体质量增加均减少(均P < 0.01), 且随着吸烟时间持续, 各吸烟组与空白对照组大鼠的体质量差异逐渐加大(均P < 0.01), 但各吸烟组大鼠之间体质量差异无统计学意义(P > 0.05), 见图 3。提示烟雾会导致大鼠体质量增加减少, 但与本实验设定的抽吸方式无关。

|
| 与空白对照组比较, **P < 0.01. 图 3 各组大鼠抽吸烟雾28 d后体质量变化比较 Fig. 3 The body weight of rats in different smoking groups during 28 days |
空白对照组大鼠支气管黏膜层完整, 气道表面可见较完整的纤毛, 支气管周围、肺泡和肺泡间无炎症细胞浸润现象。与空白对照组比较, 1 mg深度抽吸组大鼠肺部组织未见明显的巨噬细胞和中性粒细胞浸润, 5 mg深度抽吸组及11 mg国标抽吸组大鼠肺部组织有少量巨噬细胞和中性粒细胞浸润, 11 mg深度抽吸组大鼠支气管周围和肺泡间隔可见大量炎症细胞浸润, 尤其以中性粒细胞、巨噬细胞和淋巴细胞浸润最为显著。同时, 11 mg深度抽吸组大鼠肺泡壁由于炎症细胞浸润而明显增厚, 部分肺泡壁出现断裂的现象; 杯状细胞增生, 气道平滑肌轻度肥大, 肺泡壁变薄, 除部分肺泡破裂以外还出现明显的肺泡腔融合、扩大及肺大疱形成(图 4)。提示深度抽吸11 mg焦油含量的卷烟比其它模式更能诱导肺部炎症细胞浸润及肺组织损伤, 同时该组早期慢性阻塞性肺疾病样的病理学改变也更明显。
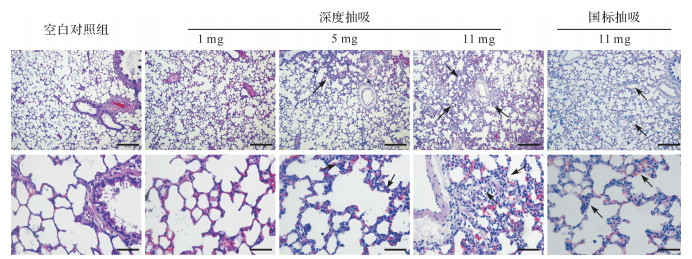
|
| 空白对照组支气管黏膜完整, 气道表面可见完整的纤毛, 支气管周围、肺泡和肺泡间无炎症细胞浸润现象; 1mg深度抽吸组与空白对照组相比同样无显著的病理改变; 5mg深度抽吸组支气管黏膜轻度不完整, 气道表面纤毛轻度受损, 支气管周围、肺泡和肺泡间有轻度的炎症细胞浸润; 11mg深度抽吸组呈现明显的支气管黏膜损伤, 气道表面纤毛脱落, 杯状细胞化生, 支气管周围、肺泡和肺泡间严重的炎症细胞浸润, 肺实变, 肺泡间隔断裂, 气道平滑肌轻度增生和肥大; 11mg国标抽吸组呈现明显的支气管黏膜损伤, 气道表面纤毛脱落, 轻度的杯状细胞化生, 支气管周围特别是肺泡和肺泡间有较多的炎症细胞浸润现象, 肺泡间隔断裂, 肺泡壁变薄以及形成肺大疱.上图:标尺=400 μm; 下图:标尺=100 μm. 图 4 各组大鼠肺组织病理学改变(HE染色) Fig. 4 Effects of cigarette smoking with different manners on pulmonary histology in rats (HE staining) |
1 mg深度抽吸组、5 mg深度抽吸组肺泡灌洗液中总细胞数与空白对照组差异无统计学意义(均P > 0.05), 而11 mg深度抽吸组和11 mg国标抽吸烟组肺泡灌洗液中总细胞数显著上升(均P < 0.05), 见表 2。分类计数结果显示:1 mg深度抽吸组肺泡灌洗液巨噬细胞、淋巴细胞和中性粒细胞计数与空白对照组差异无统计学意义(均P > 0.05);5 mg深度抽吸组肺泡灌洗液淋巴细胞和中性粒细胞计数大于空白对照组(均P < 0.05), 而巨噬细胞数与空白对照组差异无统计学意义(P > 0.05)。11 mg深度抽吸和11 mg国标抽吸能显著诱导巨噬细胞、中性粒细胞及淋巴细胞的肺部浸润(均P < 0.05), 同时11 mg深度抽吸组肺部炎症细胞的总细胞数、淋巴细胞数和中性粒细胞数均大于11 mg国标抽吸组(均P < 0.05), 见表 2。以上结果提示深度抽吸5、11 mg和国标抽吸11 mg焦油含量的卷烟均能显著诱导大鼠肺部的炎症发生; 且对于同一焦油含量(11 mg)的卷烟, 深度抽吸比国标抽吸更能诱导大鼠肺部炎症发生。
| (x±s, 1×104) | |||||
| 组别 | n | 总细胞计数 | 巨噬细胞数 | 淋巴细胞数 | 中性粒细胞数 |
| 空白对照组 | 10 | 150.37±22.16 | 125.05±25.65 | 20.71±5.82 | 4.46±2.97 |
| 1 mg深度抽吸组 | 10 | 152.25±22.16 | 129.47±17.42 | 25.09±5.12 | 4.69±3.35 |
| 5 mg深度抽吸组 | 10 | 173.68±32.11 | 129.38±25.52 | 34.19±11.13* | 9.49±6.13* |
| 11 mg深度抽吸组 | 10 | 241.41±60.33**# | 155.19±33.43* | 41.66±16.35**# | 45.00±29.66**# |
| 11 mg国标抽吸组 | 10 | 182.76±29.69* | 135.65±23.65* | 36.53±12.74** | 10.04±6.32* |
| 与空白对照组比较, *P < 0.05, **P < 0.01;与11 mg国标抽吸组比较, #P < 0.05. | |||||
各组大鼠肺泡灌洗液中IL-1β、TNF-α含量见表 3。与空白对照组比较, 1 mg深度抽吸组肺泡灌洗液中IL-1β和TNF-α含量差异均无统计学意义(均P > 0.05);5 mg深度抽吸组、11 mg深度抽吸组、11 mg国标抽吸组肺泡灌洗液中IL-1β、TNF-α的分泌量与空白对照组差异有统计学意义(均P < 0.01)。以上结果提示深度抽吸5、11 mg以及国标抽吸11 mg焦油含量的卷烟均能显著诱导大鼠肺部炎症因子IL-1β、TNF-α的分泌。
| (x±s, pg/mL) | |||
| 组别 | n | IL-1β | TNF-α |
| 空白对照组 | 10 | 20.58±12.36 | 167.66±54.39 |
| 1 mg深度抽吸组 | 10 | 23.38±12.33 | 171.22±73.99 |
| 5 mg深度抽吸组 | 10 | 28.98±10.66** | 212.45±68.30** |
| 11 mg深度抽吸组 | 10 | 36.65±17.23** | 260.32±111.67** |
| 11 mg国标抽吸组 | 10 | 30.42±14.29** | 223.08±71.75** |
| 与空白对照组比较, **P < 0.01 | |||
1 mg深度抽吸组MPO、SOD活性和GSH、活性氧、丙二醛的含量与空白对照组差异均无统计学意义(均P > 0.05);5 mg深度抽吸组、11 mg深度抽吸组及11 mg国标抽吸组MPO、SOD活性和GSH、活性氧、丙二醛的含量与空白对照组差异均有统计学意义(P < 0.01或P < 0.05);11 mg深度抽吸组SOD、MPO活性和GSH、活性氧、丙二醛含量与11 mg国标抽吸组差异均有统计学意义(均P < 0.05), 见表 4。提示深度抽吸5、11 mg及国标抽吸11 mg焦油含量的卷烟均能促使SOD活性及GSH含量下降, 促使MPO活性、活性氧和丙二醛含量上升; 同时深度抽吸模式的作用强于国标抽吸。
| (x±s) | ||||||
| 组别 | n | MPO (U/g) | GSH (μmol/ mg) | SOD (U/mg) | 活性氧(AU/mg) | 丙二醛(nmol/ mg) |
| 空白对照组 | 10 | 0.27±0.10 | 12.73±2.54 | 0.79±0.10 | 2.72±0.32 | 1.48±0.13 |
| 1 mg深度抽吸组 | 10 | 0.28±0.11 | 12.01±1.67 | 0.75±0.13 | 2.74±0.33 | 1.56±0.33 |
| 5 mg深度抽吸组 | 10 | 0.42±0.13* | 10.09±1.40* | 0.69±0.06* | 3.60±0.19* | 2.34±0.27* |
| 11 mg深度抽吸组 | 10 | 0.68±0.11**# | 8.60±1.61**# | 0.55±0.11**# | 5.16±0.44**# | 3.90±0.48**# |
| 11 mg国标抽吸组 | 10 | 0.44±0.11* | 10.32±1.93* | 0.66±0.06* | 3.82±0.32* | 2.49±0.32* |
| MPO:髓过氧化物酶; GSH:还原型谷胱甘肽; SOD:超氧化物歧化酶.与空白对照组比较, *P < 0.05, **P < 0.01;与11 mg国标抽吸组比较, #P < 0.05 | ||||||
肺损伤是吸烟最常见且发病率较高的病症之一。吸烟诱导肺损伤的主要发病机制主要分为三个方面:肺部炎症浸润、蛋白酶/抗蛋白酶失衡、氧化和抗氧化失衡[13-14]。以往吸烟诱导肺损伤的动物模型研究重点关注大量吸烟后肺功能、肺部炎症细胞浸润或肺部重塑功能改变, 对模型诱导物--卷烟烟气未能进行系统定量研究。本研究以吸烟机结合大鼠口鼻暴露塔的方式建立不同模式下口鼻式吸烟诱导大鼠肺损伤的动物模型, 并通过肺组织中炎症细胞浸润, 氧化/抗氧化水平等指标比较高、中、低三种焦油含量及加拿大深度抽吸和国际标准抽吸模式对大鼠肺损伤的诱导作用, 为定量染毒和暴露提供了有益的参考, 也为进一步定量研究卷烟诱导的肺损伤打下基础。
以往评价卷烟对肺损伤作用时, 往往采用动物全身暴露并且被动吸入主流烟气的方法。这种方式与人实际吸烟过程中对卷烟烟雾的吸入和吐出过程存在较大差异, 且烟气全身暴露状况下卷烟烟气还会通过黏膜或舔毛等方式进入动物体内, 导致实际吸入的烟雾浓度个体差异大[15-16]。我们采用吸烟机结合大鼠口鼻暴露装置的方法观察卷烟吸入肺部时发现, 卷烟烟雾浓度呈现明显的倒“U”型峰波动, 这与人实际吸烟过程中肺内卷烟烟雾质量浓度的变化过程类似, 可以此来模拟人吸烟过程[12, 17-18]。我们采用的吸烟系统能同时监控大鼠口鼻暴露塔内气体的温度、湿度、压力、含氧量、烟雾质量浓度等指标, 保证了实验的可控性; 同时保证实验对象氧气供应, 不会像全身暴露方式那样导致动物缺氧、窒息或致死的情况。在整个实验中, 所有大鼠未出现中毒、窒息、受伤等症状, 且此过程中大鼠饮食、活动正常, 体毛具有光泽, 未出现异样状态。
通过检测肺泡灌洗液炎症细胞数量发现, 深度抽吸1 mg焦油含量的卷烟不能显著诱导大鼠肺部炎症细胞浸润和炎症因子释放; 深度抽吸5 mg焦油含量的卷烟可显著诱导大鼠肺组织中IL-1β与TNF-α的分泌, 以及大鼠肺泡灌洗液中中性粒细胞和淋巴细胞的浸润; 国标抽吸或深度抽吸11 mg焦油含量的卷烟均能诱导肺部各类炎症细胞的浸润及炎症因子分泌。MPO为中性粒细胞特有的过氧化物酶, 可以与过氧化氢及氯离子形成次氯酸, 从而形成具有氧化能力的自由基。通过对大鼠肺部组织的MPO活性进行检测, 我们发现不同组卷烟对大鼠肺部组织MPO活性的诱导作用与其诱导肺部炎症的结果一致。GSH是体内重要的抗氧化物质, 是肺部抗氧化的屏障; SOD能催化氧自由基形成过氧化氢, 从而清除体内氧自由基, 是重要的抗氧化酶。GSH和SOD是反映肺组织氧化应激水平的重要标志物。活性氧主要指超氧自由基、过氧化氢及下游产物的氧化物及过氧化物; 丙二醛是氧自由基与生物膜不饱和脂肪酸发生脂质过氧化的代谢产物, 两者直接或间接反映了组织中氧自由基含量和细胞损伤程度。在对大鼠肺部组织中GSH、活性氧、丙二醛含量和SOD活性检测中发现, 深度抽吸5 mg和11 mg焦油含量的卷烟及国标抽吸11 mg焦油含量的卷烟均能促使GSH含量和SOD活性下降, 同时显著促使活性氧和丙二醛含量上升。上述各抽吸模式下氧化还原相关的指标改变与肺组织的病理学改变一致, 从而从另一个侧面反映了肺损伤与不同吸烟模式有关。
综上所述, 口鼻式吸烟诱导大鼠肺损伤模型建立成功与否除了与选择的样品卷烟种类有直接关系以外, 还与吸烟的模式直接相关。通过进一步分析样品卷烟主流烟气中焦油、尼古丁及一氧化碳等有害物质的含量, 发现大鼠肺部炎症细胞浸润程度、炎症因子分泌增加程度及肺组织氧化应激水平与主流烟气中这三种物质的含量呈正相关性, 即烟气中焦油等有害物质含量越高的吸烟方式及卷烟更易诱导形成大鼠肺损伤模型。
| [1] | BARNES P J. Future treatments for chronic obstructive pulmonary disease and its comorbidities[J]. Proc Am Thorac Soc, 2008, 5 (8) :857–864. doi:10.1513/pats.200807-069TH |
| [2] | GIEMBYCZ M A, FIELD S K. Roflumilast:first phosphodiesterase 4 inhibitor approved for treatment of COPD[J]. Drug Des Devel Ther, 2010, 4 :147–158. |
| [3] | WITSCHI H, ESPIRITU I, UYEMINAMI D. Chemoprevention of tobacco smoke-induced lung tumors in A/J strain mice with dietary myo-inositol and dexamethasone[J]. Carcinogenesis, 1999, 20 (7) :1375–1378. doi:10.1093/carcin/20.7.1375 |
| [4] | WITSCHI H, UYEMINAMI D, MORAN D, et al. Chemoprevention of tobacco-smoke lung carcinogenesis in mice after cessation of smoke exposure[J]. Carcinogenesis, 2000, 21 (5) :977–982. doi:10.1093/carcin/21.5.977 |
| [5] | ONIZAWA S, AOSHIBA K, KAJITA M, et al. Platinum nanoparticle antioxidants inhibit pulmonary inflammation in mice exposed to cigarette smoke[J]. Pulm Pharmacol Ther, 2009, 22 (4) :340–349. doi:10.1016/j.pupt.2008.12.015 |
| [6] | 毕波, 周昆, 郑赛晶, 等. 卷烟诱导小鼠咳嗽和痰分泌模型的建立[J]. 实验动物科学, 2010, 27 (2) : 10–12. BI Bo, ZHOU Kun, ZHENG Saijing, et al. Establishment of cigarette induced cough and sputum secretion mice model[J]. Laboratory Animal Science, 2010, 27 (2) :10–12. (in Chinese) |
| [7] | WYATT T A, GENTRY-NIELSEN M J, PAVLIK J A, et al. Desensitization of PKA-stimulated ciliary beat frequency in an ethanol-fed rat model of cigarette smoke exposure[J]. Alcohol Clin Exp Res, 2004, 28 (7) :998–1004. doi:10.1097/01.ALC.0000130805.75641.F4 |
| [8] | 宁维, 陈利平, 李瑜, 等. 全烟气致小鼠肺损伤模型的建立[J]. 烟草科技, 2013, 46 (11) : 36–40. NING Wei, CHEN Liping, LI Yu, et al. Development of model for whole smoke-induced lung injury in mice[J]. Tobacco Science&Technology, 2013, 46 (11) :36–40. (in Chinese) |
| [9] | LU Y, MORIMOTO K. Exposure level to cigarette tar or nicotine is associated with leukocyte DNA damage in male Japanese smokers[J]. Mutagenesis, 2008, 23 (6) :451–455. doi:10.1093/mutage/gen034 |
| [10] | MCCARTY K M, SANTELLA R M, STECK S E, et al. PAH-DNA adducts, cigarette smoking, GST polymorphisms, and breast cancer risk[J]. Environ Health Perspect, 2009, 117 (4) :552–558. doi:10.1289/ehp.0800119 |
| [11] | CHENG H G, MCBRIDE O, PHILLIPS M R. Relationship between knowledge about the harms of smoking and smoking status in the 2010 Global Adult Tobacco China Survey[J]. Tob Control, 2015, 24 (1) :54–61. doi:10.1136/tobaccocontrol-2013-051163 |
| [12] | ISO/TC126/WG9/N016 A review of human smoking behaviour data and recommendation for a new ISO standard for the machine smoking of cigarettes[R]//Report of the ad hoc WG 9 smoking behavior review team to ISO/TC 126 WG 9, 2005. |
| [13] | PROCTOR R N. The global smoking epidemic:a history and status report[J]. Clin Lung Cancer, 2004, 5 (6) :371–376. doi:10.3816/CLC.2004.n.016 |
| [14] | ZHOU G, XIAO W, XU C, et al. Chemical constituents of tobacco smoke induce the production of interleukin-8 in human bronchial epithelium, 16HBE cells[J]. Tob Induc Dis, 2016, 14 :24. doi:10.1186/s12971-016-0089-4 |
| [15] | COGGINS C R. An updated review of inhalation studies with cigarette smoke in laboratory animals[J]. Int J Toxicol, 2007, 26 (4) :331–338. doi:10.1080/10915810701490190 |
| [16] | COGGINS C R. A further review of inhalation studies with cigarette smoke and lung cancer in experimental animals, including transgenic mice[J]. Inhal Toxicol, 2010, 22 (12) :974–983. doi:10.3109/08958378.2010.501831 |
| [17] | COGGINS C R. A review of chronic inhalation studies with mainstream cigarette smoke in rats and mice[J]. Toxicol Pathol, 1998, 26 (3) :307–314. doi:10.1177/019262339802600301 |
| [18] | 颜水明, 李斌, 谢国勇, 等. 卷烟设计参数对钟形抽吸曲线下烟气稀释作用的影响[J]. 烟草科技, 2015, 48 (9) : 62–68. YAN Shuiming, LI Bin, XIE Guoyong, et al. Effects of cigarette material parameters on cigarette smoke dilution under bell-shaped puff profile[J]. Tobacco Science&Technology, 2015, 48 (9) :62–68. (in Chinese) |




