2. 浙江大学医学院神经科学研究所, 浙江 杭州 310058
2. Institute of Neuroscience, Zhejiang University School of Medicine, Hangzhou 310058, China
缺血性脑卒中(ischemic stroke, IS)是临床上常见的神经系统疾病之一, 发病率高、致残率高、病死率高, 且发病年龄有年轻化趋势。作为脑卒中的主要类型之一, IS能够导致神经系统出现严重的形态学和分子生物学改变[1]。脑组织对缺血缺氧极为敏感, 尽早恢复血液再灌注是临床上处理IS的主要原则, 但血流恢复后由于氧自由基生成、钙超载等因素导致脑组织损伤和功能障碍进一步加重, 引起星形胶质细胞活化、炎症反应加剧、神经细胞凋亡等缺血再灌注损伤(ischemia reperfusion injury)[2]。脑组织缺血再灌注损伤是加重IS病理进程的关键因素之一。缺血直接导致脑组织损伤, 再灌注后由于氧自由基合成增加, 上调NF-κB使环氧化酶-2(cyclooxygenase 2, COX-2)和诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)表达增加[3], 导致缺血所致的脑组织结构和功能障碍进一步加重。脑组织缺血区由两部分组成:缺血性核心区和其周围的半暗带, 半暗带是电沉默带, 但仍然有明显的血流通过, 存在着大量处于休眠状态或半休眠状态的神经细胞, 具有可逆性, 因此, 减少脑组织缺血再灌注损伤缺血半暗带的面积可以减轻脑卒中后损伤。
中国传统中药材雷公藤有抗肿瘤、抗炎、免疫抑制的作用, 并已广泛应用于多种炎症和自身免疫性疾病(如类风湿关节炎)的治疗中。雷公藤的提取物-雷公藤甲素(triptolide)是雷公藤主要的活性成分[4], 具有分子量小和亲脂性的特点, 易于透过血脑屏障[5], 对神经系统具有保护作用。在体内和体外实验中, 雷公藤甲素均能够有效地保护脂多糖诱导的多巴胺能神经元的损伤[6]。同时, 雷公藤甲素能够促进神经生长因子(nerve growth factor, NGF)的合成[7], 并抑制星形胶质细胞聚集和炎症反应[8], 促进脊髓损伤的修复。另外, 已知雷公藤甲素能够通过抑制小胶质细胞的活化[9], 从而抑制星形胶质细胞中的NF-κB信号传导通路, 使COX-2表达减少[10]。然而, 雷公藤甲素对脑组织缺血再灌注损伤的作用至今仍不明确。大脑中动脉闭塞再灌注脑组织缺血动物模型已广泛应用于脑组织缺血和相关干预措施的研究中[11]。因此, 本研究主要观察雷公藤甲素对脑组织缺血再灌注损伤后炎症反应的影响以及可能的分子生物学机制, 为临床IS的药物治疗提供参考依据。
1 材料与方法 1.1 实验动物及分组清洁级雄性SD大鼠80只, 体质量230~250 g, 由浙江大学实验动物中心提供。实验环境温度恒定为(23±1)℃, 每日光照时间固定为12 h, 食物和水随意取用。将大鼠随机分为五组, 每组各16只:①健康对照组; ②手术对照组; ③溶剂对照组; ④模型对照组; ⑤雷公藤甲素组。健康对照组未采取手术; 手术对照组采取与模型对照组相同的术式, 仅未闭塞大脑中动脉; 雷公藤甲素组术前24 h将雷公藤甲素溶于DMSO溶剂中腹腔注射(0.2 mg/kg)。溶剂对照组大鼠术前腹腔注射与雷公藤甲素组等体积的DMSO溶剂, 注射后24 h进行常规手术。雷公藤甲素购自德国Merck公司, 注射前溶于DMSO溶剂中。
1.2 造模方法大鼠局灶性脑组织缺血再灌注损伤模型参照Longa等[12]的方法建立。具体操作过程如下:大鼠称体质量, 腹腔注射4%水合氯醛(9 mL/kg)麻醉。大鼠仰卧固定后, 颈部正中纵切口, 分离并暴露右侧颈总动脉、颈外动脉和颈内动脉。用A 4-0-缝合线, 结扎右侧颈总动脉近心端和颈外动脉基底部, 右侧颈总动脉处剪口, 用头端烧成圆钝形、直径为0.26 mm的线栓插入右侧颈总动脉管腔, 并轻轻地前进至颈内动脉远端直到不能推进为止, 约18 mm。缺血90 min后缓慢地将线栓拉出并结扎右侧颈总动脉远端, 形成再灌注损伤。缝合切口, 术毕。放回笼内, 单笼饲养。大鼠苏醒后左上肢屈曲、行走时左侧旋转或左侧肢体瘫痪者为堵塞成功。手术对照组大鼠只分离、暴露血管, 不结扎右侧颈总动脉及颈外动脉, 不插入线栓。
1.3 神经症状评分参照Longa等[12]的方法对SD大鼠术后神经症状进行评分。评分标准:0分为无明显神经功能缺损症状; 1分为不能完全伸展左侧前爪; 2分为行走时向左侧旋转; 3分为行走时向左侧倾倒; 4分为不能自行行走, 意识障碍。采用双盲方式评估。
1.4 计算脑梗死体积和脑组织含水量麻醉后断头取脑, 由前至后切成5个2 mm厚度的冠状切片。脑片浸入美国Sigma公司生产的2% TTC溶液中, 37℃避光孵育30 min。正常组织呈均匀红色, 梗死组织呈苍白色。染色后将脑片浸入4%多聚甲醛固定30 min, 拍照。采用SigmaScan Pro 5软件分析, 以梗死脑组织体积占大脑总体积的百分比计算脑梗死体积。含水量检测:用电子秤称量梗死大脑半球质量(湿重)后, 置于105℃烘箱干燥过夜, 并再次称取质量(干重)。脑组织含水量=[(湿重-干重)/湿重]×100%[13]。
1.5 TUNEL法检测细胞凋亡麻醉后迅速打开胸腔, 由左心室灌注等渗氯化钠溶液500 mL冲洗血管通路, 再灌注4%多聚甲醛200 mL。断头取脑, 脑组织标本浸于4%多聚甲醛中固定24 h后, 再浸入30%的蔗糖溶液中。常规制作冰冻切片, 厚约20 μm, TBS浸泡冰冻切片, 室温放置15 min, 采用德国Roche公司的TUNEL试剂盒检测细胞凋亡的情况, 按说明书操作。共聚焦倒置显微镜检测免疫荧光, 凋亡细胞TUNEL标记阳性。每张切片在缺血区随机计数5个高倍镜视野(200×)中的阳性细胞数, 取平均值为该切片凋亡细胞数。
1.6 免疫组织化学法检测GFAP阳性星形胶质细胞冰冻切片回温后PBS清洗, PBST室温通透1 h, 35%血清室温封闭1~2 h。采用美国Thermo公司生产的兔抗GFAP (1:1000)4℃孵育过夜。PBS彻底清洗后用FITC标记的抗兔IgG免疫荧光染色, 室温避光2 h, PBS再次清洗, 抗荧光淬灭封片剂封片, 共聚焦倒置显微镜检测免疫荧光。每张切片在缺血区随机计数5个高倍镜视野(200×)中的GFAP阳性星形胶质细胞数, 取平均值。
1.7 免疫组织化学法测定大鼠脑组织iNOS、COX-2、NF-κB蛋白表达水平灌注取脑制作冠状冰冻切片。体积分数为3%过氧化氢灭活内源性过氧化物酶活性, 0.3% Triton X-100+10%山羊血清的PBS溶液(终浓度为0.01 mol/L)封闭。分别加入美国Thermo公司生产的iNOS、COX-2、NF-κB (p65)一抗(兔, 1:200)4℃孵育过夜。PBS彻底漂洗后置于美国Santa Cruz Biotechnology公司生产的HRP标记的羊抗兔IgG (1:200)二抗中孵育1 h, PBS彻底漂洗后, DAB显色。每张切片在缺血区随机计数5个高倍镜视野(200×)中的阳性细胞数, 取平均值。
1.8 实时定量PCR检测iNOS、COX-2 mRNA表达采用美国Invitrogen公司生产的TRIzol试剂盒提取缺血半暗带脑组织的总RNA。RNA样本浓度由波长260 nm处吸光度值测定。各组取1 μg RNA样本, 采用美国Invitrogen公司生产的SuperScript®Ⅲ逆转录试剂盒逆转录成cDNA。使用β-actin作为内参, 每个样本一式三份进行分析。靶基因和特异性引物如下:iNOS, 上游引物TGGTGAGGGGACTGGACTTT, 下游引物CCAACTCTGCTGTTCTCCGT; COX-2, 上游引物ACGGACTTGCTCACTTTG, 下游引物GGAGAACAGATGGGATTAC。PCR反应条件:94℃ 5 min后依次94℃ 30 s、58℃ 30 s、72℃ 1 min, 共35个循环。将10 μL PCR反应产物进行1.5%的琼脂糖凝胶电泳。凝胶成像仪分析结果, 采用FluorChem Beta 1.1软件分析PCR产物浓度。
1.9 统计学方法检测结果均以均数±标准差(x±s)表示, 使用SPSS 18.0软件进行统计分析, 采用方差分析进行多组变量间的比较, 两两比较采用LSD-t检验, P<0.05为有统计学意义。
2 结果 2.1 雷公藤甲素减轻脑组织水肿脑组织含水量测量结果显示, 相对于健康对照组和手术对照组[分别为(76.67±0.20)%和(75.01±0.19)%], 模型对照组和溶剂对照组大鼠脑组织含水量增加[分别为(87.22±0.31)%和(85.56±0.44)%, 均P<0.01];与模型对照组和溶剂对照组比较, 雷公藤甲素组脑组织含水量增加减少[(80.03±0.46)%, 均P<0.05]。
2.2 雷公藤甲素减轻神经功能损伤健康对照组和手术对照组无损伤, 所有大鼠Longa评分为0分; 溶剂对照组和模型对照组大鼠神经功能损伤显著, Longa评分分别为2.42±0.19和2.50±0.18, 雷公藤甲素组神经功能损伤减轻, Longa评分为1.38±0.20, 与溶剂对照组和模型对照组差异均有统计学意义(均P<0.05)。提示雷公藤甲素能够有效减轻SD大鼠的神经功能损伤程度。
2.3 雷公藤甲素减少脑组织梗死体积TTC脑组织染色后各组梗死部位见图 1。健康对照组和手术对照组梗死体积均为零。模型对照组和溶剂对照组梗死体积较大, 分别为(22.1±3.2)%和(21.5±2.1)%, 与健康对照组和手术对照组差异均有统计学意义(均P < 0.01)。雷公藤甲素组梗死体积比溶剂对照组和模型对照组缩小[(8.3±1.4)%, 均P < 0.01]。
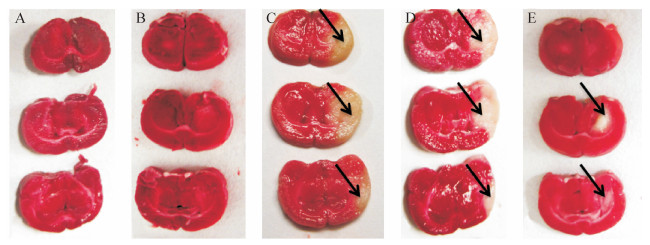
|
| TTC染色利用TTC和活细胞线粒体内的琥珀酸脱氢酶反应, 生成红色的甲臢, 缺血脑组织脱氢酶活性下降, 显示为苍白色. A、B:健康对照组和手术对照组大鼠脑组织表现为均匀一致的红色; C、D:模型对照组和溶剂对照组大脑中动脉分布区域脑组织出现大范围苍白色梗死(箭头所示); E:雷公藤甲素组苍白色梗死区域体积比模型对照组和溶剂对照组缩小(箭头所示). 图 1 各组梗死脑组织大体形态比较 Fig. 1 Brain infarct volume in five groups of rats |
健康对照组和手术对照组大鼠脑组织细胞凋亡较少, TUNEL阳性细胞数分别为24.53±1.89和26.42±3.61;溶剂对照组和模型对照组TUNEL阳性细胞的数量显著增加, 分别为120.75±5.42和118.87±6.30, 与健康对照组和手术对照组差异均有统计学意义(均P<0.01)。相对于溶剂对照组和模型对照组, 雷公藤甲素组的TUNEL阳性细胞的数量明显减少, 仅为64.15±3.52(均P<0.05), 见图 2。结果表明, 雷公藤甲素能够有效地抑制细胞凋亡。
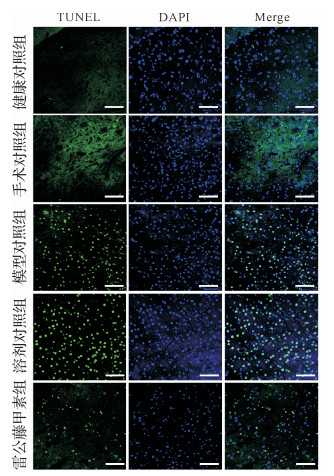
|
| 免疫荧光下TUNEL检测法将凋亡细胞标记成绿色, 同时其他细胞核均可标记成蓝色, Merge显示同视野重合荧光, 凋亡细胞与健康细胞分布散点图.健康对照组和手术对照组TUNEL染色阴性; 模型对照组和溶剂对照组TUNEL阳性细胞增多; 雷公藤甲素组TUNEL阳性细胞减少.标尺=50 μm. 图 2 各组神经细胞凋亡数比较 Fig. 2 Apoptotic cells in five groups of rats |
健康对照组和手术对照组GFAP阳性星形胶质细胞较少, 模型对照组半暗带中聚集着较多的GFAP阳性星形胶质细胞(与健康对照组、手术对照组比较, 均P<0.01);相对于模型对照组, 雷公藤甲素组GFAP阳性星形胶质细胞减少(P<0.05), 见图 3。结果表明, 雷公藤甲素能够有效抑制星形胶质细胞的活化。

|
| GFAP将星形胶质细胞标记为绿色.A:健康对照组星形胶质细胞状态正常; B:模型对照组星形胶质细胞数量增多、体积增大; C:雷公藤甲素组星形胶质细胞体积增大, 但数量并没有增加.标尺=100 μm. 图 3 各组活化星形胶质细胞比较 Fig. 3 Effect of triptolide on the immunoreactivities of glial fibrillary acid protein (GFAP) |
免疫组织化学检测结果显示, 健康对照组和手术对照组表达COX-2和iNOS蛋白较少, 溶剂对照组和模型对照组表达COX-2和iNOS蛋白增加(均P < 0.01), 雷公藤甲素组比溶剂对照组和模型对照组表达COX-2和iNOS蛋白减少(均P < 0.05), 见表 1和图 4、5。

|
| A、B:健康对照组和手术对照组iNOS阳性细胞(棕褐色)低水平表达; C、D:模型对照组和溶剂对照组iNOS阳性细胞(棕褐色)明显增多; E:雷公藤甲素组iNOS阳性细胞(棕褐色)增多减少.标尺=100 μm. 图 4 雷公藤甲素对iNOS表达的影响 Fig. 4 Effect of tritolide on the expression of iNOS |

|
| A、B:健康对照组和手术对照组COX-2阳性细胞(棕褐色)低水平表达; C、D:模型对照组和溶剂对照组COX-2阳性细胞(棕褐色)明显增多; E:雷公藤甲素组COX-2阳性细胞(棕褐色)增多减少.标尺=100 μm. 图 5 雷公藤甲素对COX-2表达的影响 Fig. 5 Effect of tritolide on the expression of COX-2 |
| (x±s, n=16) | |||
| 组别 | iNOS | COX-2 | NF-κB |
| 健康对照组 | 6.25±0.96 | 9.52±0.89 | 6.92±1.15 |
| 手术对照组 | 8.33±1.01 | 10.03±0.96 | 7.69±1.10 |
| 模型对照组 | 162.53±1.25# | 162.38±13.80# | 122.12±5.01# |
| 溶剂对照组 | 158.03±2.08# | 150.03±19.04# | 111.54±11.53# |
| 雷公藤甲素组 | 91.67±1.31* | 95.24±5.07* | 75.03±12.06* |
| iNOS:诱导型一氧化氮合酶; COX-2:环氧化酶-2.与健康对照组和手术对照组比较, #P<0.01;与模型对照组和溶剂对照组比较, *P < 0.05. | |||
实时定量PCR结果显示, 健康对照组和手术对照组大鼠神经细胞表达COX-2和iNOS mRNA较少, 溶剂对照组和模型对照组COX-2和iNOS mRNA表达增多(均P < 0.01), 而雷公藤甲素组比溶剂对照组和模型对照组COX-2、iNOS mRNA表达减少(均P < 0.01), 见表 2和图 6。提示雷公藤甲素对COX-2和iNOS表达有抑制作用。

|
| iNOS:诱导型一氧化氮合酶; COX-2:环氧化酶-2.1、2:健康对照组和手术对照组少量表达COX-2和iNOS; 3、4:模型对照组和溶剂对照组COX-2和iNOS表达增加; 5:雷公藤甲素组COX-2和iNOS表达增加减少. 图 6 各组大鼠COX-2和iNOS mRNA的表达 Fig. 6 Expression of COX-2 and iNOS mRNA in five groups |
| (x±s) | |||
| 组别 | n | iNOS | COX-2 |
| 健康对照组 | 16 | 9.85±0.60 | 24.24±2.12 |
| 手术对照组 | 16 | 12.12±1.36 | 23.48±1.51 |
| 模型对照组 | 16 | 75.76±2.27# | 86.36±2.12# |
| 溶剂对照组 | 16 | 69.70±0.90# | 63.64±2.42# |
| 雷公藤甲素组 | 16 | 24.30±0.76* | 17.58±0.45* |
| iNOS:诱导型一氧化氮合酶; COX-2:环氧化酶-2.与健康对照组和手术对照组比较, #P<0.01;与模型对照组和溶剂对照组比较, *P<0.01. | |||
免疫组织化学检测结果显示, 健康对照组和手术对照组表达NF-κB蛋白较少, 溶剂对照组和模型对照组表达NF-κB蛋白增加(均P < 0.01), 雷公藤甲素组比溶剂对照组和模型对照组表达NF-κB蛋白减少(均P < 0.05), 见表 1和图 7。

|
| NF-κB在组织中标记为棕褐色. A、B:健康对照组和手术对照组低水平表达NF-κB阳性细胞; C、D:模型对照组和溶剂对照组NF-κB阳性细胞增多; E:雷公藤甲素组NF-κB阳性细胞增加减少.标尺=100 μm. 图 7 雷公藤甲素对NF-κB表达的影响 Fig. 7 Effect of tritolide on the expression of NF-κB |
星形胶质细胞是构成血脑屏障的重要部分, 也是一把“双刃剑”。早期随着脑组织缺血损伤程度的加深, 其形态逐渐发生改变。轻至中等程度的星形胶质细胞活化可在一定程度上调胶质纤维酸性蛋白(GFAP)的表达, 使胞体肥大, 但细胞之间无重叠, 且几乎没有细胞数目增加[14]; 如果损伤因素能够控制, 这一过程是可逆的, 此时具有一定的炎症抑制作用。严重的星形胶质细胞活化常有GFAP表达显著提高、胞体肥大及细胞增殖, 细胞之间相互重叠, 与细胞外稠密的胶原共同构成致密的胶质瘢痕, 不仅成为轴突生长的物理屏障, 其分泌的TNF、IL-1β、IL-6、干扰素、COX-2等炎性因子也直接对轴突生长产生抑制作用[15]。本实验中雷公藤甲素组GFAP阳性星形胶质细胞仅有体积增大, 但数量并没有增加, 提示雷公藤甲素可以抑制星形胶质细胞过度激活所造成的继发性损伤, 对脑组织有保护作用。
脑组织缺血再灌注损伤是调节并推进IS的至关重要的因素。脑组织缺血时, 神经元能表达COX-2和iNOS, 激活小胶质细胞产生活性氧, 活性氧攻击线粒体使细胞色素c释放到细胞质中, 激活caspase基因, 诱导细胞凋亡[15]。有研究表明, 缺氧应激对缺血再灌注的脑内皮细胞有基因毒性和细胞毒性作用, 表现为染色体畸变、细胞凋亡等[16]。兴奋性氨基酸的神经毒性作用是损伤脑组织的启动者和执行者, 它不仅可以直接导致细胞坏死, 也可诱导细胞凋亡[17]。iNOS可诱导谷氨酸兴奋毒性[18], 进一步加重缺血再灌注损伤。本研究中, 雷公藤甲素组的TUNEL阳性细胞数量相对模型对照组和溶剂对照组减少, 提示雷公藤甲素可以保护神经细胞, 减少凋亡。
大量研究表明, 脑组织缺血再灌注后由炎症反应参与的级联性病理生理事件会造成神经元死亡及神经功能障碍, 并最终导致脑损伤[19-20]。在IS中, 炎症反应能够促使机体释放大量的COX-2和iNOS[21]。COX-2作为脑组织缺血再灌注损伤后异常表达的产物, 是产生氧自由基的关键酶[22]。iNOS表达上调, 使一氧化氮合成增加, 在星形胶质细胞中可上调bax和下调bcl-2, 激活caspase诱导细胞凋亡。本研究结果表明, 雷公藤甲素能够抑制COX-2和iNOS这两种蛋白的表达, 发挥炎症调节作用。
NF-κB是一种重要的转录因子, 它可以调节各种基因, 包括免疫和炎症反应的表达。既往的多项研究均发现, NF-κB在缺血再灌注损伤中发挥着作用[23]。NF-κB激活能够增加促炎基因包括iNOS、COX-2、TNF-α和IL-1β的表达[24]。本次研究结果显示, 雷公藤甲素能够减少NF-κB在脑组织缺血组织的表达, 是NF-κB的强效抑制剂, 具有较强的抗炎和神经保护作用[25]。DNA修复转录因子(TFIIH)的XPB亚基是雷公藤甲素的关键靶位[26], 推测雷公藤甲素可能是通过对XPB和TFIIH活化的抑制作用, 来抑制NF-κB信号转导通路, 发挥其神经保护作用。
综上所述, 雷公藤甲素可以通过抑制星形胶质细胞活化, 减少细胞凋亡, 抑制炎症反应, 以减少脑梗死体积, 降低脑水肿程度, 减轻神经功能损伤程度, 对脑组织缺血再灌注损伤具有一定的保护作用。本研究为雷公藤甲素在脑组织缺血再灌注损伤的临床用药提供了一定的理论依据, 但实验观察时间较短, 如果将检测时间点延长到术后72 h, 可能会观察到更多的下游因子的作用。
| [1] | BAI S, HU Z, YANG Y, et al. Anti-inflammatory and neuroprotective effects of triptolide via the NF-κB signaling pathway in a rat MCAO model[J]. Anat Rec (Hoboken), 2016, 299 (2) :256–266. doi:10.1002/ar.23293 |
| [2] | XU Z, XU R X, LIU B S, et al. Time window characteristics of cultured rat hippocampal rat hippocampal neurons subjected to ischemia and reperfusion[J]. Chin J Traumatol, 2005, 8 (3) :179–182. |
| [3] | CHAN P H. Reactive oxygen radicals in signaling and damage in the ischemie brain[J]. J Cereb Blood Flow Metab, 2001, 21 (1) :2–14. |
| [4] | ZHAO G, VASZAR L T, QIU D, et al. Anti-inflammatory effects of triptolide in human bronchial epithelial cells[J]. Am J Physiol Lung Cell Mol Physiol, 2000, 279 (5) :L958–L966. |
| [5] | WANG X, LIANG X B, Li F Q, et al. Therapeutic strategies for Parkinson's disease:the ancient meets the future-traditional Chinese herbal medicine, electroacupuncture, gene therapy and stem cells[J]. Neurochem Res, 2008, 33 (10) :1956–1963. doi:10.1007/s11064-008-9691-z |
| [6] | GENG Y, FANG M, WANG J, et al. Triptolide down-regulates COX-2 expression and PGE2 release by suppressing the activity of NF-κB and MAP kinases in lipopolysaccharide-treated PC12 cells[J]. Phytother Res, 2012, 26 (3) :337–343. |
| [7] | XUE B, JIAO J, ZHANG L, et al. Triptolide upregulates NGF synthesis in rat astrocyte cultures[J]. Neurochem Res, 2007, 32 (7) :1113–1119. doi:10.1007/s11064-006-9253-1 |
| [8] | SU Z, YUAN Y, CAO L, et al. Triptolide promotes spinal cord repair by inhibiting astrogliosis and inflammation[J]. Glia, 2010, 58 (8) :901–915. doi:10.1002/glia.v58:8 |
| [9] | LIU Y, CHEN H L, YANG G. Extract of Tripterygium wilfordii Hook F protect dopaminergic neurons against lipopolysaccharide-induced inflammatory damage[J]. Am J Chin Med, 2010, 38 (4) :801–814. doi:10.1142/S0192415X10008251 |
| [10] | GUAN T, LIU Q, QIAN Y, et al. Ruscogenin reduces cerebral ischemic injury via NF-κB-mediated inflammatory pathway in the mouse model of experimental stroke[J]. Eur J Pharmacol, 2013, 714 (1-3) :303–311. doi:10.1016/j.ejphar.2013.07.036 |
| [11] | 陈卫伟, 杨留才, 潘施文, 等. 线栓法制备SD大鼠局灶性脑缺血再灌注损伤模型[J]. 中国组织工程研究与临床康复, 2011, 15 (50) : 9377–9380. CHEN Weiwei, YANG Liucai, PAN Shiwen, et al. Preparation of Sprague-Dawley rat models of focal cerebral ischemia-reperfusion injury by suture method[J]. Chinese Journal of Tissue Engineering Research, 2011, 15 (50) :9377–9380. (in Chinese) |
| [12] | LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20 (1) :84–91. doi:10.1161/01.STR.20.1.84 |
| [13] | MDZINARISHVILI A, KIEWERT C, KUMAR V, et al. Bilobalide prevents ischemia-induced edema formation in vitro and in vivo[J]. Neuroscience, 2007, 144 (1) :217–222. doi:10.1016/j.neuroscience.2006.08.037 |
| [14] | YANG F, LIU Y, TU J, et al. Activated astrocytes enhance the dopaminergic differentiation of stem cells and promote brain repair through bFGF[J]. Nat Commun, 2014, 5 :5627. doi:10.1038/ncomms6627 |
| [15] | 李琳, 张志强. 脑缺血再灌注损伤中细胞凋亡的研究进展[J]. 中华物理医学与康复杂志, 2005, 27 (1) : 60–62. LI Lin, ZHANG Zhiqiang. Research progress of apoptosis in ischemia-reperfusion injury[J]. Chinese Journal of Physical Medicine and Rehabiltation, 2005, 27 (1) :60–62. (in Chinese) |
| [16] | BRESGEN N, KARLHUBER G, KRIZBAI I, et al. Oxidative stress in cultured cerebral endothelial cells induces chromosomal aberrations, micronuclei, and apoptosis[J]. J Neurosci Res, 2003, 72 :327–333. doi:10.1002/jnr.10582 |
| [17] | DOHMEN C, KUMURA E, ROSNER G, et al. Extracellular correlates of glutamate toxicity in short-term cerebral ischemia and reperfusion:a direct in vivo comparison between white and gray matter[J]. Brain Res, 2005, 1037 (1-2) :43–51. doi:10.1016/j.brainres.2004.12.046 |
| [18] | WEI J, QUAST M. Effect of nitric oxide synthesis inhibitor on a hyperglycemia rat model of reversible focal ischemia:detection of excitatory amino acids release and hydroxyl radical formation[J]. Brain Res, 1998, 791 (1-2) :146–156. doi:10.1016/S0006-8993(98)00089-4 |
| [19] | CEULEMANS AO, ZGAVC T, KOOIJMAN R, et al. The dual role of the neuroinflammatory response after ischemic stroke:modulatory effects of hypothermia[J]. J Neuroinflammation, 2010, 7 :74. doi:10.1186/1742-2094-7-74 |
| [20] | SHICHITA T, SAKAGUCHI R, SUZUKI M, et al. Post-ischemic inflammation in the brain[J]. Front Immunol, 2012, 3 (3) :132. |
| [21] | DENES A, THORNTON P, ROTHWELL N J, et al. Inflammation and brain injury:acute cerebral ischaemia, peripheral and central inflammation[J]. Brain Behav Immun, 2010, 24 (5) :708–723. doi:10.1016/j.bbi.2009.09.010 |
| [22] | YE Z, WANG N, XIA P, et al. Delayed administration of parecoxib, a specific COX-2 inhibitor, attenuated postischemic neuronal apoptosis by phosphorylation Akt and GSK-3β[J]. Neurochem Res, 2012, 37 (2) :321–329. doi:10.1007/s11064-011-0615-y |
| [23] | CLEMENS J A, STEPHENSON D T, YIN T, et al. Drug-induced neuroprotection from global ischemia is associated with prevention of persistent but not transient activation of nuclear factor-kappaB in rats[J]. Stroke, 1998, 29 (3) :677–682. doi:10.1161/01.STR.29.3.677 |
| [24] | YASUDA Y, SHIMODA T, UNO K, et al. Temporal and sequential changes of glial cells and cytokine expression during neuronal degeneration after transient global ischemia in rats[J]. J Neuroinflammation, 2011, 8 :70. doi:10.1186/1742-2094-8-70 |
| [25] | QIU D, ZHAO G, AOKI Y, et al. Immunosuppressant PG490(Triptolide) inhibits T-cell interleukin-2 expression at the level of purine-box/nuclear factor of activated T-cells and NF-kappaB transcriptional activation[J]. J Biol Chem, 1999, 274 (19) :13443–13450. doi:10.1074/jbc.274.19.13443 |
| [26] | TITOV D V, GILMAN B, HE Q L, et al. XPB, a subunit of TFⅡH, is a target of the natural product Triptolide[J]. Nat Chem Biol, 2011, 7 (3) :182–188. doi:10.1038/nchembio.522 |




