2. 兰州大学第一医院耳鼻咽喉头颈外科, 甘肃 兰州 730000
2. Department of Otolaryngology-Head and Neck Surgery, the First Hospital of Lanzhou University, Lanzhou 730000, China
细辛为多年生草本马兜铃科植物, 中医学认为其具有温化寒凝、开通鼻窍之功能, 常包含在治疗变应性鼻炎(allergic rhinitis)的中药方剂中, 如麻黄附子细辛汤、鼻克敏汤等。有研究表明, 细辛挥发油具有抗炎、抗变态反应的作用, 其机制为抑制炎症介质的释放, 显著降低炎症组织及其渗出液中组胺含量[1]。细辛挥发油在治疗过敏性鼻炎过程中还发挥免疫抑制作用, 其作用机制可能与其调节T淋巴细胞亚群分布, 降低T辅助细胞1/2(Th1/Th2)比值, 抑制内啡肽、干扰素产生等有关[2-3]。现代研究表明, 细辛挥发油的成分有甲基丁香酚(methyleugenol)、优藏茴香酮、细辛醚、榄香素、龙脑等, 其中甲基丁香酚是其主要活性成分[4]。Shin等[5]用RNA印迹法证明了甲基丁香酚能直接抑制肥大细胞释放组氨酸和组氨酸脱羧酶的基因超表达。由组胺酸脱羧基而成的组胺在变应性鼻炎发病的多个环节尤其在变态反应的速发相起重要作用, 是参与变应性鼻炎发病机制的一种重要的炎性介质。
黏蛋白(mucins)是一种高度糖基化的大分子蛋白, 其至少有七种(MUC1、MUC2、MUC4、MUC5B、MUC5AC、MUC7、MUC8)表达在气道, 且表达模式十分复杂, 在不同的气道水平、发育阶段、气道条件以及不同类型分泌细胞表达的黏蛋白基因种类和数量有很大不同。但不论是健康个体还是气道疾病患者, 气道分泌的黏液中MUC5AC都是其最主要的黏蛋白成分。MUC5AC在变应性鼻炎的鼻黏膜中呈高表达的状态[6-7], 本文通过实时荧光定量PCR和免疫组织化学检测变应性鼻炎模型大鼠鼻黏膜组织MUC5AC的变化, 进一步探讨甲基丁香酚通过MUC5AC抑制变应性鼻炎的机制。
1 材料与方法 1.1 实验动物及分组72只SPF级健康Wistar大鼠, 雌雄各半, 4~6周龄, 体质量160~170 g, 由甘肃中医药大学SPF动物实验室提供, 动物许可证号SCXR (甘)2001-0001。从中选取12只大鼠作为正常对照组, 另60只进行造模处理。造模成功后, 再随机分成模型对照组、氯雷他定组和甲基丁香酚小、中、大剂量组共五组, 每组12只。六组大鼠均饲养于甘肃中医药大学SPF动物中心。
1.2 主要试剂及仪器卵清蛋白(A5503, 5 g/瓶, Ⅴ级, 美国Sigma公司, 批号1001445093), 氢氧化铝(500 g/瓶, AR级, 天津市致远化学试剂有限公司), 氯雷他定(10 mg/片, 成都恒瑞制药有限公司, 生产批号140502), 甲基丁香酚(100 mL/瓶, 生产批号c10005528), TRIzol (100 mL/瓶, Ambion公司, 生产批号15596026), 逆转录试剂盒(200RXNS, 日本TaKaRa公司, 生产批号AK3101), MUC5AC引物由宝生物工程(大连)有限公司合成; Tli RNaseH Plus (1 mL/支, 日本TaKaRa公司, 生产批号AK6401), 实时定量PCR仪为罗氏LightCycler 480, MUC5AC一抗(美国Abcam公司, 生产批号1458026)、二抗试剂盒(北京中杉金桥生物技术有限公司, 生产批号SP-9001)。
1.3 模型建立造模方法参照文献[8]。将0.3 mg卵清蛋白和30 mg氢氧化铝加等渗氯化钠溶液配成1 mL混悬液, 对模型对照组、氯雷他定组和甲基丁香酚各组大鼠行腹腔注射基础致敏, 空白对照组以等量等渗氯化钠溶液替代, 隔日一次, 共14 d。自第15天开始鼻腔激发:用微量进样器以2%卵清蛋白滴鼻, 50 μL/侧, 正常对照组以等量等渗氯化钠溶液替代, 每日一次, 共七次。末次鼻腔激发后观察大鼠挠鼻、喷嚏和流涕表现, 计数30 min内挠鼻、喷嚏次数及流涕量, 根据动物行为学评分标准记录[8]:①挠鼻-轻度:轻擦鼻二次以下记1分; 重度:抓挠鼻、面不止, 动作快而反复二次以上记2分。②喷嚏-0个为0分, 1~3个为1分, 4~10个为2分, 10个以上为3分。③流涕-清涕流至前鼻孔为1分, 超过前鼻孔为2分, 流涕满面为3分。叠加量化评分超过5分者判为造模成功, 60只大鼠全部造模成功。
1.4 给药干预大鼠的给药剂量(mg/kg)=人的给药剂量(mg/m2)/大鼠的体质量(kg)×大鼠的体表面积(m2)。氯雷他定组:每只大鼠给予氯雷他定(10 mg/片, 1片/次, 1次/d)1 mg/kg溶于2 mL等渗氯化钠溶液灌胃, 1次/d, 共6周。甲基丁香酚各组:鉴于已有实验证明甲基丁香酚高于40 mg/kg有细胞毒性[8], 因此, 小、中、大剂量组分别给予甲基丁香酚10 mg/kg、20 mg/kg、40 mg/kg混悬于2 mL等渗氯化钠溶液灌胃, 1次/d, 共6周。正常对照组和模型对照组均以2 mL等渗氯化钠溶液灌胃, 1次/d, 共6周。
在实验6周时间内, 模型对照组、氯雷他定组和甲基丁香酚各组均以2%卵清蛋白滴鼻维持激发, 50 μL/侧, 隔天1次, 正常对照组以等量等渗氯化钠溶液替代。末次滴鼻后对各组大鼠行为学叠加量化评分。分别在干预1、2、4和6周后每组随机取3只大鼠处死, 快速剥取大鼠的鼻腔黏膜, 一侧于-80 ℃保存, 用于实时荧光定量PCR检测; 另一侧则取完整鼻黏膜组织用于免疫组织化学检测。
1.5 实时定量PCR检测各组鼻黏膜组织MUC5AC mRNA的表达采用TRIzol试剂参照说明书提取各组大鼠的鼻黏膜组织总RNA, 琼脂糖凝胶电泳法检测总RNA质量。取4 μL RNA逆转录合成cDNA, 其中2 μL cDNA为模板扩增, β-actin为内参照, 并设阴性对照, 反应条件相同。引物序列: β-actin, 上游5'-GGAGATTACTGCCCTGGCTCCTA-3', 下游5'-GACTCATCGTACTCCTGCTTGCTG-3';MUC5AC, 上游5'-ggAACCATCATCTACAACCA gACA-3', 下游5'-CCTgACTAACCCCTTTgA CCAC-3'。采用相对定量法, 在RT-PCR仪上收集各个模板的Ct值, ΔCt=Ct目的基因-Ct内参基因, 本实验采用1000/2Δct的计算数据作为统计数据, 由此分别计算各组大鼠的MUC5AC mRNA在大鼠鼻黏膜的相对表达量。
1.6 免疫组织化学法检测各组鼻黏膜组织MUC5AC蛋白的表达取各组大鼠鼻黏膜组织, 4 %中性多聚甲醛固定, 常规石蜡包埋, 4 μm厚连续切片, 常规脱蜡。采用免疫组织化学SP法染色, 柠檬酸修复, 其余步骤按SP试剂盒说明书进行。MUC5AC一抗单克隆抗体1:200稀释, 用已知阳性片作为阳性对照, PBS代替一抗作为阴性对照。DAB显色, 常规脱水、透明和封片。显微镜观察组织细胞内黏膜MUC5AC的表达情况, 每张切片400倍下随机选取5个视野计数阳性细胞数, 以肉眼可见棕色的阳性反应产物为染色阳性的判定标准。根据每个视野阳性细胞及此视野内所有上皮细胞数计算阳性细胞百分率, 取平均值。
1.7 统计学方法采用SPSS 17.0进行统计学处理。所有数据服从正态分布, 均以均数±标准差(x±s)表示。用Kolmogorov-Smirnov (K-S检验)进行检验, 任意两组间均数的比较采用单因素方差分析, 大鼠鼻部症状评分及MUC5AC蛋白阳性细胞百分率采用LSD-t检验, 实时荧光定量PCR检测结果采用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 各组行为学评分比较给药干预过程中, 甲基丁香酚中、大剂量组及氯雷他定组的大鼠喷嚏次数、挠鼻次数和鼻分泌物逐渐减少。甲基丁香酚中剂量组在干预1周后的叠加评分与模型对照组差异无统计学意义(P>0.05);干预2、4、6周后叠加评分低于模型对照组, 差异有统计学意义(均P < 0.05);干预4、6周后与氯雷他定组差异无统计学意义(均P>0.05)。甲基丁香酚大剂量组在干预1周后的叠加评分低于模型对照组, 差异有统计学意义(P#60;0.05);干预1、2周后叠加评分高于氯雷他定组, 差异也有统计学意义(均P#60;0.05);干预4、6周时与氯雷他定组差异无统计学意义(均P>0.05)。氯雷他定组在干预1周后叠加评分低于模型对照组, 差异有统计学意义(P#60;0.05)。在整个干预过程中, 甲基丁香酚小剂量组与模型对照组大鼠鼻部过敏症状差异均无统计学意义(均P>0.05)。见图 1。

|
| A:干预1周后, B:干预2周后, C:干预4周后, D:干预6周后.与正常对照组比较, *P < 0.05;与模型对照组比较, #P < 0.05;与氯雷他定组比较, ▲P < 0.05. 图 1 各组干预后大鼠行为学评分比较 Fig. 1 The nasal symptom scores in rats |
甲基丁香酚中剂量组在干预1、2周后MUC5AC mRNA表达量与模型对照组差异均无统计学意义(均P>0.05), 干预4、6周后MUC5AC mRNA表达量低于模型组, 差异均有统计学意义(均P < 0.05), 干预4、6周后与氯雷他定组差异均无统计学意义(均P>0.05);甲基丁香酚大剂量组在干预1周后MUC5AC mRNA表达量与模型对照组差异无统计学意义(P>0.05), 干预2、4、6周后MUC5AC mRNA表达量均低于模型对照组(均P < 0.05), 干预4、6周后与氯雷他定组差异无统计学意义(均P>0.05)。氯雷他定组在干预1周后与模型对照组差异有统计学意义(P < 0.05)。在整个干预过程中, 甲基丁香酚小剂量组与模型对照组差异均无统计学意义(均P>0.05)。见图 2。
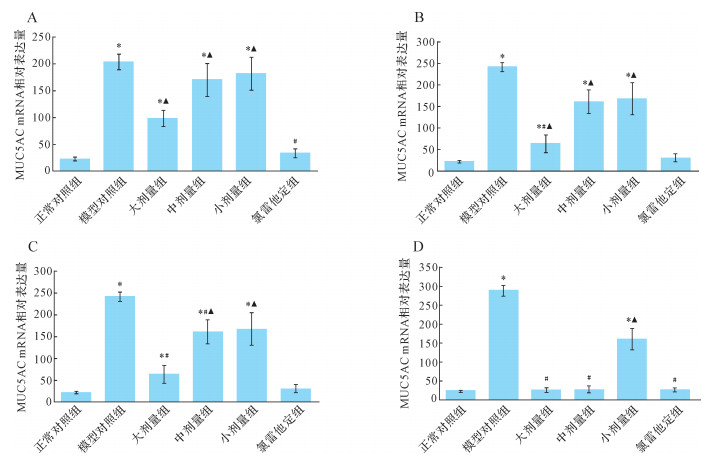
|
| A:干预1周后, B:干预2周后, C:干预4周后, D:干预6周后.与正常对照组比较, *P < 0.05;与模型对照组比较, #P < 0.05;与氯雷他定组比较, ▲P < 0.05. 图 2 各组干预后大鼠鼻黏膜组织MUC5AC mRNA表达量比较 Fig. 2 The relative quantity of MUC5AC mRNA in nasal mucosa of rats |
黏蛋白MUC5AC主要表达在纤毛柱状上皮的杯状细胞和黏液腺, 正常对照组与模型对照组表达部位基本一致。模型对照组MUC5AC的表达量无论是在纤毛柱状上皮的杯状细胞还是黏液腺均多于正常对照组。见图 3。
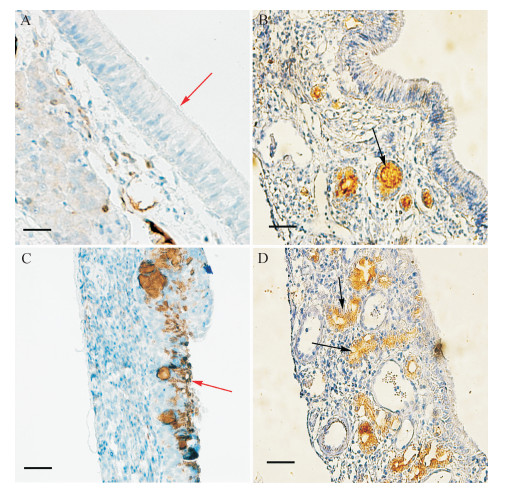
|
| A、B:正常对照组; C、D:模型对照组.红色箭头所示为MUC5AC在大鼠鼻黏膜柱状上皮的表达; 黑色箭头所示为MUC5AC在固有层黏液腺的表达.标尺=100 μm. 图 3 MUC5AC在大鼠鼻黏膜表达部位 Fig. 3 The expression of MUC5AC in nasal mucosa of rats |
甲基丁香酚中剂量组在干预1、2周后MUC5AC蛋白表达阳性细胞百分率与模型对照组差异均无统计学意义(均P>0.05);干预4、6周后MUC5AC蛋白表达阳性细胞百分率低于模型对照组(均P < 0.05), 与氯雷他定组差异无统计学意义(均P>0.05)。甲基丁香酚大剂量组在干预1周后MUC5AC蛋白阳性表达细胞百分率与模型对照组差异无统计学意义(均P>0.05);干预2、4、6周后MUC5AC蛋白表达阳性细胞百分率均低于模型对照组, 差异均有统计学意义(均P < 0.05);干预4、6周后与氯雷他定组差异均无统计学意义(均P>0.05)。氯雷他定组在干预1周后与模型对照组差异无统计学意义(P>0.05)。在整个干预过程中, 小剂量组与模型对照组差异均无统计学意义(均P>0.05)。见表 1。
| (x±s, %) | |||||
| 组别 | n | 1周 | 2周 | 4周 | 6周 |
| 正常对照组 | 3 | 17.46±3.22 | 19.65±3.46 | 15.34±4.90 | 16.23±5.79 |
| 模型对照组 | 3 | 39.40±2.88* | 38.22±3.12* | 37.38±4.00* | 36.22±3.17* |
| 甲基丁香酚大剂量组 | 3 | 36.29±3.09*▲ | 26.33±2.21*#▲ | 23.77±2.69*# | 18.32±3.14# |
| 中剂量组 | 3 | 37.78±2.11*▲ | 35.65±3.24*▲ | 27.89±1.90*# | 21.24±3.67# |
| 小剂量组 | 3 | 38.65±2.89*▲ | 36.78±1.90*▲ | 36.54±2.49*▲ | 37.45±1.67*▲ |
| 氯雷他定组 | 3 | 27.34±3.79* | 20.46±4.67*# | 19.57±3.90# | 15.77±3.67# |
| 与正常对照组比较, *P < 0.05;与模型对照组比较, #P < 0.05;与氯雷他定组比较, ▲P < 0.05. | |||||
变应性鼻炎是由免疫球蛋白IgE介导的介质(主要是组胺、激肽类、白三烯等)释放、并有多种免疫活性细胞(嗜酸粒细胞等)和细胞因子IL-3、IL-4、IL-5、IL-6、IL-9、IL-10、IL-13等参与的鼻黏膜慢性炎症反应性疾病[9]。Th1/Th2在数量及功能上的失衡是变应性鼻炎发病机制中的重要环节, Th2细胞优势释放IL-3、IL-4、IL-5、IL-13、粒细胞集落刺激生物因子(如GM-CSF)等细胞因子, 其中IL-4、IL-5、IL-13促进B淋巴细胞分化为浆细胞从而在IgE的调节中起到重要作用[10]; 而GM-CSF、IL-3、IL-5在嗜酸性粒细胞祖细胞的产生、嗜酸性粒细胞的分化、募集、成熟及分泌中起重要作用[11]。
黏液分泌是开放性管状器官管腔的重要保护机制, 正常气道上皮分泌少量黏液, 具有保护和润滑气道的作用, 是呼吸系统固有免疫的第一道防线。在变应性鼻炎中, 有黏液分泌异常的现象, 江英等[12]在电镜观察的结果中发现在变应性鼻炎大鼠鼻黏膜的表面有着大量稠厚黏液毯。黏蛋白是组成黏液的重要成分, 江德鹏等[13]发现MUC5AC异常升高可引起黏液量增多并造成鼻黏膜损伤。在变应性鼻炎患者, 镶嵌在假复层纤毛柱状上皮之间的杯状细胞对于黏蛋白的分泌具有重要作用[14]。Th2细胞分泌IL-4、L-5以及IL-13的刺激使杯状细胞增生, 杯状细胞的增生又是MUC5AC分泌增多的基础[15-16]。组胺、表皮生长因子、TGF、白三烯(LT)、IL-4、L-5、IL-9以及IL-13均可刺激杯状细胞, 使其分泌MUC5AC异常增多[17]。
MUC5AC的表达不仅在蛋白合成及分泌过程受到调控, 并且在转录水平(mRNA)也受到相关因素的调节。组胺可以促进TNF-α释放[18], TNF-α通过启动NF-κB途径调节炎症因子来调控MUC5AC的表达[19-20]; 组胺的释放与嗜酸性粒细胞的数量及活性有关[21], 组胺产生并释放TGF-α, 继而通过TGF-α-Ras/Raf-MEK-ERKSp1途径刺激MUC5AC基因的表达[22]。MUC5AC在各种因素刺激中表达增强提示其在变应性鼻炎发病机制中起重要作用。变应性鼻炎病程中黏蛋白异常分泌可导致鼻黏膜纤毛输送系统功能的降低, 会影响变应原的清除, 从而加重变应性鼻炎病情[6]。我们的研究也发现, 模型对照组大鼠鼻黏膜MUC5AC蛋白表达阳性细胞百分率以及MUC5AC mRNA表达量均高于正常对照组。
组胺是参与过敏性鼻炎发病机制的一种重要的炎性介质, 作用于H1受体引起血管扩张、渗透性增高、腺体分泌增多及神经反射等反应。Th2细胞分泌的IL-4、IL-5、IL-13刺激B淋巴细胞分泌IgE进而刺激肥大细胞分泌组胺, 而Th2细胞分泌的IL-9可以直接刺激肥大细胞分泌组胺[23]。组胺在变应性鼻炎这种Ⅰ型超敏反应中通过增强致炎因子和趋化因子的分泌参与了变态反应炎症, 这些因子可以诱导人鼻黏膜中嗜酸性粒细胞, 使鼻黏膜上皮及黏膜下嗜酸性粒细胞浸润、增多、活化, 并且嗜酸性粒细胞阳离子蛋白、主要碱性蛋白质等递质及趋化因子在其作用下表达和释放增加, 而这些趋化因子反过来可促进组胺的释放[24], 从而形成了一个正反馈的作用途径。龙小博等[25]用组胺刺激体外培养的变应性鼻炎鼻黏膜组织, 观察到MUC5AC基因及蛋白水平显著增加, 说明组胺也能上调黏蛋白MUC5AC的表达。氯雷他定具有阻断外周组胺H1受体的作用, 其作用机制与甲基丁香酚有相近之处, 所以选作阳性对照。在本实验中, 氯雷他定组在干预1周后MUC5AC蛋白表达阳性细胞百分率以及MUC5AC mRNA表达量较模型对照组明显减少, 说明组胺对于杯状细胞及腺体的刺激是MUC5AC分泌的重要因素。
鉴于组胺在变应性鼻炎中的作用及组胺对于MUC5AC的影响, 本实验在变应原持续激发下, 用不同剂量的甲基丁香酚对大鼠进行灌胃干预, 运用免疫组织化学和实时荧光定量PCR的方法分别检测鼻黏膜MUC5AC蛋白和mRNA的表达。
在甲基丁香酚干预过程中我们发现, 大、中剂量组分别在干预1周后和2周后的症状叠加评分较模型对照组明显降低, 同时MUC5AC的表达也较模型对照组明显降低, 证明甲基丁香酚可以抑制MUC5AC的表达, 从而减轻大鼠变应性鼻炎症状。甲基丁香酚对于变应性鼻炎大鼠鼻黏膜MUC5AC表达的影响可能存在以下机制:①甲基丁香酚抑制肥大细胞释放组氨酸和组氨酸脱羧酶的基因超表达, 进而抑制了组胺致MUC5AC分泌增加的途径, 使MUC5AC在杯状细胞及腺体的表达也相应降低; ②组胺生成减少对于IL及趋化因子的促进作用减弱, 这些因子对于组胺的反向促进作用也相应减弱, 从而使整个炎症反应体系减弱, 刺激腺体及杯状细胞分泌MUC5AC的作用减弱; ③组胺生成受到抑制, TNF-α的分泌相应减少, NF-κB途径启动受到抑制, 炎症反应进一步减弱, MUC5AC基因的表达相对降低; ④组胺生成减少, 嗜酸性粒细胞数量减少、活性减弱, 其释放TGF-α受到抑制, TGF-α-Ras/Raf-MEK-ERKSp1途径启动受到抑制, MUC5AC基因的表达相对降低。
此外, 甲基丁香酚大、中剂量组分别在干预2周、4周后MUC5AC蛋白阳性细胞表达率和mRNA表达少于模型对照组; 甲基丁香酚大剂量组在干预4周后, MUC5AC蛋白阳性细胞表达率和mRNA表达与氯雷他定组接近; 甲基丁香酚中剂量组在干预6周后, MUC5AC蛋白阳性细胞表达率高于氯雷他定组; 甲基丁香酚小剂量组MUC5AC蛋白阳性表达在干预过程中与模型对照组接近。此浓度梯度的差异不但可以证明甲基丁香酚干预对变应性鼻炎大鼠鼻黏膜过度分泌MUC5AC有效, 也说明此有效性与甲基丁香酚之间存在量效关系。同时, 我们也发现, 在干预过程中MUC5AC蛋白和mRNA较模型对照组均减少, 说明甲基丁香酚对于变应性鼻炎大鼠鼻黏膜MUC5AC的影响在蛋白水平及mRNA水平具有一致性。
综上所述, 甲基丁香酚对于变应性鼻炎大鼠鼻黏膜MUC5AC确有一定的抑制作用, 其可能是通过抑制组胺等炎性介质的生成进而减少了MUC5AC的分泌。但是, 甲基丁香酚是否有影响MUC5AC分泌的其他途径, 则需要进一步的研究。甲基丁香酚作为中药细辛的提纯成分, 是未来中药研究的热点及趋势, 本研究为未来甲基丁香酚在临床上的应用研究提供了重要依据。
| [1] | 梁少瑜, 谭晓梅, 曾永长, 等. 细辛挥发油对过敏性鼻炎豚鼠鼻黏膜和组胺影响的初步研究[J]. 中国实验方剂学杂志, 2011, 17 (2) : 149–151. LIANG Shaoyu, TAN Xiaomei, ZENG Yongchang, et al. Preliminary study on effects of Xixin oil on blood histamine pathomorphological change in nasal mucosa in guinea pigs with allergic rhinitis[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17 (2) :149–151. (in Chinese) |
| [2] | 王龙妹, 傅惠娣, 周志兰. 细辛、苍耳子对小鼠干扰素诱生的影响[J]. 中国临床药学杂志, 1999, 8 (1) : 23–25. WANG Longmei, FU Huidi, ZHOU Zhilan. Effects of Herba asari and Fructus xanthii on interferon induction in rats[J]. Chinese Journal of Clinical Pharmacy, 1999, 8 (1) :23–25. (in Chinese) |
| [3] | 章育正, 余上才, 赵慧娟, 等. 苍耳子和细辛的免疫抑制作用[J]. 上海免疫学杂志, 1993, 13 (6) : 334–336. ZHANG Yuzheng, YU Shangcai, ZHAO Huijuan, et al. Immunosuppressive effect of fructus xanthii and asarum[J]. Shanghai Journal of Immunology, 1993, 13 (6) :334–336. (in Chinese) |
| [4] | 刘玉红, 易进海, 黄蛟, 等. RP-HPLC法同时测定细辛中甲基丁香酚、黄樟醚和细辛脂素的含量[J]. 药物分析杂志, 2012, 32 (5) : 822–825. LIU Yuhong, YI Jinhai, HUANG Jiao, et al. RP-HPLC simultaneous determination of methyleugenol, safrole and asarinin in Asari Radix et Rhizoma[J]. Chinese Journal of Pharmaceutical Analysis, 2012, 32 (5) :822–825. (in Chinese) |
| [5] | SHIN B K, LEE E H, KIM H M. Suppression of L-histidine decarboxylase mRNA expression by methyleugeol[J]. Biochem Biophys Res Commun, 1997, 232 (1) :188–191. doi:10.1006/bbrc.1997.6260 |
| [6] | 黄建民, 何韶衡, 赵卫华. 气道粘液、黏蛋白及其分泌调节[J]. 中国病理生理杂志, 2003, 19 (9) : 1267–1271. HUANG Jianmin, HE Shaoheng, ZHAO Weihua. Airway mucus, mucins and their secretory regulations[J]. Chinese Journal of Pathophysiology, 2003, 19 (9) :1267–1271. (in Chinese) |
| [7] | 韩菲, 安云芳, 赵长青. 大鼠变应性鼻炎模型下呼吸道细胞因子及黏蛋白的改变[J]. 中国耳鼻咽喉头颈外科杂志, 2005, 40 (5) : 339–342. HAN Fei, AN Yunfang, ZHAO Changqing. Alteration of cytokines and mucin in lower respiratory tract in allergic rhinitis model in rats[J]. Chinese Journal of Otorhinolaryngology Head and Neck Surgery, 2005, 40 (5) :339–342. (in Chinese) |
| [8] | 李钦, 李玉芬, 陈彦林, 等. 白细胞介素5和13受体对变应性鼻炎大鼠血管细胞黏附分子1及γ干扰素的影响[J]. 中华耳鼻咽喉头颈外科杂志, 2012, 47 (8) : 638–641. LI Qin, LI Yufen, CHEN Yanlin, et al. Effect of combined use of sIL-5Rα and sIL-13Rα2 on VCAM-1 and IFN-γ in allergic rhinitis rats[J]. Chinese Journal of Otorhinolaryngology Head and Neck Surgery, 2012, 47 (8) :638–641. (in Chinese) |
| [9] | JHONSON J D, RYAN M J, TOFT J D Ⅱ, et al. Two-year toxicity and carcinogenicity study of methyleugenol in F344/N rats and B6C3F (1) mice[J]. J Agric Food chem, 2000, 48 (8) :3620–3632. doi:10.1021/jf000364a |
| [10] | 孟庆翔.尘螨变应原舌下免疫治疗对变应性鼻炎TSLP-OX40L信号通路介导的TH2型免疫反应的影响及其临床疗效观察[D].广州:南方医科大学, 2014. MENG Qingxiang.The impact of sublingual immunotherapy with dust mite allergen on TH2 type immune responses mediated by TSLP-OX40L signaling pathway and clinical efficacy in patients with allergic rhinitis[D].Guangzhou:Southern Medical University, 2014.(in Chinese) |
| [11] | 张慧, 耿曼英, 闫保星, 等. IL-4/STAT6在变应性鼻炎豚鼠鼻黏膜的表达及鼻用糖皮质激素对其表达的影响[J]. 临床耳鼻喉头颈外科杂志, 2012, 26 (8) : 364–367. ZHANG Hui, GENG Manying, YAN Baoxing, et al. Histologic expressions of IL-4/STAT6 in nasal mucosa of guinea pig allergic rhinitis models and effect of glucocorticoid on them[J]. Chinese Journal of Otorhinolaryngology Head and Neck Surgery, 2012, 26 (8) :364–367. (in Chinese) |
| [12] | 江英, 席克虎, 陈小婉, 等. 18β-甘草次酸对变应性鼻炎大鼠鼻黏膜纤毛超微结构的影响[J]. 第二军医大学学报, 2015, 36 (1) : 26–33. JIANG Ying, XI Kehu, CHEN Xiaowan, et al. Effect of 18β-glycyrrhetinic acid on ultrastructure of nasal mucosa in rat models of allergic rhinitis[J]. Academic Journal of Second Military Medical University, 2015, 36 (1) :26–33. doi:10.3724/SP.J.1008.2015.00026 (in Chinese) |
| [13] | 江德鹏.白介素13诱导气道黏液高分泌的机制及其调控研究[D].重庆:重庆医科大学, 2012. JIANG Depeng.Study on the mechanism of interleukin 13 induces airway mucus hypersecretion and its regulation[D].Chongqing:Chongqing Medical University, 2012.(in Chinese) http://www.cnki.com.cn/Article/CJFDTOTAL-LCFK201209067.htm |
| [14] | 马睿, 万欢英, 黄绍光, 等. COPD患者气道杯状细胞增生和粘蛋白表达量的变化[J]. 上海第二医科大学学报, 2004, 24 (12) : 1031–1033. MA Rui, WAN Huanying, HUANG Shaoguang, et al. Goblet cell hyperplasia and abnormallities in mucin expression in COPD patients[J]. Acdademic Journal of Shanghai Second Medical University, 2004, 24 (12) :1031–1033. (in Chinese) |
| [15] | HACHA J, TOMLINSON K, MAERTENS L, et al. Nebulized anti-IL-13 monoclonal antibody Fab'fragment reduces allergen-induced asthma[J]. Am J Respir Cell Mol Biol, 2012, 47 (5) :709–717. doi:10.1165/rcmb.2012-0031OC |
| [16] | WEI Q, SHA Y, BHATTACHARYA A, et al. Regulation of IL-4 receptor signaling by STUB1 in lung inflammation[J]. Am J Respir Crit Care Med, 2014, 189 (1) :16–29. |
| [17] | MA Y, HALAYKO A J, BASU S, et al. Sustained suppression of IL-13 by a vaccine attenuates airway inflammation and remodeling in mice[J]. Am J Respir Cell Mol Biol, 2013, 48 (5) :540–549. doi:10.1165/rcmb.2012-0060OC |
| [18] | 张学文, 钮洪艳, 周晓燕. 组胺H1受体拮抗剂对变应性鼻炎大鼠血清中TNF-α仪和NO的影响[J]. 中国误诊学杂志, 2011, 11 (27) : 6568–6569. ZHANG Xuewen, NIU Hongyan, ZHOU Xiaoyan. Effect of histamine H1 receptors antagonist on TNF alpha and NO in blood serum in rats with allergic rhinitis[J]. Chinese Journal of Misdiagnostics, 2011, 11 (27) :6568–6569. (in Chinese) |
| [19] | 李莉.NF-κB介导丙烯醛刺激大鼠气道MUC5AC和MUC2高表达[D].成都:四川大学, 2004. LI Li.Acrolein stimulates overexpression of MUC5AC and MUC2 in rats airways through the activation of NF-κB[D].Chengdu:Sichuan University, 2004.(in Chinese) |
| [20] | 李琪, 周向东. TNF-α与香烟烟雾在诱导气道上皮细胞株黏蛋白表达的相互作用[J]. 基础医学与临床, 2009, 29 (11) : 1139–1143. LI Qi, ZHOU Xiangdong. Interaction of TNF-α and cigarette smoke extract in respiratory mucus expression[J]. Basic&Clinical Medicine, 2009, 29 (11) :1139–1143. (in Chinese) |
| [21] | 邓秋, 周芸, 杨军, 等. 布地奈德对变应性鼻炎豚鼠鼻粘膜嗜酸性粒细胞及组胺的影响[J]. 中国临床药理学与治疗学, 2006, 11 (7) : 756–759. DENG Qiu, ZHOU Yun, YANG Jun, et al. Effect of budesonide on nasal mucosa of guinea pig allergic rhinitis eosinophils and histamine[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2006, 11 (7) :756–759. (in Chinese) |
| [22] | 纪琛琪, 郭永清. 黏蛋白在鼻及呼吸道的表达及意义[J]. 医学综述, 2008, 14 (16) : 2409–2411. JI Chenqi, GUO Yongqing. Expression and significance of mucin in nose and airway tract[J]. Medical Recapitulate, 2008, 14 (16) :2409–2411. (in Chinese) |
| [23] | TREVOR J L, DESHANE J S. Refractory asthma:mechanisms, targets, and therapy[J]. Allergy, 2014, 69 (7) :817–827. doi:10.1111/all.12412 |
| [24] | 潘虎.组胺和花生四烯酸体外诱导变态反应性炎症的发生及其干预[D].重庆:第三军医大学, 2004. PAN Hu.The allergic inflammation induced by histamine and arachidonic acid in nasal polyps and skin in vitro and its interference[D].Chongqing:Third Military Medical University, 2004.(in Chinese) |
| [25] | 龙小博, 甄宏韬, 彭璐, 等. 布地奈德对变应性鼻炎鼻黏膜黏蛋白MUC5AC和MUC5B表达的影响[J]. 华中科技大学学报(医学版), 2007, 36 (5) : 648–651. LONG Xiaobo, ZHEN Hongtao, PENG Lu, et al. Effect of budesonide on the expression of MUC5AC and MUC5B in allergic rhinitis[J]. Acta Medicinae Universitatis Scientiae et Technologiae Huazhong, 2007, 36 (5) :648–651. (in Chinese) |




