2. 第四军医大学西京医院老年病科, 陕西 西安 710032
2. Department of Gerontology, Xijing Hospital, the Fourth Military Medical University, Xi'an 710032, China
骨性关节炎(osteoarthritis, OA)是一种严重影响老年人生活质量和危害老年人健康的慢性退行性骨关节疾病[1]。OA系由机械和生物性因素共同作用引起关节软骨细胞、细胞外基质、软骨下骨合成和降解动态失衡所致。目前, 对于OA的病因和病理机制尚不完全明确, 有文献报道与骨内压/关节腔内压过高、自由基氧化应激、免疫因子、脂蛋白基因等改变相关[2-3]。如何在OA发生发展的初期进行预防和治疗成为国内外学者研究的重点。Whitworth等[4]应用干细胞疗法从软骨修复方面早期干预OA, 但长期疗效有待提高; Klag等[5]尝试运用C型利钠肽(CNP)从基因层面治疗OA, 但目前难以解决CNP作用部位的局限性及最佳作用量的微调等问题。
天然药物因其毒性小、不良反应少、经济、安全, 逐渐成为抗OA研究的重点之一[6]。薯蓣皂苷元(diosgenin, Dgn)是甾体总皂苷的一种, 在薯蓣科植物中含量最为丰富, 有广泛的生物学作用, 如抗肿瘤、抗高血脂、抗炎、促进成骨细胞的增殖分化及抑制破骨细胞的形成等。现代药理学研究证实, Dgn具有抗氧化、抗炎、免疫调节、改善微循环等多种功效。Shishodia等[7]报道Dgn通过下调Akt、IκB激酶活化和NF-κB的表达抑制破骨细胞形成、侵袭和扩散。Saha等[8]研究证实, Dgn通过抑制人单核细胞系THP-1细胞诱导的TNF-α、IκB激酶组织因子活性表达及氧化应激反应发挥抗OA作用, 但其作用机制尚未完全阐明。在OA的病理进程中, 证实NF-κB途径通过促炎反应发挥作用[9]。酪氨酸蛋白激酶/信号转导子和转录激活子(janus activated kinase signal transducer/activator of transcription, JAK/STAT)是近年来发现的重要的细胞内信号转导通路家族, 其对多种疾病的发生、发展过程有重要的调控作用。Li等[10]报道在OA或类风湿性关节炎中抑制JAK2/STAT3信号通路时, 可有效降低趋化因子CXCL16及其受体CXCR6的水平。Ohba等[11]研究证实在软骨细胞内平衡方面, 分泌性卷曲蛋白1与STAT3的磷酸化呈正相关。de Andrés等[12]对JAK/STAT通路抑制剂-细胞因子信号转导抑制因子(SOCS)与OA的关联进行研究, 发现在OA中SOCS2表达减少, 而SOCS1和SOCS3未受影响。
本研究主要通过JAK2/STAT3信号通路与OA病理中软骨细胞代谢的相关性以及Dgn在此过程中的作用研究, 为临床治疗OA提供新的思路和依据。
1 材料与方法 1.1 实验动物、试剂和仪器SPF级C57BL/6小鼠, 雄鼠15只, 体质量为13.20~18.55 g, 平均(15.50±3.80) g, 遗传背景H-2b, 由兰州军区总医院动物实验中心提供; Dgn、DMSO、胰蛋白酶购自美国Sigma-Aldrich公司; AG490(JAK2/STAT3通路阻断剂)、蛋白酶抑制剂、JAK2/STAT3抗体、Ac-FOXO1抗体、β-actin抗体购自美国Santa Cruz公司; 羊抗小鼠、羊抗兔和兔抗羊IgG二抗购自北京中杉金桥生物技术有限公司; DMEM低糖培养液购自美国HycLone公司; 小牛血清购自杭州四季青生物工程材料有限公司; RPMI1640购自美国Gibco公司; RIPA蛋白质裂解液购自美国ProMab公司; 蛋白上样缓冲液购自上海碧云天生物技术有限公司; 线粒体提取盒购自武汉博士德生物工程有限公司; 冷场扫描电镜购自日本奥林巴斯公司。
1.2 OA模型的制备和分组将15只C57BL/6小鼠随机分为健康对照组、模型对照组和Dgn组。健康对照组正常饲养4周。模型对照组采用腹腔戊巴比妥钠麻醉后, 乙醇消毒, 于解剖显微镜下进行无菌手术。用眼科剪沿膝关节内侧纵向剪开皮肤、黏膜(避免剪断附着于黏膜上的血管), 使内侧副韧带暴露; 换用维纳斯剪在视野中央的内侧副韧带做一小切口, 在内侧副韧带切口处划断半月板上下缘的关节囊, 用神经剥离子钩出内侧半月板并剪断, 切口留下剪断的内侧副韧带及半月板; 消毒后依次进行缝合, 饲养4周。Dgn组在模型对照组的基础上, 术后每日接受Dgn腹腔注射(100 mg/kg)。4周后脱颈处死三组共计15只小鼠, 并分别取30只膝关节组织(股骨髁及胫骨平台软骨)待用。
1.3 软骨细胞的提取及培养将分离的模型对照组小鼠膝关节组织置于培养瓶中, 再放置于1 mg/mL胶原酶Ⅰ的HEPES缓冲液(硫酸镁溶液0.8 mmol/L、氯化镁溶液116.0 mmol/L、氯化钾溶液5.4 mmol/L、磷酸氢钠溶液10.0 mmol/L、葡萄糖5.1 mmol/L, HEPES 20.0 mmol/L, 酸碱度值7.3)中消化, 重复消化三次, 每次3~5 min。用含10%血清的DMEM溶液终止消化, 置于低速离心机中离心5 min, 相对离心力为200×g。弃去上清液, 用含10%血清和0.01 mmol/L的DMEM溶液重悬细胞。用筛网(200目)过滤没有贴壁的细胞, 去除未消化的组织块。收集过滤的细胞悬液进行细胞计数, 按照实验要求种入不同的培养瓶或者培养板中。
1.4 实验细胞分组取模型对照组对数生长期细胞, 以每孔2×105/mL接种于多聚赖氨酸包被的96孔板中, 于37 ℃、5%二氧化碳培养箱中孵育, 24 h内细胞达到80%~90%融合后, 用含体积分数0.01%FBS的DMEM孵育细胞24 h, 使细胞同步化。观察JAK2/STAT3蛋白的表达, 并加入JAK2/STAT3通路阻断剂AG490以观测相关指标的变化; 同时观察OA模型小鼠细胞线粒体氧化应激指标表达情况。此部分实验共分为四组:①模型对照组; ②Dgn组; ③Dgn+阻断剂组; ④阻断剂对照组。
1.5 甲苯胺蓝染色观察软骨标本的组织学形态三组软骨组织标本采用常规病理石蜡切片法处理, 进行软骨标本组织脱钙。经脱水、透明、石蜡包埋, 用组织切片机进行5 μm厚度的连续切片, 按常规方法对切片进行甲苯胺蓝染色, 光学显微镜下观察软骨组织标本的组织学形态。
1.6 电子显微镜观察软骨标本表面超微结构将标本用0.2 mol/L 3%戊二醛固定2 h, 经PBS缓冲液清洗、锇酸固定、脱水、乙酸异戊酯置换、临界点干燥程序处理后, 在标本样品表面镀金, 冷场扫描电镜观察各组处理的软骨组织标本的形态和结构。
1.7 蛋白质印迹法检测p-JAK2、p-STAT3、Bax等相关蛋白的表达将裂解后的悬液置于4 ℃低温离心机离心15 min, 相对离心力为200×g。取离心后上清液, 一部分用BCA法进行蛋白定量, 另一部分按照4:1的体积比加入上样缓冲液, 沸水中煮7 min。蛋白质印迹法检测的具体方法为取30 μg总蛋白进行SDS-PAGE, 并电转移至硝酸纤维素膜(NC膜)上。根据预染Marker提示, 将NC膜按照相对分子质量剪成不同条带, 分别用含有p-JAK2、p-STAT3、Bax、琥珀酸脱氢酶(succinate dehydrogenase, SDH)、细胞色素C氧化酶(cytochrome C oxidase, COX)或β-actin (1:1000)一抗的TBST溶液4 ℃孵育过夜。过夜后, TBST摇床洗三次, 每次10 min。然后用1:5000的对应二抗孵育条带2 h。再次TBST摇床洗三次后用ECL液进行曝光显影, Bio-RAD照相系统拍照, 并用目标条带与内标条带(β-actin)的积分吸光度值的比值百分率表示p-JAK2、p-STAT3、Bax、SDH和COX的蛋白表达水平。
1.8 比色法测定线粒体中超氧化物歧化酶(superoxide dismutase, SOD)的含量及活性软骨细胞接种、用药处理步骤同1.3和1.4。以0.25%的胰蛋白酶消化、收集细胞, 待超声波打碎细胞后, 根据试剂盒说明书加入检测试剂, 采用分光光度仪比色法检测各管吸光度值, 考马斯亮蓝法测定蛋白质量后校正SOD的含量及活性。
1.9 统计学方法采用SPSS 16.0统计软件进行统计分析, 所有实验数据均以均数±标准差(x±s)表示, 各组数据比较前先进行方差齐性检验, 各组总的组间差异比较采用单因素方差分析(One-Way ANOVA), 以Newman-Keuls检验进行组间的两两比较。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组软骨标本形态学观察结果比较小鼠软骨组织甲苯胺蓝染色结果显示, 与健康对照组比较, 模型对照组软骨组织损伤严重, 部分软骨细胞膜破裂, 个别细胞呈多形性改变; Dgn组软骨细胞形态完整, 增殖正常(图 1)。提示Dgn对软骨细胞具有保护作用, 可减少细胞凋亡, 降低OA所导致的软骨细胞染色体、细胞膜等破坏。
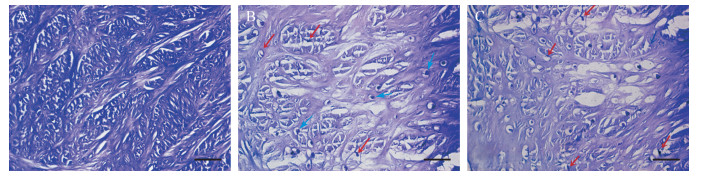
|
| A:健康对照组软骨组织标本表面较完整, 光滑度较好, 软骨细胞形态规则, 细胞膜完整, 细胞质丰富, 细胞核呈椭圆形, 染色质分布均匀; B:模型对照组软骨组织标本表面略微不平, 出现粗糙现象, 可见部分软骨细胞膜破裂, 细胞排列紊乱, 细胞呈多形性改变且细胞质少; C:Dgn组软骨细胞形态较规则, 细胞膜完整.红色箭头:染色质浓缩、中聚及边缘化; 蓝色箭头:细胞核浓缩, 细胞膜破裂.标尺=25 μm. 图 1 各组软骨细胞形态(甲苯胺蓝染色) Fig. 1 Chondrocyte morphology in each group (toluidine blue staining) |
电镜下观察各组软骨组织超微结构, 与健康对照组比较, 模型对照组软骨组织标本表面损伤较为严重, Dgn组软骨标本表面光滑度、胶原纤维排列、暴露、完整度方面均优于模型对照组(图 2)。提示Dgn可维持软骨表面的正常形态, 减轻OA导致的软骨表面破损程度。
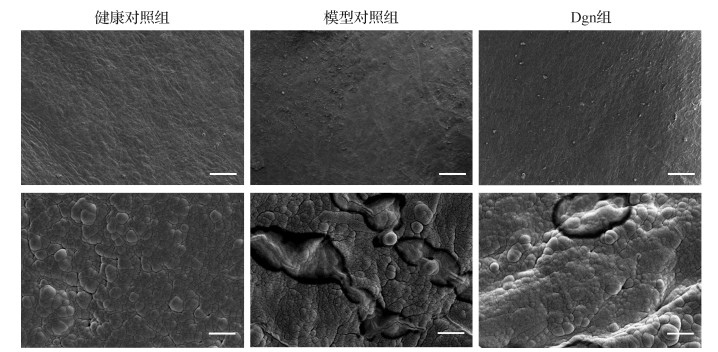
|
| 健康对照组软骨组织标本表面平整光滑, 胶原纤维束排列整齐紧密, 呈均匀平行或交叉状; 模型对照组软骨组织标本已出现大部分浅层剥脱现象, 表面失去光滑度, 呈现粗糙感, 并有覆盖全部组织表面趋势, 胶原纤维束粗细不一, 部分胶原纤维束界限不清; Dgn组软骨组织标本表面整体平整, 有正常圆形突起, 胶原纤维无暴露, 胶原纤维束致密有序排列, 个别区域出现胶原纤维束断层现象.上:标尺=200 μm; 下:标尺=10 μm. 图 2 各组软骨细胞超微结构形态 Fig. 2 Comparison of samples under electron microscope ultrastructure |
四组p-JAK2、p-STAT3蛋白表达见图 3。与模型对照组[(35.88±8.00)%、(27.35±3.00)%]比较, Dgn组p-JAK2、p-STAT3蛋白表达水平增加[(110.50±12.00) %、(85.00±10.00)%, P < 0.05), 而Dgn+阻断剂组p-JAK2、p-STAT3水平降低[(86.82±10.00)%、(56.33±6.00)%, P < 0.05)]。提示模型对照组JAK2/STAT3信号通路受到抑制, Dgn可增加p-JAK2和p-STAT3的表达水平, 阻断剂则可减弱上述保护效果, 在OA病变的基础上进一步抑制JAK2/STAT3信号通路。

|
| 1:模型对照组; 2:Dgn组; 3:Dgn+阻断剂组; 4:阻断剂对照组. 图 3 各组软骨细胞中p-JAK2和p-STAT3蛋白的表达 Fig. 3 Expression of p-JAK2 and p-STAT3 protein in cartilage cells of each group |
在通过线粒体应激诱导的细胞凋亡中, Bax蛋白起关键作用, 检测Bax蛋白可以反映细胞凋亡水平。四组Bax蛋白表达见图 4。与模型对照组[(62.98±8.00)%]比较, Dgn组Bax蛋白表达水平降低[(35.55±5.00)%, P < 0.05], Dgn+阻断剂组Bax蛋白水平升高[(80.52±10.00)%, P < 0.05]。提示Dgn可有效抑制软骨细胞凋亡, 阻断剂可逆转上述保护效果, 进一步促进软骨细胞的凋亡。

|
| 1:模型对照组; 2:Dgn组; 3:Dgn+阻断剂组; 4:阻断剂对照组. 图 4 各组软骨细胞中Bax蛋白的表达 Fig. 4 Expression of Bax protein in cartilage cells of each group |
当软骨细胞凋亡时, SDH和COX是反映线粒体氧化应激功能的标志物。与模型对照组[(28.75±3.00)%和(37.00±3.00)%]比较, Dgn组SDH和COX蛋白表达水平增加[(85.72±10.00)%和(121.38±10.00)%, P < 0.05];加入JAK2/STAT3通路阻断剂后, SDH和COX表达水平降低[(47.22±5.00) %和(80.58±8.00)%, P < 0.05), 见图 5。提示Dgn可有效提高OA软骨细胞线粒体中SDH和COX的表达水平, JAK2/STAT3通路阻断剂可减弱Dgn上述作用, 进一步加重软骨细胞氧化应激损伤。
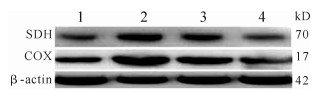
|
| 1:模型对照组; 2:Dgn组; 3:Dgn+阻断剂组; 4:阻断剂对照组. 图 5 各组软骨细胞中SDH和COX蛋白的表达 Fig. 5 Expression of SDH and COX protein in cartilage cells of each group |
SOD是生物体内清除自由基的首要物质。与模型对照组[(7.67±0.80) U/mg]比较, Dgn组SOD含量增加[(23.51±1.70) U/mg, P < 0.05];加入JAK2/STAT3通路阻断剂后SOD活性降低[(13.25±1.68) U/mg, P < 0.05]。该结果提示加入Dgn后, 软骨细胞线粒体氧化应激损伤减轻, 而JAK2/STAT3通路阻断剂则可减弱软骨细胞线粒体抗氧化应激能力。
3 讨论OA严重影响患者的日常生活, 后期易造成关节畸形。任红革等[13]报道, 分解/合成代谢相关细胞因子(基质金属蛋白酶、TGF、胰岛素样生长及成纤维细胞生长因子等), 炎症因子(IL、单核细胞趋化因子和TNF)等在OA的进展中发挥重要作用。Jung等[14]证实Dgn可能通过抑制NF-κB、p65的激活、血管内皮生长因子和基质金属蛋白酶-9的分泌, 从而抑制炎症反应进行, 减轻炎症反应对关节软骨及骨组织的侵蚀破坏。Wang等[15]在运用Dgn治疗OA过程中发现, Dgn可以有效减轻软骨细胞降解, 该效应与减轻氧化应激有关, 并且与NF-κB和OPG/RANKL/RANK信号通路活化有关。
Terrell等[16]发现炎症因子IL-6通过活化JAK/STAT通路促进心肌肥厚。Park等[17]发现JAK/STAT通路介导了氧化应激引起的肺上皮细胞合成表面活性物质的减少。Wen等[18]发现抑制JAK/STAT可以减轻缺血再灌注损伤引起的肠黏膜细胞损伤和凋亡。Yammani等[19]证实IL-7通过激活JAK/STAT通路及JAK-3和STAT-3的磷酸化, 诱导S100A4和基质金属蛋白酶-13的产生, 最终加重OA的发展。Millward-Sadler等[20]研究发现OA软骨细胞中的IL-4受体与STAT6依赖性途径密切相关。基于以上文献报道, 我们采用Dgn后处理OA, 观察Dgn和JAK2/STAT3信号通路之间的相关性。
在本研究中, 我们选择将OA小鼠模型软骨细胞设为对照组, 分别给予JAK2/STAT3信号通路特异性的阻断剂AG490、Dgn及同时行两种方式处理, 检测JAK2/STAT3信号通路中各指标蛋白。在OA的基础上给予阻断剂的目的如下:①进一步证实加入JAK2/STAT3通路阻断剂后, 软骨细胞的JAK2/STAT3磷酸化水平降低; ②与Dgn组比较结果差异明显, 提示Dgn后的效果类似于JAK2/STAT3通路激动剂; ③与加入Dgn和阻断剂比较, 证实Dgn和阻断剂之间存在相互逆转作用。在总结分析实验结果过程中, 我们体会上述实验分组设计存在不足, 倘若同时加入JAK2/STAT3信号通路特异性的激动剂coumermycin A1/colivelin, 实验结论将更为肯定。
JAK/STAT通路与炎症反应、氧化应激、细胞损伤、凋亡等密切相关, 本研究中我们证实:模型对照组p-JAK2、p-STAT3蛋白表达水平降低, 表明其中JAK2/STAT3信号通路受到抑制, 加速OA的进展; Dgn处理可显著提高p-JAK2、p-STAT3蛋白表达水平, 有效减轻OA病理过程中软骨细胞的损伤, 从而发挥抗OA中软骨细胞保护作用, 而JAK2/STAT3阻断剂可逆转Dgn的保护效果。在目前已知的凋亡调节蛋白中, Bcl-2家族在各类刺激信号引起的凋亡中起关键作用。Bcl-2和Bax蛋白水平高低与凋亡调控直接相关: Bax增高, 促进细胞凋亡; Bcl-2增高, 抑制细胞凋亡。Bax表达水平较高时, 可形成Bax/Bax同二聚体, 导致细胞凋亡。本研究模型对照组Bax蛋白表达水平升高, 表明其软骨细胞凋亡增加, 而Dgn可显著降低凋亡相关蛋白Bax表达, 抑制软骨细胞的凋亡, 阻断剂则使Dgn的保护作用下降。氧化应激在机体代谢过程中起着关键作用, 而提高抗氧化系统功能或抑制氧化应激均可防止细胞损伤的发生。据此机制, 天然抗氧化系统SOD、SDH和COX可减轻氧化应激所导致的细胞损伤作用。氧化应激相关指标检测发现, Dgn可以有效提高OA软骨细胞粒体中SOD、SDH和COX水平, 减少因氧化应激损伤导致的软骨细胞凋亡, 阻断剂可以逆转Dgn抗软骨细胞线粒体氧化应激损伤的作用。
本研究结果揭示:Dgn在提高维持软骨细胞完整性、抑制软骨细胞凋亡、增强线粒体抗氧化应激能力方面具有重要作用。分析其作用机制可能如下:①Dgn可通过抑制异丙肾上腺素诱导的谷胱甘肽及其依赖的抗氧化酶和抗过氧化物酶水平的改变, 进而提高抗氧化酶活性[21], 抑制自由基产生的抗氧化能力; ②Dgn作用于NF-κB、羟甲基戊二酰辅酶A还原酶、酪氨酸激酶2等抗炎分子靶点, 减少炎症介质IL-1、IL-6等的产生[22]; ③激活JAK2/STAT3信号通路, 进而抑制炎症因子表达, 降低炎症反应; ④当软骨细胞在DNA损伤时, Dgn通过升高p-JAK2、p-STAT3表达水平抑制p53的活性, 提高软骨细胞DNA修复能力, 减少凋亡。
综上所述, 在OA的渐进性发展过程中, 软骨细胞的代谢与JAK2/STAT3信号通路密切相关, Dgn因其自身特性, 通过激活JAK2/STAT3通路, 进一步减轻软骨细胞炎症反应、线粒体氧化应激损伤和细胞凋亡, 从而发挥预防及治疗OA作用。此过程是否涉及其他细胞因子尚待继续深入研究。
志谢 感谢兰州军区总医院李慎松、高明喧、田琦副主任医师及陈慧主管护师在研究过程中给予的指导, 感谢甘肃省中医药大学王荣、石杰硕士在数据分析中的帮助| [1] | KRAUS V B, KILFOIL T M, HASH T W, et al. Atlas of radiographic features of osteoarthritis of the ankle and hindfo[J]. Osteoarthritis Cartilage, 2015, 23 (12) :2059–2085. doi:10.1016/j.joca.2015.08.008 |
| [2] | 付博, 杨宝林. 骨性关节炎研究进展[J]. 辽宁中医药大学学报, 2014, 16 (7) : 243–246. FU Bo, YANG Baolin. Study progress of osteoarthritis[J]. Journal of Liaoning University of TCM, 2014, 16 (7) :243–246. (in Chinese) |
| [3] | 张荣凯, 杨禄坤, 黄丽娟, 等. 脂蛋白基因在早期骨关节炎软骨下骨的表达[J]. 中国骨伤, 2014, 27 (1) : 54–57. ZHANG Rongkai, YANG Lukun, HUANG Lijuan, et al. Expression of lipoprotein related genes in subchondral bone of early experimental osteoarthritis[J]. China Journal of Orthopaedics and Traumatology, 2014, 27 (1) :54–57. (in Chinese) |
| [4] | WHITWORTH D J, BANKS T A. Stem cell therapies for treating osteoarthritis:prescient or premature[J]. Vet J, 2014, 202 (3) :416–424. doi:10.1016/j.tvjl.2014.09.024 |
| [5] | KLAG K A, HORTON W A. Advances in treatment of achondroplasia and osteoarthritis[J]. Hum Mol Genet, 2016, 25 (R1) :R2–R8. doi:10.1093/hmg/ddv419 |
| [6] | LEPAGE C, LÉGER D Y, BERTRAND J, et al. Diosgenin induces death receptor-5 through activation of p38 pathway and promotes TRAIL-induced apoptosis in colon cancer cells[J]. Cancer Lett, 2011, 301 (2) :193–202. doi:10.1016/j.canlet.2010.12.003 |
| [7] | SHISHODIA S, AGGARWAL B. Diosgenin inhibits osteoclastogenesis, invasion, and proliferation through the downregulation of Akt, IκB kinase activation and NF-κB-regulated gene expression[J]. Oncogene, 2006, 25 (10) :1463–1473. doi:10.1038/sj.onc.1209194 |
| [8] | SAHA S, GOSWAMI G, PANDRANGI A. Isolation and prevention of calcium oxalate-induced apoptotic death and oxidative stress in MDCK cells by diosgenin[J]. Chem Biol Interact, 2014, 224 (224C) :51–57. |
| [9] | CHEN P S, SHIH Y H, HUANG H C, et al. Diosgenin, a steroidal saponin, inhibits migration and invasion of human prostate cancer PC-3 cells by reducing matrix metalloproteinases expression[J]. PLoS One, 2011, 6 (5) :e20164. doi:10.1371/journal.pone.0020164 |
| [10] | LI C H, XU L L, ZHAO J X, et al. CXCL16 upregulates RANKL expression in rheumatoid arthritis synovial fibroblasts through the JAK2/STAT3 and p38/MAPK signaling pathway[J]. Inflamm Res, 2016, 65 (3) :193–202. doi:10.1007/s00011-015-0905-y |
| [11] | OHBA S, LANIGAN T M, ROESSLER B J. Leptin receptor JAK2/STAT3 signaling modulates expression of Frizzled receptors in articular chondrocytes[J]. Osteoarthritis Cartilage, 2010, 18 (12) :1620–1629. doi:10.1016/j.joca.2010.09.006 |
| [12] | DE ANDRÉS M C, IMAGAWA K, HASHIMOTO K, et al. Suppressors of cytokine signalling (SOCS) are reduced in osteoarthritis[J]. Biochem Biophys Res Commun, 2011, 407 (1) :54–59. doi:10.1016/j.bbrc.2011.02.101 |
| [13] | 任红革, 崔逢德. 细胞因子在骨性关节炎中的表达与应用[J]. 中国组织工程研究, 2012, 16 (52) : 9828–9835. REN Hongge, CUI Fengde. Expression and application of cytokines in osteoarthritis[J]. Chinese Journal of Tissue Engineering Research, 2012, 16 (52) :9828–9835. (in Chinese) |
| [14] | JUNG D H, PARK H J, BYUN H E, et al. Diosgenin inhibits macrophage-derived inflammatory mediators through downregulation of CK2, JNK, NF-κB and AP-1 activation[J]. Int Immunopharmacol, 2010, 10 (9) :1047–1054. doi:10.1016/j.intimp.2010.06.004 |
| [15] | WANG L, MA T, ZHENG Y, et al. Diosgenin inhibits IL-1β-induced expression of inflammatory mediators in human osteoarthritis chondrocytes[J]. Int J Clin Exp Pathol, 2015, 8 (5) :4830–4836. |
| [16] | TERRELL A M, CRISOSTOMO P R, WAIRIUKO G M, et al. Jak/STAT/SOCS signaling circuits and associated cytokine-mediated inflammation and hypertrophy in the heart[J]. Shock, 2006, 26 (3) :226–234. doi:10.1097/01.shk.0000226341.32786.b9 |
| [17] | PARK S K, DAHMER M K, QUASNEY M W. MAPK and JAK-STAT signaling pathways are involved in the oxidative stress-induced decrease in expression of surfactant protein genes[J]. Cell Physiol Biochem, 2012, 30 (2) :334–346. doi:10.1159/000339068 |
| [18] | WEN S H, LI Y, LI C, et al. Ischemic postconditioning during reperfusion attenuates intestinal injury and mucosal cell apoptosis by inhibiting JAK/STAT signaling activation[J]. Shock, 2012, 38 (4) :411–419. doi:10.1097/SHK.0b013e3182662266 |
| [19] | YAMMANI R R, LONG D, LOESER R F. Interleukin-7 stimulates secretion of S100A4 by activating the JAK/STAT signaling pathway in human articular chondrocytes[J]. Arthritis Rheum, 2009, 60 (3) :792–800. doi:10.1002/art.v60:3 |
| [20] | MILLWARD-SADLER S J, KHAN N S, BRACHER M G, et al. Roles for the interleukin-4 receptor and associated JAK/STAT proteins in human articular chondrocyte mechanotransduction[J]. Osteoarthritis Cartilage, 2006, 14 (10) :991–1001. doi:10.1016/j.joca.2006.03.013 |
| [21] | TEIXEIRA C C, LIU Y, THANT L M, et al. Foxo1, a novel regulator of osteoblast differentiation and skeletogenesis[J]. J Biol Chem, 2010, 285 (40) :31055–31065. doi:10.1074/jbc.M109.079962 |
| [22] | SALIMEH A, MOHAMMADI M, RASHIDI B. Preconditioning with diosgenin and treadmill exercise preserves the cardiac toxicity of isoproterenol in rats[J]. J Physiol Biochem, 2013, 69 (2) :255–265. doi:10.1007/s13105-012-0208-5 |




