2. 浙江大学医学院附属第一医院感染科 传染病诊治国家重点实验室, 浙江 杭州 310003
2. State Key Laboratory for Diagnosis and Treatment of Infectious Diseases, Department of Infectious Disease, the First Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310003, China
由于肝脏功能的多样性、结构的复杂性,在体外完全模拟肝细胞的生长微环境并在体外重建肝细胞的功能十分困难。微胶囊技术能为细胞提供一个有利于细胞组织重建的微环境,使细胞的形态接近于在体的组织。目前微囊技术已广泛用于生物人工肝研究[1]。我们前期的研究发现,海藻酸钠—壳聚糖(AC)微囊包裹可提高永生化人肝细胞HepLL培养白蛋白合成和清除氨、利多卡因能力[2],肝细胞动态培养时,在施加的振荡或者是旋转等外力的作用下,肝细胞能够形成球形聚集体,而循环灌流系统又持续地为细胞提供了气体和养分,更有利于细胞的生长。
微囊细胞转瓶培养技术结合了微囊培养和转瓶培养的优点,有利于囊内细胞高密度、快速生长并合成和分泌活性物质,而HepG2细胞目前也广泛用于生物人工肝研究[3-5]。我们前期的研究发现,在0~4 r/min范围内,Bellco转瓶培养的微囊HepLL永生化人肝细胞、HepG2细胞随转速增加,细胞数目、白蛋白合成量、氨清除量、安定转化量均逐渐升高[6],但是其细胞数和细胞功能仍无法满足临床需要。鉴于转瓶的转速难以进一步提高,本实验重点研究变速旋转培养的微囊HepLL、HepG2细胞聚集体数目和细胞活性能否较匀速旋转培养进一步提升,力图摸索出适合肝细胞高活性增长的最佳培养方式,为生物人工肝临床应用奠定基础。
1 材料与方法 1.1 材料、试剂和仪器DMEM高糖培养基、小牛血清(FCS)、碳酸氢钠、青霉素、链霉素、EDTA、胰蛋白酶均购自美国Gibco公司;海藻酸(Fluka No. 71238)、HEPES、MOPS、氯化钙、二甲基亚砜均购自美国Sigma公司;壳聚糖(>85%去乙酰化,黏度30~100 mpas,水溶性)购自中国山东省济南海得贝海洋生物工程有限公司;永生化人源性肝细胞HepLL由本室构建[7];HepG2由浙江大学医学院附属第一医院肝胆外科研究室惠赠;Coulter-Z2购自美国Coulter公司;ELISA试剂盒购自美国Bethyl公司;比色法分析仪购自美国Sigma-Aldrich公司;高效液相色谱仪购自美国Agilent公司。
1.2 实验分组随机分为两大组:一步法AC包裹HepLL细胞和一步法AC包裹HepG2细胞,两大组按匀速旋转培养(转瓶转速均为4 r/min)、变速旋转培养(培养2 d或4 d后转速由2 r/min增加为4 r/min)分为三小组,最终实验分组为LY组(HepLL匀速旋转培养)、LB-A组(HepLL培养 2 d后转速由2 r/min增加为4 r/min)、LB-B组(HepLL培养4 d后转速由2 r/min增加为4 r/min)、GY组(HepG2匀速旋转培养)、GB-A组(HepG2培养2 d后转速由2 r/min增加为4 r/min)、GB-B(HepG2培养4 d后转速由2 r/min增加为4 r/min)。各组所包埋的细胞密度均为1.5×106,各组初始细胞数目均为1.0×107。各组分别取样进行形态学、超微结构观察,检测白蛋白合成、氨的清除量以及安定转化功能。
1.3 一步法AC微胶囊包裹25%胰蛋白酶消化细胞,锥虫蓝染色检测细胞存活率,存活率大于95%,计数,加入1.5%海藻酸钠溶液,调整细胞密度为1.5×106/mL,连接微胶囊发生器,调节参数使海藻酸钠形成均匀稳定的小液珠,液滴滴入终浓度为0.1 mol/L氯化钙、0.5%水溶性壳聚糖和13 mmol/L的HEPES溶液,持续搅拌30 min[2],无血清DMEM高糖培养液洗涤三遍,微胶囊移入转瓶(1000 mL),加入含10%FBS的DMEM高糖培养液200 mL培养(1×107细胞/200 mL)。
1.4 微胶囊细胞转瓶培养和换液按上述实验设计分组,微胶囊细胞部分置于转瓶培养仪上层匀速旋转培养,部分放到转瓶培养仪下层变速旋转培养,5%二氧化碳、37 ℃,DMEM高糖培养基(含10%胚胎新生牛血清、7 g/L碳酸氢钠,100 U/mL青霉素,100 μg/mL链霉素),每48 h用细胞筛网过滤培养的微胶囊细胞,更换200 mL新鲜培养基,废弃培养基留样储存于-80 ℃冰箱。
1.5 观察微胶囊细胞聚集体及细胞形态分别于微胶囊包裹后2、4、6、8、10、12、14、16 d,随机称取10 mL微胶囊,弃去培养基,于0.1 mol/L柠檬酸盐、酸碱度 7.4、37 ℃孵育5 min,溶解囊膜,弃上清液;PBS重复清洗三次,弃上清液,加入少许含10%FBS的DMEM高糖培养基,Coulter-Z2计数器计数聚集体数目和聚集体直径[8]。之后PBS重复清洗三次,弃上清液,600 r/min离心10 min,HE染色观察细胞形态,锥虫蓝染色检测细胞活力,血细胞计数仪检测细胞数目,计数结果乘以20即为当日该组微胶囊细胞总数,每组实验重复三次,最后结果取平均值。
1.6 ELISA法检测微胶囊细胞白蛋白合成功能1.5中废弃培养基留样采用ELISA检测白蛋白合成量[单位pg/(cell·h)],每组实验重复三次,最后结果取平均值。其中胚胎新生牛血清所含的白蛋白不会与ELISA试剂盒所用的抗人白蛋白抗体交联。
1.7 比色法检测微胶囊细胞氨清除功能每48 h用细胞筛网过滤培养的微胶囊化细胞,弃去旧培养基,用等渗氯化钠溶液洗涤三遍,加入含1 mmol/L 氯化铵的无血清DMEM高糖培养液,37 ℃转瓶培养2 h。取上清液用比色法检测氨的浓度,每组实验重复三次,最后结果取平均值。
1.8 高效液相色谱(HPLC)法检测安定转化功能每48 h用细胞筛网过滤培养的微胶囊化细胞,弃去旧培养基,用等渗氯化钠溶液洗涤三遍,加入含5 μg/L安定的无血清DMEM高糖培养液,37 ℃转瓶培养2 h。取上清液用HPLC法检测安定浓度。
1.9 统计学方法实验数据误差范围均在2%以内,结果以均数±标准差(x±s)表示,采用Excel 2003和SPSS 11.5统计学软件处理,组间比较采用重复测量的方差分析,以P<0.05为差异有统计学意义。
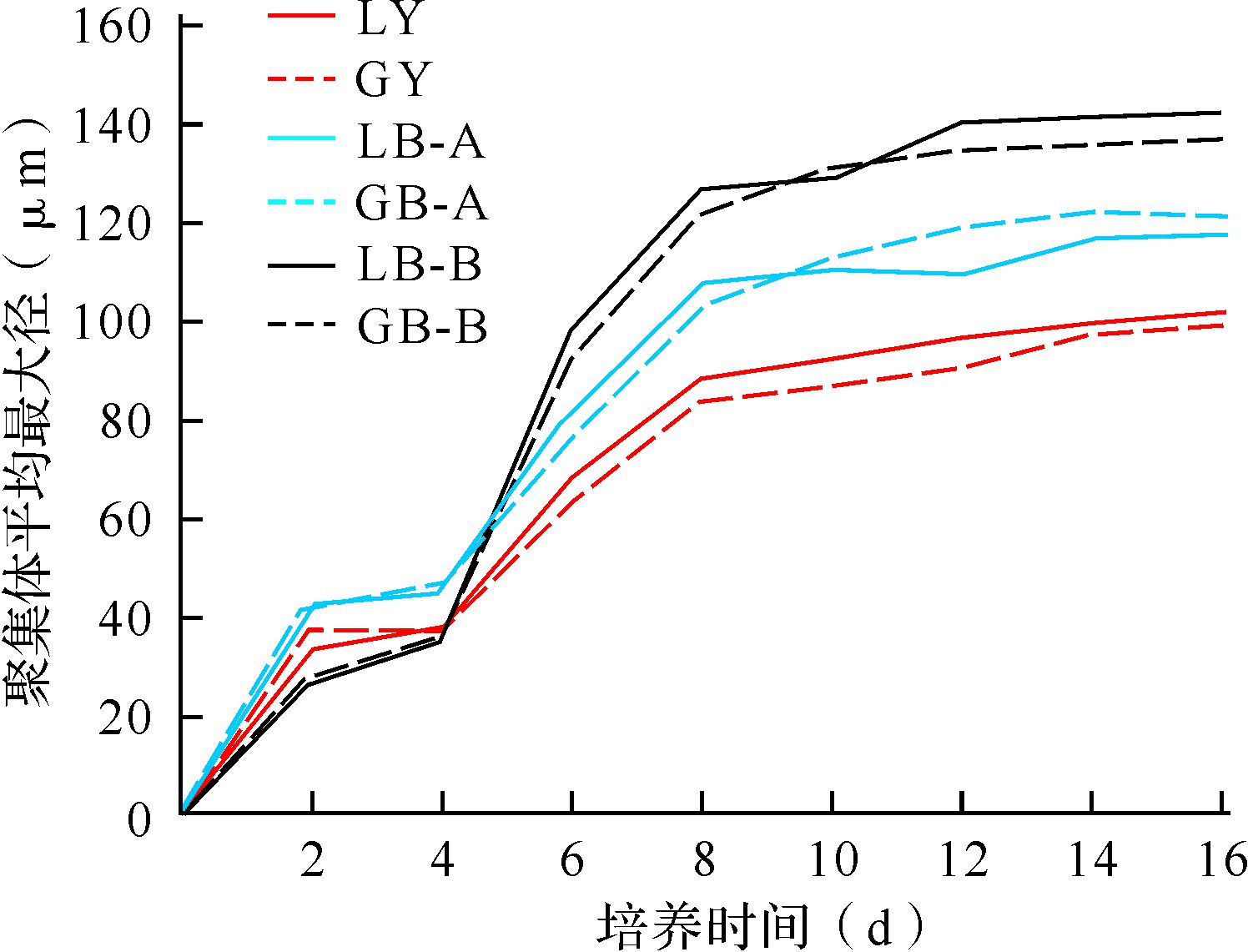
2 结 果 2.1 各组细胞聚集体数量及形态比较AC微胶囊光镜下呈圆球形,膜表面光滑,大小均匀,直径为400~500 μm,置于倒置显微镜下观察,变速旋转培养A、B组分别需15、20 h始可见聚集体形成,匀速旋转培养均于第8小时即可见聚集体形成,各组聚集体形态呈球形。总体趋势如下:与匀速旋转培养比较,同种细胞株变速旋转培养6、8、10、12、14、16 d每个微胶囊内聚集体平均个数均增多(均P<0.01)、平均最大径增大(均P<0.01),变速旋转培养B组比A组培养6、8、10、12、14、16 d微胶囊细胞聚集体平均个数均增多(均P<0.01)、平均最大径均增大(均P<0.01);同样培养条件下,各个时间点HepLL细胞聚集体平均个数均比HepG2细胞多(均P<0.05),聚集体平均最大径两种细胞均无明显区别(均P>0.05);培养2、4 d各组微胶囊细胞聚集体平均个数、平均最大径差异均无统计学意义 (均P>0.05),见图 1、2。激光共聚焦显微镜观察微胶囊内细胞的形态增殖规律与倒置显微镜下观测的结果基本一致;分层观察显示:细胞分布均匀、生长情况良好。说明变速旋转培养较匀速旋转培养有利于微胶囊细胞聚集体生长。

|
| 除培养2、4 d外,培养6、8、10、12、14、16 d LY与LB-A、LB-B比较,LB-A与LB-B比较,GY与GB-A、GB-B比较,GB-A与GB-B比较,LY与GY比较,LB-A与GB-A比较,LB-B与GB-B比较,均P<0.05. 图 1 各组微胶囊肝细胞聚集体平均个数比较 Fig. 1 Comparison of average numbers of microencapsulated hepatocytes aggregates in each group |
|
| 除培养2、4 d外,培养6、8、10、12、14、16 d LY与LB-A、LB-B比较,LB-A与LB-B比较,GY与GB-A、GB-B比较,GB-A与GB-B比较,均P<0.05. 图 2 各组微胶囊肝细胞聚集体平均最大径比较 Fig. 2 Comparison of the average maximum diameters of microencapsulated hepatocytes aggregate in each group |
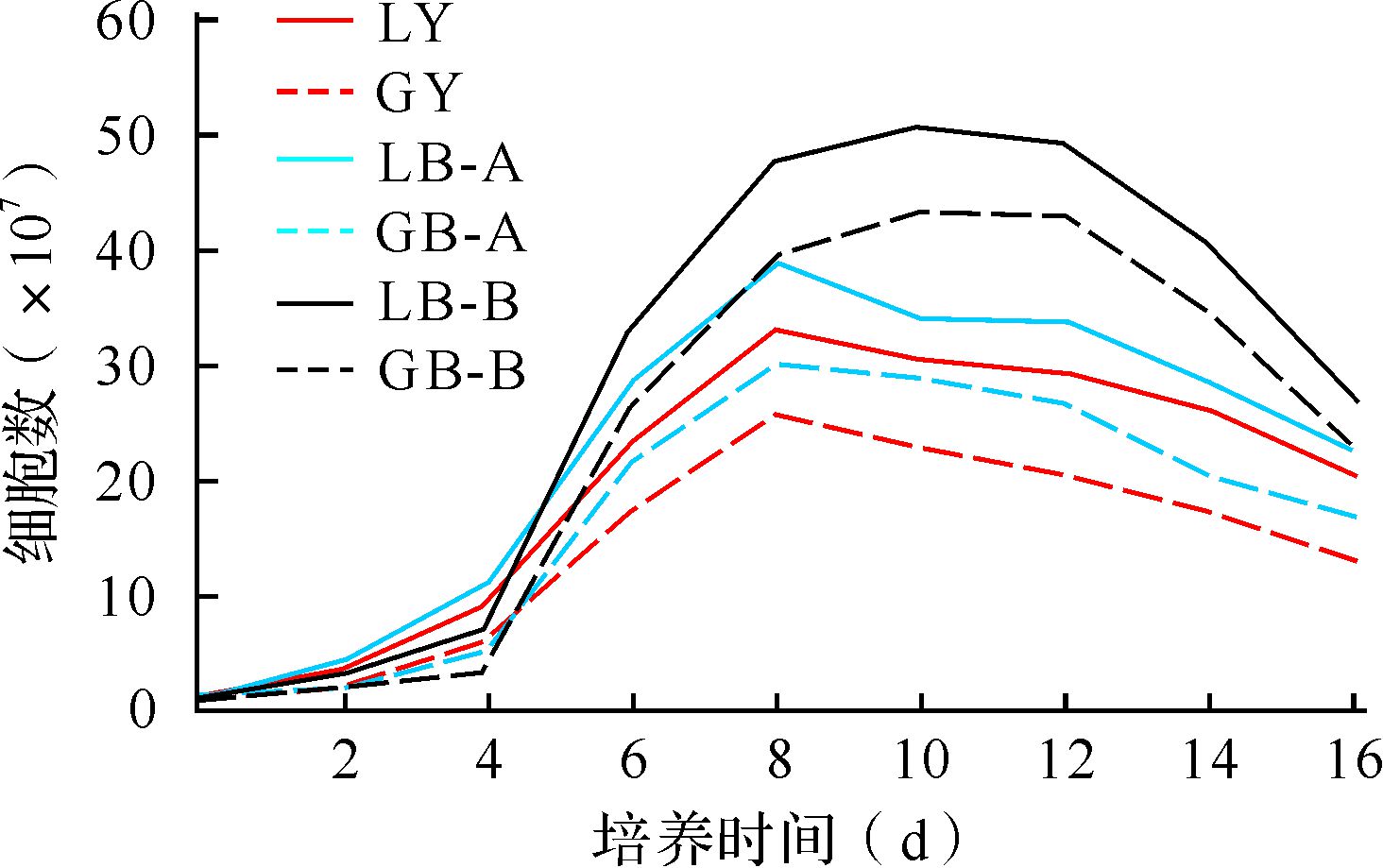
与匀速旋转培养比较,培养6、8、10、12、14、16 d,同种细胞株变速旋转微胶囊细胞数均增多(均P<0.01),变速旋转培养B组比A组也增多(均P<0.01);同样培养条件下,HepLL细胞数培养6、8、10、12、14、16 d均比HepG2细胞增多(均P<0.05)。培养2、4 d各组微胶囊细胞数差异均无统计学意义 (均P>0.05),见图 3。提示变速旋转培养较匀速旋转培养有利于微胶囊细胞快速扩增。
|
| 除培养2、4 d外,培养6、8、10、12、14、16 d LY与LB-A、LB-B比较,LB-A与LB-B比较,GY与GB-A、GB-B比较,GB-A与GB-B比较,LY与GY比较,LB-A与GB-A比较,LB-B与GB-B比较,均P<0.05. 图 3 各组微胶囊HepLL、HepG2细胞增殖曲线 Fig. 3 Growth curves of AC microcapsules HepLL,HepG2 cells in each group |
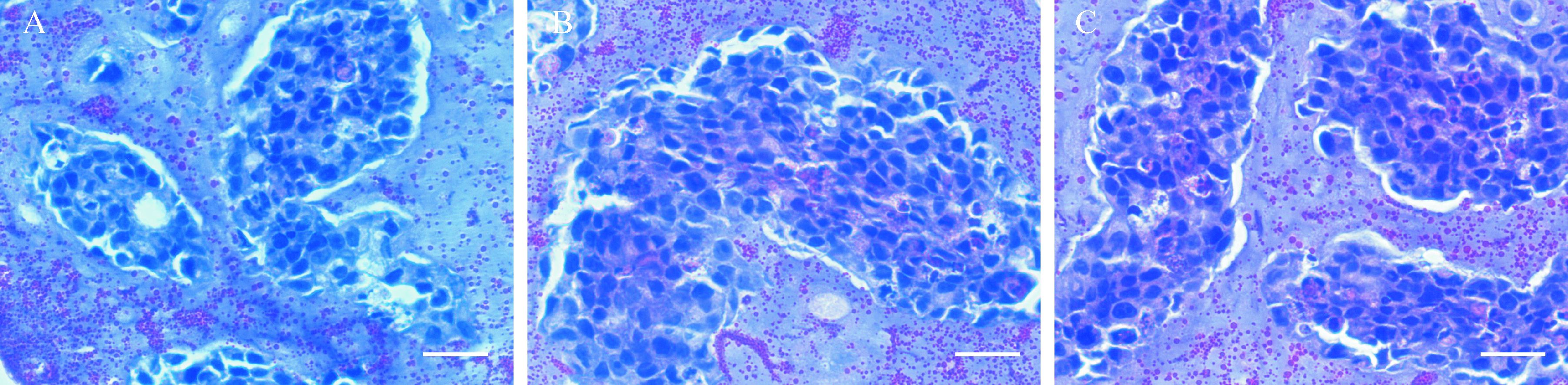
AC微胶囊包裹细胞HE染色结果显示各组微胶囊内细胞形态呈上皮细胞样,生长情况良好。任何时间点,微胶囊内均未见明显坏死细胞,即使在聚集体最大径160 μm时,聚集体中心也未见明显坏死细胞,见图 4。说明实验条件适合各组微胶囊细胞生长分裂。
|
| A: LY组;B: GB-B组;C:GB-A组. 各组细胞形态呈上皮细胞样,均未见明显坏死细胞,各组间相似.标尺=0.5 μm. 图 4 各组AC微胶囊HepLL、HepG2细胞光镜下组织病理学表现 Fig. 4 The histopathological features of HepLL and HepG2 cells under light microscope |
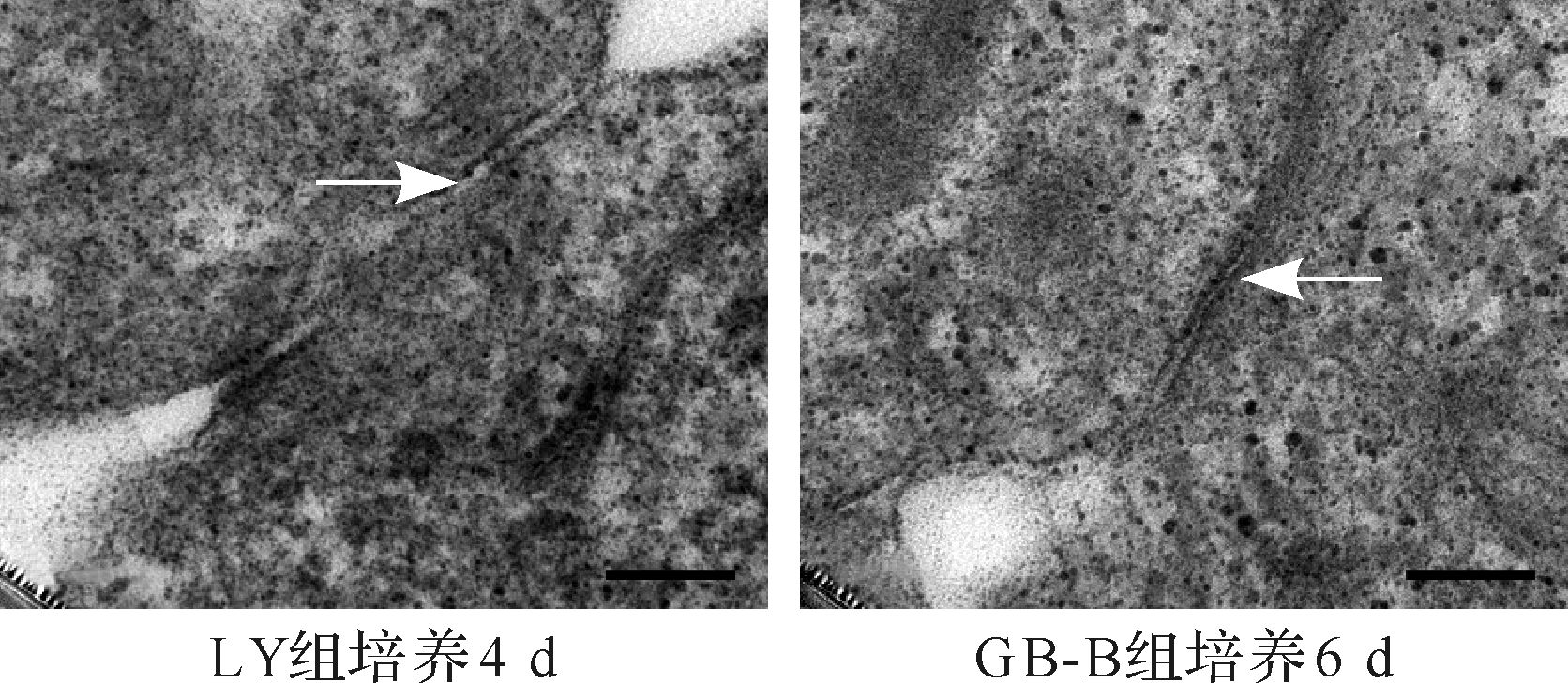
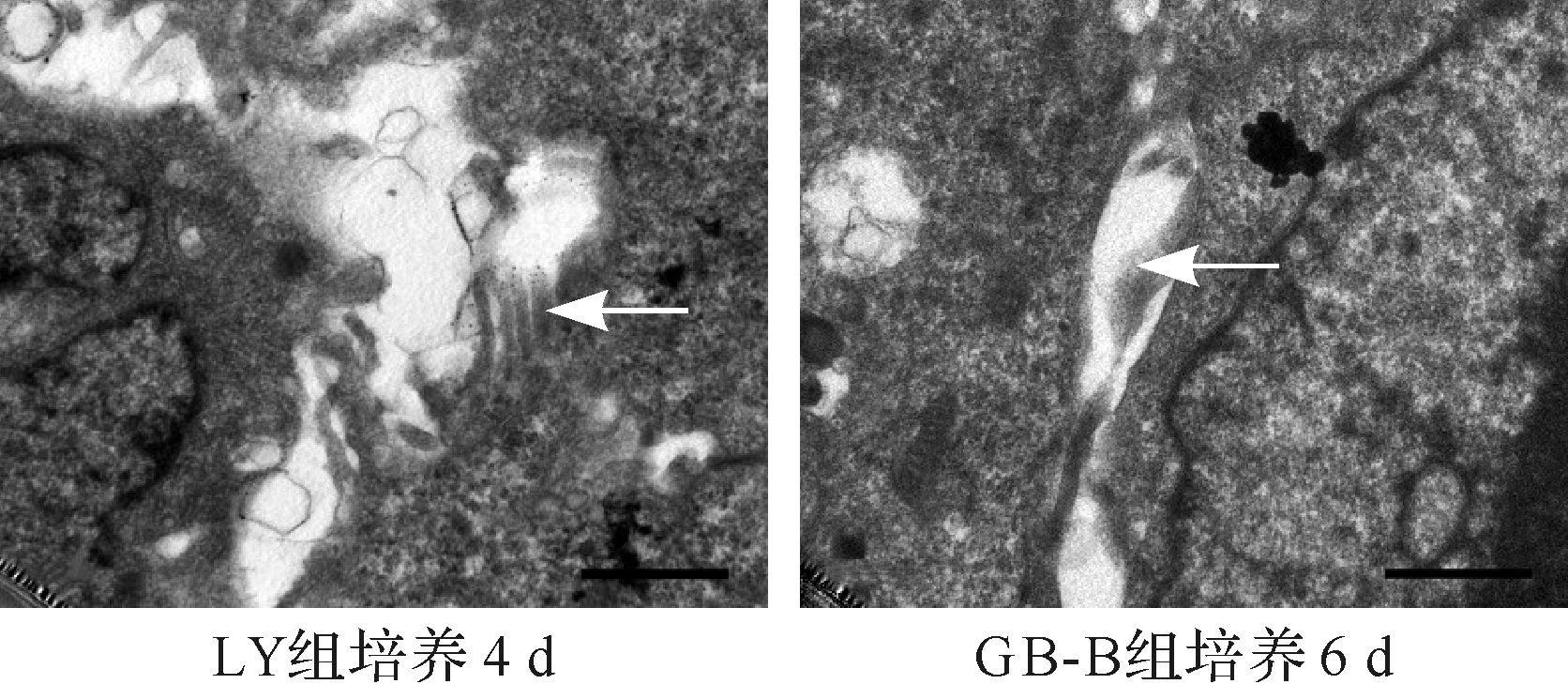
透射电镜下微胶囊内HepLL、HepG2细胞形态完整,胞膜光滑,核仁明显,富含线粒体、内质网及糖原颗粒,匀速培养组培养4 d可观察到紧密连接、微绒毛类毛细胆管样结构,而变速培养B组及A组均培养6 d才可以看到类似结构,见图 5~7。提示变速培养初期不利于细胞生长发育。
|
| 标尺=0.2 μm. 图 5 LY组和GB-B组细胞间紧密连接(箭头所示) Fig. 5 Cell tight junction in HepLL-Y and HepG2-BB groups |

|
| 标尺=0.04 μm. 图 6 LY组和GB-B组细胞间类毛细胆管结构(箭头所示) Fig. 6 Cholangiole-like structure in HepLL-Y and HepG2-BB groups |
|
| 标尺=0.04 μm. 图 7 LY组和GB-B组细胞间类毛细胆管结构内的微绒毛(箭头所示) Fig. 7 Microvilli in cholangiole-like structure of HepLL-Y and HepG2-BB groups |
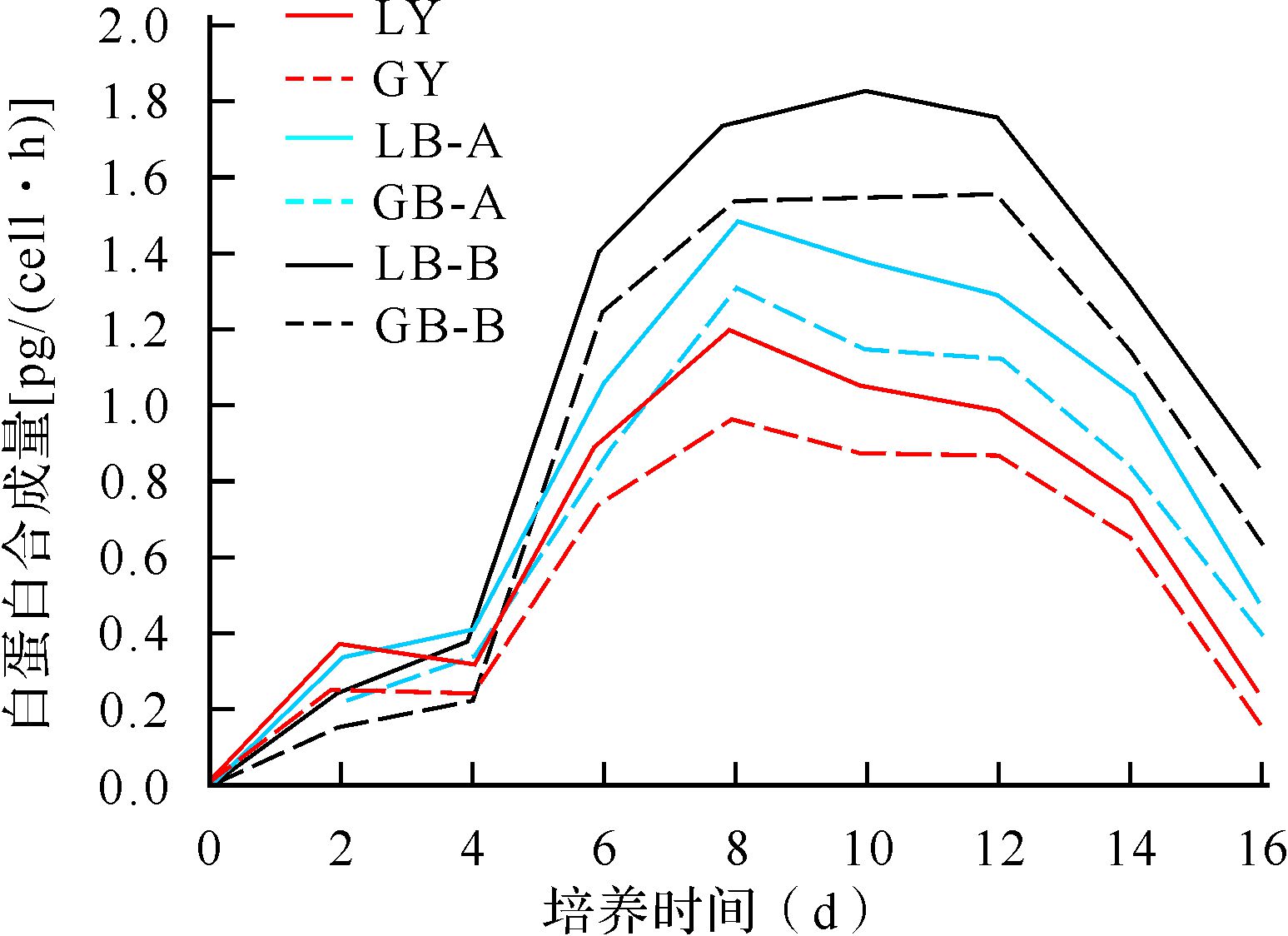
与匀速旋转培养组比较,同种细胞株变速旋转培养组培养6、8、10、12、14、16 d微胶囊细胞白蛋白合成量明显增加(均P<0.01),变速旋转培养B组比A组培养6、8、10、12、14、16 d微胶囊细胞白蛋白合成量明显增加(均P<0.01);同种培养条件下,HepLL组各个时间点的白蛋白合成均比HepG2组明显增加(均P<0.05);培养2、4 d各组微胶囊细胞白蛋白合成量差异无统计学意义(均P>0.05),见图 8。提示变速旋转培养较匀速旋转培养有利于微胶囊细胞白蛋白合成。
|
| 除培养2、4 d外,培养6、8、10、12、14、16 d LY与LB-A、LB-B比较,LB-A与LB-B比较,GY与GB-A、GB-B比较,GB-A与GB-B比较,LY与GY比较,LB-A与GB-A比较,LB-B与GB-B比较,均P<0.05. 图 8 各组微胶囊HepLL、HepG2细胞白蛋白合成功能比较 Fig. 8 Aalbumin synthesis activity of AC microencapsulated HepLL and HepG2 cells |
与匀速旋转培养组相比,变速旋转培养组微胶囊细胞培养6、8、10、12、14、16 d安定转化量明显增加(均P<0.01),变速旋转培养B组比A组培养6、8、10、12、14、16 d微胶囊细胞安定转化量明显增加(均P<0.01);同种培养条件下,HepLL组在各个时间点的安定转化量均比HepG2组增加(均P<0.05);培养2、4 d各组微胶囊细胞安定转化能力差异无统计学意义(均P>0.05),见图 9。提示微胶囊细胞变速旋转培养安定转化功能优于匀速旋转培养。

|
| 除培养2、4 d外,培养6、8、10、12、14、16 d LY与LB-A、LB-B比较,LB-A与LB-B比较,GY与GB-A、GB-B比较,GB-A与GB-B比较,LY与GY比较,LB-A与GB-A比较,LB-B与GB-B比较,均P<0.05. 图 9 各组微胶囊HepLL、HepG2细胞安定转化功能比较 Fig. 9 Diazepam clearance activity of AC microencapsulated HepLL and HepG2 cells |
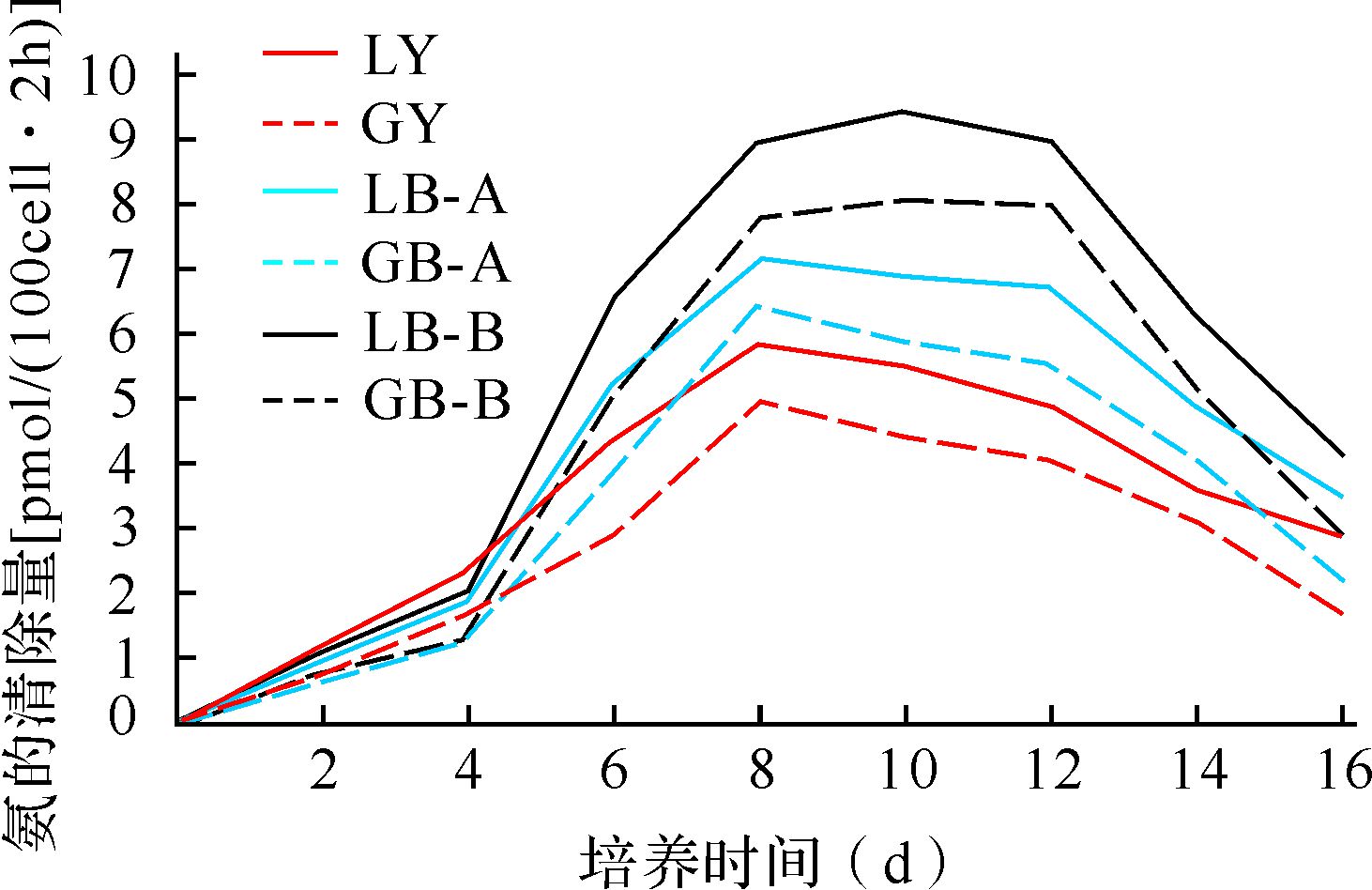
与匀速旋转培养组相比,变速旋转培养组微胶囊细胞培养6、8、10、12、14、16 d氨清除量均增加(均P<0.01),变速旋转培养B组比A组培养6、8、10、12、14、16 d微胶囊细胞氨清除量均增加(均P<0.01);同种培养条件下,HepLL组在各个时间点的氨清除量均比HepG2组增加(均P<0.05);培养2、4 d各组微胶囊细胞氨清除量差异均无统计学意义(均P>0.05),见图 10。提示变速旋转培养较匀速旋转培养有利于微胶囊细胞清除氨。
|
| 除培养2、4 d外,培养6、8、10、12、14、16 d LY与LB-A、LB-B比较,LB-A与LB-B比较,GY与GB-A、GB-B比较,GB-A与GB-B比较,LY与GY比较,LB-A与GB-A比较,LB-B与GB-B比较,均P<0.05. 图 10 AC微胶囊HepLL、HepG2细胞氨的清除功能比较 Fig. 10 Ammonium clearance activity of AC microencapsulated HepLL and HepG2 cells |
研究发现微胶囊肝细胞前4 d转速2 r/min,以后转速调整为4 r/min变速培养组(变速培养B组),较从始至终均4 r/min匀速培养组(匀速培养Y组)及前2 d转速2 r/min而培养2 d以后转速调整为4 r/min变速培养组(变速培养A组),微胶囊HepLL、HepG2细胞培养6、8、10、12、14、16 d聚集体大小、个数、微胶囊细胞总数、白蛋白合成量、氨清除量、安定转化量均上升,但是培养2、4 d各项指标差异均无统计学意义。原因考虑与微胶囊细胞包裹时低酸碱值和温度的改变导致气体、营养成分和代谢废物扩散不均匀,代谢废物聚积,阻碍了细胞获取充足的养分而导致生长迟缓甚至停滞[9],因此微胶囊包裹初期选择合适的转速显得尤为重要。转速太小,大部分微胶囊始终滞留在瓶壁,无法得到充分的培养液供给;转速太高,细胞无法立即适应,影响氧气和营养物质向微胶囊内部输送,影响细胞的生长和功能的发挥;适当的转速不会引起涡流,为适宜的生长环境提供了气体,防止了湍动引起的气泡、气室[10],同时对流加快[11],增加了培养基中的溶氧,有利于细胞从微胶囊包裹的损伤中迅速修复并高活性扩增。同时实验也说明微胶囊细胞前4 d仍处于恢复期,把握好前4 d的转速非常重要。实验仅观察两种变速培养模式,未来应该尽可能改变变速培养方式,摸索出最适合微胶囊细胞高活性、长时间、迅速扩增的培养方式。
文献报道肝细胞聚集体大小超过100 μm会影响氧气弥散速度,聚集体中心肝细胞缺氧坏死概率显著增加[12],但本研究发现各组细胞虽然培养16 d增殖速度明显减慢,聚集体最大径超过160 μm,但镜下仍然未见聚集体中心坏死,细胞存活率均达到95%以上,考虑Bellco转瓶培养系水平旋转,旋转过程中正常的重力向量被持续改变而随机化,囊内细胞处于模拟太空失重状态,类似于旋转微重力培养,减少了培养液对细胞产生的机械剪切力,增加细胞培养营养的补充,促进代谢产物的排出;同时细胞生长受到持续低剪切力刺激,且不断改变方向的重力向量可能直接影响基因表达,或者间接促进细胞的自分泌或旁分泌,有利于细胞间的信号传递,有利于细胞—细胞、细胞—基质之间按组织学特性相互接触,有利于聚集体内细胞分化,因而不易形成坏死中心[13]。
虽然各组聚集体最大径随培养天数不断增加,但聚集体数目并非线性增加,考虑与部分聚集体彼此互相聚集,形成更大聚集体有关。培养8 d以后各组聚集体最大径均缓慢增加,但匀速培养组白蛋白合成量、氨清除量、安定转化功能却迅速下降,考虑聚集体太大,营养和代谢产物渗透难度加大,影响细胞活性发挥。变速培养组虽然聚集体及紧密连接、类毛细胆管样结构形成时间较匀速培养组均较迟,但聚集体数、大小、细胞数、细胞活性均高于匀速培养组,而且细胞高活性维持时间延长,说明变速培养更有利于形成高质量的三维组织聚合物,更有利于细胞的长期、高活性、快速扩增。
目前,HepG2已广泛用于生物人工肝研究。我们的研究发现同种培养条件下,微胶囊HepLL细胞聚集体数、微胶囊细胞数、白蛋白合成量、氨清除量、安定转化功能均高于微胶囊HepG2细胞,但聚集体大小差别不大,考虑与HepLL和HepG2虽然同为永生化细胞株,但HepG2系肿瘤细胞株,而HepLL来源于25岁脑死亡患者,生物学特性仍然存在差异有关,同时提示HepLL有可能代替HepG2用于人工肝治疗。
总之,变速旋转培养较匀速旋转培养明显促进微胶囊HepLL、HepG2细胞活性的发挥;同种培养条件下,微胶囊HepLL细胞聚集体数、微胶囊细胞总数、白蛋白合成量、氨清除量、安定转化功能高于微胶囊HepG2;未来HepLL有可能代替HepG2用于人工肝治疗。
| [1] | DHAWAN A, STROM S C, SOKAL E, et al. Human hepatocyte transplantation[J]. Methods Mol Biol, 2010, 640 :525–534. doi:10.1007/978-1-60761-688-7 |
| [2] | YU C B, LV G L, PAN X P, et al. In vitro large-scale cultivation and evaluation of microencapsulated immortalized human hepatocytes (HepLL) in roller bottles[J]. Int J Artif Organs, 2009, 32 (5) :272–281. |
| [3] | SELDEN C, SPEARMAN C W, KAHN D, et al. Evaluation of encapsulated liver cell spheroids in a fluidised-bed bioartificial liver for treatment of ischaemic acute liver failure in pigs in a translational setting[J]. PLoS One, 2013, 8 (12) . |
| [4] | PALAKKAN A A, RAJ D K, ROJAN J, et al. Evaluation of polypropylene hollow-fiber prototype bioreactor for bioartificial liver[J]. Tissue Eng Part A, 2013, 19 (9-10) :1056–1066. doi:10.1089/ten.tea.2012.0332 |
| [5] | ZHANG S C, LIU T, WANG Y J. Porous and single-skinned polyethersulfone membranes support the growth of HepG2 cells: a potential biomaterial for bioartificial liver systems[J]. J Biomater Appl, 2012, 27 (3) :359–366. doi:10.1177/0885328211406299 |
| [6] | CHEN Y, YU C, LV G, et al. Rapid large-scale culturing of microencapsulated hepatocytes: a promising approach for cell-based hepatic support[J]. Transplant Proc, 2014, 46 (5) :1649–1657. doi:10.1016/j.transproceed.2014.03.002 |
| [7] | LI J, LI L J, CAO H C, et al. Establishment of highly differentiated immortalized human hepatocyte line with simian virus 40 large tumor antigen for liver based cell therapy[J]. ASAIO J, 2005, 51 (3) :262–268. doi:10.1097/01.MAT.0000161045.16805.8B |
| [8] | NYBERG S L, HARDIN J, AMIOT B, et al. Rapid, large-scale formation of porcine hepatocyte spheroids in a novel spheroid reservoir bioartificial liver[J]. Liver Transpl, 2005, 11 (8) :901–910. doi:10.1002/(ISSN)1527-6473 |
| [9] | YU S, HAN B, PENG C. A preliminary study of Alginate, Heparin-Chitosan-Alginate and Heparin microencapsulated hepatocytes system[J]. Hepatogastroenterology, 2012, 59 (116) :1234–1240. |
| [10] | HAN C, JIANG C, YU C, et al. Differentiation of transforming growth factorβ1-induced mesenchymal stem cells into nucleus pulposus-like cells under simulated microgravity conditions[J]. Cell Mol Biol (Noisy-le-grand), 2015, 61 (2) :50–55. |
| [11] | CONSOLO F, BARIANI C, Mantalaris A, et al. Computational modeling for the optimization of a cardiogenic 3D bioprocess of encapsulated embryonic stem cells[J]. Biomech Model Mechanobiol, 2012, 11 (1-2) :261–277. doi:10.1007/s10237-011-0308-0 |
| [12] | ACIKGÖZ A, GIRI S, CHO M G, et al. Morphological and functional analysis of hepatocyte spheroids generated on poly-HEMA-treated surfaces under the influence of fetal calf serum and nonparenchymal cells[J]. Biomolecules, 2013, 3 (1) :242–269. doi:10.3390/biom3010242 |
| [13] | HUANG X, ZHANG X, WANG X, et al. Microenvironment of alginate-based microcapsules for cell culture and tissue engineering[J]. J Biosci Bioeng, 2012, 114 (1) :1–8. doi:10.1016/j.jbiosc.2012.02.024 |




