2. 浙江省立同德医院检验科, 浙江 杭州 310012
2. Clinical Laboratory, Tongde Hospital of Zhejiang Province, Hangzhou 310012, China
多发性骨髓瘤(multiple myeloma,MM)是一种骨髓浆细胞的恶性疾病,通常是由意义未明的单克隆免疫球蛋白病(monoclonal gammopathy of undetermined significance,MGUS)——克隆性浆细胞增殖的无症状癌症前期进展而来。MGUS在50岁以上的人群中出现的概率为3%,并且以每年1%的概率进展为MM及相关的恶性疾病[1]。微RNA(microRNA,miRNA,miR-)是一组具有调节作用的非编码RNA,由19~25个核苷酸组成,调节紊乱的miRNA既可以是肿瘤基因,也可以作为肿瘤抑制因子发挥作用。miR-221和miR-222(简称miR-221/222)是高度同源的两种miRNA,在X染色体上以串联序列编码。在一些人类实体肿瘤和血液系统肿瘤中,miR-221/222作为肿瘤miRNA发挥作用[2-5]。miR-221/222过表达可干扰多组涉及增殖和凋亡的基因靶位,包括周期依赖性激酶抑制剂p27kip1和p57kip2[6],前凋亡因子PUMA、BIM和APAF-1[7],细胞生长和凋亡的关键调节因子PTEN及金属蛋白酶抑制剂TIMP3等[8]。
有研究者用TaqMan低密度阵列检测MM患者的血清miRNA,发现miR-221显著上调[9]。也有研究者发现,miRNA与M-蛋白类型有一定的联系,在轻链型、IgG或IgA型MM中,miRNA的表达谱有差别[10]。外周血循环miRNA是一种非侵入性的预后判断生物学标志[11]。在本研究中,我们进一步用实时定量PCR方法检测了MGUS及MM患者血清和浆细胞中miR-221/222的表达水平,旨在分析MGUS及MM患者miR-221/222的表达情况及其与M-蛋白类型之间的关系,并探讨miR-221/222作为辅助MGUS及MM诊断及预后判断生物学指标的可能性。
1 材料与方法 1.1 材料来源检测样本来自2013年1月至2015年12月浙江大学医学院附属邵逸夫医院及浙江省立同德医院收治的14例MGUS患者,其中男性8例、女性6例,平均年龄(63.7±11.9)岁;81例MM患者,其中男性49例、女性32例,平均年龄(63.4±10.3)岁;对照组10名,系因外周血有轻度异常,为排除血液系统疾病而做骨髓检查,最终排除血液系统及其他系统疾病的就诊者,其中男性5名、女性5名,平均年龄(58.8±5.4)岁。各组对象年龄差异无统计学意义(P>0.05)。所有患者均检测血/尿免疫球蛋白电泳及血清游离轻链、β2微球蛋白(β2-MG)和血常规、生化指标,并通过骨髓细胞学检查等符合MGUS、MM诊断标准。81例MM患者中,免疫学分型为IgG、IgA、轻链型的患者分别为45、27、9例;初诊和复发分别为72例和9例;Durie-Salmo(DS)分期为Ⅰ期、Ⅱ期、Ⅲ期的患者分别为22例、22例、37例。同时根据疗效将获得随访的35例MM患者分为缓解组(22例)和难治组(13例)。疗效评价根据《中国多发性骨髓瘤诊治指南(2015年修订)》中的标准[12],分为完全缓解、接近完全缓解、部分缓解、微小缓解、无变化、平台期、疾病进展。缓解组的纳入标准为疗效达到部分缓解及以上,难治组的纳入标准为疗效未达到部分缓解及以下者。
采集待检者骨髓样本并留取血清样本2 mL。本研究经医院伦理审查委员会审批通过,样本采集均获得研究对象本人知情同意。
1.2 主要试剂与仪器CD138浆细胞分选磁珠购自德国Miltenyi Biotec公司,淋巴细胞分离液购自北京鼎国昌盛生物技术有限公司,血液/血浆RNA提取纯化试剂盒购自德国Qiagen公司,外源cel-miR-39(1.6×108拷贝/μL)购自德国QIAGEN公司,Trizol试剂购自美国Ambion公司,TaqMan miRNA逆转录试剂盒、RT引物和PCR引物探针均购自美国Life Technologies公司。SLAN-96P荧光定量PCR仪购自上海宏石医疗科技有限公司。BD FACSCanto Ⅱ 流式细胞仪购自美国BD公司。
1.3 CD138磁珠分选纯化骨髓浆细胞取待检者骨髓液5 mL用淋巴细胞分离液(Ficoll)分离单个核细胞并计数,每1×107个细胞加PBS 80 μL及CD138磁珠20 μL,4 ℃孵育15 min,过柱分离浆细胞,流式细胞仪检测浆细胞纯度,MM及MGUS患者样本纯度中位数为90%(80%~98%),对照组样本纯度中位数为21%(18%~26%)。收获纯化的浆细胞置于-20 ℃冻存备用。
1.4 总miRNA的提取血清miRNA提取采用血液或血浆RNA提取纯化试剂盒,按照厂家说明书提供的步骤操作,提取过程中加入外源cel-miR-39 3.5 μL作为参照,最后用52.5 μL去RNA酶灭菌水(DEPC水)洗脱,提取后的RNA保存于-80 ℃。浆细胞总miRNA采用Trizol试剂提取,按照厂家说明书提供的步骤操作,最后用16.5 μL DEPC水洗脱,提取后的RNA置于-80 ℃冰箱保存。
1.5 互补DNA的合成采用TaqMan microRNA逆转录试剂盒,血清及浆细胞miRNA各取5 μL进行逆转录实验。逆转录体系为:RNA模板2 μg、反转录引物2 μL、去离子水补足至11μL。将反应体系混匀,瞬时离心(12 000×g),70 ℃10 min,冰育min,再加5×RT缓冲液5 μL、dNTP混合物(2.5 mm)2 μL、RNA水解酶抑制剂(40 U/μL)0.5 μL、逆转录酶(200 U/μL)0.5 μL、去离子水补足至25 μL,混匀,42 ℃ 60 min,70 ℃ 10 min。合成的互补DNA置于-80 ℃冰箱保存。
1.6 实时定量PCR检测miR-221/222的表达血清及浆细胞miRNA逆转录为互补DNA后进行PCR(20 μL):10×Taq 缓冲液 2 μL,10 mmol dNTP 0.4 μL,镁离子溶液0.8 μL,Taq酶0.2 μL,DEPC水14.27 μL,互补DNA 1.33 μL,20×TaqMan基因表达预混液(miR-221/222、cel-miR-39、RNU44)1 μL。每个反应做两个复孔,反应条件:95 ℃ 10 min预变性;95 ℃ 15 s 和60 ℃ 1 min退火延伸,40个循环。cel-miR-39作为血清miRNA检测的外参,RNU44作为浆细胞miRNA检测的内参。
1.7 统计学方法采用SPSS 16.0软件进行统计分析。根据Δct计算miR-221/222的相对表达量。各组数据经正态分布及方差齐性检验,呈偏态分布,用中位数(四分位数)[M(Q1,Q3)]表示,并用Mann-Whitney U检验比较组间差异,相关性分析采用Spearman直线相关分析。以P<0.05为差异有统计学意义。血清miR-221的测定结果采用受试者工作特征(ROC)曲线分析,并计算曲线下面积,测定的cut-off值从ROC曲线上获得。
2 结 果 2.1 MGUS和MM患者血清、浆细胞miR-221/222表达变化MGUS患者和MM患者血清miR-221/222的表达量均较对照组高,差异均有统计学意义(均P<0.01);而MGUS与MM两组间血清miR-221/222的表达量差异均无统计学意义(均P>0.05),见表 1。
| M(Q1,Q3) | ||||
| 组别 | 血清 | 浆细胞 | ||
| miR-221 | miR-222 | miR-221 | miR-222 | |
| 对照组 | 1.18(0.37,2.02) | 1.61(0.76,2.34) | -0.75(-1.59,0.17) | -3.04(-3.61,-2.75) |
| MGUS患者 | -2.29(-2.66,-1.16)** | -2.95(-3.93,-2.27)** | 2.42(1.42,5.61)** | -1.63(-2.65,1.14)** |
| MM患者 | -2.58(-3.63,-1.94)** | -3.88(-5.11,-2.49)** | 3.05(-0.09,5.53)** | -1.77(-3.36,0.09)* |
| MGUS:意义未明单克隆免疫球蛋白病;MM:多发性骨髓瘤;与对照组比较,* P<0.05,** P<0.01. | ||||
MGUS患者和MM患者浆细胞miR-221/222的表达量均较对照组低(P<0.05或<0.01),而在MGUS与MM患者间浆细胞miR-221/222的表达量差异均无统计学意义(均P>0.05),见表 1。
2.2 MGUS和MM患者血清与浆细胞、miR-221与miR-222表达量之间的相关性分析将患者血清样本与对应的浆细胞样本miR-221、miR-222的Δct值做Spearman秩相关分析,结果发现miR-221和miR-222在血清与浆细胞中的表达量均无相关性(r=0.024和-0.127,均P>0.05),图 1A、B中可见散点分布无规律,说明血清与浆细胞内的miR-221、miR-222表达水平并不一致。将血清和浆细胞样本miR-221与miR-222的Δct值做相关性分析,结果发现血清和浆细胞样本miR-221与miR-222的表达量之间均具有相关性(r=0.534和0.552,均P<0.01),图 1C、1D中散点基本沿对角线分布,说明在血清和浆细胞中miR-221与miR-222的表达量之间呈正相关。
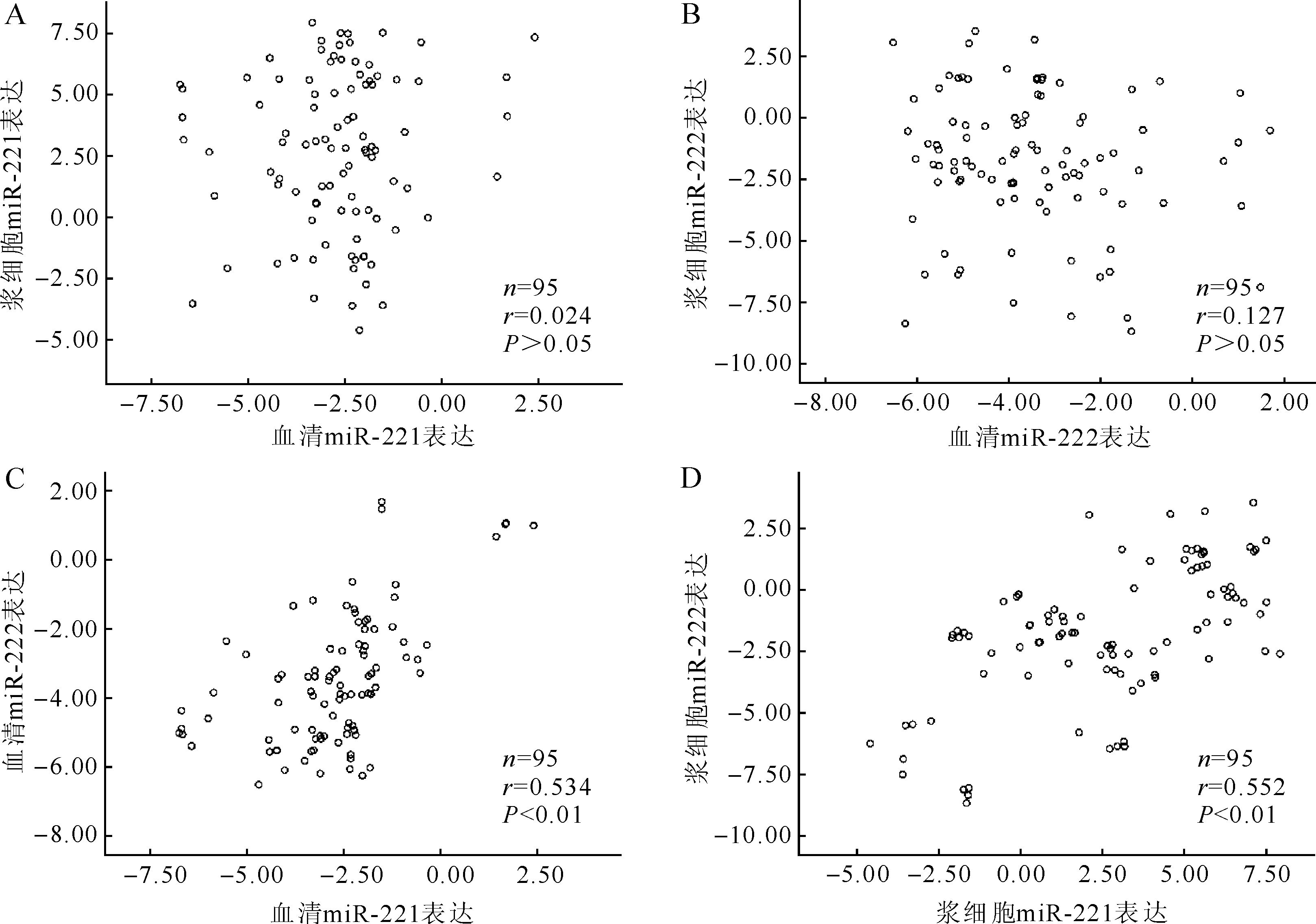
|
| MGUS:意义未明单克隆免疫球蛋白病;MM:多发性骨髓瘤. 图 1 95例MGUS和MM患者miR-221/222在血清及浆细胞中表达水平的相关性分析散点图 Fig. 1 Scatter diagram of miR-221/222 correlation analysis in serum and plasma cells from 95 patients with MGUS or MM |
MM患者按免疫学分型分为IgG型、IgA型、轻链型,其血清miR-221表达量分别为-2.33(-3.32,-1.84)、-2.86(-4.19,-2.22)、-3.24(-3.89,-1.95),结果 IgG型 与 IgA型(U=492,P>0.05)、IgG型与轻链型(U=180,P>0.05)、IgA型与轻链型(U=110,P>0.05)之间血清miR-221表达量差异均无统计学意义,说明血清miR-221的表达量在不同免疫学类型的MM患者中并无区别。
根据DS分期将MM患者分为Ⅰ期、Ⅱ期、Ⅲ期。结果MGUS、Ⅰ期MM、Ⅱ期MM、Ⅲ期MM患者血清miR-221的表达量分别为-2.29(-2.66,-1.16)、-1.85(-2.04,-1.42)、-2.24(-2.47,-1.84)、-3.80(-4.86,-3.23),MGUS患者与Ⅰ期MM患者之间血清miR-221的表达量差异无统计学意义(U=110,P>0.05),而Ⅰ期与Ⅱ期MM患者(U=143,P<0.05)、Ⅱ期与Ⅲ期MM患者(U=44.5,P<0.01)之间血清miR-221的表达量差异均有统计学意义,Ⅲ期MM患者血清miR-221表达量高于MGUS患者和Ⅰ期、Ⅱ期MM患者。
MM初诊患者与复发患者血清miR-221的表达量分别为-2.35(-3.26,-1.87)与-6.43(-6.69,-3.89),差异具有统计学意义(U=33,P<0.01),复发患者血清miR-221表达量高于初诊患者。
2.4 miR-221/222在临床诊断MGUS和MM中的价值血清miR-221/222或浆细胞miR-221/222用于临床诊断MGUS和MM患者的ROC曲线下面积均大于0.7,见表 2、图 2;其中血清miR-221/222的ROC曲线下面积均大于0.9,其临床应用价值更高。
| 检测指标 | ROC曲线下面积 | P值 | cut-off值 | 敏感度(%) | 特异度(%) |
| 血清miR-221 | 0.968 | <0.01 | -0.095 | 100.0 | 95.8 |
| 血清miR-222 | 0.976 | <0.01 | -0.045 | 100.0 | 92.6 |
| 浆细胞miR-221 | 0.801 | <0.01 | -0.135 | 80.0 | 80.0 |
| 浆细胞miR-222 | 0.727 | 0.018 | -2.600 | 68.4 | 90.0 |
| MGUS:意义未明单克隆免疫球蛋白病;MM:多发性骨髓瘤. | |||||
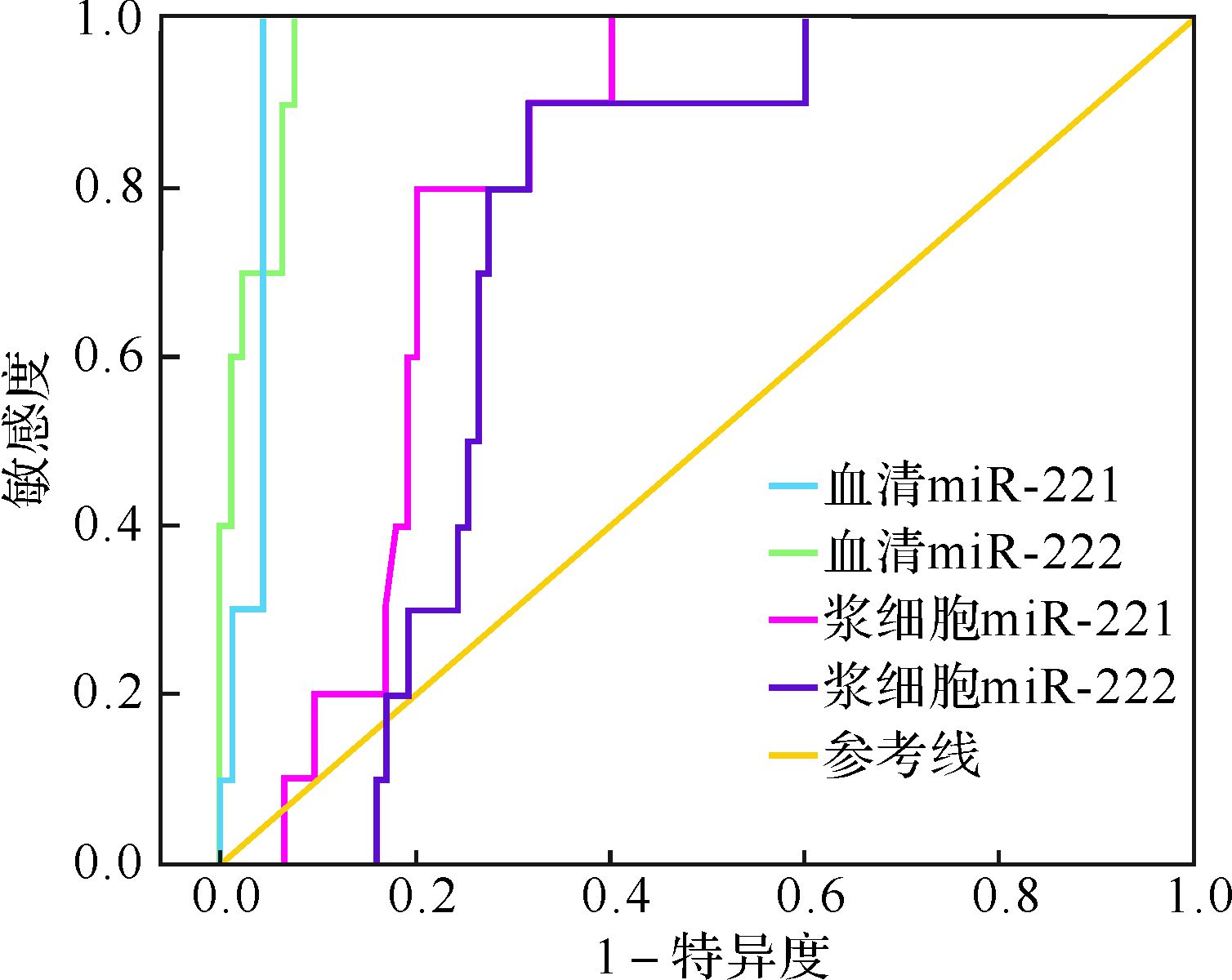
|
| MGUS:意义未明单克隆免疫球蛋白病;MM:多发性骨髓瘤. 图 2 血清及浆细胞miR-221/222 诊断MGUS、MM患者的ROC曲线 Fig. 2 ROC curves of miR-221/222 in serum and plasma cells in diagnosis of MGUS/MM |
用ROC曲线分析血清miR-221区分Ⅲ期与Ⅱ期以下MM时的价值,ROC曲线下面积达到0.963(P<0.01),当cut-off值为-3.09时,敏感度为97.7%,特异度为83.8%,见图 3。
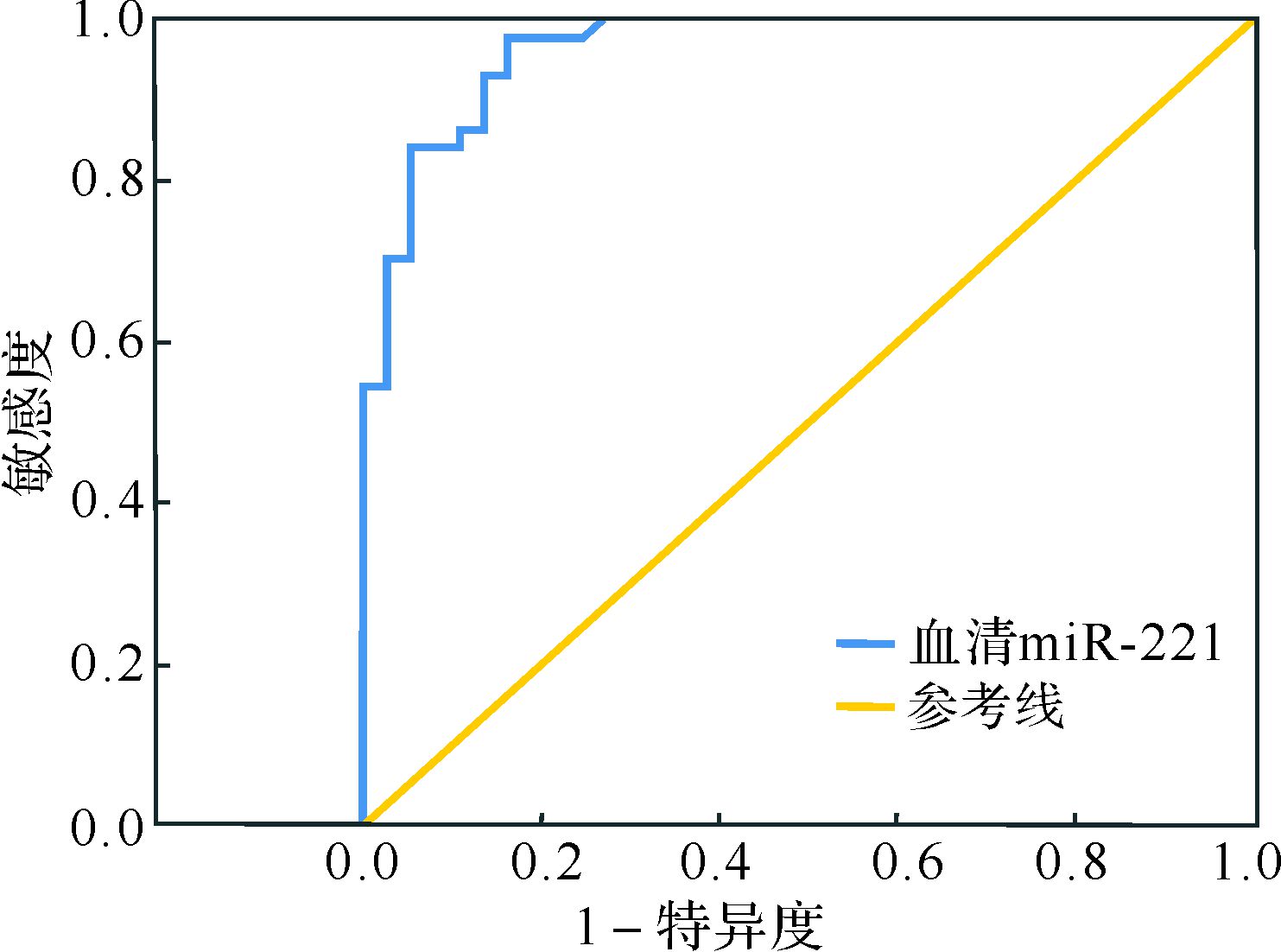
|
| MM:多发性骨髓瘤. 图 3 血清miR-221 ROC曲线区分MM Ⅲ期患者与Ⅱ期以下患者 Fig. 3 ROC curve of serum miR-221 to distinguish Durie-Salmon Ⅲ from others in MM |
缓解组治疗后血清miR-221表达量减少(U=51.5,P<0.01),难治组治疗前后血清miR-221表达量差异无统计学意义(U=67.5,P>0.05)。治疗前两组患者之间血清miR-221表达水平差异无统计学意义(U=133,P>0.05),治疗后两组患者血清miR-221表达水平差异具有统计学意义(U=4,P<0.01),见图 4。说明经过有效治疗,血清miR-221的表达量会随之减少。
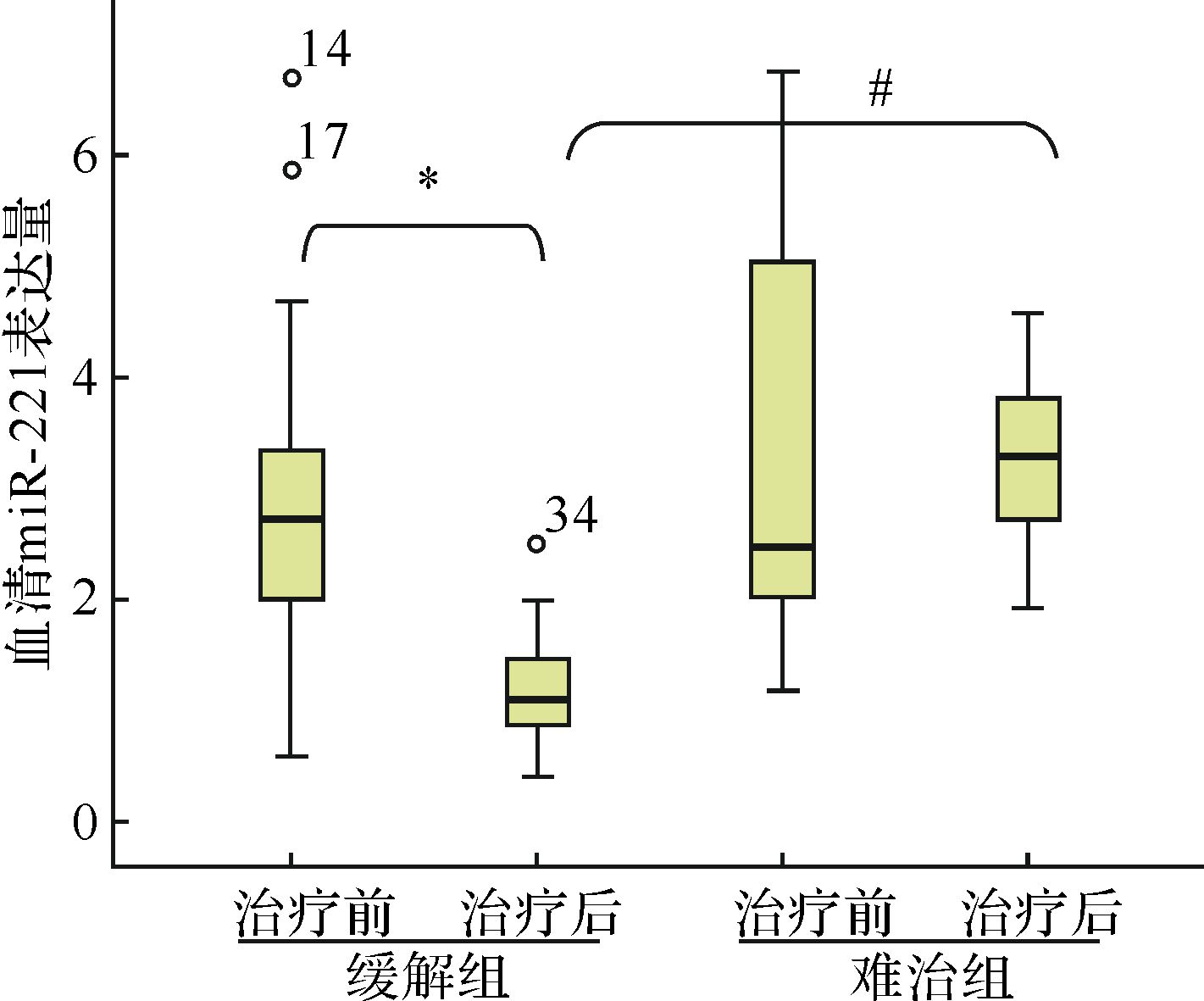
|
| MM:多发性骨髓瘤;与缓解组治疗前比较,* P<0.01,与缓解组治疗后比较,# P<0.01. 图 4 MM患者缓解组与难治组治疗前后血清miR-221表达量比较 Fig. 4 Serum miR-221 levels before and after chemotherapy in remission group and refractory group of MM patients |
以-Δct值代表血清miR-221的表达量与血清β2-MG水平做Spearman直线相关分析,结果35例MM患者治疗前后血清β2-MG 水平与血清miR-221的表达量呈正相关(r=0.524,P<0.01),见图 5。说明血清miR-221表达量与患者的血清β2-MG水平具有一定的相关性。
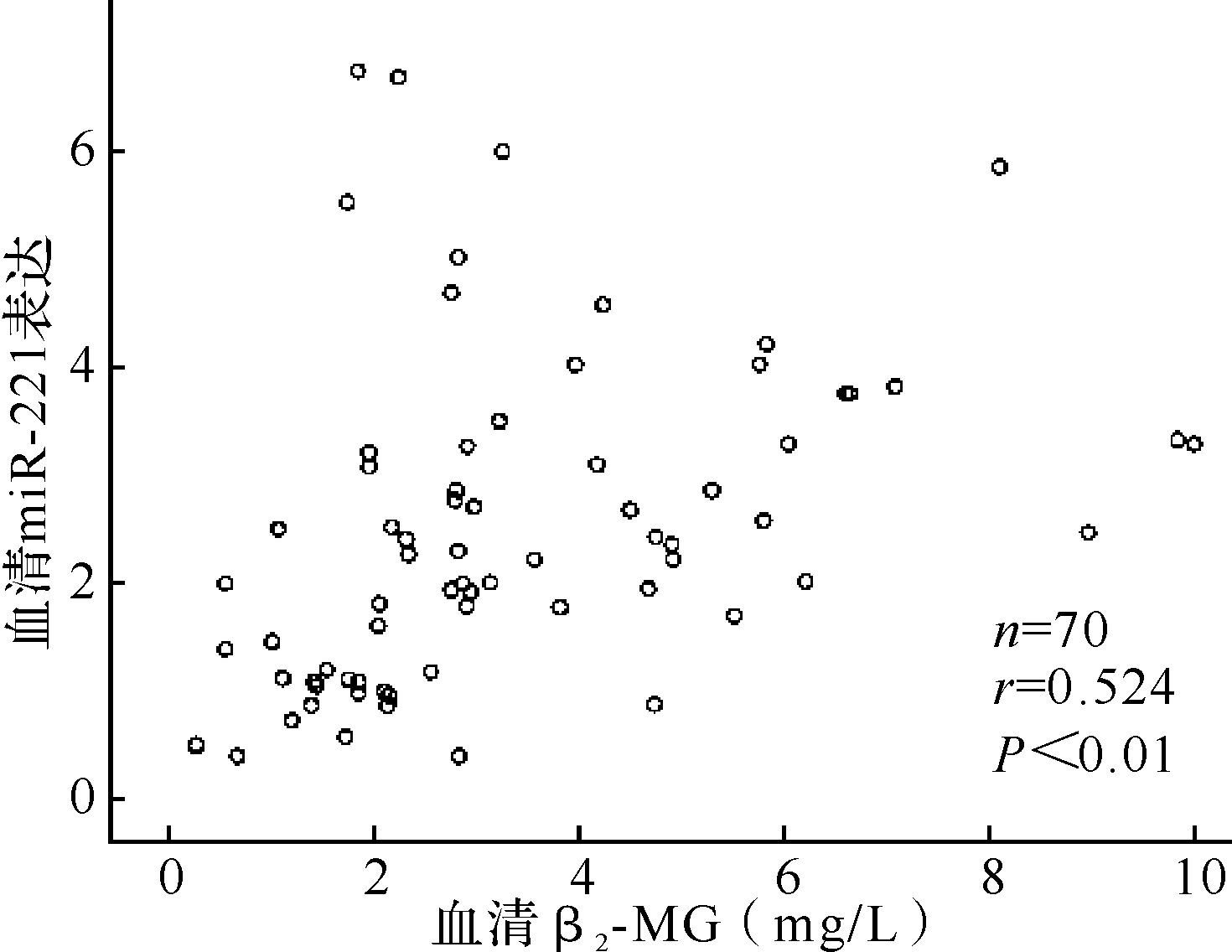
|
| MM:多发性骨髓瘤;β2-MG:β2微球蛋白. 图 5 MM患者血清β2-MG水平与血清miR-221表达量的相关性分析 Fig. 5 Correlations between serum miR221 and serum β2-MG levels in MM patients |
miR-221、miR-222是高度同源的两种miRNA,在X染色体上以串联序列编码,最近研究发现其在多种人类肿瘤中表达上调。miR-221/222上调的原因可能是NF-κB的异位调节改变了miR-221、miR-222的表达。miR-221、miR-222启动子的上游处于两个分开的末端区,两者通过NF-κB亚基p65结合起来,并在荧光素酶报告基因分析中驱动有效翻译,从而上调了miR-221、miR-222的表达。位点指向性突变可干扰p65与位点的结合或者NF-κB活化后的异位抑制能减少荧光素酶的活性。此外,c-Jun这一因子与p65的结合还具有协同上调miR-221、miR-222的作用[13]。miR-221、miR-222过表达可干扰多组涉及增殖和凋亡的基因靶点,包括c-kit、p27和p57基因等[14-16]。c-kit可以启动凋亡程序,p27和p57是肿瘤抑制因子,p27kip1和/或p57kip2可以负向调节G1期向S期的细胞周期进程,而miR-221、miR-222作为肿瘤基因可通过下调p27kip1和/或p57kip2来促进细胞增殖[17-18]。此外,miR-221、miR-222的表达还会阻止TRAIL诱导的细胞死亡,并以PTEN和TIMP3为靶点促进肿瘤细胞的增殖和生存,miR-221/222还可将前凋亡基因PUMA作为调节目标以抑制细胞凋亡[7, 19]。因此,miR-221、miR-222有可能作为潜在的作用靶点应用于肿瘤治疗。
Lionetti等[20]发现,血清生物标志物与肿瘤状态相关的浆细胞内miRNA并不重叠。分析原因可能是血清中miRNA呈选择性分泌,或者是由于血清中miRNA是体内其它细胞所产生的,也可能是MM患者浆细胞膜的通透性高而使miRNA更容易释放到外周循环中。本研究结果也类似,MGUS和MM患者血清miR-221、miR-222的表达量均较对照组高,而浆细胞中miR-221、miR-222的表达量反而较对照组低,且miR-221、miR-222在血清及浆细胞中的表达量之间也均无相关性。
MM最初的染色体易位包括14q32.33和4p16.3,导致MMSET和FGFR3基因调节紊乱,随着疾病进展,后来出现包括KRAS和NRAS的激活等基因突变[21]。Huang等[9]发现,MM患者的浆细胞内miR-99b和miR-221与染色体异常t(4;14)和del(13q)相关。本研究结果发现,血清及浆细胞miR-221、miR-222的表达量在MGUS和MM患者之间均无差异,分析其原因可能是t(4;14)是MM患者中较常见的染色体异常,且4号染色体及14号染色体异常在MM发展过程中较早出现,而MGUS患者虽然还未出现大量单克隆性浆细胞增殖,也尚未表现出相应的临床症状,但已经存在染色体异常。ROC曲线分析结果也显示,血清及浆细胞miR-221、miR-222表达量均有助于辅助诊断MGUS和MM,而血清miR-221、miR-222的诊断价值更高。
miR-221、miR-222是X染色体上串联序列编码的两种miRNA,本研究也发现 miR-221和miR-222在血清或在浆细胞中的表达量均存在相关性,所以单独检测miR-221或miR-222可反映两者的表达情况。
血清miR-221的表达水平与MM患者浆细胞所分泌的免疫球蛋白类型并无关系,而与患者DS分期及疾病复发有关。由此推测血清miR-221的表达量可能与MM肿瘤细胞增殖、转移能力及疾病的预后有密切关系。ROC曲线分析结果也显示,血清miR-221表达量可用于区分DS分期的Ⅲ期与Ⅱ期及以下MM患者,且诊断价值较高。
通过比较MM患者接受化疗前后血清miR-221表达量发现,能达到部分缓解以上的患者血清miR-221表达量明显降低,同时,MM患者血清miR-221表达量与血清β2-MG水平呈正相关。β2-MG是一种由淋巴细胞合成并分泌的低分子蛋白,MM导致的恶性浆细胞过度增殖和积累会导致β2-MG合成和分泌的增加,β2-MG作为肿瘤标志物与骨髓瘤细胞的负荷相平行。由此推测血清miR-221表达水平与患者肿瘤负荷水平相关,并与患者对化疗的反应性有关,这将有助于疗效监测。
综上所述,血清及浆细胞miR-221/222表达量的检测可用于辅助诊断MGUS和MM。血清miR-221还有助于MM患者疾病分期及疗效监测。miR-221/222有可能成为辅助MGUS及MM患者早期诊断、疗效评价及预后评估的一种生物学指标。
| [1] | OLTEANU H, WANG H Y, CHEN W, et al. Immunophenotypic studies of monoclonal gammopathy of undetermined significance[J/OL].BMC Clin Pathol, 2008, 8(1):13. http://cn.bing.com/academic/profile?id=2042865291&encoded=0&v=paper_preview&mkt=zh-cn |
| [2] | JIKUZONO T, KAWAMOTO M, YOSHITAKE H, et al. The miR-221/222 cluster, miR-10b and miR-92a are highly upregulated in metastatic minimally invasive follicular thyroid carcinoma[J]. Int J Oncol, 2013, 42 (6) :1858–1868. |
| [3] | HWANG M S, YU N, STINSON S Y, et al. miR-221/222 targets adiponectin receptor 1 to promote the epithelial-to-mesenchymal transition in breast cancer[J/OL]. PLoS One, 2013, 8(6): e66502. http://cn.bing.com/academic/profile?id=1971831531&encoded=0&v=paper_preview&mkt=zh-cn |
| [4] | PINEAU P, VOLINIA S, MCJUNKIN K, et al. miR-221 overexpression contributes to liver tumorigenesis[J]. Proc Natl Acad Sci U S A, 2010, 107 (1) :264–269. doi:10.1073/pnas.0907904107 |
| [5] | LIU S, SUN X, WANG M, et al. A microRNA 221-and 222-mediated feedback loop maintains constitutive activation of NFκB and STAT3 in colorectal cancer cells[J]. Gastroenterology, 2014, 147 (4) :847–859. doi:10.1053/j.gastro.2014.06.006 |
| [6] | IE SEGE C, NAGEL R, EGAN D A, et al. Regulation of the p27(Kip1) tumor suppressor by miR-221 and miR-222 promotes cancer cell proliferation[J]. EMBO J, 2007, 26 (15) :3699–3708. doi:10.1038/sj.emboj.7601790 |
| [7] | ZHANG C Z, ZHANG J X, ZHANG A L, et al. MiR-221 and miR-222 target PUMA to induce cell survival in glioblastoma[J]. Mol Cancer, 2010, 9 :229. doi:10.1186/1476-4598-9-229 |
| [8] | GAROFALO M, DI LEVA G, ROMANO G, et al. miR-221&222 regulate TRAIL resistance and enhance tumorigenicity through PTEN and TIMP3 downregulation[J]. Cancer Cell, 2009, 16 (6) :498–509. doi:10.1016/j.ccr.2009.10.014 |
| [9] | HUANG J J, YU J, LI J Y, et al. Circulating microRNA expression is associated with genetic subtype and survival of multiple myeloma[J]. Med Oncol, 2012, 29 (4) :2402–2408. doi:10.1007/s12032-012-0210-3 |
| [10] | CHI J, BALLABIO E, CHEN X H, et al. MicroRNA expression in multiple myeloma is associated with genetic subtype, isotype and survival[J]. Biol Direct, 2011, 6 :23. doi:10.1186/1745-6150-6-23 |
| [11] | REID G, KIRSCHNER M B, VAN ZANDWIJK N, et al. Circulating microRNAs: association with disease and potential use as biomarkers[J]. Crit Rev Oncol Hematol, 2011, 80 (2) :193–208. doi:10.1016/j.critrevonc.2010.11.004 |
| [12] | 黄晓军, 路瑾, 侯健, 等. 中国多发性骨髓瘤诊治指南(2015年修订)[J]. 中华内科杂志, 2015, 54 (12) : 1066–1070. HUANG Xiaojun, LU Jin, HOU Jian, et al. Guidelines for diagnosis and treatment of multiple myeloma in China (revised in 2015)[J]. Chinese Journal of Internal Medicine, 2015, 54 (12) :1066–1070. (in Chinese) |
| [13] | GALARDI S, MERCATELLI N, FARACE M G, et al. NF-kB and c-Jun induce the expression of the oncogenic miR-221 and miR-222 in prostate carcinoma and glioblastoma cells[J]. Nucleic Acids Res, 2011, 39 (9) :3892–3902. doi:10.1093/nar/gkr006 |
| [14] | LOTTEMAN C D, KENT O A, MENDELL J T, et al. Functional integration of microRNAs into oncogenic and tumor suppressor pathways[J]. Cell Cycle, 2008, 7 (16) :2493–2499. doi:10.4161/cc.7.16.6452 |
| [15] | VISONE R, CROCE C M. MiRNAs and cancer[J]. Am J Pathol, 2009, 174 (4) :1131–1138. doi:10.2353/ajpath.2009.080794 |
| [16] | SREDNI S T, BONALDO M F, COSTA F F, et al. Upregulation of miR-221 and miR-222 in atypical teratoid/rhabdoid tumors: potential therapeutic targets[J]. Childs Nerv Syst, 2010, 26 (3) :279–283. doi:10.1007/s00381-009-1028-y |
| [17] | LE SAGE C, NAGEL R, EGAN D A, et al. Regulation of the p27(Kip1) tumor suppressor by miR-221 and miR-222 promotes cancer cell proliferation[J]. EMBO J, 2007, 26 (15) :3699–3708. doi:10.1038/sj.emboj.7601790 |
| [18] | FELICETTI F, ERRICO M C, BOTTERO L, et al. The promyelocytic leukemia zinc finger-microRNA-221/-222 pathway controls melanoma progression through multiple oncogenic mechanisms[J]. Cancer Res, 2008, 68 (8) :2745–2754. doi:10.1158/0008-5472.CAN-07-2538 |
| [19] | DI MATTINO M T, GULLÀ A, CANTAFIO M E, et al. In vitro and in vivo anti-tumor activity of miR-221/222 inhibitors in multiple myeloma[J]. Oncotarget, 2013, 4 (2) :242–255. |
| [20] | LIONETTI M, BIASIOLO M, AGNELLI L, et al. Identification of microRNA expression patterns and definition of a microRNA/mRNA regulatory network in distinct molecular groups of multiple myeloma[J/OL]. Blood, 2009, 114(25): e20-e26. http://cn.bing.com/academic/profile?id=2094636384&encoded=0&v=paper_preview&mkt=zh-cn |
| [21] | PALUMBO A, ANDERSON K. Multiple myeloma[J]. N Engl J Med, 2011, 364 (11) :1046–1060. doi:10.1056/NEJMra1011442 |




