2. 浙江省宁波市第一医院肿瘤放疗科, 浙江 宁波 315010 ;
3. 南京医科大学附属苏州医院放疗科, 江苏 苏州 215001 ;
4. 南京医科大学附属苏州医院苏州肿瘤中心重点实验室, 江苏 苏州 215001
2. Department of Radio-Oncology, Ningbo First Hospital, Ningbo 315010, China ;
3. Department of Radio-Oncology, Suzhou Municipal Hospital, Nanjing Medical University, Suzhou 215001, China ;
4. Suzhou Cancer Center Core Laboratory, Suzhou Municipal Hospital, Nanjing Medical University, Suzhou 215001, China
食管癌是我国的一种常见恶性肿瘤,患者预后差,病死率高,其5年存活率只有10%左右。深入研究食管癌发生发展的机制,寻找可以有效干预食管癌进展的分子靶点,是提高食管癌患者疗效和改善其预后的有效途径。跨损伤DNA合成(translesion DNA synthesis,TLS)属于一种复制后修复过程,普遍存在于低等到高等真核生物中。当DNA链在复制过程中遇到损伤时,TLS DNA聚合酶便会替换复制性DNA聚合酶,以损伤的核苷酸为模板掺入碱基,保证复制顺利完成。然而,TLS DNA聚合酶的忠实度较低,容忍复制过程错误的同时,易引起基因突变的发生,增加基因组不稳定性,导致肿瘤的发生[1]。近来研究表明,TLS途径中多个相关基因在食管癌组织中呈过表达,与食管癌的发生发展相关,并影响食管癌细胞的化疗敏感性[2-3]。
RAD18是TLS途径中的关键基因,属于一种E3泛素连接酶[4]。RAD18可聚集在 DNA损伤位点,与其他分子相互作用,单泛素化增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)招募TLS DNA聚合酶替换复制性DNA聚合酶,参与复制后修复。尽管已有文献报道RAD18在食管癌组织中过表达,但是关于RAD18对食管癌细胞特性的影响报道甚少。在本研究中,我们选取人食管癌细胞株ECA-109作为细胞模型,采用靶向RAD18的小干扰RNA(RAD18-siRNA)抑制RAD18在ECA-109细胞中的表达,观察RAD18对食管癌细胞增殖和化疗药物敏感性的影响,并进一步探讨相关机制。
1 材料与方法 1.1 材料与试剂人食管鳞癌样本取自2008年10月至2010年12月在南京医科大学附属苏州医院外科手术切除并经组织病理学检查证实的食管鳞癌患者(患者术前未经放疗或化疗)44例,其中男性31例,女性13例。肿瘤直径≤ 3 cm 20例,>3 cm 24例;组织分化属低分化12例,中分化18例,高分化14例;临床分期Ⅰ~Ⅱa期25例,Ⅱb~Ⅲ期19例。人食管鳞癌细胞株ECA-109细胞购于中国科学院典型培养物保藏委员会细胞库。DMEM、FBS均购于澳大利亚Hyclone公司;RAD18、CyclinD1基因引物购于生工生物工程(上海)有限公司;Trizol、逆转录试剂盒购于美国赛默飞公司;荧光定量PCR试剂购于宝生物工程(大连)有限公司;siRNA片段购于广州市锐博生物科技有限公司;Lipofectamine 3000转染试剂购于美国Invitrogen公司;RAD18、细胞周期蛋白D1(CyclinD1)抗体购于美国Abcam公司,β-actin抗体、二抗、CCK-8试剂购于上海碧云天生物技术有限公司。
1.2 cDNA制备和荧光定量PCR检测基因表达1200×g离心收集对数生长期的细胞各1×106个细胞(食管鳞癌组织100 mg),用Trizol试剂提取细胞总RNA后。分别取500 ng RNA进行逆转录,反应体系20 μL,42 ℃反应60 min,70 ℃ 5 min,冰上放置5 min后,-20 ℃保存。取2 μL逆转录产物进行荧光定量PCR反应。PCR扩增条件为:预变性95 ℃,10 min;PCR扩增,40个循环,95 ℃,15 s,60 ℃,45 s。使用比较ct值法分别计算样本中RAD18和CyclinD1的表达水平,目的基因表达=2-(ct目的基因-ct内参)。使用的内参及目的基因引物序列详见表 1。
| 基因名称 | 引物序列 | |
| RAD18 | 正向5’ -TTGGTTTGGTTTGGTTTGGT-3’ | |
| 反向5’-CCATCATGGAGCTGCTGTAA-3’ | ||
| CyclinD1 | 正向5’-CCCTCGGTGTCCTACTTCAAATGT-3’ | |
| 反向5’-GGAAGCGGTCCAGGTAGTTCAT-3’ | ||
| β-actin | 正向5’-AGCGAGCATCCCCCAAAGTT-3’ | |
| 反向5’-GGGCACGAAGGCTCATCATT-3’ |
将细胞接种于六孔板,培养24 h后,细胞汇合度达到70%~90%,进行转染。配制转染体系:A液用125 μL Opti-MEM培养基稀释5 μL siRNA试剂;B液用125 μL Opti-MEM培养基稀释3.75 μL Lipofectamine 3000转染试剂;将稀释好的A液与B液混合,轻柔混匀,室温放置5 min。将混合液加到六孔板中,继续培养24~48 h。RAD18-siRNA序列为:CCGCATATTAGATGAACTG。
1.4 蛋白质印迹法检测蛋白表达细胞转染48 h后,收集未转染组和RAD18-siRNA组细胞,提取细胞总蛋白后利用SDS-PAGE凝胶80 V电泳30 min,120 V电泳约1 h,通过250 mA电转移2 h至PVDF膜。5%脱脂奶粉封闭1 h,一抗(RAD18 1∶1000,CyclinD1 1∶1000,β-actin 1∶1000)4 ℃孵育过夜,TBST洗膜三次后,室温孵育HRP标记二抗1 h,洗膜三次后,利用ECL试剂盒显色。
1.5 CCK-8法检测细胞增殖和细胞存活率细胞转染24 h后收集未转染组和RAD18-siRNA组细胞,并接种于96 孔板中,每孔约2×103个细胞,分别于1、2、3、4、5 d后,在每孔中加入10 μL CCK-8试剂,继续培养2 h。酶标仪450 nm 波长下检测各孔的吸光度值。将转染的细胞接种于96孔板,继续培养24 h,分别加入0、12.5、25.0、50.0、100.0、200.0 μmol的顺铂,或0、25、50、100、200、400 μmol的5-氟尿嘧啶,其中0 μmol为对照组,同时设立空白组(只含培养基不含药物和细胞) 进行校正,每组样品5个复孔。继续培养48 h后,每孔加入CCK-8试剂10 μL,继续培养2 h。酶标仪450 nm波长下检测各孔的吸光度值。细胞存活率=RAD18-siRNA组平均吸光度值/未转染组平均吸光度值×100%。
1.6 流式细胞术检测细胞周期细胞接种于六孔板转染后,培养24 h,收集未转染组和RAD18-siRNA组细胞,用PBS洗一遍,并用预冷的75%乙醇在4 ℃固定过夜。固定后的细胞经PBS冲洗一次,离心并用0.5 mL(浓度为100 μg/mL)PI室温避光孵育30 min,用滤膜过滤后上流式细胞仪检测,FAC Scan软件分析细胞周期分布情况。
1.7 统计学方法采用统计软件SPSS 19.0进行数据分析,实验数据以均数±标准差(x±s) 表示。相关性分析采用Pearson检验,两组间比较采用配对样本t检验,以P<0.05为差异有统计学意义。
2 结 果 2.1 siRNA对ECA-109细胞RAD18和CyclinD1表达的影响ECA-109细胞转染siRNA后继续培养24 h或48 h收集细胞,分别检测基因 mRNA水平和蛋白质水平的表达。与未转染组比较,RAD18-siRNA组RAD18的mRNA水平明显降低(下降71.4%),差异有统计学意义(P<0.05)。蛋白质印迹法检测结果显示,与未转染组比较,RAD18-siRNA组RAD18和CyclinD1的表达均减少(图 1)。提示在食管鳞癌细胞ECA-109中RAD18可以影响CyclinD1的表达。
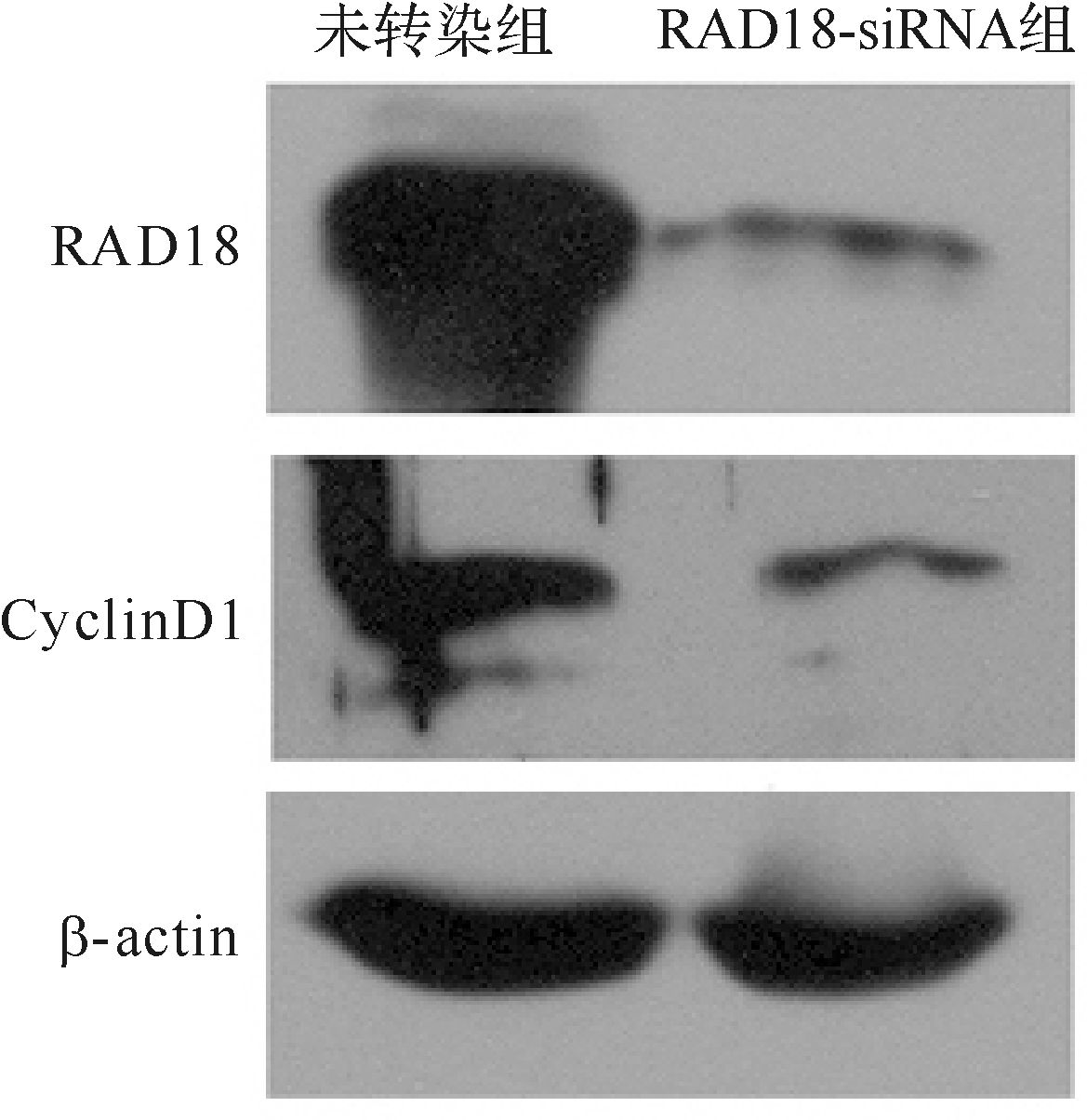
|
| 图 1 蛋白质印迹法检测RAD18和CyclinD1蛋白的表达 Fig. 1 The protein expression of RAD18 and CyclinD1 detected by Western blot |
ECA-109细胞转染siRNA后培养第1、2天时,未转染组和RAD18-siRNA组细胞吸光度值无明显差异;继续培养至第3、4、5天时,RAD18-siRNA组细胞吸光度值较未转染组降低(图 2A,P<0.05)。流式细胞仪检测细胞周期结果表明,转染siRNA后,细胞周期G1期的细胞数增多,而G2/M期细胞数减少(图 2B,P<0.05)。提示RAD18低表达诱导细胞出现G1期阻滞,从而抑制细胞的增殖。
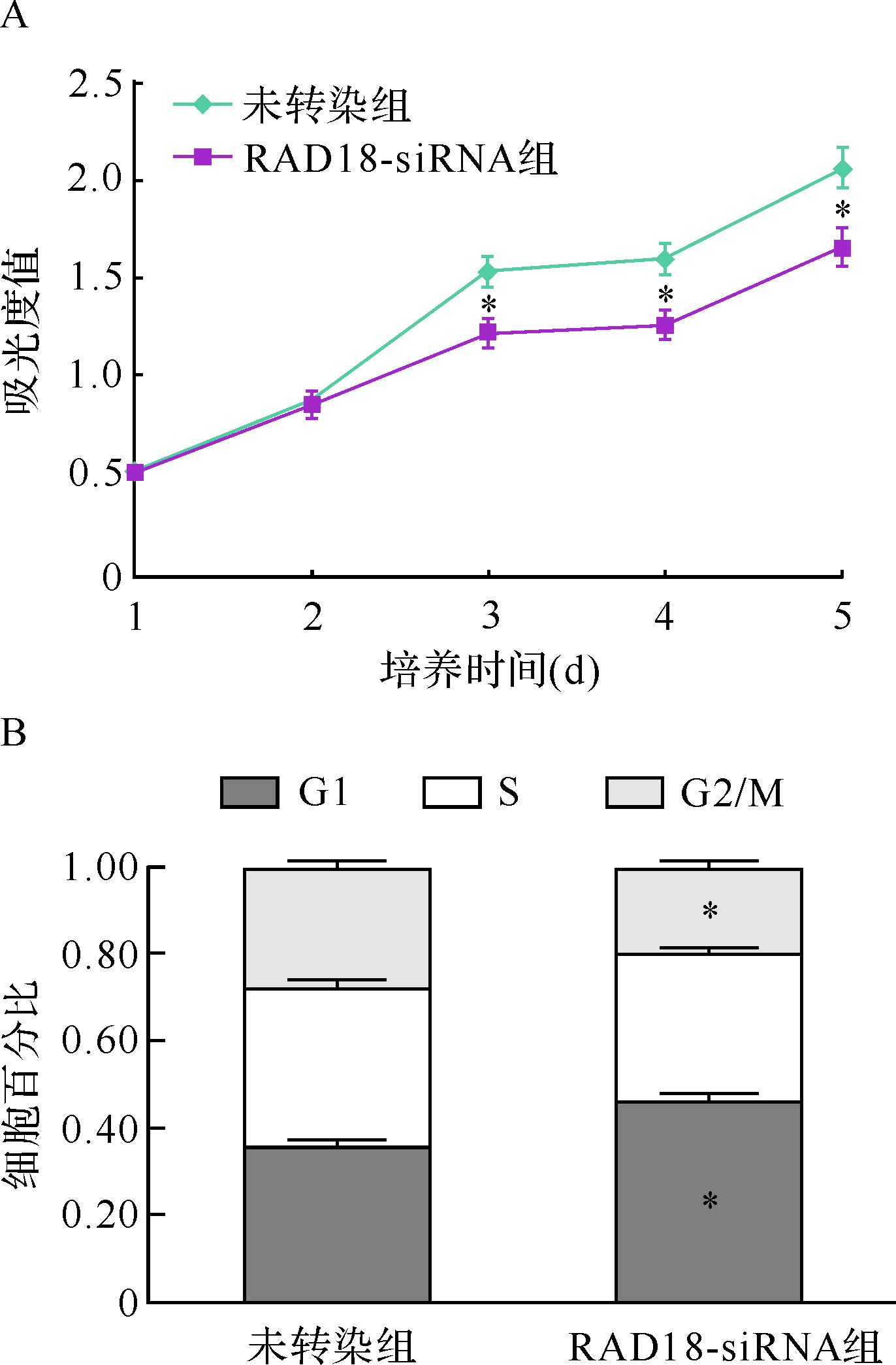
|
| A:两组细胞生长曲线比较; B:两组细胞周期分布比较.与未转染组比较,*P<0.05. 图 2 RAD18-siRNA组细胞增殖曲线和周期分布变化 Fig. 2 Cell proliferation and cell cycle distribution of ECA-109 cells in RAD18-siRNA group and untransfected group |
ECA-109细胞转染siRNA后加入不同浓度顺铂或5-氟尿嘧啶处理,结果表明,随着药物浓度增加,两组细胞的存活率逐渐下降。顺铂处理后未转染组半数抑制浓度(IC50)为135.9 μmol/L,RAD18-siRNA组IC50为114.1 μmol/L;5-氟尿嘧啶处理后未转染组IC50为634.4 μmol/L,RAD18-siRNA组IC50为177.0 μmol/L,两者差异均有统计学意义(均P<0.05),见图 3。提示RAD18-siRNA转染后细胞对两种化疗药物更加敏感。
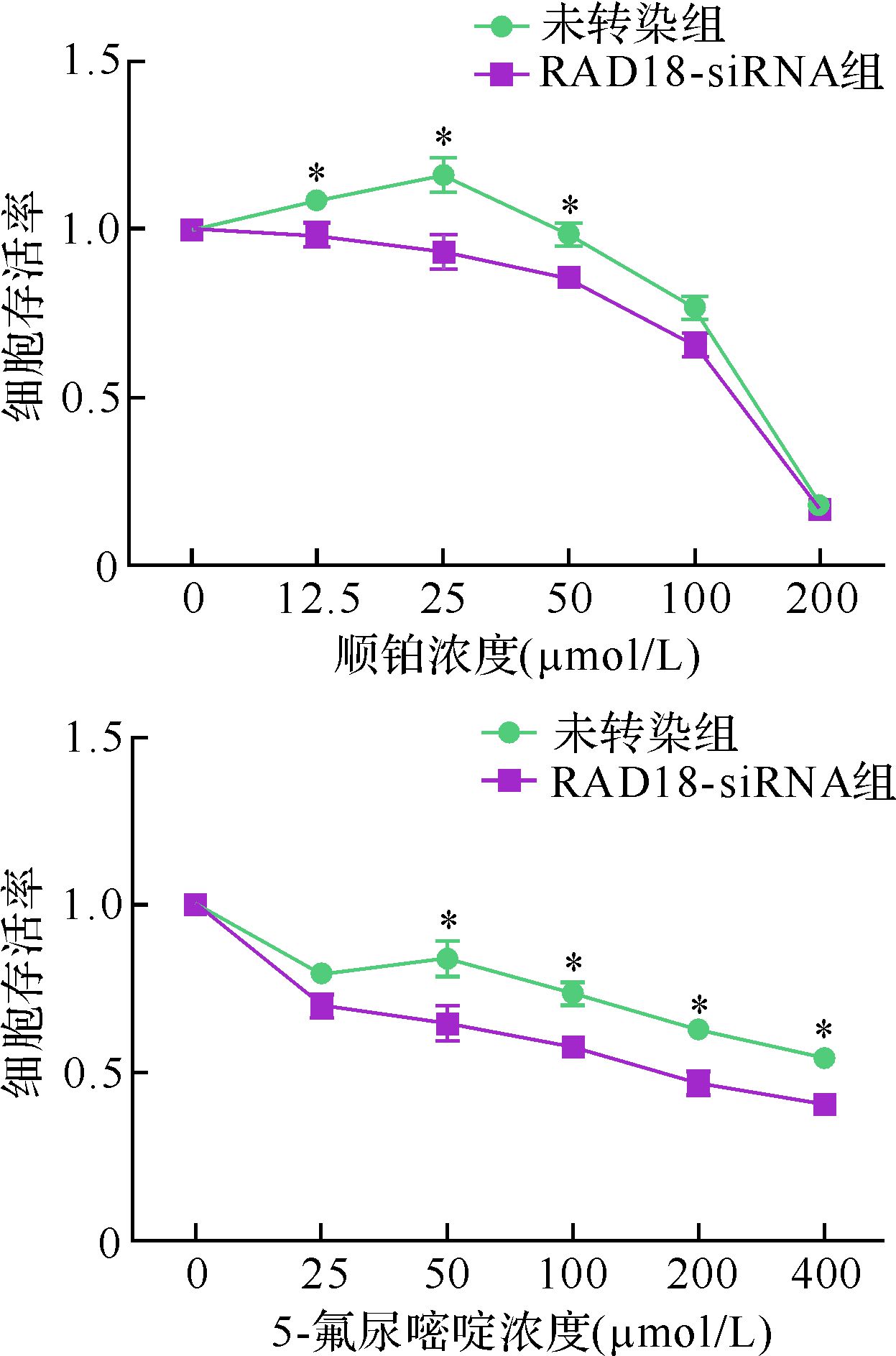
|
| 与RAD18-siRNA组比较,*P<0.05. 图 3 不同浓度顺铂或5-氟尿嘧啶处理后ECA-109细胞存活率变化 Fig. 3 Effect of chemotherapy (cisplatin or 5-FU) on the survival rate of ECA-109 cells |
荧光定量PCR方法检测RAD18 mRNA和CyclinD1 mRNA在44份食管鳞癌组织样本中的表达,结果见图 4。表明RAD18 mRNA与CyclinD1 mRNA呈显著正相关(r=0.478,P<0.01)。
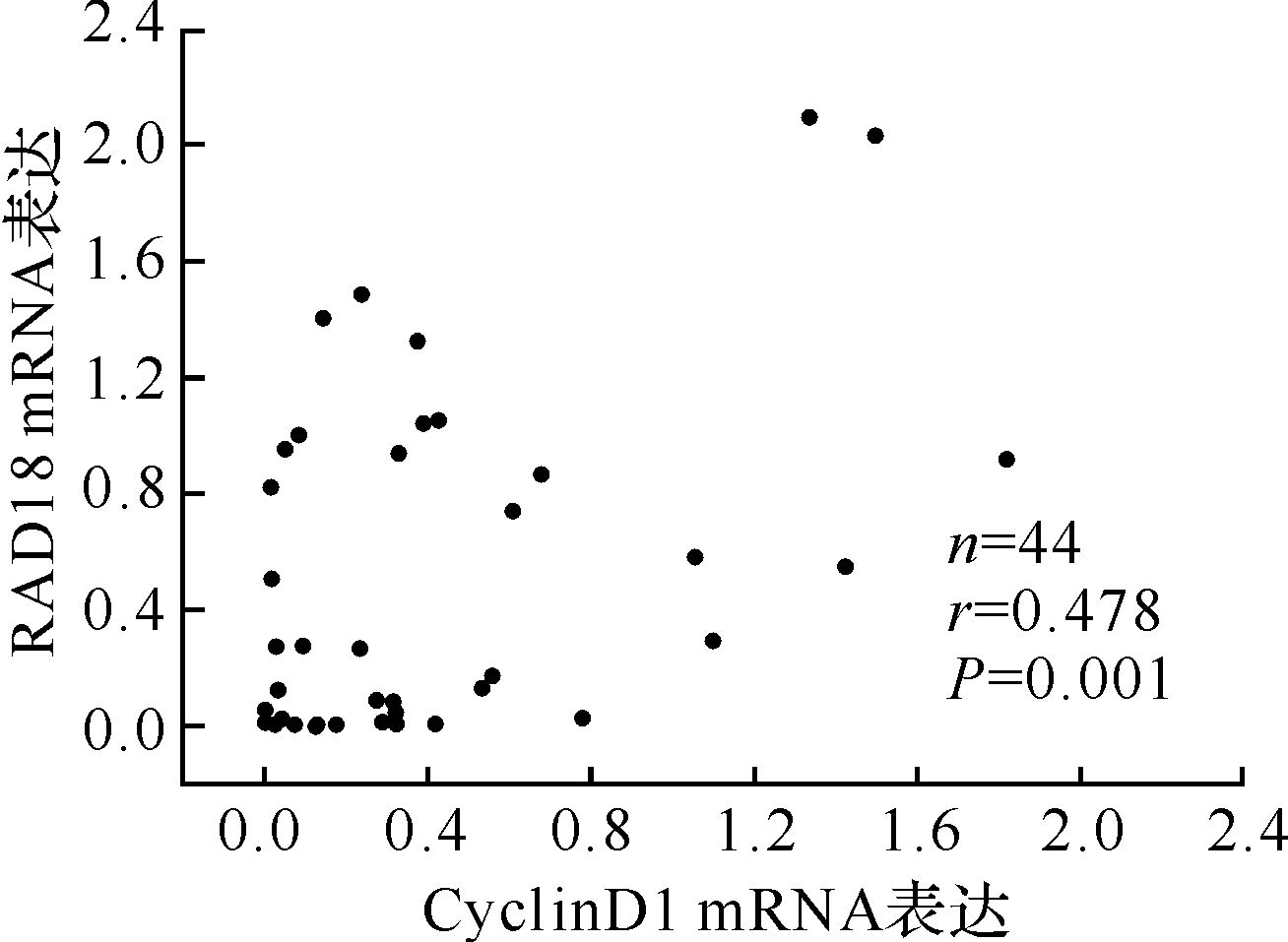
|
| 图 4 食管鳞癌组织中RAD18 mRNA和CyclinD1 mRNA表达的相关性分析 Fig. 4 Relationship between the mRNA expression of RAD18 and CyclinD1 in esophageal squamous cell carcinoma |
食管癌是威胁人类健康和生命的常见恶性肿瘤之一,在我国居癌症病死率第四位。全球的食管癌有70%左右发生在中国,且以鳞状细胞癌为主。目前临床治疗晚期食管鳞癌是以顺铂联合氟尿嘧啶的化疗方案,但其有效率仅为33%~36%,导致患者5年存活率只有10%左右[5-6]。食管鳞癌的发病原因除遗传因素外,还与饮食习惯、吸烟和饮酒等因素相关。这些危险因素可能会引起食管上皮细胞基因突变的不断累积,进而形成肿瘤。
TLS又名损伤旁路(lesion bypass),是生物体长期进化过程中形成的一套应急机制,普遍存在于真核生物中。当DNA链在复制过程中遇到损伤时,高忠实度的DNA聚合酶就会在损伤或者突变的位点前停下,在增殖细胞核抗原抗体的介导下进行聚合酶的转换,转换为低忠实度的TLS合成酶,并以损伤的核苷酸为模板继续合成碱基。TLS聚合酶主要包括DNA聚合酶ζ、κ、η、ι、μ,相对于复制性聚合酶而言,其忠实度较低,能够容忍复制过程中的错误,积累一些原本应该被清除的DNA突变,累积起来的DNA突变可能导致癌基因的激活,以及抑癌基因的失活,从而导致肿瘤的发生发展。研究表明,DNA聚合酶ζ和ι mRNA在肺癌、胃癌和结直肠癌中低表达[7],但在食管癌中高表达[2],且与患者淋巴结转移以及食管鳞癌细胞的侵袭呈正相关[3, 8]。
在DNA损伤修复过程中,PCNA介导的聚合酶转换起关键作用。其164位点的赖氨酸残基能够发生一系列的泛素化修饰并介导两种不同的损伤耐受机制,即TLS和无错耐受通路。目前认为单泛素化的PCNA介导TLS,而多泛素化的PCNA介导无错耐受通路。RAD18是一种E3泛素连接酶,可以与另外一种E2泛素结合酶RAD6紧密结合成二聚体,该二聚体通过RAD18上的活性区域与复制受阻的单链DNA 结合,并使PCNA164氨基酸单泛素化,从而激活了有易误性的TLS通路[9]。RAD18失活可降低小鼠胚胎干细胞和鸡DT40细胞的DNA复制损伤修复能力[10-11]。
近来关于RAD18与肿瘤的相关性引起诸多研究者关注。在人脑胶质瘤细胞模型中,抑制RAD18表达可增加脑胶质瘤细胞对电离辐射的敏感性[12];在人肺腺癌细胞模型中,抑制RAD18表达可增加肺腺癌细胞对顺铂的敏感性[13]。2011年朱孝中等[14]报道了RAD18基因在食管鳞癌组织中过表达。为了进一步验证RAD18对食管癌细胞的影响,本研究采用RAD18-siRNA抑制RAD18在食管癌细胞株ECA-109中的表达,结果显示下调RAD18表达可影响食管癌细胞增殖,诱导食管癌细胞G1期阻滞,增加食管癌细胞对顺铂和5-氟尿嘧啶的敏感性。
CyclinD1是一种细胞周期蛋白,其可通过结合并激活G1时期特有的周期蛋白依赖性激酶CDK4,磷酸化的G1期周期抑制蛋白Rb,使之与转录因子E2F解离,从而转录活细胞周期的基因,推动细胞周期由G1期进入到S期,促进肿瘤细胞增殖[15],影响肿瘤细胞对化疗药物的抵抗性[16-17]。CyclinD1在食管鳞癌组织中的表达率约为80%[18],可能是与食管鳞癌有最直接关系的癌基因[19]。在食管癌细胞模型中,本研究发现抑制RAD18可下调CyclinD1的表达;在食管癌组织样本中,进一步证实RAD18的表达水平与CyclinD1的表达水平成正相关。因此,我们推测RAD18可能通过CyclinD1来调控食管癌细胞的增殖和对化疗药物的抵抗性。
综上所述,RAD18在食管癌细胞中过表达可促进食管细胞增殖,增加食管癌细胞对化疗药物的抵抗性;下调RAD18在食管细胞中表达,可抑制食管细胞增殖,增加食管癌细胞化疗药物的敏感性。因此,靶向RAD18可能是提高食管鳞癌对化疗药物敏感性的一项策略。
| [1] | GHOSAL G, CHEN J. DNA damage tolerance: a double-edged sword guarding the genome[J]. Transl Cancer Res, 2013, 2 (3) :107–129. |
| [2] | ZHOU J, ZHANG S, XIE L, et al. Overexpression of DNA polymerase iota (Poliota) in esophageal squamous cell carcinoma[J]. Cancer Sci, 2012, 103 (8) :1574–1579. doi:10.1111/j.1349-7006.2012.02309.x |
| [3] | ZHU X, ZOU S, ZHOU J, et al. REV3L, the catalytic subunit of DNA polymeraseζ, is involved in the progression and chemoresistance of esophageal squamous cell carcinoma[J]. Oncol Rep, 2016, 35 (3) :1664–1670. |
| [4] | WONG R P, AGUISSA-TOUÉA H, WANI A A, et al. Elevated expression of Rad18 regulates melanoma cell proliferation[J]. Pigment Cell Melanoma Res, 2012, 25 (2) :213–218. doi:10.1111/pcr.2012.25.issue-2 |
| [5] | TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65 (2) :87–108. doi:10.3322/caac.21262 |
| [6] | LI J S, YING J M, WANG X W, et al. Promoter methylation of tumor suppressor genes in esophageal squamous cell carcinoma[J]. Chin J Cancer, 2013, 32 (1) :3–11. doi:10.5732/cjc.011.10381 |
| [7] | PAN Q, FANG Y, XU Y, et al. Down-regulation of DNA polymerases kappa eta, iota, and zeta in human lung, stomach, and colorectal cancers[J]. Cancer Lett, 2005, 217 (2) :139–147. doi:10.1016/j.canlet.2004.07.021 |
| [8] | SUN H, ZOU S, ZHANG S, et al. Elevated DNA polymerase iota (Poli) is involved in the acquisition of aggressive phenotypes of human esophageal squamous cell cancer[J]. Int J Clin Exp Pathol, 2015, 8 (4) :3591–3601. |
| [9] | 秦周帅, 张传林, 萧伟. 受PCNA翻译后修饰调控的DNA损伤耐受机制[J]. 生命科学, 2014, 26 (11) : 1143–1156. QIN Zhoushuai, ZHANG Chuanlin, XIAO Wei. DNA damage tolerance controlled by PCNA post-translational modifications[J]. Chinese Bulletin of Life Sciences, 2014, 26 (11) :1143–1156. (in Chinese) |
| [10] | TATEISHI S, SAKURABA Y, MASUYAMA S, et al. Dysfunction of human Rad18 results in defective postreplication repair and hypersensitivity to multiple mutagens[J]. Proc Natl Acad Sci U S A, 2000, 97 (14) :7927–7932. doi:10.1073/pnas.97.14.7927 |
| [11] | TATEISHI S, NIWA H, MIYAZAKI J, et al. Enhanced genomic instability and defective postreplication repair in RAD18 knockout mouse embryonic stem cells[J]. Mol Cell Biol, 2003, 23 (2) :474–481. doi:10.1128/MCB.23.2.474-481.2003 |
| [12] | XIE C, WANG H, CHENG H, et al. RAD18 mediates resistance to ionizing radiation in human gliomacells[J]. Biochem Biophys Res Commun, 2014, 445 (1) :263–268. doi:10.1016/j.bbrc.2014.02.003 |
| [13] | 苏晋豫, 李坚, 陈永昌, 等. RAD18基因敲除增强肺腺癌细胞对顺铂的敏感性[J]. 江苏大学学报:医学版, 2015, 25 (2) : 103–108. SU Jinyu, LI Jian, CHEN Yongchang, et al. Knockdown of RAD18 gene by siRNA enhance the sensitivitytocisplatin in lung adenocarcinoma[J]. Journal of Jiangsu University(Medicine Edition), 2015, 25 (2) :103–108. (in Chinese) |
| [14] | 朱孝中, 俞力超, 施舜缤, 等. 跨损伤DNA合成通路中关键基因在食管鳞癌中的表达研究[J]. 苏州大学学报:医学版, 2011, 31 (1) : 127–130. ZHU Xiaozhong, YU Lichao, SHI Shunbin, et al. Study of the expression of key gen in translesion DNA synthesis in esophageal squamous cell carcinomas[J]. Journal of Soochow University(Medicine Edition), 2011, 31 (1) :127–130. (in Chinese) |
| [15] | MUSGROVE E A, CALDON C E, BARRACLOUGH J, et al. Cyclin D as a therapeutic target in cancer[J]. Nat Rev Cancer, 2011, 11 (8) :558–572. doi:10.1038/nrc3090 |
| [16] | HUERTA S, HARRIS D M, JAZIREHI A, et al. Gene expression profile of metastatic colon cancer cells resistant to cisplatin-induced apoptosis[J]. Int J Oncol, 2003, 22 (3) :663–670. |
| [17] | QIN A, YU Q, GAO Y, et al. Inhibition of STAT3/CyclinD1 pathway promotes chemotherapeuticsensitivity of colorectal cancer[J]. Biochem Biophys Res Commun, 2015, 457 (4) :681–687. doi:10.1016/j.bbrc.2015.01.048 |
| [18] | IKEGUCHI M, SAKATANI T, UETA T, et al. Cyclin D1 expression and retinoblastoma gene protein (pRB) expression in esophageal squamous cell carcinoma[J]. J Cancer Res Clin, 2001, 127 (9) :531–536. doi:10.1007/s004320100265 |
| [19] | Prognostic significance of CyclinD1 and E-Cadherin in patients with esophageal squamous cell carcinoma: multiinstitutional retrospective analysis. Research Committee on Malignancy of Esophageal Cancer, Japanese Society for Esophageal Diseases[J]. J Am Coll Surg, 2001, 192 (6) :708–718. doi:10.1016/S1072-7515(01)00840-7 |




