2. 宁波市鄞州第二医院病理科, 浙江 宁波 315100
2. Department of Pathology, Yinzhou Second Hospital of Ningbo City, Ningbo 315100, China
结直肠癌是消化道常见的恶性肿瘤。近年来,随着我国饮食结构的变化,结直肠癌的发病率和病死率逐年增加[1]。正常黏膜—腺瘤—癌演变学说是目前公认的结直肠癌发生学说,但结直肠腺瘤癌变是一个多基因、多阶段综合作用的结果,与癌基因激活和抑癌基因失活、细胞信号转导系统紊乱,细胞的无控性增殖及凋亡抑制等密切相关[2]。最近研究表明,间质微环境主要成员肿瘤相关成纤维细胞(tumor associated fibroblasts,TAF)在肿瘤发展过程中起重要作用[3]。推测研究结直肠TAF有利于揭示结直肠肿瘤的发病机制,对提高临床病理诊断水平具有重要意义。本研究通过检测结直肠低级别腺瘤、高级别腺瘤及结直肠腺癌组织中TAF CD10表达和肿瘤细胞β-catenin、Ki-67、p53、CyclinD1的表达情况,并比较TAF CD10在结直肠腺瘤复发患者与非复发患者的表达情况,以探讨TAF CD10在结直肠腺瘤复发、癌变病理过程中可能的作用及意义。
1 对象与方法 1.1 研究对象选取宁波市鄞州第二医院病理科2010年1月至2015年8月收治的经组织病理学诊断证实的低级别腺瘤50例、高级别腺瘤50例、结直肠腺癌50例作为研究对象,以结直肠腺癌标本远端切缘正常黏膜为配对的正常对照,患者中男性89例,女性61例,年龄19~82岁,平均年龄(61.21±3.56)岁。同时收集2007年1月至2009年12月收治的先经组织病理学诊断证实的低级别腺瘤3年后复发,再次行腺瘤摘除的100例患者资料,其中男性71例,女性29例,年龄22~83岁,平均年龄(58.31±6.47)岁。入选标准:①每次结肠镜检查均为完整结肠镜检查,其他部位无原发肿瘤,术前均未行放化疗、免疫及生物治疗;②患者在初次结肠镜检查后半年内至少接受过一次结肠镜复查,以排除初次结肠镜检查中漏诊的腺瘤;③具有家族性腺瘤性息肉病、炎症性肠病及结直肠腺癌病者除外;④组织病理学检查确诊为低级别腺瘤,并且间隔一段时间后再次入院行结肠镜检查的患者。入选病例均知情同意。
1.2 检测试剂CD10、β-catenin、Ki-67、CyclinD1、p53、平滑肌肌动蛋白、Des鼠单克隆抗体,SP-900试剂盒DAB显色剂均购自中国福州迈新生物技术开发有限公司。
1.3 免疫组织化学检测CD10、β-catenin、Ki-67、CyclinD1、p53的表达所有手术标本经10%甲醛溶液固定,规范取材,常规石蜡包埋切片,并用HE染色,然后在光镜下进行细胞形态学观察。采用Envision二步法进行免疫组织化学标记。常规抗体标记后采用DAB显色,苏木精复染后显微镜下观察。
1.4 免疫组织化学结果判定免疫组织化学结果判定采用显微镜观察评分。CD10的阳性结果判定标准为:TAF的细胞膜和/或细胞质内出现清晰均匀棕黄色颗粒着色同时背景无非特异性着色。β-catenin表达于肿瘤细胞而间质细胞不表达。β-catenin主要表达于正常黏膜上皮细胞膜,其染色结果判断标准参照文献[4]:细胞膜阳性表达>70%为正常表达,细胞膜阳性表达<70%为表达缺失,细胞核阳性表达>10%为胞核阳性表达(即为异常表达)。Ki-67在肿瘤中分布不均,选取3个阳性率最高的区域计数,取其平均值作为该例增殖指数。CD10、CyclinD1、β-catenin、p53按其阳性细胞数量和阳性强度进行定量评分:阳性细胞数<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分[5]。轻度着色为1分,中度着色为2分,强着色为3分[5],两者相乘积0~3(0~+)定义为阴性,4~12(++~+++)定义为阳性。
1.5 结直肠腺瘤及腺癌形态评判标准腺瘤定义为存在异型增生的上皮,可将异型增生分为低级别与高级别,其中低级别腺瘤的细胞不典型性表现为削尖的核位于细胞质基底部;高级别腺瘤可见细胞显著异常和明显结构复杂的腺体。结直肠腺癌的定义:肿瘤浸润黏膜肌层,进入黏膜下层。所有切片均由两位高年资主治医师依据2012版消化系统肿瘤WHO的诊断标准[6],双盲形式阅片。
1.6 统计学方法采用SPSS 13.0 统计软件包进行统计分析,结果用例数(百分率)[n(%)]表示,各组间率的比较采用χ2检验,CD10与p53、Ki-67、β-catenin、CyclinD1相关性分析采用Spearman检验,P<0.05为差异有统计学意义。
2 结 果 2.1 结直肠腺瘤和腺癌中CD10、β-catenin、Ki-67、P53、CyclinD1阳性率比较CD10主要表达于瘤细胞周围的TAF(图 1A),CD10阳性的TAF细胞同时也表达平滑肌肌动蛋白(图 1B),而不表达Des,提示TAF细胞是纤维源性细胞而非肌源性细胞。在150例病例中,TAF中CD10在结直肠低级别腺瘤、高级别腺瘤、腺癌中的阳性率分别为22%、50%、78%,差异均有统计学意义(均P<0.01),见图 2、表 1。
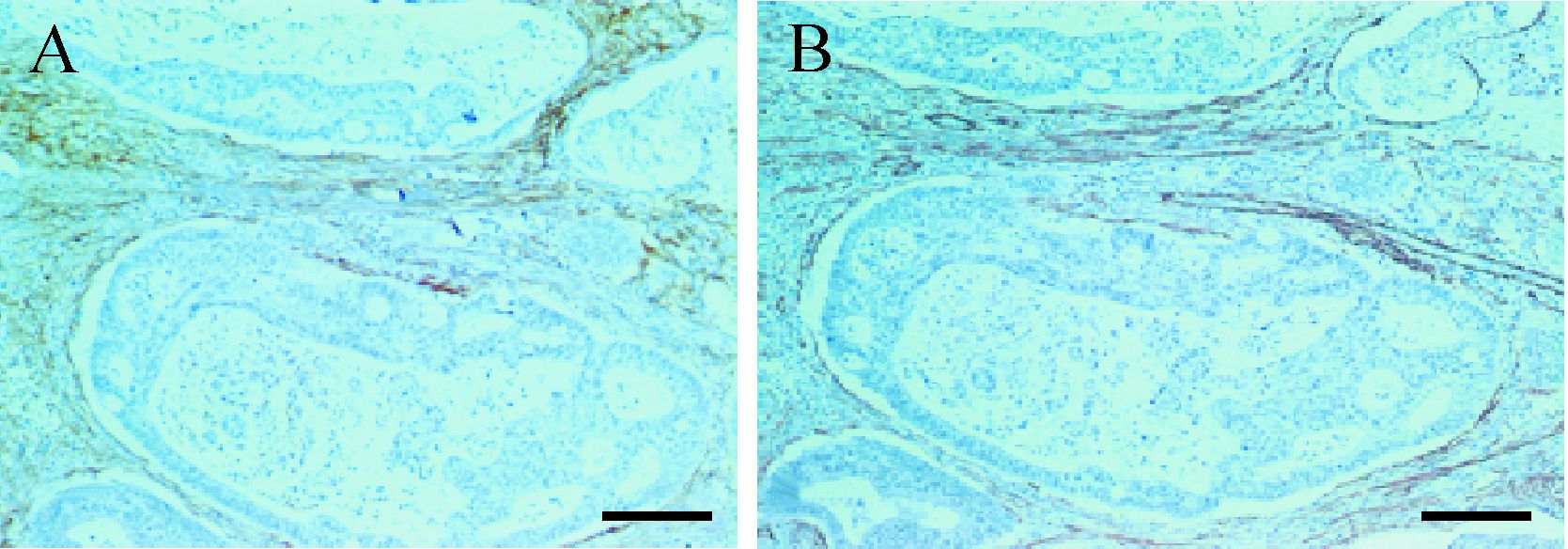
|
| A: 结肠腺癌间质中TAF增生旺盛,CD10在结肠腺癌细胞周围TAF中呈棕色颗粒状表达;B: 平滑肌肌动蛋白在结肠腺癌细胞周围TAF中呈棕色颗粒状表达,CD10阳性的TAF同时也表达平滑肌肌动蛋白.标尺=100 μm. 图 1 结直肠腺癌中TAF 同时表达平滑肌肌动蛋白和CD10 Fig. 1 TAF with smooth muscle actin expression also expressed CD10 in colorectal cancer |
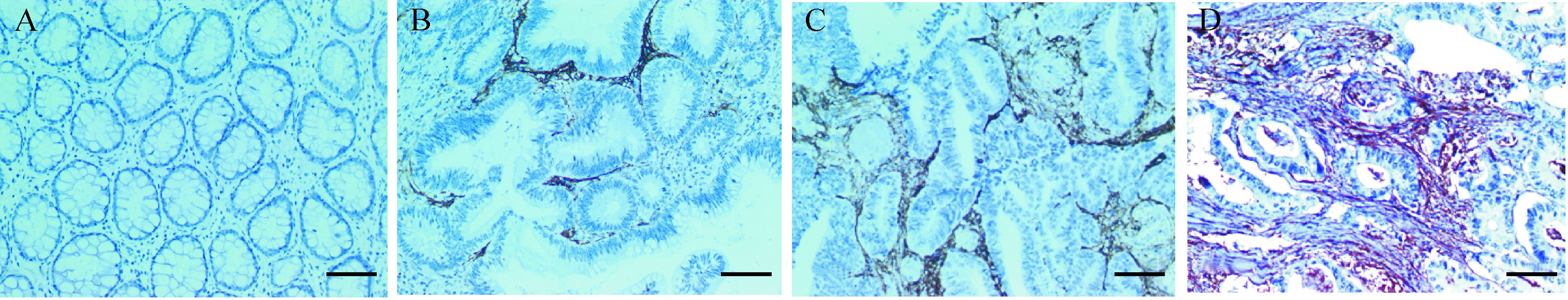
|
| A: 结直肠正常黏膜中腺体圆形排列整齐,间质中无TAF,CD10阴性;B:结直肠低级别腺瘤中腺体外形不规则,细胞核拉长、增大、拥挤,呈笔杆状,间质中TAF稍增生,CD10在TAF细胞胞浆中轻度颗粒状着色;C:结直肠高级别腺瘤中腺体结构复杂,细胞显著异常,核浆比增加,间质中TAF明显增生,CD10在TAF胞浆中中度颗粒状着色;D:结直肠腺癌细胞多形性明显,细胞核浓染,间质中TAF增生旺盛,CD10在TAF胞浆中重度颗粒状着色.标尺=100 μm. 图 2 CD10在低级别腺瘤、高级别腺瘤和结直肠腺癌TAF中的表达 Fig. 2 The expression of TAF CD10 in low/high grade adenoma tissues and colorectal cancer tissues |
| [n(%)] | ||||||
| 组别 | n | CD10阳性 | p53阳性 | Ki-67阳性 | β-catenin阳性 | CyclinD1阳性 |
| 低级别腺瘤 | 50 | 11(22) | 17(34) | 30(60) | 0(0) | 15(30) |
| 高级别腺瘤 | 50 | 25(50) | 29(58) | 41(82) | 2(4) | 25(50) |
| 腺 癌 | 50 | 39(78) | 33(66) | 47(94) | 26(52) | 22(44) |
| χ2值 | 33.248 | 11.125 | 17.717 | 58.377 | 4.421 | |
| P值 | <0.01 | <0.01 | <0.01 | <0.01 | 0.110 | |
p53、 Ki-67、β-catenin在结直肠低级别腺瘤、高级别腺瘤、腺癌中的核阳性率差异均有统计学意义(均P<0.01),CyclinD1在结直肠低级别腺瘤、高级别腺瘤及腺癌中的核阳性率差异无统计学意义(P>0.05),见表 1。
2.2 结直肠腺瘤和腺癌细胞核CD10表达与p53、Ki-67、β-catenin、CyclinD1表达的相关性分析在结直肠腺瘤和腺癌中,TAF中CD10与肿瘤细胞p53、Ki-67、β-catenin核阳性表达均呈正相关(r=0.264、0.307、0.320,均P<0.01),而与CyclinD1、β-catenin膜阳性表达无明显相关性(r=0.012、-0.073,均P>0.05),见表 2。
| CD10 | p53 | Ki-67 | β-catenin核定位 | β-catenin膜定位 | CyclinD1 | ||||||||||||||||
| - | + | ++ | +++ | - | + | ++ | +++ | - | + | ++ | +++ | - | + | ++ | +++ | - | + | ++ | +++ | ||
| - | 6 | 12 | 3 | 1 | 2 | 10 | 8 | 2 | 13 | 6 | 2 | 1 | 18 | 16 | 6 | 1 | 3 | 14 | 5 | 1 | |
| + | 14 | 33 | 12 | 18 | 1 | 21 | 42 | 13 | 30 | 38 | 7 | 2 | 17 | 12 | 3 | 2 | 3 | 61 | 10 | 2 | |
| ++ | 5 | 14 | 6 | 20 | 2 | 3 | 15 | 25 | 7 | 21 | 16 | 1 | 32 | 4 | 16 | 2 | 1 | 37 | 6 | 1 | |
| +++ | 1 | 2 | 2 | 1 | 3 | 1 | 1 | 1 | 2 | 1 | 1 | 2 | 13 | 5 | 2 | 1 | 1 | 2 | 2 | 1 | |
| r值 | 0.264 | 0.307 | 0.320 | 0.073 | 0.012 | ||||||||||||||||
| P值 | <0.01 | <0.01 | <0.01 | 0.372 | 0.882 | ||||||||||||||||
低级别腺瘤患者复发43例、非复发57例。复发患者3年以后复发为低级别腺瘤19例、高级别腺瘤8例、腺癌16例。复发者TAF中CD10阳性率(41.9%)高于非复发者(12.3%),16例低级别腺瘤复发为腺癌者的CD10阳性率(68.8%)高于27例复发为腺瘤者(25.9%,χ2=11.438、7.570,均P<0.05),见表 3。
| [n(%)] | ||
| 组别 | n | CD10阳性 |
| 复发 | 43 | 18(41.9)* |
| 复发为癌 | 16 | 11(68.7)# |
| 复发为腺瘤 | 27 | 7(25.9) |
| 非复发 | 57 | 7(12.3) |
| 与非复发组比较,*P<0.01;与复发为腺瘤比较,#P<0.01. | ||
腺瘤癌变途径是结直肠腺癌发生的经典途径。通过预警分子早期发现具有癌变潜能的腺瘤并有效手术切除能达到早期发现并降低癌变率,从而减少结直肠腺癌患者的病死率。已有研究表明,结直肠癌中相关信号分子及信号通路的改变在结直肠癌的发生、发展和侵袭转移等过程中起重要作用[7]。
CD10是一种锌指金属蛋白酶,表达于人体的多种正常细胞和肿瘤细胞中。功能上CD10可以水解结合于疏水氨基酸氨基残基的多肽,CD10的α-氨基的碳是酶切位点,研究表明其在间质中表达时参与多种肿瘤的侵袭和进展[8-10]。目前对CD10在肿瘤细胞表达的研究较多[11],而对CD10在间质中表达及临床意义的研究尚少。张荣菊等[12]对CD10在乳腺癌间质中表达的研究发现,CD10可能在乳腺原位癌发展为乳腺浸润癌的过程中起重要作用,并为肿瘤细胞生长、增殖、迁移提供适宜的微环境。Ogawa等[13]研究发现CD10在结直肠癌间质细胞中表达增加对结直肠癌发展起重要作用。本研究结果证实,TAF CD10在结直肠低级别腺瘤、高级别腺瘤及腺癌中的阳性率逐渐增高,且低级别腺瘤复发者高于非复发者,提示CD10参与肿瘤细胞逐渐获得具有侵袭性生物学行为的过程,与结直肠腺瘤癌变的发生有一定的关系。TAF中CD10的表达通过多种途径共同参与肿瘤的发生,若对内镜活检腺瘤标本进行CD10蛋白检测,将存在TAF表达CD10增加的患者作为癌变高危人群密切随访,有望提高结直肠癌的早期诊断率。
p53是抑癌基因,也是细胞凋亡的重要相关基因,野生型p53可激活Bax基因,从而解除bcl-2对细胞凋亡的抑制作用,促进凋亡的发生。当p53基因突变后,失去了对端粒酶的抑制作用,促进了细胞的永生长[14]。本研究结果显示,p53蛋白表达在结直肠腺癌和高级别腺瘤组多于低级别腺瘤组,表明此时细胞凋亡相对受到抑制,肿瘤细胞积累速度加快;TAF中CD10阳性表达与p53核阳性表达呈正相关,提示表达CD10的TAF对肿瘤的生长和恶性转化具有促进作用。
Ki-67是存在于增生细胞核的一种非组蛋白核蛋白,定位于第十号染色体,其表达可反映肿瘤细胞的增生活性,与恶性肿瘤的发展、转移和预后高度相关。本研究表明,随着CD10在TAF中表达增加,周围肿瘤性腺体Ki-67表达也增高,其在结直肠低级别腺瘤、高级别腺瘤和腺癌的阳性表达呈逐级增加的趋势。这提示TAF中CD10在腺瘤表达越高,腺瘤癌变趋势越明显,预后越差。
β-catenin是Wnt信号通路中有转录调控活性的核心分子。只有β-catenin向核内移动才能发挥Wnt信号通路的生物学效应。段光杰等[15]研究表明,β-catenin胞质及胞核表达与腺瘤癌变发生密切相关。Sugai等[16]的研究也发现β-catenin的核表达在结直肠腺瘤癌变中起关键作用。本研究结论提示,β-catenin的核阳性表达在结直肠腺癌与高级别腺瘤、低级别腺瘤之间差异均有统计学意义。同时有研究发现超过94%的结直肠腺癌中存在Wnt信号通路的异常改变[17]。β-catenin作为Wnt/β-catenin信号转导通路的中枢成分,其与TAF中CD10呈正相关,推测CD10可能通过介导肿瘤信号通路调控肿瘤相关因子,导致细胞转化等多种方式参与癌变的过程。CD10在肿瘤TAF中的表达增加对Wnt信号通路有积极促进作用,而Wnt信号通路的激活亦可能加速正常黏膜—腺瘤—癌的进程。
本研究结果显示,TAF中CD10阳性率依次为结直肠腺癌>高级别腺瘤>低级别腺瘤,β-catenin、Ki-67阳性率依次为结直肠腺癌>高级别腺瘤>低级别腺瘤,并且CD10与肿瘤细胞β-catenin、Ki-67、 p53核阳性表达均呈正相关。多项研究结果表明,第一次结肠镜检查发现腺瘤患者在腺瘤完整切除后3~5年再发腺瘤的概率为20%~50%,其中20%的腺瘤为高危腺瘤[18-22]。为明确TAF中CD10表达与结直肠腺瘤复发相关,本研究同时选取了100例低级别腺瘤患者,观察腺瘤完整切除3年后再次复发与否及复发为结直肠腺癌或复发为腺瘤的患者TAF中CD10表达情况。结果显示,TAF中CD10表达在低级别腺瘤复发者中高于非复发者,在复发为结直肠腺癌者中高于复发为腺瘤者。
CD10在正常黏膜—腺瘤—癌序列表达逐渐增多,且低级别腺瘤复发为癌的患者CD10阳性率高于复发为腺瘤的患者,推测CD10可能是阶梯式癌发生中的重要分子。本研究将TAF中CD10与Wnt/β-catenin通路联系起来,初步探讨了其在结直肠腺癌发生、发展过程中可能的机制。CD10联合β-catenin、Ki-67和p53有望在肿瘤综合治疗中成为新的治疗靶标。
在临床工作中,病理医师接收到肠镜活检小标本,按WHO诊断标准没有足够证据诊断为结直肠腺癌还需再次肠镜活检的情况下,对活检肠镜小标本联合检测CD10、β-catenin、Ki-67和p53有助于结直肠腺瘤癌变的早期诊断和生物学行为的评估,帮助其提高诊断准确性。
| [1] | 万德森. 我国结直肠癌的流行趋势及对策[J]. 中华肿瘤杂志, 2011, 33 (7) : 481–483. WAN Desen. Epidemiological trend and control strategy of colorectal cancer in China[J]. Chinese Journal of Oncology, 2011, 33 (7) :481–483. (in Chinese) |
| [2] | SINIEROPE F A, REGO R L, GARRITY-PARK M M, et al. Alterations in cell proliferation and apoptosis in colon cancers with microsatellite instability[J]. Int J Cancer, 2007, 120 (6) :1232–1238. doi:10.1002/(ISSN)1097-0215 |
| [3] | FULLÁR A, DUDÁS J, OLÁH L, et al. Remodeling of extracellular matrix by normal and tumor-associated fibroblasts promotes cervical cancer progression[J]. BMC Cancer, 2015, 15 :256. doi:10.1186/s12885-015-1272-3 |
| [4] | MARUYAMA K, OCHIAI A, AKIMOTO S, et al. Cytoplasmic beta-catenin accumulation as a predictor of hematogenous metastasis in human colorectal cancer[J]. Oncology, 2000, 59 (4) :302–309. doi:10.1159/000012187 |
| [5] | RAVIZZA T, BOER K, REDEKER S, et al. The IL-1 system in epilepsy-associated malformations of cortical development[J]. Neurobiol Dis, 2006, 24 (1) :128–143. doi:10.1016/j.nbd.2006.06.003 |
| [6] | 崔全才, 孟宇宏, 王鲁平. 消化系统肿瘤WHO分类[M]. 4版.北京: 人民卫生出版社, 2012 : 334 -335. CUI Quancai, MENG Yuhong, WANG Luping. WHO classification of tumours of the digestive system[M]. 4th ed.Beijing: People's Medical Publishing House Co.Ltd, 2012 : 334 -335. (in Chinese) |
| [7] | 步宏. 分子病理学:疾病的分子基础[M]. 北京: 科学出版社, 2012 : 461 -466. BU Hong. Molecular pathology: the molecular basis of human disease[M]. Beijing: Science Press, 2012 : 461 -466. (in Chinese) |
| [8] | MAKRETSOV N A, HAYES M, CARTER B A, et al. Stromal CD10 expression in invasive breast carcinoma correlates with poor prognosis, estrogen receptor negativity, and high grade[J]. Mod Pathol, 2007, 20 (1) :84–89. doi:10.1038/modpathol.3800713 |
| [9] | IWAYA K, OGAWA H, IZUMI M, et al. Stromal expression of CD10 in invasive breast carcinoma: a new predictor of clinical outcome[J]. Virchows Arch, 2002, 440 (6) :589–593. doi:10.1007/s00428-002-0639-4 |
| [10] | HUANG W B, ZHOU X J, CHEN J Y, et al. CD10-positive stromal cells in gastric carcinoma: correlation with invasion and metastasis[J]. Jpn J Clin Oncol, 2005, 35 (5) :245–250. doi:10.1093/jjco/hyi076 |
| [11] | JANG T J, PARK J B, LEE J I, et al. The expression of CD10 and CD15 is progressively increased during colorectal cancer development[J]. Korean J Pathol, 2013, 47 (4) :340–347. doi:10.4132/KoreanJPathol.2013.47.4.340 |
| [12] | 张荣菊, 牛昀, 高玉霞, 等. 间质CD10和Ezrin在乳腺癌中的表达及其意义[J]. 中华实验外科杂志, 2010, 27 (6) : 705–707. ZHANG Rongju, NIU Yun, GAO Yuxia, et al. Expression and significance of stromal CD10 and Ezrin in ductal carcinoma in situ and invasive ductal carcinoma of breast[J]. Chinese Journal of Experimental Surgery, 2010, 27 (6) :705–707. (in Chinese) |
| [13] | OGAWA H, IWAYA K, IZUMI M, et al. Expression of CD10 by stromal cells during colorectal tumor development[J]. Hum Pathl, 2002, 33 (8) :806–811. doi:10.1053/hupa.2002.125773 |
| [14] | SOOD A K, COFFIN J, JABBARI S, et al. P53 null mutations are associated with a telomerase negative phenotype in ovarian carcinoma[J]. Cancer Biol Ther, 2002, 1 (5) :511–517. doi:10.4161/cbt.1.5.167 |
| [15] | 段光杰, 阎晓初, 刘丽梅, 等. β-链接素与基质金属蛋白酶-7在大肠腺瘤及其癌变组织表达的意义[J]. 消化外科, 2005, 4 (3) : 185–189. DUAN Guangjie, YAN Xiaochu, Liu Limei, et al. Significance ofβ-catenin and matrix metalloproteinase-7 expressions in colorectal adenoma and malignant tissue[J]. Journal of Digestive Surgery, 2005, 4 (3) :185–189. (in Chinese) |
| [16] | SUGAI T, TSUKAHARA M, ENDOH M, et al. Analysis of cell cycle-related proteins in gastric intramucosal differentiated-type cancers based on mucin phenotypes: a novel hypothesis of early gastric carcinogenesis based on mucin phenotype[J]. BMC Gastroenterol, 2010, 10 (22) :2832–2834. |
| [17] | Cancer Genome Atlas Network. Comprehensive molecular characterization of human colon and rectal cancer[J]. Nature, 2012, 487 (7407) :330–337. doi:10.1038/nature11252 |
| [18] | ZAUBER A G, WINAWER S J, O'BRIEN M J, et al. Colonoscopic polypectomy and long-term prevention of colorectal cancer deaths[J]. N Engl J Med, 2012, 366 (8) :687–696. doi:10.1056/NEJMoa1100370 |
| [19] | VAN HEIJNINGEN E M, LANSDORP-VOGELAAR I, KUIPERS E J, et al. Features of adenoma and colonoscopy associated with recurrent colorectal neoplasia based on a large community-based study[J]. Gastroenterology, 2013, 144 (7) :1410–1418. doi:10.1053/j.gastro.2013.03.002 |
| [20] | SCHATZKIN A, LANZA E, CORLE D, et al. Lack of effect of a low-fat, high-fiber diet on the recurrence of colorectal adenomas. Polyp Prevention Trial Study Group[J]. N Engl J Med, 2000, 342 (16) :1149–1155. doi:10.1056/NEJM200004203421601 |
| [21] | BARON J A, COLE B F, SANDLER R S, et al. A randomized trial of aspirin to prevent colorectal adenomas[J]. N Engl J Med, 2003, 348 (10) :891–899. doi:10.1056/NEJMoa021735 |
| [22] | LIEBERMAN D A, WEISS D G, HARFORD W V, et al. Five-year colon surveillance after screening colonoscopy[J]. Gastroenterology, 2007, 133 (4) :1077–1085. doi:10.1053/j.gastro.2007.07.006 |




