神经系统由神经元和神经胶质细胞(以下简称胶质细胞)组成。传统研究大多把焦点集中在神经元上,认为胶质细胞起着支撑和保护神经元、营养维持等辅助作用。然而,越来越多的研究表明,胶质细胞的作用远不止这些。神经元的分化、存活、增殖、迁移、形态、电路形成、突触建立和维持离子平衡、神经传导等过程似乎都涉及胶质细胞[1]。
秀丽隐杆线虫(Caenorhadits elegans,C.elegans, 中文简称线虫)是研究神经系统发育与功能的理想模型动物。线虫的神经系统结构简单,并且由于进化上的高度保守,其神经元中神经递质、离子通道、神经递质受体的种类和功能,以及细胞内生物学过程和信号通路都与高等动物高度一致[2]。线虫神经元一个非常重要的特征是可以在没有胶质细胞营养支持的情况下存活[3],这点与其他模型生物不同,因此可解决在保证神经元存活状态下研究胶质细胞功能的难题。本文归纳总结了目前已知线虫胶质细胞对神经系统发育和功能的影响及机制,有助于提示其他生物模型研究胶质细胞对神经系统影响的机制,也有助于人类神经精神疾病的诊断和研究。
1 线虫胶质细胞的结构线虫有56个胶质细胞,其中包括24个鞘状胶质细胞(sheath glia)、26个槽状胶质细胞(socket glia)和6个由中胚层分化而来的谷氨酸受体胶质细胞(glutamate receptor glia)。目前在线虫中发现的胶质细胞主要分布在四种感觉器官:化学感受器(amphid)、头部感受器(cephalic)、外唇感受器(outer labial sensilla)和内唇感受器(inner labial sensilla)。每一种感觉器官由感觉神经元和两种胶质细胞组成。这两种胶质细胞分别是槽状胶质细胞和鞘状胶质细胞。
最大的化学感受器由12对神经元组成,其中8对神经元将固定的基于微管组织的感觉纤毛穿过鼻尖一个管状通道与外界环境相接触,如图 1A所示。这些特殊的感觉纤毛上的受体可以广泛感受机械、温度、气味、酸碱度、高盐、高渗透压和重金属等理化刺激[4],穿过的管状通道被称为化学感受器通道。化学感受器通道是由位于远端化学感受器鞘状胶质细胞(AMsh glia)的角质层和前部的电子密集内层组成。AWA、AWB、AWC这三个神经元的感觉神经末梢穿过化学感受器通道后进行了分支,其分支嵌入鞘状胶质细胞中感受挥发性的化学物质。感受温度的AFD神经元则直接嵌入了鞘状胶质细胞中[5],如同手指伸在手套中[6]。
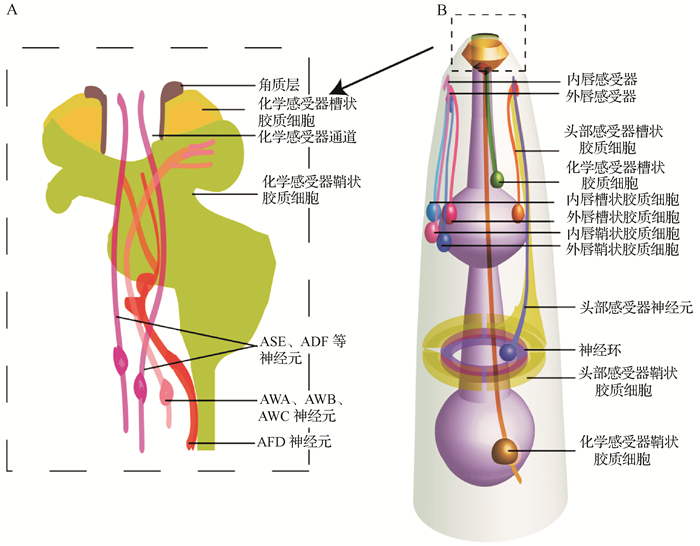
|
| A:线虫鼻尖的化学感受器示意图;B:线虫头部四种感觉器官胶质细胞的示意图. 图 1 线虫胶质细胞结构图 Fig. 1 Structure of glial cells in C. elegans |
头部感受器鞘状胶质细胞(CEPsh glia)有四个,与其他胶质细胞的区别在于其不仅在前部鞘状包裹保护头部感受器神经元末梢,后部还延伸到神经环(nerve ring)将其片状包裹,如同一个手环,如图 1B所示。神经环上包含大部分的突触,分布着神经系统主要的神经纤维网络,相当于线虫的脑。这些鞘状胶质细胞结构类似于脊椎动物的星形胶质细胞,并同样可能参与突触形成、突触调节和形成围绕神经环的渗透屏障[7]。头部感受器槽状胶质细胞(CEPso glia)形成孔道包围在唇部的头部感受器神经元树突,如图 1B所示。
线虫的唇部分为六部分,其上对称分布着六个内唇感受器和六个外唇感受器,每个外唇感受器排列在内唇感受器的后面,如图 1B、2A所示。与化学感受器不同的是,内唇槽状通道不衬有角质层,而是被介于槽状通道与表皮下通道之间的细胞外物质所围绕[6],如图 2B所示。与内唇感受器相似的是,外唇感受器通道也不衬有角质层。正如脊椎动物一样,线虫胶质细胞形态的多样性和对应神经元配对有力地表明:胶质细胞是不能互换的,它们为对应的神经元提供独特的环境和定制的功能。

|
| A:线虫四种感觉器官唇部位置示意图;B:线虫内唇感受器的结构. 图 2 线虫头部的主要感觉器官 Fig. 2 Four major sensory organs in the head of C. elegans |
研究表明,线虫化学感受神经元与其胶质细胞的发育是通过“锚定和拉伸”机制而形成[6, 8]。这两种细胞首先在线虫头部附近生成,接着在鼻尖处形成短的树突并锚定在前端,然后它们的细胞体向后迁移,伸出树突,胶质化进程随后伴随进行[6, 8]。树突尖端的锚定至少需要两种蛋白参与:神经元细胞分泌的含有透明带结构域的DYF-7蛋白和附近非神经元细胞分泌的含有带黏蛋白结构域的DEX-1蛋白。dyf-7和dex-1突变体不仅会影响化学感受器神经元树突的长度,而且会影响胶质细胞的鞘状结构,这表明在感觉器官中神经元和胶质细胞的形态是紧密联系的[8]。尽管目前尚不清楚DEX-1是否表达在化学感受器鞘状胶质细胞,但其他观察结果表明,胶质细胞对化学感受器树突延伸有直接作用。研究发现,在胚胎发育早期损毁化学感受器鞘状胶质细胞后,其包裹的化学感觉神经元的树突缩短,类似于dyf-7和dex-1突变体,如图 3A所示。类似地,在胚胎发育时期损毁头部感受器鞘状胶质细胞后,头部感受器神经元的树突没有延伸到位,轴突导向异常[9],如图 3B所示。然而,当把dyf-7或dex-1的cDNA表达在化学感受器胶质细胞中时,能弥补每个相应突变体的树突延伸缺陷,这提示胶质细胞在建立或修饰树突尖端锚定所需的细胞外基质过程中发挥作用。
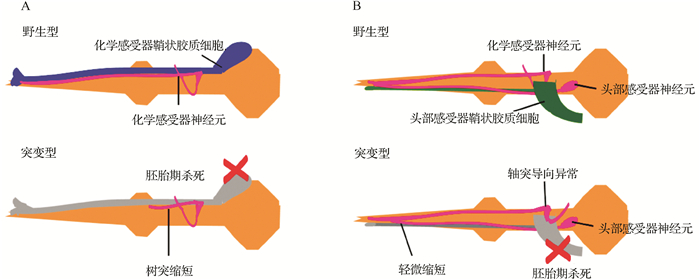
|
| A:在胚胎发育早期以激光损毁化学感受器鞘状胶质细胞导致化学感受器神经元的树突严重缩短;B:在胚胎发育时期以激光损毁头部感受器鞘状胶质细胞后导致CEP神经元树突轻微缩短和化学感受器神经元轴突导向缺陷.[9] 图 3 胚胎发育时期缺失胶质细胞导致线虫树突延伸和轴突导向缺陷 Fig. 3 Loss of glial cells in embryonic stage effects dendrite extension and axonal guidance in C.elegans |
在类似的损毁实验中,Sulston等[10]发现槽状胶质细胞在指导树突和特定的感觉器官中起了重要作用。损毁某一感觉器官的槽状胶质细胞导致这个感觉器官的树突和鞘状胶质细胞渗入另一个不同的感觉器官。这样,树突与槽状胶质细胞一起被另一个鞘状胶质细胞包裹。这个结果表明,不同的槽状胶质细胞是不等效的。
此外,胶质细胞在组织和引导轴突生长中发挥着重要作用。腹侧头部感受器鞘状胶质细胞表达了线虫的神经生长因子UNC-6。当UNC-6缺乏时神经元轴突的导向受到影响[9],并且UNC-6也是位于神经环的中间神经元RIA的轴突正确导向所必需的[11]。当头部感受器鞘状胶质细胞在胚胎发育期被损毁后,有的线虫不能形成神经环,有的形成一个神经元轴突混乱、导向分布广泛、分支异常的特殊神经环[9]。综上所述,胶质细胞在线虫的树突延伸和轴突的导向延伸中发挥关键作用。
2.2 线虫胶质细胞影响神经突触的发生神经轴突或树突生长的完成必须伴随着神经元与靶细胞之间特定突触的形成。头部感受器鞘状胶质细胞包围着突触丰富的神经环,神经环上的一对中间神经元AIY和RIA之间的突触形成需要AIY上的轴突导向因子受体UNC-40/DCC[11]。腹侧头部感受器鞘状胶质细胞与AIY相联系,表达UNC-6/netrin[12]。unc-6突变体显示的突触发生缺陷与unc-40突变体相似,这提示头部感受器鞘状胶质细胞可能参与突触发生。与此推测一致的是,影响溶质载体蛋白CIMA-1(表达在与头部感受器鞘状胶质细胞相联系的皮下细胞)的突变体可以导致这些胶质细胞扩展,而这种扩展可以诱导异位突触位点的形成[13]。
2.3 线虫胶质细胞对感受器通道形成的影响如前所述,在线虫感觉器官中,胶质细胞包裹着感觉神经元树突前端的感觉接受末端,形成一个神经末梢被胶质分泌物所包围的特殊仓,如图 1所示。在这些仓(以下称为胶质仓)中,化学感受器鞘状胶质细胞胶质仓的大小可被一个修补相关蛋白DAF-6调节[14-16]。DAF-6位于化学感受器通道,也定位于其他管腔结构的顶面。将daf-6基因突变后,化学感受器鞘状胶质细胞胶质仓畸变臃肿,并且由于胶质仓密闭的物理限制,感觉神经元的纤毛异常弯曲以至于不能伸出到外环境,这意味着化学感受器的功能需要位于化学感受器通道的完整性[16]。DAF-6可能限制胶质仓的大小,也可以说是促进胶质仓扩张的反作用机制。daf-6突变体的表型可在编码NEMO/MAP激酶同源物的lit-1基因突变后被抑制。尽管在daf-6和lit-1双突变品系中,胶质仓的大小看起来几乎是正常的,但是在lit-1单突变品系中胶质仓太窄以至于不能全部容纳化学感受器的感觉纤毛。因此,LIT-1的作用可能是促进胶质仓的扩张[17-18]。
LIT-1在许多胶质细胞中表达,定位于胶质仓管腔的皮下区域。缺失胶质仓定位保守序列的LIT-1尽管仍能在其他细胞中发挥作用,但已不能弥补lit-1突变带来的胶质仓缺陷,这说明定位对胶质仓的功能很重要[17-18]。蛋白质相互作用研究表明,LIT-1结合肌动蛋白和肌动蛋白调节Wiscott-Aldrich综合征蛋白(WASP)。LIT-1的对接位点可能是高度富集在胶质仓的表面的肌动蛋白。将WASP的编码基因wsp-1突变后也可以抑制daf-6突变引起的胶质仓缺陷,这提示LIT-1和WASP两者都能促进胶质仓的扩张[17]。
此外,位于胶质仓表面的一种囊泡分拣连接蛋白SNX-1可以拮抗DAF-6[18]。到目前为止的研究表明,针对胶质仓有两股相反的作用力,一股促进扩张,一股抑制扩张,这两股力量使得感受器通道可以形成适当的大小。
2.4 线虫胶质细胞可作为神经元的起源MCM是一类雄虫特有的中间神经元。在雄虫L3时期只可观察到两侧的化学感受器槽状胶质细胞,到了L4早期时却可观察到两侧的化学感受器槽状胶质细胞和MCM细胞共存。在雌雄同体头部没有观察到化学感受器槽状胶质细胞分裂,同时也没有观察到MCM细胞存在。L3时期损毁一侧的化学感受器槽状胶质细胞导致此侧MCM细胞的消失,而在L4中期也就是MCM细胞已出现的时候损毁化学感受器槽状胶质细胞却不能使MCM细胞丢失。这些结果提示化学感受器槽状胶质细胞是MCM的前体细胞[19]。
3 线虫胶质细胞对神经系统功能的影响 3.1 线虫胶质细胞通过维持神经元形态控制感觉神经元功能如前所述,许多理化刺激由线虫头部的化学感受器感知[4]。将线虫胶质细胞损毁后,并未导致与其他动物一样的神经元死亡,因此我们可能在没有严重破坏神经系统的情况下研究神经元的功能。在化学感受器的形态形成后将化学感受器鞘状胶质细胞损毁,可以观察到其包裹的其中两个感知气味的AWA、AWC神经元表现出对各种气味物质的趋向性缺陷,感知温度的AFD神经元功能也发生故障,使得线虫有趋热性缺陷[3]。这些神经元的感觉接受末端都被化学感受器鞘状胶质细胞包围,却在胶质细胞被损毁后发生了退化。而AWB神经元的感觉接受末端受到的影响较小,其功能似乎并未受到影响,提示化学感受器鞘状胶质细胞在维持感觉接受末端的形态上发挥了重要作用,这些神经元功能的异常很可能与他们的神经末梢变异有关。
3.2 线虫胶质细胞直接控制感觉神经元功能在化学感受器鞘状胶质细胞损毁后,ASE、ADL和ASH神经元的形态仍保持正常却不能发挥正常功能[3]。因此,胶质细胞在控制神经元的形态和功能两方面似乎有着不同的机制,胶质细胞可以直接影响神经元的活动。
为了解密胶质细胞影响化学感受器神经元活动的机制,Bacaj等[3]对fig-1的研究跨出了第一步。fig-1基因表达在化学感受器鞘状胶质细胞并编码含有血小板反应蛋白TSP-1结构域和类表皮生长因子结构域的分泌蛋白FIG-1。在哺乳动物,星型胶质细胞通过分泌血小板反应蛋白来调节突触的组装和功能[20-21],因此FIG-1蛋白具有特殊的研究意义。在fig-1突变体中的化学感受器神经元表现出对1-辛醇厌恶反应的降低。这种突变体不再像野生型一样吸收亲脂性染料,而是吸收亲水性染料[3]。这些结果提示FIG-1可能与哺乳动物的血小板反应蛋白具有相同的功能,可以调节化学感受器神经元检测和处理外环境信号的神经突触。
随后有研究证明胶质细胞通过通道活动调节神经元的活动。线虫能检测并逃避低酸碱度环境。在这个行为中,一种退化蛋白(DEG/ENaC)的离子通道蛋白DEG-1,在化学感受器感觉神经元ASK中发挥了作用。在胶质细胞中表达的另一种DEG/ENaC离子通道蛋白ACD-1突变后,线虫检测酸碱度这一行为受到影响。只有将acd-1基因特定表达在化学感受器鞘状胶质细胞上时才能弥补这种缺陷[22]。因而,ACD-1通道是化学感受器鞘状胶质细胞所必需的;而DELM-1、 DELM-2通道在内唇和外唇槽状胶质细胞中发挥作用。DELM-1、 DELM-2作用于这些胶质细胞来控制对触碰反应的响应。同样,只有在这些特定的槽状胶质细胞中重新表达这两个通道才能弥补delm-1和delm-2基因敲除突变体带来的缺陷。DELM-1、 DELM-2不是用来保持神经元结构的完整性或者神经元通道的细胞分布,而是对神经元的功能产生作用[23]。
此外,Yoshida等[24]发现表达在化学感受器鞘状胶质细胞的钾离子/氯离子协同转运体KCC-3调节AFD的活动动态。如前所述,ADF在线虫感知和记忆温度过程中扮演重要作用,而神经环路需要趋热性也是已知的[24-26]。KCC-3蛋白非细胞自主地控制AFD神经元的活动。kcc-3基因不是AFD神经元的发育和维持所必需的,而是用来调节其功能[24]。
最近,有研究发现在胶质细胞中表达的swip-10基因能够抑制多巴胺神经元的活动。swip-10突变体不能清除突触外多余的谷氨酸,导致多巴胺释放过量,改变了多巴胺能神经元的兴奋性[25]。
3.3 线虫胶质细胞对神经元可塑性的影响树突棘和感觉神经元突起是特殊的神经元接受末端用来响应外界刺激的两个例子。树突棘检测并传播突触前神经递质释放触发的信号,感觉接受末端处理并解释外部感觉刺激。这两种结构在形态、功能和分子组成上有惊人的相似性[26]。这两个结构也表现出形态可塑性。在线虫中,被化学感受器鞘状胶质细胞包裹的AWB、AWC感觉神经元的接受末端在响应感觉缺失或感觉信号扰乱时会发生形态改变[27-28]。为了应对高温、食物缺乏和高线虫密度的环境,线虫会进入一个保护发育阶段,称为持久期(dauer)。在持久期,AWC神经元的感觉接受末端会在化学感受器鞘状胶质细胞包裹的范围内重塑。化学感受器鞘状胶质细胞也会独立地与之同时重塑来限制这些末端的生长。研究表明,外界刺激引起的胶质仓大小变化导致神经元接受末端生长空间的抑制[29]。Otx/Otd转录因子基因ttx-1的突变体阻止胶质细胞扩张和融合,并且细胞特异挽救实验表明,TTX-1蛋白在化学感受器鞘状胶质细胞中发挥抑制胶质细胞扩张的作用[29-30]。化学感受器鞘状胶质细胞融合需要TTX-1目的基因ver-1。环境温度升高时,ver-1的表达上调。温度感觉和ttx-1表达以往认为是AFD神经元所特有的,但是化学感受器鞘状胶质细胞也可以表达ttx-1,并且在缺乏AFD时依然可以响应温度变化[29]。因此,有些胶质细胞可以感受特定的外界刺激,用这些信息来调节与其相应神经元的活动。
3.4 线虫胶质细胞直接响应刺激胶质细胞是神经系统的重要组成部分,但其如何应对体内的生理刺激仍是未知的。Ding等[31]发现相比于相邻的机械感受ASH神经元,化学感受器鞘状胶质细胞对触觉刺激更加敏感,可以记录到强劲的内向电流和钙响应。用上皮钠离子通道阻断剂可以阻断ASH神经元中碰触引起的电流和钙信号,却不能阻断化学感受器鞘状胶质细胞。这些结果表明,化学感受器鞘状胶质细胞积极响应触觉刺激,可能是细胞自主的机械感觉受体。
4 结语胶质细胞是神经科学的巨大谜团之一。果蝇和线虫等无脊椎模型动物在研究胶质细胞对神经系统发育、形态学和功能的影响机制上起到了很重要的基础性作用。目前研究表明,线虫胶质细胞可能通过建立或修饰树突尖端锚定所需的细胞外基质影响树突延伸。腹侧头部感受器鞘状胶质细胞通过表达线虫的神经生长因子UNC-6组织和引导轴突生长,并可能参与突触发生。线虫胶质细胞还通过表达一些特异的蛋白来调节胶质仓的大小和控制某些神经元的功能。另外,线虫胶质细胞不仅可作为神经元的起源,还可以感受特定的外界刺激,用这些信息来调节与之相应神经元的活动,并且某些胶质细胞(如化学感受器鞘状胶质细胞)可积极响应触觉刺激,可能是细胞自主的机械感觉受体。
然而,尽管目前取得了一些进展,仍有很多问题尚待研究。比如,胶质细胞与神经元之间是否存在实时的双向信息传送?如果有,其分子生物学基础是什么,又如何影响神经系统的功能?胶质细胞能够直接感受机械、化学等理化刺激进而影响感觉和行为吗?其分子生物学和环路机制何在?这些问题是胶质细胞研究领域的核心问题,然而目前均缺乏明确的答案。线虫体系具有操作快捷、在体研究技术方便成熟(如在体胞内钙信号实时检测、在体膜片钳电生理记录、光遗传学技术等)、易于行为学监测等优点,因此适合开展这些问题的研究,从而有助于阐明胶质细胞对于神经系统的发育和功能的影响及机制,也有助于神经精神疾病(如孤独症、精神分裂症、脑部胶质瘤和阿尔茨海默病等)的诊断、治疗和针对性药物开发[31]。
| [1] | BARRES B A. The mystery and magic of glia: a perspective on their roles in health and disease[J]. Neuron, 2008, 60 (3) :430–440. doi:10.1016/j.neuron.2008.10.013 |
| [2] | ZHANG Y, LU H, BARGMANN C I. Pathogenic bacteria induce aversive olfactory learning in Caenorhabditis elegans[J]. Nature, 2005, 438 (7065) :179–184. doi:10.1038/nature04216 |
| [3] | BACAJ T, TEVLIN M, LU Y, et al. Glia are essential for sensory organ function in C. elegans[J]. Science, 2008, 322 (5902) :744–747. doi:10.1126/science.1163074 |
| [4] | BARGMANN C I. Chemosensation in C. elegans[J]. WormBook, 2006 :1–29. |
| [5] | OIKONOMOU G, SHAHAM S. The glia of Caenorhabditis elegans[J]. Glia, 2011, 59 (9) :1253–1263. doi:10.1002/glia.21084 |
| [6] | WARD S, THOMSON N, WHITE J G, et al. Electron microscopical reconstruction of the anterior sensory anatomy of the nematode Caenorhabditis elegans[J]. J Comp Neurol, 1975, 160 (3) :313–337. doi:10.1002/(ISSN)1096-9861 |
| [7] | SHAHAM S. Glia-neuron interactions in the nervous system of Caenorhabditis elegans[J]. Curr Opin Neurobiol, 2006, 16 (5) :522–528. doi:10.1016/j.conb.2006.08.001 |
| [8] | HEIMAN M G, SHAHAM S. DEX-1 and DYF-7 establish sensory dendrite length by anchoring dendritic tips during cell migration[J]. Cell, 2009, 137 (2) :344–355. doi:10.1016/j.cell.2009.01.057 |
| [9] | YOSHIMURA S, MURRAY J I, LU Y, et al. mls-2 and vab-3 Control glia development, hlh-17/Olig expression and glia-dependent neurite extension in C. elegans[J]. Development, 2008, 135 (13) :2263–2275. doi:10.1242/dev.019547 |
| [10] | SULSTON J E, SCHIERENBERG E, WHITE J G, et al. The embryonic cell lineage of the nematode Caenorhabditis elegans[J]. Dev Biol, 1983, 100 (1) :64–119. doi:10.1016/0012-1606(83)90201-4 |
| [11] | COLÓN-RAMOS D A, MARGETA M A, SHEN K. Glia promote local synaptogenesis through UNC-6(netrin) signaling in C. elegans[J]. Science, 2007, 318 (5847) :103–106. doi:10.1126/science.1143762 |
| [12] | WHITE J G, SOUTHGATE E, THOMSON J N, et al. The structure of the nervous system of the nematode Caenorhabditis elegans[J]. Philos Trans R Soc Lond B Biol Sci, 1986, 314 (1165) :1–340. doi:10.1098/rstb.1986.0056 |
| [13] | SHAO Z, WATANABE S, CHRISTENSEN R, et al. Synapse location during growth depends on glia location[J]. Cell, 2013, 154 (2) :337–350. doi:10.1016/j.cell.2013.06.028 |
| [14] | RIDDLE D L, SWANSON M M, ALBERT P S. Interacting genes in nematode dauer larva formation[J]. Nature, 1981, 290 (5808) :668–671. doi:10.1038/290668a0 |
| [15] | HERMAN R K. Mosaic analysis of two genes that affect nervous system structure in Caenorhabditis elegans[J]. Genetics, 1987, 116 (3) :377–388. |
| [16] | PERENS E A, SHAHAM S. C. elegans daf-6 encodes a patched-related protein required for lumen formation[J]. Dev Cell, 2005, 8 (6) :893–906. doi:10.1016/j.devcel.2005.03.009 |
| [17] | OIKONOMOU G, PERENS E A, LU Y, et al. Opposing activities of LIT-1/NLK and DAF-6/patched-related direct sensory compartment morphogenesis in C. elegans[J/OL]. PLoS Biol, 2011, 9(8): e1001121. |
| [18] | OIKONOMOU G, SHAHAM S. On the morphogenesis of glial compartments in the sensory organs of Caenorhabditis elegans[J]. Worm, 2012, 1 (1) :51–55. doi:10.4161/worm.19343 |
| [19] | SAMMUT M, COOK S J, NGUYEN K C, et al. Glia-derived neurons are required for sex-specific learning in C. elegans[J]. Nature, 2015, 526 (7573) :385–390. doi:10.1038/nature15700 |
| [20] | CHRISTOPHERSON K S, ULLIAN E M, STOKES C C, et al. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis[J]. Cell, 2005, 120 (3) :421–433. doi:10.1016/j.cell.2004.12.020 |
| [21] | EROGLU C, ALLEN N J, SUSMAN M W, et al. Gabapentin receptor alpha2delta-1 is a neuronal thrombospondin receptor responsible for excitatory CNS synaptogenesis[J]. Cell, 2009, 139 (2) :380–392. doi:10.1016/j.cell.2009.09.025 |
| [22] | WANG Y, APICELLA A JR, LEE S K, et al. A glial DEG/ENaC channel functions with neuronal channel DEG-1 to mediate specific sensory functions in C. elegans[J]. EMBO J, 2008, 27 (18) :2388–2399. doi:10.1038/emboj.2008.161 |
| [23] | HAN L, WANG Y, SANGALETTI R, et al. Two novel DEG/ENaC channel subunits expressed in glia are needed for nose-touch sensitivity in Caenorhabditis elegans[J]. J Neurosci, 2013, 33 (3) :936–949. doi:10.1523/JNEUROSCI.2749-12.2013 |
| [24] | YOSHIDA A, NAKANO S, SUZUKI T, et al. A glial K+/Cl- cotransporter modifies temperature-evoked dynamics in Caenorhabditis elegans sensory neurons[J]. Genes Brain Behav, 2016, 15 (4) :429–440. doi:10.1111/gbb.2016.15.issue-4 |
| [25] | HARDAWAY J A, STURGEON S M, SNARRENBERG C L, et al. Glial expression of the Caenorhabditis elegans gene swip-10 supports glutamate dependent control of extrasynaptic dopamine signaling[J]. J Neurosci, 2015, 35 (25) :9409–9423. doi:10.1523/JNEUROSCI.0800-15.2015 |
| [26] | SHAHAM S. Chemosensory organs as models of neuronal synapses[J]. Nat Rev Neurosci, 2010, 11 (3) :212–217. |
| [27] | ROAYAIE K, CRUMP J G, SAGASTI A, et al. The G alpha protein ODR-3 mediates olfactory and nociceptive function and controls cilium morphogenesis in C. elegans olfactory neurons[J]. Neuron, 1998, 20 (1) :55–67. doi:10.1016/S0896-6273(00)80434-1 |
| [28] | MUKHOPADHYAY S, LU Y, SHAHAM S, et al. Sensory signaling-dependent remodeling of olfactory cilia architecture in C. elegans[J]. Dev Cell, 2008, 14 (5) :762–774. doi:10.1016/j.devcel.2008.03.002 |
| [29] | PROCKO C, LU Y, SHAHAM S. Glia delimit shape changes of sensory neuron receptive endings in C. elegans[J]. Development, 2011, 138 (7) :1371–1381. doi:10.1242/dev.058305 |
| [30] | PROCKO C, LU Y, SHAHAM S. Sensory organ remodeling in Caenorhabditis elegans requires the zinc-finger protein ZTF-16[J]. Genetics, 2012, 190 (4) :1405–1415. doi:10.1534/genetics.111.137786 |
| [31] | DING G, ZOU W, ZHANG H, et al. In vivo tactile stimulation-evoked responses in Caenorhabditis elegans amphid sheath glia[J/OL]. PLoS One, 2015, 10(2): e0117114. |




