2. 浙江大学医学院附属第二医院外科, 浙江 杭州 310009
2. Department of General Surgery, the Second Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310009, China
神经纤维瘤病(neurofibromatosis, NF)是一类常染色体显性遗传性疾病,约50%的患者有家族史,累及皮肤、骨骼、眼、消化系统、神经系统等多个器官和系统,引起多发性、渐进性损害,主要包括1型NF(NF-1)、2型NF(NF-2)和施万细胞瘤病三个亚型。其中NF-1又称为冯·雷克林豪森(Von Recklinghausen)病,发病率为1:3000~1:4000[1],其致病基因定位于染色体17q11.2,以异常皮肤色素沉着(咖啡牛奶斑)、多发皮肤结节、虹膜Lisch结节及腋窝和腹股沟雀斑等为特征性表现[2-3],10%~25%患者可有出血、穿孔以及罕见的肠梗阻等消化系统受累表现[4]。
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是来源于胃肠道间叶组织的肿瘤,临床发病率较低,每年为(1~2)例/10万[5]。临床表现各异,缺乏特异性,以腹部肿块、腹痛和消化道出血三大症状最为常见,可发生于消化系统的任何部位,常见于胃和小肠。外科手术和分子靶向药物是主要治疗手段,但易复发。
NF-1合并GIST的病例国内外报道较少,NF-1合并GIST并以小肠梗阻为首要表现较罕见。本病例报道旨在提高临床医师对于NF患者腹腔内肿块的鉴别诊断能力,以期及时、正确处理各种小肠梗阻。
1 病历摘要患者男性,58岁,农民,因“上腹胀痛伴恶心、呕吐5天”于2015年7月29日入住浙江大学医学院附属第二医院。入院5天前无明显诱因出现进食后上腹部胀痛,疼痛较为难忍,伴恶心、呕吐,症状逐步加重,持续2天后于当地医院就诊,行超声检查提示:“下腹部探及9.8 cm×7.3 cm×10.0 cm偏低不均回声团,左中腹探及4.9 cm×3.5 cm偏低不均回声团”。诊断考虑“肠梗阻”,予禁食、补液等对症处理无明显好转,遂转我院住院治疗。家族史:患者父亲及儿子与患者本人一样,均患有NF-1,家族系谱图见图 1。

|
| 图 1 本例NF-1患者遗传病家族系谱图 Fig. 1 Family pedigree chart of this NF-1 case |
入我院后体格检查:心率114次/min;呼吸17次/min;血压120/88 mm Hg(1 mm Hg=0.133 kPa);体温37.1 ℃,双眼虹膜可见多个Lisch结节(图 2),躯干及四肢皮肤满布大小不等结节,质地柔软,大者如鸡蛋状、小至米粒状,背部结节致密(图 3),双肺呼吸音粗,余心肺听诊正常。腹平软,无压痛及反跳痛,肝脾肋下未及,脐周可扪及大小5 cm左右质软包块。入我院当天即行胃肠减压,并予以静脉营养、预防性抗感染等对症治疗。再次检查腹部CT,结果十二指肠水平部及升部、上段空肠异常强化伴其上胃肠梗阻性扩张,考虑NF可能;中下腹及盆腔多发肿块,胸腹盆壁多发结节(图 4),考虑NF可能;胃肠造影结果,胃肠导管尖端到达十二指肠降段水平段交界区,十二指肠水平部造影剂通过受阻;CT腹部血管成像提示神经纤维瘤:可见小肠系膜扭转,中下腹及盆腔多发肿块由肠系膜上动脉供血(图 5)。行抗炎等保守治疗3周后,剖腹探查发现:腹腔内小肠系膜扭转,十二指肠和小肠多发肿瘤,肿瘤直径0.3~15.0 cm,最大直径肿瘤位于空肠上段起始部,下垂于盆腔,与膀胱粘连致密,肿瘤表面血管丰富、触之易出血。最终行“小肠肿瘤切除,小肠部分切除(图 6),空肠造瘘,腹壁肿瘤和右侧膝部肿瘤切除”手术。术后病理检查结果:①(小肠)GIST,10.5 cm×9.0 cm大小,核分裂<5/连续50个高倍镜野(图 7A);临床危险度评估为高危级别;免疫组织化学染色呈棕黄色,符合GIST诊断(图 7B)。C-KIT基因检测结果为野生型,不适合服用伊马替尼等靶向药物治疗。②腹壁和右侧膝部肿瘤均为神经纤维瘤,免疫组织化学染色结果亦支持NF诊断(图 8)。故患者最终诊断:①NF-1伴GIST;②小肠扭转;③完全性小肠梗阻。患者术后至今恢复良好,术后5个月复诊,无腹部不适等症状。
|
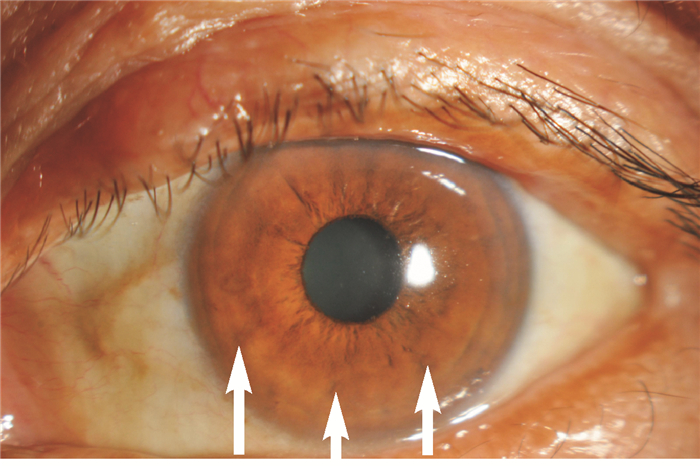
| 患者左眼虹膜上可见多个类圆形的结节(白色箭头所示),颜色略深于虹膜本身. 图 2 本例患者虹膜Lisch结节表现 Fig. 2 Lisch nodules on the patient's iris |

|
| 患者背部多发米粒至乒乓球大小结节(白色箭头所示),并可见咖啡牛奶斑(黑色箭头所示). 图 3 本例患者躯干典型皮损表现 Fig. 3 Multiple nodules and cafe-au-lait spots on the patient's back |

|
| 全腹部CT增强扫描提示,盆腔内一个巨大肿块,直径约10 cm左右,压迫膀胱直肠(黑色箭头所示). 图 4 本例患者盆腔内巨大肿块CT表现 Fig. 4 Huge tumor in the patient's pelvic cavity showed by CT |
|
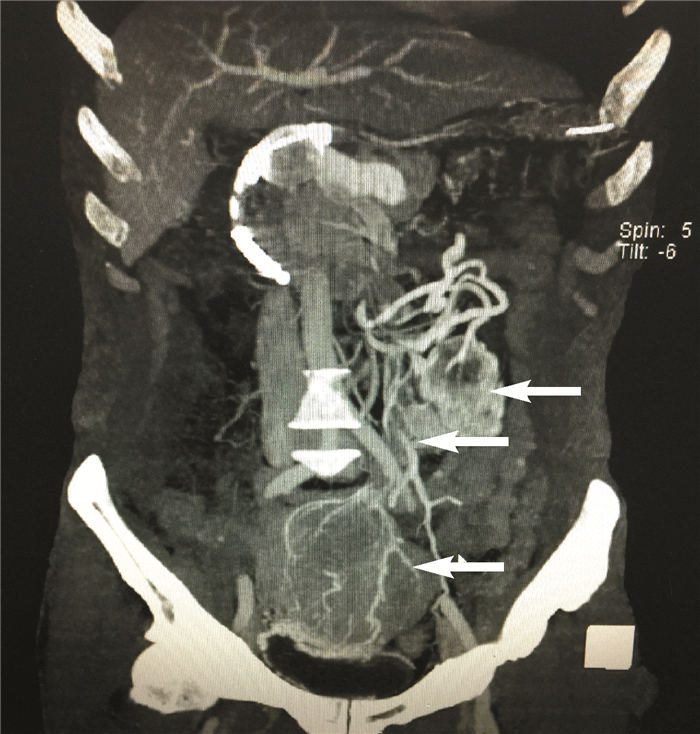
| 动脉造影显示中上腹盆腔内多发肿块(白色箭头所示). 图 5 本例患者腹腔内多发肿块CT动脉造影冠状位图像 Fig. 5 Multiple masses in abdominal cavity and pelvic cavity showed by CT angiograhy |
|
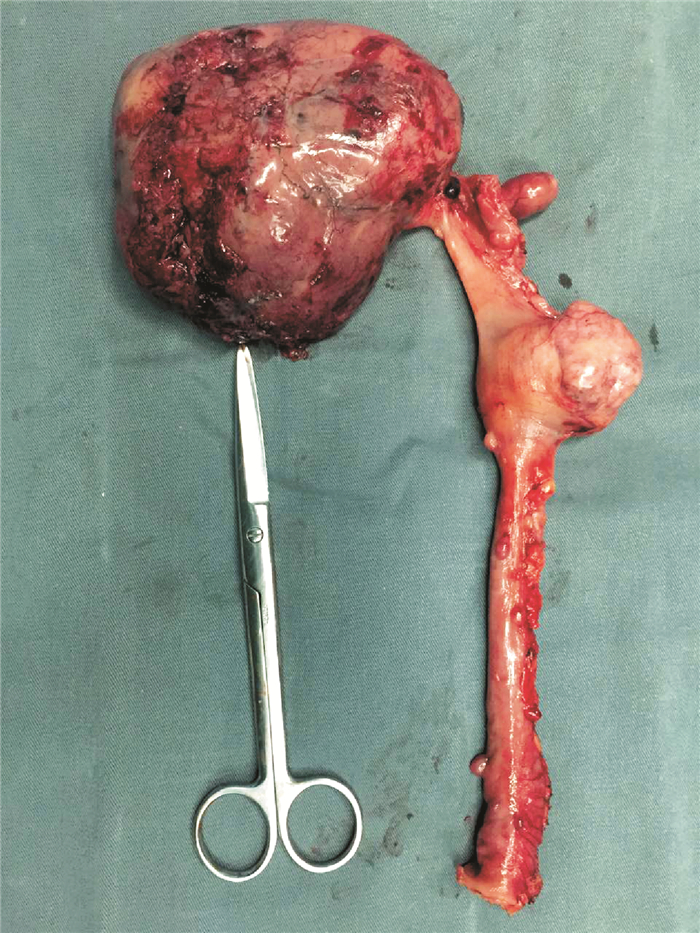
| 小肠肿块连同部分小肠一起切除,肿块直径约10 cm,被切除的小肠外壁可见直径约2 mm的多发结节. 图 6 本例患者腹腔内最大切除肿块大体形态 Fig. 6 Part of small bowel cut with the big tumor |
|
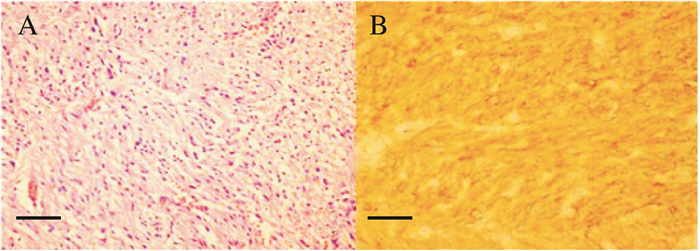
| A:肿瘤组织由短梭形细胞组成,呈片状排列;B:肿瘤细胞CD117免疫组织化学染色呈棕黄色.标尺=100 μm. 图 7 患者切除的小肠肿块显微镜下所见和CD117免疫组织化学染色表现 Fig. 7 Photomicrograhy and immunohistochemistry result of the biggest tumor(hematoxylin and eosin stained, the result of immunohistochemistry showed CD117 positive) |
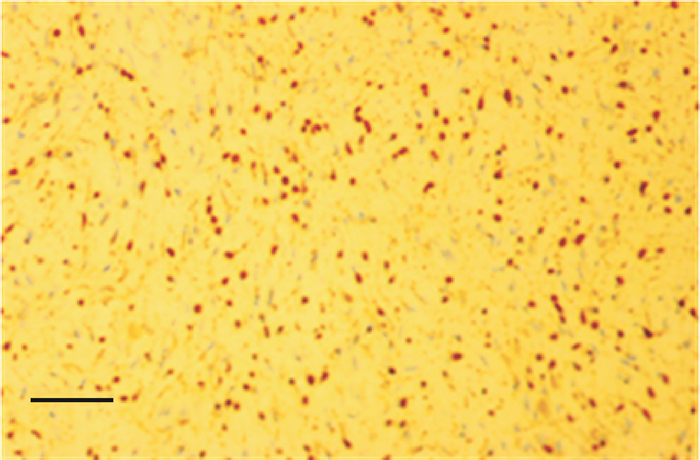
|
| 患者切除的右侧膝部结节组织显微镜下S-100免疫组织化学染色呈棕黄色.标尺=100 μm. 图 8 患者切除的右膝部结节组织免疫组织化学染色结果 Fig. 8 Result of immunohistochemistry showed S-100 positive of the nodule on right knee |
1882年Von Recklinghausen对NF-1作了详细的论述,其特征性的表现为:多发皮下神经纤维瘤,呈圆顶状结节,孤立或串珠样,有蒂或无蒂,大小不等,数量可达数十个以上,病变累及全身,多见于躯干及下肢,肿瘤较大时呈囊状下垂,有片状皮肤色素沉着,呈暗棕色,称为牛奶咖啡色斑。1988年美国国家卫生研究会制订NF-1的诊断标准[6]: ①六个或六个以上皮肤牛奶咖啡色斑,青春期前直径>5.0 mm,青春期后直径>15.0 mm;②两个或两个以上任何类型的神经纤维瘤病灶或一个丛状神经纤维瘤病灶;③腋窝或腹股沟区雀斑;④视神经胶质瘤或其他脑实质胶质瘤;⑤两个或两个以上虹膜错构瘤(Lisch结节);⑥特征性的骨性病变,包括蝶骨发育不良,假关节或长骨骨皮质变薄等;⑦一级亲属(父母、子女和兄弟姐妹)患NF-1。符合上述两项及以上者,且排除其他疾病即可诊断。本例患者临床表现典型,且其父亲及儿子均有类似疾病,因此临床确诊NF-1无疑。
NF-1的致病基因为抑癌基因[7],其产物为神经纤维瘤蛋白,该蛋白缺失后可引起Ras系统下游信号通路的异常激活,主要为Ras/Raf/MEK/ERK信号通路(即MAPK信号通路)和P13K/AKT/mTOR信号通路[8-9],上述信号通路在各种类型的肿瘤发生发展中均有作用。因此,NF-1与多种肿瘤发生相关,也可合并神经系统肿瘤(包括中枢和外周神经系统)、消化系统肿瘤等。若合并消化道肿瘤,NF-1患者多数在早期没有症状,当肿瘤增大时,可表现腹痛、消化道出血甚至休克等。由于NF-1可出现全身各部位结节样肿瘤(包括腹腔内肿瘤),故若发现腹腔内肿瘤首先考虑NF-1本身的结节所致。本病例在未进行手术之前,参与讨论的大部分医师都认为此患者腹腔内的肿瘤应该是NF-1。由于其合并其他疾病相对少见,且合并其他疾病并引发腹痛甚至肠梗阻的则更罕见,因此,经治医师一度困惑于肠梗阻的原因:究竟是NF-1本身引发的小肠梗阻,还是合并了其他消化道肿瘤比如GIST引发的小肠梗阻?不同疾病引起的小肠梗阻,后续手术方式、化学药物治疗等处理方法截然不同。
GIST是一类临床上相对少见的肿瘤,可以发生在消化系统的任何部位,最常见的原发部位是胃(65%~70%)和小肠(25%~30%),其次为结直肠(5%~10%)和食管(5%)。在空肠和回肠GIST中,合并NF-1的仅占4%左右[9],而如本例NF-1合并空肠巨大GIST肿瘤并引起肠扭转和肠梗阻的实属罕见。GIST在分子水平的发病过程目前已经基本明确,CD117是其常规的免疫组织化学检测手段。临床主要治疗手段是外科手术和分子靶向治疗。据文献报道,NF-1并存GIST的特点与一般散发GIST的特点不同:前者GIST的发病年龄相对后者小,病灶一般为多发,男女性别发病率无明显差异,最常见发病部位为小肠而非胃,肿块平均直径小,约3.8 cm左右,多呈低度恶性(核分裂<5个/50高倍镜),基因检测C-KIT基因和PDGFR基因多为野生型,对分子靶向药物伊马替尼不敏感,总体预后较后者好。而后者虽有部分病例对伊马替尼治疗有效,但因存在耐药和手术后复发的问题,总体预后要较前者差[10]。本例导致患者腹腔内小肠扭转及小肠梗阻的肿块直径达10 cm,免疫组织化学检测结果CD117阳性、S-100蛋白阴性,符合GIST诊断,与NF-1的免疫组织化学检测结果CD117阴性、S-100阳性截然不同。最终基因检测结果亦为野生型,不适用伊马替尼治疗。本例患者出现神经纤维瘤结节已经有30多年,但是其腹腔内GIST肿块较一般散发的GIST发展略慢。其GIST肿块基因检测结果C-KIT基因为野生型,符合上述文献总结的NF-1合并GIST的肿瘤特点。
临床上,术前要明确NF-1患者的小肠梗阻原因和腹腔内多发肿块的性质是相当困难的,本例亦是如此。胃肠造影只能大概明确小肠梗阻的部位,CT检查或者CT血管造影检查也只能提示肿块的大致部位、密度和血供情况,但无法完全鉴别是NF-1还是GIST所引起的。即便是多源CT或者正电子发射计算机断层显像(PET-CT)也很难做出鉴别诊断。最终确诊还是需手术获取病理组织进行免疫组织化学检测,再进一步行基因检测。若检测结果不宜伊马替尼治疗,后期可以考虑放射治疗等[11]。
综上分析,NF-1合并GIST临床比较少见[3-4],GIST肿块如此巨大引起小肠系膜扭转及小肠梗阻更是罕见[9]。NF-1合并消化道肿瘤由于疾病早期没有明显症状,诊断往往都是后期出现并发症后才明确。因此,临床上处理这类小肠梗阻患者的时候,除了首先要考虑NF-1疾病本身在腹腔内出现占位从而引起的肠梗阻之外,也需要考虑合并其他肿瘤的可能性。为了在术前能够鉴别可能合并了哪种消化道肿瘤,进行腹部以及盆腔的增强CT检查以及CT血管造影检查是必要的。进行了上述CT检查之后,若仍然不能明确肿块的大概性质则可选择PET-CT检查、肿块穿刺活检或者手术探查。手术治疗是处理这种疾病的主要手段。对于NF-1合并GIST患者,由于其病理学呈低度恶性表现,总体预后要比单纯散发GIST患者预后好,术后复发率相对低,建议果断采取手术治疗。
| [1] | REYNOLDS R M, BROWNING G G, NAWROZ L, et al. Von Recklinghausen's neurofibromatosis: neurofibromatosis type 1[J]. Lancet, 2003, 361 (9368) :1552–1554. doi:10.1016/S0140-6736(03)13166-2 |
| [2] | GAJESKI B L, KETTNER N W, AWWAD E E, et al. Neurofibromatosis type 1: clinical and imaging features of Von Recklinghausen's disease[J]. J Manipulative Physiol Ther, 2003, 26 (2) :116–127. doi:10.1067/mmt.2003.7 |
| [3] | ZÖLLER M E, REMBECK B, ODÉN A, et al. Malignant and benign tumors in patients with neurofibromatosis type 1 in a defined Swedish population[J]. Cancer, 1997, 79 (11) :2125–2131. doi:10.1002/(ISSN)1097-0142 |
| [4] | CAVALLARO G, BASILE U, GIUSTINI S, et al. Surgical management of abdominal manifestations of type 1 neurofibromatosis: experience of a single center[J]. Am Surg, 2010, 76 (4) :389–396. |
| [5] | NILSSON B, BVMMING P, MEIS-KINDBLOM J M, et al. Gastrointestinal stromal tumors: the incidence, prevalence, clinical course, and prognostication in the preimatinib mesylateera-a population-based study in western Sweden[J]. Cancer, 2005, 103 (4) :821–829. doi:10.1002/cncr.20862 |
| [6] | National Institutes of Health Consensus Development Conference. Neuroifbromatosis: conference statement[J]. Arch Neurol, 1988, 45 (5) :575–578. doi:10.1001/archneur.1988.00520290115023 |
| [7] | KHELIFA I, SAURAT J H, PRINS C. Use of imatinib in a patient with cutaneous vasculopathy in the context of von Recklinghausen disease/neurofibromatosis[J]. Br J Dermatol, 2015, 172 (1) :253–256. doi:10.1111/bjd.2015.172.issue-1 |
| [8] | ENDO M, YANMMOTO H, SETSN N, et al. Prognostic significance of AKT/mTOR and MAPK pathways and antitumor effect of mTOR inhibitor in NF1-related and sporadic malignant peripheral nerve sheath tumors[J]. Clin Cancer Res, 2013, 19 (2) :450–461. doi:10.1158/1078-0432.CCR-12-1067 |
| [9] | MIETTINEN M, FETSCH J F, SOBIN L H, et al. Gastrointestinal stromal tumors in patients with neurofibromatosis 1: a clinicopathologic and molecular genetic study of 45 cases[J]. Am J Surg Pathol, 2006, 30 (1) :90–96. doi:10.1097/01.pas.0000176433.81079.bd |
| [10] | ANDERSSON J, SIHTO H, MEIS-KINDBLOM J M, et al. NF1-associated gastrointestinal stromal tumors have unique clinical, phenotypic and genotypic characteristics[J]. Am J Surg Pathol, 2005, 29 (9) :1170–1176. doi:10.1097/01.pas.0000159775.77912.15 |
| [11] | IZQUIERDO M E, BONASTRE M T. Patient with high-risk GIST not associated with c-KIT mutations: same benefit from adjuvant therapy?[J]. Anticancer Drugs, 2012, supplement :S7–S9. |




