2. 浙江省台州医院儿科, 浙江 临海 317000
2. Department of Pediatrics, Zhejiang Taizhou Hospital, Linhai 317000, Zhejiang Province, China
幼年特发性关节炎(juvenile idiopathic arthritis,JIA)是较为常见的导致残疾的儿童期风湿性疾病,目前发病机制尚不明确。JIA临床异质性较强,2001年国际风湿病学联盟(ILAR)将其分为七种亚型,包括全身型JIA (systemic onset JIA, SOJIA)、少关节炎型JIA、类风湿因子阴性多关节炎型JIA、类风湿因子阳性多关节炎型JIA、银屑病相关型JIA、附着点炎型JIA和未分化型JIA [1]。细胞因子的研究对了解JIA的发病机制及治疗非常重要,近年来,用生物制剂治疗JIA患者取得了重大进展也证实了这一点。已有研究表明,SOJIA有别于其他亚型,是一种自身炎症性疾病,细胞因子如IL-6、IL-1β而非TNF-α在SOJIA中起重要作用,传统的TNF-α拮抗剂对SOJIA疗效有限[2-3]。郭莉等[4]研究表明,SOJIA患儿IL-6明显升高,IL-10降低。如果将全身型以外的另外几种亚型称为非SOJIA,国内外关于非SOJIA患者外周血细胞因子水平研究报道较少。本文通过分析常见非SOJIA患儿血清T辅助细胞1/2(T helper 1/2, Th1/Th2)细胞因子特点,旨在为本病的临床治疗提供依据。
1 对象与方法 1.1 研究对象将2012年1月至2015年5月在浙江大学医学院附属儿童医院风湿免疫变态反应科就诊的41例活动期非SOJIA患儿纳入研究,其中男性21例,女性20例,年龄1.3~15.8岁,平均年龄(7.78±3.45)岁。非SOJIA组包括多关节炎型11例、少关节炎型10例、附着点炎型20例。同期住院初诊为SOJIA患儿85例作为SOJIA组及201名健康体检儿童作为正常对照组。SOJIA组男性41例,女性44例,年龄0.83~14.26岁,平均年龄(7.37±3.68)岁;正常对照组男性100名,女性102名,年龄1.25~14.92岁,平均年龄(7.68±3.24)岁。所有JIA患儿均符合2001国际风湿病联盟专家制定的诊断标准[1],同时排除肝肾功能不全、全身炎症性疾病、近期感染、肿瘤和应用过激素、免疫抑制剂等患儿。非SOJIA组、SOJIA组及正常对照组之间性别构成、平均年龄差异均无统计学意义(均P>0.05)。三组儿童家长均签署知情同意书。
1.2 流式细胞术检测外周血细胞因子水平所有JIA患儿入院当天和正常对照组体检当天收集外周血2 mL,分离血清,应用流式细胞微球芯片技术捕获Th1/Th2细胞因子试剂盒Ⅱ(BDTMCBA Human TH1/TH2 Cytokine Kit Ⅱ,美国BD Biosciences产品)和FACSCalibur流式细胞仪(美国BD公司)检测Th1相关细胞因子γ干扰素、IL-2、IL-6、TNF-α和Th2相关细胞因子IL-4、IL-10。六种细胞因子的检测下限为1.0 pg/mL,上限为5000.0 pg/mL。
1.3 其他炎症指标检测所有JIA患儿入院当天常规检测外周血白细胞、中性粒细胞比例、血红蛋白、血小板计数、超敏C反应蛋白和红细胞沉降率,其正常范围:白细胞(4~10)×109/L,中性粒细胞比例50%~75%,血红蛋白110~155 g/L,血小板(100~400)×109/L,超敏C反应蛋白 < 8 mg/L,红细胞沉降率0~20 mm/h。
1.4 统计学分析采用SPSS 18.0进行统计学分析,计量资料不成正态分布采用中位数(范围)[M(Min~Max)]表示,组间比较采用Mann-Whitney U检验,各指标间的相关性分析采用Pearson相关因素分析,P < 0.05为差异有统计学意义。
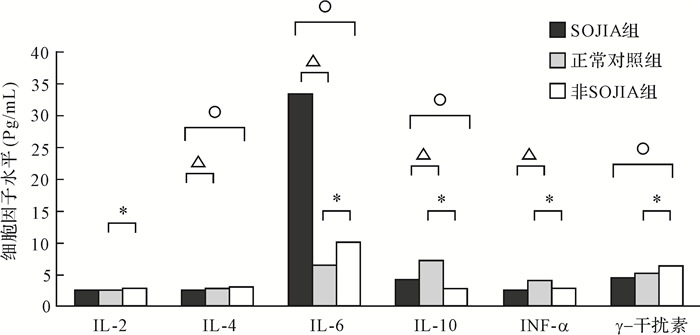
2 结果 2.1 非SOJIA患儿血清Th1/Th2细胞因子分析与正常对照组比较,非SOJIA组IL-2、IL-6、γ干扰素升高[分别2.9(1.0~7.4)与2.6(1.1~4.8)pg/mL、9.9(1.5~224.4)与6.4(2.8~26.6) pg/mL、6.3(2.2~17.6)与5.1 (1.9~12.3)pg/mL,均P < 0.05],IL-10、TNF-α降低[2.9(1.1~14.0)与7.1(3.4~20.5) pg/mL、 2.7(1.0~10.5)与3.9(1.7~13.1)pg/mL,均P < 0.01)],IL-4水平差异无统计学意义(P>0.05);SOJIA组IL-6升高[33.5(1.9~5000.0)与6.4(2.8~26.6)pg/mL],P < 0.01),IL-4、IL-10、TNF-α降低[2.3 (0.6~5.6)与2.9 (1.9~12.3)pg/mL,P < 0.05;4.1(1.1~14.0)与7.1(3.4~20.5) pg/mL,P < 0.01; 2.6(1.0~80.3)与3.9(1.7~13.1)pg/mL,P < 0.05]。与SOJIA组比较,非SOJIA组IL-6、IL-10降低[9.9(1.5~224.4)与33.5(1.9~5000.0)pg/mL、2.9(1.1~14.0)与[4.1(1.1~14.0) pg/mL,均P < 0.01],IL-4、γ干扰素升高[3.1 (0.4~7.1)与2.3 (0.6~5.6) pg/mL、6.3(2.2~17.6)与4.4(1.4~329.6) pg/mL,均P < 0.05],IL-2、TNF-α差异无统计学意义(均P>0.05)。见图 1。与正常对照组比较,非SOJIA组患儿IL-4/γ干扰素比值减小,差异有统计学意义(P < 0.01)。
|
| 非SOJIA组与正常对照组比较,*P < 0.05;SOJIA组与正常对照组比较,P < 0.05;非SOJIA组与SOJIA组比较,P < 0.05. 图 1 非SOJIA、SOJIA患儿血清Th1/Th2细胞因子水平分析 Fig. 1 Comparison of serum Th1/Th2 cytokine levels in non-SOJIA and SOJIA patients |
与少关节炎型比较,附着点炎型、多关节炎型患儿血清IL-6水平较高,差异有统计学意义(均P < 0.05),各亚型其余细胞因子水平差异无统计学意义。见表 1。
| [M(Min~Max),pg/mL)] | |||||||
| 亚型 | n | IL-2 | IL-4 | IL-6 | IL-10 | TNF-α | γ干扰素 |
| 多关节炎型 | 11 | 3.4(1.0~7.3) | 3.2(1.7~4.3) | 11.0(1.5~45.5)# | 3.0(2.4~14.0) | 2.6(1.0~10.5) | 6.2(2.2~17.6) |
| 少关节炎型 | 10 | 2.7(2.3~6.7) | 2.9(2.2~8.8) | 4.2(2.2~6.6) | 3.6(1.6~5.8) | 2.7(1.0~4.4) | 6.3(5.0~12.0) |
| 附着点炎型 | 21 | 2.9(1.0~7.4) | 3.1(1.8~5.1) | 12.7(3.8~224.4)* | 2.5(1.1~9.9) | 2.9(1.0~9.8) | 7.1(3.2~17.3) |
| 附着点炎型与少关节炎型比较,* P < 0.05;多关节炎型与少关节炎型比较,# P < 0.05. | |||||||
附着点炎型患儿血清IL-6、γ干扰素水平与超敏反应蛋白呈正相关,其余细胞因子与红细胞沉降率、超敏C反应蛋白相关性不明显。见表 2。
| 组别 | n | IL-2 | IL-4 | IL-6 | IL-6 | TNF-α | γ干扰素 | |||||||
| r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | |||
| 多关节炎型 | 11 | CRP | 0.721 | 0.019 | -0.442 | 0.201 | -0.320 | 0.367 | 0.413 | 0.236 | 0.306 | 0.390 | 0.436 | 0.208 |
| ESR | 0.563 | 0.090 | -0.688 | 0.028 | -0.093 | 0.799 | -0.117 | 0.747 | -0.419 | 0.228 | 0.286 | 0.422 | ||
| 少关节炎型 | 10 | CRP | -0.308 | 0.420 | -0.279 | 0.466 | -0.202 | 0.603 | -0.355 | 0.348 | -0.025 | 0.294 | -0.394 | 0.949 |
| ESR | -0.146 | 0.709 | -0.042 | 0.915 | -0.060 | 0.827 | -0.559 | 0.117 | -0.441 | 0.239 | -0.437 | 0.235 | ||
| 附着点炎型 | 20 | CRP | -0.086 | 0.734 | 0.357 | 0.145 | 0.801 | 0 | 0.370 | 0.131 | 0.445 | 0.064 | 0.487 | 0.040 |
| ESR | -0.479 | 0.044 | 0.325 | 0.188 | 0.307 | 0.215 | -0.148 | 0.557 | -0.381 | 0.119 | 0.284 | 0.253 | ||
| CRP:超敏C反应蛋白,ESR:红细胞沉降率. | ||||||||||||||
Th1/Th2是体内最为经典的辅助性T细胞。Th1分泌的细胞因子主要包括γ干扰素、IL-2、IL-6、IL-12、TNF-α等,Th2分泌的细胞因子主要包括IL-4、IL-5、IL-10、IL-13等。已有研究表明,类风湿关节炎发病机制与Th1/Th2失衡以及Th17分泌的细胞因子IL-17等密切相关[4-7]。而关于JIA尤其是非SOJIA患儿Th1/TH2细胞因子水平的特点少有报道。本文研究结果提示,非SOJIA组患儿IL-6、IL-10低于SOJIA组,但血清IL-2、IL-6、γ干扰素水平高于正常对照组;而血清TNF-α、IL-10水平不但没有升高,反而低于正常对照组。另外,IL-6水平在不同亚型非SOJIA患儿之间存在差异,以附着点炎型最高,多关节炎型次之,少关节炎型较低;其中附着点炎型非SOJIA患儿IL-6、TNF-α水平与超敏C反应蛋白呈正相关。
IL-6由单核细胞、T淋巴细胞及纤维母细胞产生。IL-6不但能诱导肝细胞产生急性期蛋白,激活补体,诱导促炎性细胞因子释放, 刺激中性粒细胞趋化, 加强炎性反应,还可以诱导B淋巴细胞分化和产生抗体,介导类风湿关节炎患者产生自身抗体和类风湿因子[8]。目前人源化IL-6受体拮抗剂在类风湿关节炎和SOJIA患者的有效应用,进一步证实了IL-6在类风湿关节炎及SOJIA发病机制中的作用[9],这与本研究中SOJIA患儿IL-6水平升高相符。本研究结果还显示,非SOJIA患儿外周血中IL-6表达水平升高,与Stagi等[10]报道一致;并且外周血中IL-6表达水平以附着点炎型最高,多关节炎型次之,少关节炎型较低,其中附着点炎型非SOJIA患儿IL-6水平与超敏C反应蛋白呈正相关。临床上,附着点炎型和多关节炎型患儿急性活动期除关节症状外,常有发热、乏力、倦怠等全身症状,以及超敏C反应蛋白、红细胞沉降率等炎症指标的升高,表明IL-6可能参与非SOJIA的发病机制,非SOJIA患儿外周血IL-6水平的高低对估计病情活动可能有一定帮助。这也提示针对IL-6受体的拮抗剂有望用于非SOJIA的治疗,尤其是附着点炎型和多关节炎型JIA。
TNF-α主要由单核巨噬细胞产生,是具有多项生物学效应的细胞因子。TNF-α可通过促进破骨细胞的生成,提高破骨细胞的活性和/或延长破骨细胞的存活期,在类风湿关节炎局灶性骨侵蚀的发病机制中起重要作用。类风湿关节炎滑膜组织细胞可以产生大量IL-1和TNF-α等细胞因子。JIA关节液TNF-α浓度明显高于血清TNF-a水平[11-15]。近年来,针对TNF-α受体融合蛋白抑制剂或TNF-α单克隆抗体治疗类风湿关节炎或JIA已取得一定疗效,能明显改善类风湿关节炎或JIA症状,减轻疾病活动[15]。但是,本研究结果却显示,非SOJIA组患儿血清TNF-α水平并没有上升,反而低于正常对照组,原因尚不明确。推测可能与血清TNF半衰期仅有数分钟[16]有关。本研究结果结合文献表明,JIA患儿血清TNF-α水平并不能代表滑膜或关节液TNF-α浓度,血清TNF-α水平不能作为TNF-α拮抗剂治疗JIA的参考指标。
γ干扰素主要参与Th1细胞介导的免疫应答,γ干扰素活性增加可致关节局部出现炎症反应。在本研究中,非SOJIA组的γ干扰素较正常对照组升高,IL-4变化不大,IL-4/γ干扰素比值降低。结合Wedderburn等[17]报道多关节炎型或少关节炎型JIA患儿滑膜液IL-4/γ干扰素比值较外周血降低的结果,提示非SOJIA存在Th1/Th2免疫失衡,其中Th1细胞占优势。
作为Th2细胞相关细胞因子,IL-4通过提高mRNA降解率来抑制促炎性细胞因子的合成,抑制TNF-α、IL-6、IL-8的活性,控制炎症反应,具有保护软骨和关节下骨及其他关节组织完整性的作用[18]。IL-10具有免疫抑制和抗炎作用,通过下调巨噬细胞的抗原提呈功能,从而抑制Thl细胞产生细胞因子(TNF-α、IL-2、γ干扰素)及前列腺素E2[19]。虽然IL-10也可通过多种方式提高B淋巴细胞的活性,分泌多种抗体,但在类风湿关节炎疾病模型中,IL-10主要起免疫抑制作用[20]。本研究结果显示,非SOJIA患儿血清IL-4水平变化不明显,而IL-10水平下降,表明IL-10减少可能与JIA发病有关,具体机制有待进一步研究。
综上所述,虽然非SOJIA患儿血清IL-6、IL-10水平较SOJIA低,但非SOJIA患儿血清IL-6、γ干扰素、IL-2高于正常对照组,而IL-10和TNF-α低于正常对照组,存在Th1/Th2细胞因子失衡、Th1细胞占优势的特点。而且,附着点炎型、多关节炎型非SOJIA患儿血清IL-6水平高于少关节炎型SOJIA患儿,提示IL-6可能参与非SOJIA的发病机制。本研究尚存在一定局限性,如病例数有限,由于标本来源困难无法检测治疗后、关节滑膜液细胞因子浓度等,因此,上述结论有待将来更大样本及更深入的研究证实。
| [1] | 何晓琥. 幼年特发性关节炎——国际风湿病学会联盟新分类标准讨论稿[J]. 中华儿科杂志, 2002, 40 (4) : 65–66. HE Xiaohu. Juvenile idiopathic arthritis, new classification standard discussion of the rheumatism association international union[J]. Chinese Journal of Pediatrics, 2002, 40 (4) :65–66. (in Chinese) |
| [2] | LIN Y T, WANG C T, GERSHWIN M E. The pathogenesis of oligoarticular/polyarticular vs systemic juvenile idiopathic arthritis[J]. Autoimmun Rev, 2011, 10 (8) :482–489. doi:10.1016/j.autrev.2011.02.001 |
| [3] | NIRMALA N, GROM A, GRAM H. Biomarkers in systemic juvenile idiopathic arthritis: a comparison with biomarkers in cryopyrin-associated periodic syndromes[J]. Curr Opin Rheumatol, 2014, 26 (5) :543–552. doi:10.1097/BOR.0000000000000098 |
| [4] | 郭莉, 卢美萍, 汤永民, 等. 新发活动期全身型幼年特发性关节炎血清细胞因子水平分析[J]. 中国当代儿科杂志, 2014, 16 (12) : 1241–1244. GUO Li, LU Meiping, TANG Yongmin, et al. Serum cytokine levels in children with newly diagnosed active systemic juvenile idiopathic arthritis[J]. Chinese Journal of Contemporary Pediatrics, 2014, 16 (12) :1241–1244. (in Chinese) |
| [5] | DOODES P D, CAO Y, HAMEL K M, et al. IFN-gamma regulates the requirement for IL-17 in proteoglycan-induced arthritis[J]. J Immunol, 2010, 184 (3) :1552–1559. doi:10.4049/jimmunol.0902907 |
| [6] | NIU Q, CAI B, HUANG Z C, et al. Disturbed Th17/Treg balance in patients with rheumatoid arthritis[J]. Rheumatolo Int, 2012, 32 (9) :2731–2736. doi:10.1007/s00296-011-1984-x |
| [7] | LUBBERTS E. Role of T lymphocytes in the development of rheumatoid arthritis. Implications for treatment[J]. Curr Pharm Des, 2015, 21 (2) :142–146. |
| [8] | NISHIMOTO N, KISHIMOTO T. Intedeukin 6:from bench to bedside[J]. Nat Clin Pract Rheumatol, 2006, 2 (11) :619–626. doi:10.1038/ncprheum0338 |
| [9] | YOKOTA S, TANAKA T, KISHIMOTO T. Efficacy, safety and tolerability of tocilizumab in patients with systemic juvenile idiopathic arthritis[J]. Ther Adv Musculoskelet Dis, 2012, 4 (6) :387–397. doi:10.1177/1759720X12455960 |
| [10] | STAGI S, CAVALLI L, SIGNORINI C, et al. Bone mass and quality in patients with juvenile idiopathic arthritis: longitudinal evaluation of bone-mass determinants by using dual-energy X-ray absorptiometry, peripheral quantitative computed tomography, and quantitative ultrasonography[J]. Arthritis Res Ther, 2014, 16 (2) :R83. doi:10.1186/ar4525 |
| [11] | OSTA B, BENEDETTI G, MIOSSEC P. Classical and paradoxical effects of TNF-α on bone homeostasis[J]. Front Immunol, 2014, 13 (5) :48. |
| [12] | MCINNES I B, BUCKLEY C D, ISAACS J D. Cytokines in rheumatoid arthritis-shaping the immunological landscape[J]. Nat Rev Rheumatol, 2016, 12 (1) :63–68. |
| [13] | GRAVALLESE E M, GOLDRING S R. Cellular mechanisms and the role of cytokines in bone erosions in rheumatoid arthritis[J]. Arthritis Rheum, 2000, 43 (10) :2143–2151. doi:10.1002/(ISSN)1529-0131 |
| [14] | MAKHIJA R, KINGSNORTH A N. Cytokine storm in acute pancreatitis[J]. J Hepatobiliary Pancreat Surg, 2002, 9 (4) :401–410. doi:10.1007/s005340200049 |
| [15] | 尹薇, 丁艳, 刘凡, 等. 幼年特发性关节炎患儿基质金属蛋白酶及细胞因子的改变及意义[J]. 中华风湿病学杂志, 2013, 17 (9) : 601–605. YIN Wei, DING Yan, LIU Fan, et al. Changes of matrix metalloproteinase angcytokin-es and its clinical significance in children with juvenile idiopathic arthritis[J]. Chinese Journal of Rheumatology, 2013, 17 (9) :601–605. (in Chinese) |
| [16] | TRACEY D, KLARESKOG L, SASSO E H, et al. Tumor necrosis factor antagonist mechanisms of action: a comprehensive review[J]. Pharmacol Ther, 2008, 117 (2) :244–279. doi:10.1016/j.pharmthera.2007.10.001 |
| [17] | WEDDERBURN L R, ROBINSON N, PATEL A, et al. Selective recruitment of polarized T cells expressing CCR5 and CXCR3 to the inflamed joints of children with juvenile idiopathic arthritis[J]. Arthritis Rheum, 2000, 43 (4) :765–774. doi:10.1002/1529-0131(200004)43:4<765::AID-ANR7>3.0.CO;2-B |
| [18] | LUBBERTS E, JOOSTE L A, CHABAUD M, et al. IL-4 gene therapy for collagen arthritis suppresses synovial IL-17 and osteoprotegerin ligand and prevents bone erosion[J]. J Clin Invest, 2000, 105 (12) :1697–1710. doi:10.1172/JCI7739 |
| [19] | SABAT R, GRVTZ G, WARSZAWSKA K, et al. Biology of interleukin-10[J]. Cytokine Growth Factor Rev, 2010, 21 (5) :331–344. doi:10.1016/j.cytogfr.2010.09.002 |
| [20] | COHEN S B, KATSIKIS P D, CHU C Q, et al. High level of interleukin-10 production by the activated T cell population within the rheumatoid synovial membrane[J]. Arthritis Rheum, 1995, 38 (7) :946–952. doi:10.1002/(ISSN)1529-0131 |




