2. 中山大学附属中山医院新生儿科, 广东 中山 528403 ;
3. 深圳市儿童医院新生儿科, 广东 深圳 518000
2. Department of Neonate, Zhongshan People's Hospital Affiliated to Sun Yat-sen University, Zhonshan 528403, China ;
3. Department of Neonate, Shenzhen Children's Hospital, Shenzhen 518000, China
在胎儿期,有一条连接主动脉弓和肺动脉的动脉导管,是一条胎儿循环正常通道。依靠循环血液的低氧合和胎盘产生的大量前列腺素E2、前列腺素I2等激素,胎儿时期的动脉导管保持在持续开放的状态。然而出生后,新生儿血液循环的氧分压明显上升,胎盘剥离后血液中前列腺素E2、前列腺素I2浓度急剧下降,导致新生儿动脉导管平滑肌发生痉挛收缩,在出生后较短时间内(一般是在10~15 h)发生功能性的关闭。如果出生后动脉导管持续开放,超过72 h不发生关闭称为动脉导管未闭(patent ductus arteriosus,PDA)[1]。PDA是新生儿最为常见的先天性心脏病之一(占先天性心脏病总发病数的10%),尤其是在早产儿这个特殊的群体,PDA发病率更高,出生时体质量小于1000 g的早产儿发生PDA概率高达55%[2-3]。早产儿心肺循环的毛细血管通透性高,PDA早产儿的脑血管发育不成熟,再加上有些早产儿的心功能储备欠佳,导致了早产儿脑白质损伤、脑室周围白质软化的发生风险增加[4]。
然而,并不是所有的PDA都会有病理性的影响,大量文献表明,具有血流动力学的PDA(hemodynamic significant PDA,hsPDA)才会造成病理生理的改变[5],从而导致有关并发症的发生,这种情况才需要内科或者手术治疗。因为新生儿囟门尚未闭合,病情变化快,又不易搬动等,动态监测颅脑超声显像变化可作为早期及时诊断早产儿脑白质损伤的一种有效手段[6-7];同时神经元特异性烯醇化酶(neuron specific enolase,NSE)是一种神经损伤的特异性标志物,它在血清中的水平可反映神经细胞的死亡数量[8],动态监测血清NSE水平变化也是判断早产儿脑白质损伤的可靠方法[9]。为了探讨PDA早产儿脑白质损伤发生的情况,以期为hsPDA早产儿脑白质损伤发生的诊断以及预防提供相关依据,本研究通过动态监测hsPDA早产儿的颅脑超声显像灰度值及血清NSE水平变化,观察hsPDA对早产儿脑白质损伤发生的影响。
1 对象与方法 1.1 病例来源及诊断标准2012年8月至2014年9月期间于中山大学附属中山医院新生儿科住院治疗的胎龄小于37周的患儿,根据病史、临床表现及辅助检查结果排除患儿严重感染、重度窒息病史、明显先天性畸形,根据彩色心脏超声心动图显像检查排除患儿肺动脉高压和/或如室间隔缺损等其他类型的先天性心脏病。
PDA诊断标准:超声检查提示有动脉导管水平异常分流束的视为PDA。可分为仅存在收缩期左向右分流的PDA;收缩期和舒张期均存在分流(出现这种情况说明分流量大);由右向左分流(此时病情严重,提示存在肺动脉高压)[10]。hsPDA定义:①动脉导管内径大于1.5 mm;②存在左向右分流;③左心房与主动脉根部内径比值超过1.3;④存在双向(左向右及右向左)双期(收缩期及舒张期)分流[11]。
1.2 分组hsPDA组:同期早产儿35例,出生后24 h、3 d、7 d、14 d监测床边心脏彩色多普勒超声,结果PDA内径≥1.5 mm,伴有心脏杂音、心动过速等,剔除期间患儿动脉导管闭合者;非hsPDA组:同期早产儿35例,出生后24 h、3 d、7 d、14 d监测床边心脏彩色多普勒超声,结果PDA内径小于1.0 mm,而且听诊无心脏杂音,无心动过速等异常临床表现;对照组:同期早产儿36例,出生后24 h根据床边心脏彩色多普勒超声检查证实无动脉导管开放。
三组患儿在例数、性别构成比、出生体质量、出生后阿氏评分以及纠正胎龄上的差别均无统计学意义(均P > 0.05)。纳入患儿均告知其父母亲试验相关情况,征得其同意并签署知情同意书。hsPDA组与非hsPDA组出生后24 h超声心动图显像结果:两组患儿动脉导管长度及内径差异无统计学意义,而血流速度及左心房/主动脉内径比值差异有统计学意义,见表 1。说明是否存在血流动力性改变主要受动脉导管血流速度及左心房/主动脉内径比值的影响。
| (x±s) | |||||
| 组别 | n | 动脉导管 | 左心房/主动脉内径比值 | ||
| 长度(cm) | 内径(cm) | 血流速度(cm/s) | |||
| hsPDA组 | 35 | 3.8±1.1 | 5.5±1.3 | 3.8±1.3 | 1.44±0.1 |
| 非hsPDA组 | 35 | 3.9±0.9 | 5.8±0.6 | 1.3±0.3 | 1.10±0.9 |
| P值 | >0.05 | >0.05 | <0.01 | <0.01 | |
分别于出生后3 d、7 d、14 d采集三组患儿右侧桡动脉血2 mL,分离后取上清液冷冻保存,统一检测。所有标本的检测均采用ELISA法。
1.4 颅脑超声动态监测脑白质灰度值使用GE 730超声检测仪,采用扇形小突阵探头,探头频率为5~9 mHz,于出生后3 d、7 d、14 d分别对三组患儿进行颅脑超声检查,应用医学图像分析软件截取侧脑室前角和体部周围、三角区和枕角周围和颞角周围脑白质显像灰度值,取各部位平均值。
1.5 心脏彩色超声心动图显像检测动脉导管使用HP 4500超声检测仪,探头频率8 MHz,检测动脉导管长度、内径、血流速度及左心房/主动脉内径比值差异。
1.6 统计学方法所有数据均采用SPSS 13.0统计软件进行统计学分析,运用重复测量设计方差分析和直线相关性分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 三组出生后3 d、7 d、14 d颅脑超声显像及侧脑室灰度值比较三组患儿出生后3 d、14 d侧脑室超声显像见图 1。
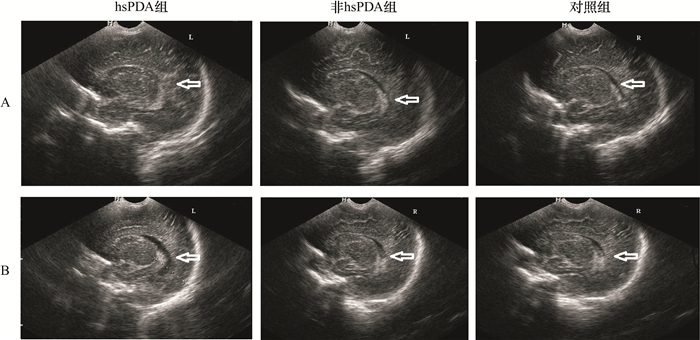
|
| A:出生后3 d,hsPDA组脑室周围脑实质回声增强,脑室变窄(箭头所示);非hsPDA组与对照组脑室周围脑实质回声未见异常,脑室大小正常(箭头所示).B:出生后14 d,hsPDA组脑室周围脑实质回声增强范围增大,脑室稍增宽(箭头所示);非hsPDA组与对照组脑室周围脑实质回声及脑室大小未见明显改变(箭头所示). 图 1 三组患儿出生后3 d、14 d颅脑超声显像 Fig. 1 Of ultrasound images of the 3 groups on d3 and d14 after birth |
hsPDA与对照组早产儿出生后3 d、7 d、14 d侧脑室显像灰度值差异均有统计学意义(均P < 0.01),非hsPDA与对照组早产儿出生后3 d、7 d、14 d侧脑室显像灰度值差异均无统计学意义(均P > 0.05)。见表 2。提示hsPDA存在脑实质损伤,而非hsPDA不一定存在脑白质病理生理改变。
| (x±s) | ||||
| 组别 | n | 3 d | 7 d | 14 d |
| hsPDA组 | 35 | 124.33±9.32* | 125.49±9.50* | 130.00±9.39* |
| 非hsPDA组 | 35 | 100.08±4.02 | 99.12±7.54 | 97.08±8.49 |
| 对照组 | 36 | 98.65±3.77 | 97.53±3.79 | 95.08±4.06 |
| 与对照组比较,* P < 0.01. | ||||
hsPDA组与对照组出生后3 d、7 d、14 d血清NSE差异均有统计学意义(均P < 0.01),非hsPDA组与对照组出生后3 d、7 d、14 d血清NSE差异均无统计学意义(均P > 0.05)。见表 3。提示hsPDA会造成神经细胞坏死,而非hsPDA不一定造成神经细胞病理改变。
| (x±s,ng/mL) | ||||
| 组别 | n | 3 d | 7 d | 14 d |
| hsPDA组 | 35 | 6.35±0.89* | 6.28±0.86* | 5.94±0.75* |
| 非hsPDA组 | 35 | 4.90±0.89 | 4.35±0.86 | 4.04±0.75 |
| 对照组 | 36 | 4.70±0.36 | 4.31±0.29 | 4.14±0.30 |
| 与对照组比较,* P < 0.01. | ||||
两组患儿动脉导管血流速度分别为(3.8±1.3) cm/s和(1.3±0.3) cm/s。将两组PDA血流速度值与侧脑室超声显像灰度值进行直线相关性分析,结果两者呈正相关(r=0.876,P < 0.01),提示PDA开放时,血流速度越大对脑白质损伤越大。
3 讨论新生儿PDA临床症状不典型,尤其早产儿心脏体征少而且性质多变,杂音不明显,给早期临床诊断带来困难。床边心脏彩色多普勒检查能够很好地观察心脏以及大血管结构,检测血流动力学变化以及心功能等情况,而且具有方便、快捷无创等诸多优点,是目前早期诊断早产儿PDA的重要手段[10-11]。PDA患儿是否存在血流动力性改变主要受动脉导管血流速度及左心房/主动脉内径比值的影响。本研究结果提示血流速度值与侧脑室超声显像灰度值呈正相关,说明PDA开放时,血流速度越大对脑白质损伤越大。
颅脑超声检查是一种很好的可以连续监测新生儿大脑变化的工具[7]。它不仅可以监测到脑室系统脑白质还能监测到脑室周围脑白质,不仅可以监测到皮质下脑白质还可以监测到深层灰质以及小脑的变化[12]。颅脑超声检查在早期就可以发现脑室旁白质损伤[9]。De Vries等[13]研究结果显示,脑白质强回声是否在一定时期内恢复正常,一定程度上体现了脑白质损伤的轻重程度。脑白质损伤的轻重程度与强回声部位是否出现囊性改变、强回声涉及面积的大小和部位密切相关。颅脑超声是早产儿脑白质损伤最实用的早期诊断手段。而NSE由三种具有特殊免疫特性的亚单位α、β、γ组成[14],其中亚单位二聚体γ系神经胶质细胞所特有,而γ-烯醇化酶则存在于神经细胞及神经内分泌组织中。有研究表明,血清中所释放的NSE水平与神经细胞的死亡数量呈正相关[14]。颅脑超声显像可以了解病变部位形态学改变,而血清NSE水平则反映了神经细胞的死亡数量。本研究显示,hsPDA患儿超声显像侧脑室灰度值及血清NSE水平hsPDA患儿高于对照组,非hsPDA患儿与对照组接近,可见hsPDA会造成脑白质的病理生理改变。因此,hsPDA患儿颅脑超声显像和血清NSE检测结果均提示存在脑白质损伤。
本研究结果提示具有血流动力学改变的动脉导管开放会造成神经细胞坏死、脑白质损伤;而没有血流动力学的动脉导管开放不一定造成脑白质病理生理改变。当动脉导管开放时,血液单向或双向分流显著增多,有效循环血量减少,导致早产儿脑血流灌注明显减少,造成脑神经缺血缺氧性改变以及血流动力学变化带来的再灌注性损伤,最终导致脑白质损伤。在病变早期,仅仅存在轻微的病理生理学改变,比如神经细胞水肿。如果此时能给予患儿积极的治疗,可以使这些轻微的损伤成为可逆性损害,不发生严重神经性损伤,大大减少后遗症的发生[11]。hsPDA持续时,新生儿(尤其是早产儿)脑白质损伤进行性加重,早产儿脑血管自我调控能力差、对缺氧敏感,hsPDA持续时间越长,患儿脑部受低氧血症、低灌注、缺血再灌注损害以及血栓栓塞等影响越重,逐渐变为不可逆性脑白质损伤。故hsPDA患儿需要早期积极正确的干预,尽早促使动脉导管的关闭,保证脑的有效循环灌注,减少脑神经缺血缺氧性改变以及再灌注性损伤,从而减少脑白质损伤发生。而非hsPDA患儿可先定期监测颅脑超声显像和血清NSE水平。
| [1] | HEO M J, LEE O S, LIM S C. Comparative evaluation for the use of oral ibuprofen and intravenous indomethacin in Korean infants with patent ductus[J]. Arch Pharm Res, 2012, 35 (9) :1673–1683. doi:10.1007/s12272-012-0919-8 |
| [2] | RICHARDS J, JOHNSON A, FOX G, et al. A second course of ibuprofen is effective in the closure of a clinically significant PDA in ELBW infants[J]. Pediatrics, 2009, 124 (2) :e287–e293. doi:10.1542/peds.2008-2232 |
| [3] | KOCH J, HENSLEY G, ROY L, et al. Prevalence of spontaneous closure of the ductus arteriosus in neonates at a birth weight of 1000 gramsor less[J]. Pediatrics, 2006, 117 (4) :1113–1121. doi:10.1542/peds.2005-1528 |
| [4] | SOUL J S, ROBERTSON R L, WYPIJD C, et al. Subtle hemorrhagic brain injury is associated with neuro developmental impairment in infants with repaired congenital heart disease[J]. J Thorac Cardiovasc Surg, 2009, 138 (2) :374–381. doi:10.1016/j.jtcvs.2009.02.027 |
| [5] | 冯琪, 李源, 王颖, 等. 早产儿动脉导管未闭的临床研究[J]. 实用儿科临床杂志, 2005 (2) : 129–131. FENG Qi, LI Yuan, WANG Ying, et al. Clinical investigation on patent ductus arteriosus of premature infants[J]. Journal of Applied Clinical Pediatrics, 2005 (2) :129–131. (in Chinese) |
| [6] | VAN WEZEI-MEIJLER G, STEGGERDA S J, LEIJSER L M. Cranial ultrasonography in neonates:role and limitations[J]. Semin Perinatol, 2010, 34 (1) :28–38. doi:10.1053/j.semperi.2009.10.002 |
| [7] | 周丛乐, 汤泽中. 三维超声在新生儿颅脑疾病诊断中的价值[J]. 临床儿科杂志, 2006, 24 (11) : 863–865. ZHOU Congle, TANG Zezhong. Diagnostic value of three-dimensional ultrasoundral in neonatal cerebral disorders[J]. Journal of Clinical Pediatrics, 2006, 24 (11) :863–865. (in Chinese) |
| [8] | DAVAL J L, POURIE G, GROJEAN S, et al. Neonatal hypoxia triggers transient apoptosis followed by neurogenesis in the rat CA1 hippocampus[J]. Pediatr Res, 2004, 55 (4) :561–567. doi:10.1203/01.PDR.0000113771.51317.37 |
| [9] | 陆俊秀, 陈敬国, 陈海燕, 等. 颅脑超声与血清NSE对早产儿脑白质损伤的诊断价值及二者相关性分析[J]. 临床儿科杂志, 2012, 30 (9) : 840–844. LU Junxiu, CHEN Jingguo, CHEN Haiyan, et al. Diagnostic value and correlation analysis of ultrasound and neuron-specific enolase in premature infant with white matter damage[J]. Journal of Clinical Pediatrics, 2012, 30 (9) :840–844. (in Chinese) |
| [10] | SKINNER J. Diagnosis of patent ductu sarteriosus[J]. Semin Neonatol, 2001, 6 (1) :49–61. doi:10.1053/siny.2000.0037 |
| [11] | LINS H, WALLESCH C W, WUNDERLICH M T. Sequential analyses of neurobiochemical markers of cerebral damage in cerebrospinal fluid and serum in CNS infections[J]. Acta Neurol Scand, 2005, 112 (5) :303–308. doi:10.1111/ane.2005.112.issue-5 |
| [12] | BROUWER M J, DE VRIES L S, PISTORIUS L, et al. Ultrasound measurements of the lateral ventricles in neonates:why, how and when? A systematic review[J]. Acta Paediatr, 2010, 99 (9) :1298–1306. doi:10.1111/j.1651-2227.2010.01830.x |
| [13] | DE VRIES L S, GROENENDAAL F. Patterns of neonatal hypoxic-ischaemic brain injury[J]. Neuroradiology, 2010, 52 (6) :555–566. doi:10.1007/s00234-010-0674-9 |
| [14] | HONDA M, TSURUTA R, KANEKO T, et al. Serum glial fibrillary acidic protein is a highly specific biomarker for traumatic brain injury in humans compared with S-100B and neuron-specific enolase[J]. J Trauma, 2010, 69 (1) :104–109. doi:10.1097/TA.0b013e3181bbd485 |




