动作电位是神经信息编码的基本单元,根据其发放频率和发放模式的不同,可以编码多种信息[1]。动作电位的发放特征决定了神经元的输入和输出功能,对神经元环路的功能起到非常重要的作用。例如,不同动作电位的发放模式可以编码不同的刺激强度,而不同的刺激强度代表了不同的信息。因此,了解动作电位发放模式的特征对认识神经信息的编码规律至关重要。在成年小鼠神经元中,神经元的动作电位主要包含四种发放模式:强直发放(tonic firing)、阶段性发放(phasic firing)、延迟发放(delay firing)和单个发放(single spike)[2-4]。当给予神经元去极化脉冲时,在整个脉冲过程表现为持续发放的为强直发放,仅在电流注入的开始发放数个动作电位的为阶段性发放,在电流注入的始端出现动作电位的延迟发放为延迟发放,仅在去极化电流始端发放一个动作电位的为单个发放。一些报道发现在小鼠皮层神经元中存在“规则发放”和“不规则发放”[5-7],其发放特点对应于强直发放和单个发放。目前尚没有关于新生小鼠中神经元动作电位发放模式在电生理特性上的研究报道。本研究采用全细胞膜片钳技术,采用出生后3 d的小鼠急性全脑组织切片标本观察皮层神经元的主动和被动膜电学特性,并根据动作电位的发放模式将神经元分为三类,进而观察了不同动作电位发放模式在神经元电学特性上的差异, 以期为进一步探究皮层神经元动作电位发放模式的形成机制及兴奋编码机制的研究提供实验依据。
1 材料与方法 1.1 材料及仪器清洁级C57/B6J小鼠购自上海斯莱克公司。雌雄不拘,小鼠在明暗12 h交替、温度25 ℃、湿度≥40%的环境中饲养。实验用河豚毒素购自北京百灵威科技有限公司;三磷酸腺嘌苷二钠、三磷酸鸟苷三钠、4-羟乙基哌嗪乙磺酸(HEPES)和乙二醇双(2-氨基乙基醚)四乙酸(EGTA)均购自美国西格玛(Sigma)公司;木防己毒素购自英国Tocris公司。
红外相差显微镜(WI-RSH)购自日本奥林巴斯(Olympus)公司;毛细玻璃电极毛坯(B150-86-7.5)购于美国Havard公司;铂金丝购于美国W.P.I.公司;震动切片机(1000 plus)购于美国Vibrotome公司;电极拉制仪(P-97)购于美国Sutter公司;PClamp 10.1记录分析软件、信号放大器(MultiClamp 700B)和Digidata 1440A数模转换器购自美国Molecular devices公司;Master-8可编程刺激器购自以色列A.M.P.I公司。
1.2 全脑组织切片制作将出生3 d的小鼠置于密闭罐中用异氟烷麻醉后断头取脑,将全脑置于持续充有5%二氧化碳和95%氧气的饱和人工脑脊液(含119 mmol/L氯化钠,2.5 mmol/L氯化钙,26.2 mmol/L碳酸氢钠,1.0 mmol/L磷酸二氢钠,1.3 mmol/L硫酸镁,11.0 mmol/L葡萄糖)的冰水混合物中冷却5 min,切片槽中提前倒入饱和人工脑脊液,并充入5%二氧化碳和95%氧气的混合气体。使用温控仪将切片槽温度控制在4 ℃以内。沿冠状面将脑干切除,然后将剩余的脑组织垂直粘在托盘上,并固定在切片槽中,从嗅球处往下切片,至出现脑室时开始收集切片,切片的厚度为300 μm。将切下的切片迅速移至混合气体与人工脑脊液形成的气液界面,25 ℃孵育2 h。
1.3 全细胞膜片钳记录孵育2 h后将切片从孵育槽移至记录槽中进行全细胞记录,用锚将脑片固定,使用蠕动泵持续灌流氧饱和的人工脑脊液,流速为2 mL/min。实验使用奥林巴斯红外相差显微可视系统记录,首先在低倍镜下定位到皮层区,再转至高倍水浸镜下找到切片表面。在切片表面选取表面光滑、形态呈锥形、无明显膨胀的神经元进行记录。使用玻璃微电极拉制仪分六步拉制玻璃微电极,电极电阻为4~6 MΩ。电极内液的成分为:115 mmol/L葡萄糖酸钾,20 mmol/L氯化钾,10 mmol/L氢氧化钾,2 mmol/L氯化镁,10 mmol/L 4-羟乙基哌嗪乙磺酸,0.4 mmol/L乙二醇双(2-氨基乙基醚)四乙酸,4 mmol/L三磷酸腺嘌苷二钠和1 mmol/L三磷酸鸟苷三钠,用氢氧化钾和葡萄糖酸调整酸碱度值至7.2,渗透浓度调整在290~310 mmol/L。电生理信号的采样率为10 kHz,噪音强度控制在5 pA以内。
1.4 神经元电生理特性的测量静息膜电位在破膜的一瞬间、电流I为0模式(即电流钳模式下不给予神经元电流输入)下得到。输入阻抗在电压钳模式下给予-20 mV过极化电压下得到。在电压钳模式下给予神经元一系列的去极化电压(-60~+30 mV,步进为10 mV)得到电压依赖性电流的发放情况。在电流钳模式下获得动作电位的发放情况,记录时若神经元的电位不在-60 mV则先给予神经元适量电流使其维持在-60 mV左右,然后再给予神经元一系列的去极化电流(0~200 pA,步进为20 pA),由此得到动作电位的发放情况[8]。分析在80 pA电流下的第一个动作电位发放的形态,包括上升时间(rise time)、幅值(amplitude)、阈值(threshold)、超极化后幅值(afterhyperpolarisation)和宽度(duration)。测量方法如图 1所示。阈值为上升相速度到达10 V/s的点对应的电压值[8],宽度为阈值点至动作电位过极化最低点的时间段,幅值为阈值至顶点的电压幅值,上升时间为从阈电位到峰值所用的去极化时间。系统的液接电位(liquid junction potential)为-20.4 mV,实验结果中的静息膜电位为加上液接电位后的值。
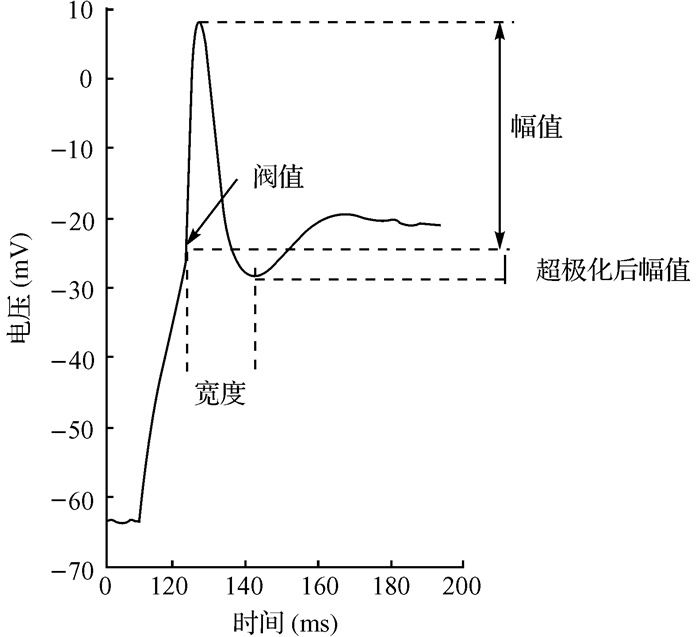
|
| 图 1 神经元动作电位的形态分析示例 Fig. 1 Example of morphology analysis of action potential |
使用SPSS 16.0软件对定量数据进行分析,数值以均数±标准差(x±s)表示。对不同发放模式在静息膜电位、输入阻抗、去极化电流阈值及动作电位形态的统计使用单因素方差分析,对不同发放模式在电压依赖性电流和动作电位发放数量上的统计使用双因素方差分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 皮层神经元动作电位发放模式及其对去极化电流阈值的影响给予神经元一系列的去极化电流后神经元动作电位的发放情况如图 2所示。在出生3 d的小鼠皮层神经元中存在三种类型的动作电位:强直发放(n=5)、阶段性发放(n=8)和单个发放(n=10)。其中n为记录到的样本数。强直发放神经元在给予80 pA电流时表现为在整个电流注入过程中动作电位发放间隔较为均匀, 阶段性发放仅在始端发放数个动作电位,单个发放仅在始端发放一个动作电位。
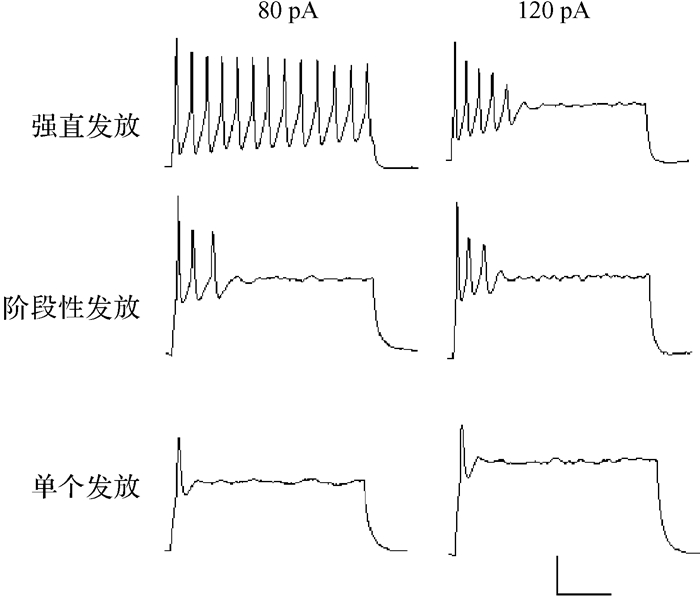
|
| 横标尺=100 ms,纵标尺=20 mV. 图 2 神经元动作电位发放模式 Fig. 2 Action potential firing patterns of cortical neurons |
比较三种神经元的去极化电流阈值,即首次诱发动作电位的电流值。单个发放神经元、阶段性发放神经元和强直发放神经元去极化电流阈值分别为(72.0±12.7) pA、(47.5±5.3) pA、(24.0±4.0) pA(P=0.018)。强直发放神经元的去极化电流阈值低于单个发放神经元(P=0.006)和阶段性发放神经元(P=0.019),阶段性发放神经元与单个发放神经元的去极化电流阈值差异无统计学意义(P=0.123)。
2.2 不同动作电位发放模式的神经元动作电位形态比较不同动作电位发放模式的神经元给予80 pA去极化电流时第一个动作电位的形态分析结果见表 1。其中单个发放神经元、阶段性发放神经元和强直发放神经元的上升时间、幅值、宽度和阈值有差异。其中单个发放神经元的上升时间长于阶段性发放神经元(P=0.015)和强直发放神经元(P=0.003);单个发放神经元的幅值大于阶段性发放神经元(P=0.041)和强直发放神经元(P=0.005);单个发放神经元的宽度大于强直发放神经元(P=0.003),阈值高于强直发放神经元(P=0.01)。三种动作电位在动作电位的超极化后幅值没有差异(P=0.763)。结果提示不同发放模式的神经元在动作电位形态上存在差异。
| (x±s) | ||||||
| 动作电位发放模式 | n | 上升时间(ms) | 幅值(mV) | 阈值(mV) | 宽度(ms) | 超极化后幅值(mV) |
| 强直发放 | 5 | 0.80±0.07** | 43.9±3.6** | -29.7±0.3** | 9.1±0.9** | 10.6±6.5 |
| 阶段性发放 | 8 | 1.09±0.15* | 35.5±5.7* | -23.4±1.3 | 12.2±1.3 | 14.6±3.8 |
| 单个发放 | 9 | 1.76±0.22## | 22.9±2.8## | -21.0±2.4## | 15.7±1.3## | 11.2±3.1 |
| F值 | 6.597 | 5.603 | 4.188 | 6.282 | 0.275 | |
| P值 | 0.007 | 0.012 | 0.031 | 0.008 | 0.763 | |
| 与单个发放神经元比较,* P < 0.05,** P < 0.01;与强直发放神经元比较,## P < 0.01. | ||||||
在电压钳下通过给予神经元一系列去极化电压观察神经元的电反应,结果如图 3所示。图 3A为不同动作电位类型的神经元电流反应的示例。图 3B显示具有不同动作电位类型的神经元电压依赖性瞬时内向电流的幅值有差异,神经元强直发放内向电流瞬时最强,其次是阶段性发放神经元,单个发放神经元最弱(P < 0.001)。三组两两比较皆有差异,其中瞬时内向电流强直发放神经元高于单个发放神经元(P < 0.001)和阶段性发放神经元(P=0.009),阶段性发放神经元又高于单个发放神经元(P=0.001)。图 3C显示具有不同动作电位类型的神经元在电压依赖性延迟外向电流的幅值上存在差异,外向电流强直发放神经元最高,然后是阶段性发放神经元和单个发放神经元(P < 0.001)。三组两两比较发现,强直发放神经元的持续外向电流高于单个发放神经元(P < 0.001),与阶段性发放神经元无差异(P=0.065),阶段性发放神经元的持续外向电流高于单个发放神经元(P=0.041)。结果表明,不同动作电位的发放模式的神经元电压依赖性内向电流和外向电流不同。
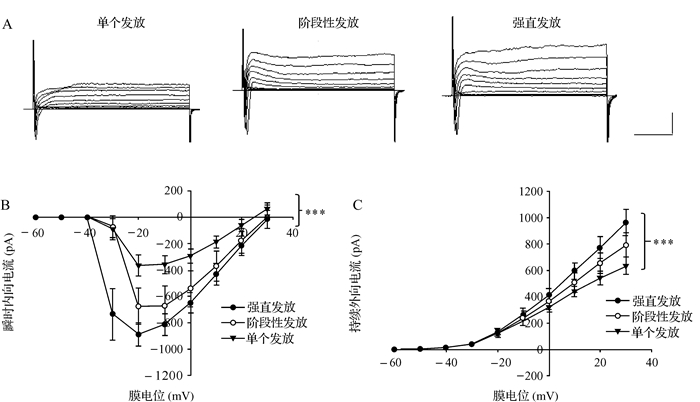
|
| A:不同动作电位发放模式的神经元在一系列去极化电压(-60~+30 mV,步幅为10 mV,时间为80 ms)下的电流原始反应图,横标尺=20 ms,纵标尺=500 pA. B:具有不同动作电位发放模式的神经元瞬时内向电流对比图.C:具有不同动作电位发放模式的神经元持续外向电流对比图.双因素方差分析,***P < 0.001. 图 3 不同动作电位发放模式神经元电压依赖性电流的差异 Fig. 3 The differences of action potential firing patterns in voltage-dependent current in postnatal 3-d cortical neurons |
通过观察神经元的输入阻抗和静息膜电位探究动作电位发放模式对神经元膜被动特性的影响,结果三种动作电位的发放模式神经元膜电位和输入阻抗差异均无统计学意义,见表 2。
| (x±s) | ||
| 指标 | 静息膜电位(mV) | 输入阻抗(MΩ) |
| 强直发放神经元 | -48.3±3.3 | 1.89±0.29 |
| 阶段性发放神经元 | -50.8±4.0 | 2.01±0.31 |
| 单个发放神经元 | -59.6±3.3 | 2.60±0.29 |
| F值 | 1.358 | 1.191 |
| P值 | 0.279 | 0.828 |
在不同电流注入时神经元动作电位的发放可能会表现出不同的模式,规定归类的顺序为强直发放>阶段性发放>单个发放,即该神经元在给予一系列去极化电流时若出现强直发放则认为是强直发放,若没有强直发放但有阶段性发放则认为是阶段性发放,单个发放则为在全部电流注入时仅出现一个动作电位的发放。强直发放在60 pA电流注入时发放数量较多,而在注入120 pA电流时发放数量没有增加反而减少,这可能是快速钠通道失活的缘故[4]。
本研究发现具有不同动作电位发放模式的神经元在神经元膜的主动特性如去极化电流阈值、动作电位形态、电压依赖性内向电流和外向电流方面均存在差异:①不同发放模式的神经元电压依赖性内向电流和外向电流的发放幅值从大到小排列依次为强直发放、阶段性发放和单个发放;②不同发放模式的神经元去极化电流阈值存在差异,此结果与成年鼠中的研究结果一致[9];③在不同发放模式的神经元动作电位形态分析中,上述三种神经元动作电位的上升时间、幅值、阈值和宽度不同,这一结果与成年小鼠中的研究结果一致[4, 9],其中宽度的结果与新生小鼠脊神经元研究一致[10];④不同发放模式的神经元静息膜电位和输入阻抗没有差异。
神经元受到去极化刺激导致电压依赖性钠通道快速激活和失活,使钠离子迅速内流产生内向电流[11]。灌流钠通道阻断剂河豚毒素后,电压依赖性瞬时内向电流消失,进一步证明了瞬时内向电流为河豚毒素敏感的钠通道介导的[7]。Ruddy等[12-13]研究发现电压依赖性持续外向电流可被钾通道阻断剂四甲基氯化铵阻断,即此电流为四甲基氯化铵敏感的延迟整流钾电流。延迟整流钾电流在去极化下迅速激活,但是在数秒后才失活,延迟了动作电位的发放,并参与动作电位的复极化。动作电位发放模式在电压依赖性电流方面的差异是由电压依赖性钠通道和钾通道引起的,这可能与钠通道和钾通道的分布及数量有关,如钠通道的密度越大,越靠近轴突则钠电流的幅值就越大[14]。不同动作电位发放模式在动作电位的阈值及形态上不同,说明不同神经元的兴奋性不同,可能是钠通道的变化引起的。
神经元动作电位发放模式的差异可能是机体编码信号的重要手段。强直发放神经元适合编码兴奋的密度与宽度;单个发放神经元仅在兴奋的始端发放,可以作为兴奋性信号的“探测器”[3];阶段性发放表现出对动作电位发放的快速适应且动作电位的数量随着给予电流的强度增加而增加,这种特性与脊髓背侧作为疼痛感受器的神经元相似[15]。本研究首次探究了出生3 d小鼠皮层神经动作电位的发放模式,分析了不同动作电位发放模式的特征,这对进一步探究新生神经元兴奋编码的机制具有重要意义。
| [1] | 寿天德. 神经生物学[M]. 北京: 高等教育出版社, 2001 : 37 -39. SHOU Tiande. Neurophysiology[M]. Beijing: Higher Education Press, 2001 : 37 -39. (in Chinese) |
| [2] | DAVIES A J, NORTH R A. Electrophysiological and morphological properties of neurons in the substantia gelatinosa of the mouse trigeminal subnucleus caudalis[J]. Pain, 2009, 146 (1-2) :214–221. |
| [3] | LI J, BACCEI M L. Neonatal tissue injury reduces the intrinsic excitability of adult mouse superficial dorsal horn neurons[J]. Neuroscience, 2014, 256 :392–402. doi:10.1016/j.neuroscience.2013.10.057 |
| [4] | RUSCHEWEYH R, SANDKUHLER J. Lamina-specific membrane and discharge properties of rat spinal dorsal horn neurons in vitro[J]. J Physiol, 2002, 541 (1) :231–244. doi:10.1113/jphysiol.2002.017756 |
| [5] | CHO R H, SEGAWA S, MIZUNO A, et al. Intracellularly labeled pyramidal neurons in the cortical areas projecting to the spinal cord. I. Electrophysiological properties of pyramidal neurons[J]. Neurosci Res, 2004, 50 (4) :381–394. |
| [6] | LIAO C C, LEE L J. Evidence for structural and functional changes of subplate neurons in developing rat barrel cortex[J]. Brain Struct Funct, 2012, 217 (2) :275–292. doi:10.1007/s00429-011-0354-5 |
| [7] | CAULI B, AUDINAT E, LAMBOLEZ B, et al. Molecular and physiological diversity of cortical nonpyramidal cells[J]. J Neurosci, 1997, 17 (10) :3894–3906. |
| [8] | GAZINA E V, LEAW B T W, RICHARDS K L, et al. 'Neonatal' Nav1.2 reduces neuronal excitability and affects seizure susceptibility and behavior[J]. Hum Mol Genet, 2015, 24 (5) :1457–1468. doi:10.1093/hmg/ddu562 |
| [9] | FRANCIS H W, MANIS P B. Effects of deafferentation on the electrophysiology of ventral cochlear nucleus neurons[J]. Hear Res, 2000, 149 (1-2) :91–105. doi:10.1016/S0378-5955(00)00165-9 |
| [10] | DAI Y, CARLIN K P, LI Z, et al. Electrophysiological and pharmacological properties of locomotor activity-related neurons in cfos-EGFP mice[J]. J Neurophysiol, 2009, 102 (6) :3365–3383. doi:10.1152/jn.00265.2009 |
| [11] | BANDO Y, HIRANO T, TAGAWA Y. Dysfunction of KCNK potassium channels impairs neuronal migration in the developing mouse cerebral cortex[J]. Cereb Cortex, 2014, 24 (4) :1017–1029. doi:10.1093/cercor/bhs387 |
| [12] | RUDY B. Diversity and ubiquity of K channels[J]. Neuroscience, 1988, 25 (3) :729–749. doi:10.1016/0306-4522(88)90033-4 |
| [13] | VACHER H, MOHAPATRA D P, TRIMMER J S. Localization and targeting of voltage-dependent ion channels in mammalian central neurons[J]. Physiol Rev, 2008, 88 (4) :1407–1447. doi:10.1152/physrev.00002.2008 |
| [14] | DIB-HAJJ S D, TYRRELL L, BLACK J A, et al. NaN, a novel voltage-gated Na channel, is expressed preferentially in peripheral sensory neurons and down-regulated after axotomy[J]. Proc Natl Acad Sci U S A, 1998, 95 (15) :8963–8968. doi:10.1073/pnas.95.15.8963 |
| [15] | LOPEZ-GARCIA J A, KING A E. Membrane properties of physiologically classified rat dorsal horn neurons in vitro: correlation with cutaneous sensory afferent input[J]. Eur J Neurosci, 1994, 6 (6) :998–1007. doi:10.1111/ejn.1994.6.issue-6 |




