高效抗逆转录病毒治疗(highly active antiretroviral therapy,HAART)抑制HIV在患者体内的复制,降低血浆病毒量,重建机体的免疫功能,显著降低HIV感染者病死率,延长患者的生存时间[1]。HIV感染者需终身服用HAART药物,随之而来长期HAART对骨骼的影响备受关注。国外研究表明,HAART药物可能会直接干扰成骨细胞和破骨细胞[2],或者影响肾功能干扰骨代谢[3];但亦有学者认为HAART对骨密度影响不大[4],HAART对骨密度的影响可能与治疗方案及治疗时间有关[5]。国内有关HAART对艾滋病患者骨密度的影响也有报道[6]。鉴于骨代谢变化往往先于骨密度变化,本研究观察了82例采用不同HAART方案治疗2年以上的HIV感染者的骨代谢指标,以分析不同HAART方案对HIV感染者远期骨代谢的影响。
1 对象与方法 1.1 对象来源回顾性收集2012年1月~2016年5月在浙江大学医学院附属第一医院门诊接受HAART的82例HIV感染者资料,患者均符合2011版《艾滋病诊疗指南》中HIV感染的诊断[7],HAART方案为两种核苷类逆转录酶抑制剂加一种非核苷类逆转录酶抑制剂或蛋白酶抑制剂。根据方案包含替诺福韦(tenofovirdisoproxil)或叠氮胸苷(azidothymidine)分为替诺福韦组和叠氮胸苷组。每组各41例,其中男性75例,女性7例;患者平均年龄(39.98±14.37)岁。患者均未接受过其他抗HIV治疗,HAART后未出现机会性感染或艾滋病相关恶性肿瘤,均无高血压、糖尿病、心脏病、慢性肾功能不全等代谢性疾病,女性未怀孕或绝经。患者均签署用药知情同意书。
1.2 两组患者基线资料比较治疗前两组患者年龄、CD4+T细胞计数、ALT、尿素氮浓度、肌酐浓度、肾小球滤过率(glomerular fitrafion rate, GFR)和血钙、血ALP浓度差异均无统计学意义(均P > 0.05),替诺福韦组血磷浓度大于叠氮胸苷组(P < 0.05),见表 1。
| [(x±s)或M(Q25~Q75)] | ||||||||||
| 组别 | n | 年龄(岁) | CD4+T细胞 数(/mm3) |
ALT (U/L) |
尿素氮 (mmol/L) |
血肌酐 (μmol/L) |
GFR (mL/min) |
血钙 (mmol/L) |
血磷 (mmol/L) |
血ALP (U/L) |
| 替诺福韦组 | 41 | 40.34±15.23 | 107.00 (51.50~229.00) |
24.00 (15.50~35.00) |
4.10 (3.30~6.45) |
71.00 (58~85) |
110.08±39.18 | 2.25±0.17 | 1.22±0.21 | 80.00 (60.50~96.00) |
| 叠氮胸苷组 | 41 | 39.61±13.62 | 104.00 (56.00~227.50) |
19.00 (12.50~28.00) |
4.10 (3.15~5.75) |
71.00 (58~79) |
120.31±28.61 | 2.24±0.11 | 1.11±0.21 | 72.00 (59.00~93.50) |
| P值 | 0.819 | 0.904 | 0.145 | 0.495 | 0.393 | 0.181 | 0.561 | 0.022 | 0.478 | |
| GFR:肾小球滤过率,ALP:碱性磷酸酶. | ||||||||||
由于叠氮胸苷有骨髓抑制副作用,对于红细胞、白细胞、血小板计数偏小的患者一般选用替诺福韦,因此两组血三系指标未做比较。检测血ALT排除肝脏对血ALP的影响,检测尿素氮、肌酐排除治疗前肾功能差异。替诺福韦引起骨代谢异常往往先引起肾小管磷重吸收障碍,比较两组在服药后6、12、18、24、30个月患者GFR和血钙、血磷、血ALP浓度变化趋势,分析替诺福韦对长期HAART的HIV感染者骨代谢的影响。
1.4 CD4+T细胞计数以BECKMAN COULTER cytomics FC 500MPL流式细胞仪上样检测,测出CD4+T细胞比值,结合SYSMEX血细胞分析仪测出全血粒细胞,计算出全血中CD4+T细胞绝对值。
1.5 骨代谢和肝肾功能指标检测HITACHI(日立)7600型全自动生化检测仪检测血ALT、血ALP、血肌酐、血尿素氮、血钙、血磷浓度和GFR。
1.6 统计学方法采用SPSS 19.0软件进行统计分析。正态分布或接近正态分布的计量资料用均数±标准差(x±s)表示,非正态分布计量资料用中位数(四分位数间距)[M(Q25~Q75)]表示,计数资料用频数表示。正态分布资料采用配对t检验或者单因素方差分析,非正态分布采用二样本Wilcoxon W检验或k样本Kruskal-Walli检验,相关性分析采用Spearman秩和相关检验,两组差异比较采用重复测量设计的方差分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 两组治疗后CD4+T细胞数值变化HAART后两组患者CD4+T细胞均比治疗前增加(均P < 0.05),两组患者CD4+T细胞数增加均与治疗时间呈正相关(r=0.479、0.519,均P < 0.05),替诺福韦组与叠氮胸苷组治疗后6、12、18、24、30个月各时间点CD4+T细胞数数值差异均无统计学意义(均P > 0.05)。CD4+T细胞数值变化与治疗时间相关而与不同用药无关,说明两种治疗方案均能增加患者的CD4+T细胞,抗病毒疗效无明显差异。见表 2。
| [M(Q25~Q75),mm3] | |||||||
| 组别 | n | 0个月 | 6个月 | 12个月 | 18个月 | 24个月 | 30个月 |
| 替诺福韦组 | 41 | 107.00 (51.50~229.00) |
185.00 * (114.00~286.00) |
230.00 * (168.50~370.00) |
256.00 * (204.00~416.50) |
315.00 * (233.00~436.50) |
363.50 * (247.75~437.25) |
| 叠氮胸苷组 | 41 | 104.00 (56.00~227.50) |
209.00 * (122.00~298.00) |
268.00 * (151.00~353.00) |
342.00 * (200.00~429.00) |
354.00 * (236.50~450.50) |
362.00 * (243.00~443.00) |
| P值 | 0.904 | 0.802 | 0.970 | 0.842 | 0.770 | 0.939 | |
| 与0个月比较,*P < 0.05. | |||||||
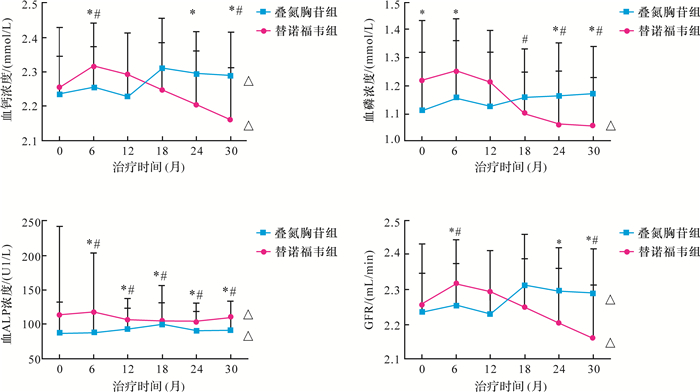
替诺福韦组在治疗6个月时血磷浓度增加不明显,而血钙浓度、血ALP浓度增加(P < 0.05)。随着治疗时间延长,患者血钙、血磷浓度逐渐减少,血清ALP增加(均P < 0.05)。该组患者在治疗18个月后血钙、血磷浓度较治疗6个月时减少(均P < 0.05)。治疗30个月与治疗前比较,血钙、血磷浓度降低、血ALP浓度增加(均P < 0.05),见表 3。说明替诺福韦组经过抗病毒治疗6个月后,其骨代谢改善;但随着治疗时间继续延长,替诺福韦引起血钙、血磷减少,血ALP增加。治疗至18个月时,替诺福韦组血钙、血磷浓度较6个月减少,血ALP呈代偿性增加,治疗时间越长,替诺福韦方案对患者的骨代谢影响越大。
| [(x±s)或M(Q25~Q75)] | ||||||
| 治疗时间(月) | n | GFR (mL/min) | 血钙(mmol/L) | 血磷(mmol/L) | 血ALP(U/L) | |
| 0个月 | 41 | 110.08±39.18 | 2.25±0.17 | 1.22±0.21 | 80(60.5~96.0) | |
| 6个月 | 41 | 120.71±62.85 | 2.31±0.13 | 1.25±0.19 | 99(79.5~124.0)* | |
| 12个月 | 41 | 113.67±41.30 | 2.29±0.12 | 1.21±0.18 | 98(83.0~115.0)* | |
| 18个月 | 41 | 104.94±32.24# | 2.25±0.14# | 1.10±0.15* # | 104(88.0~111.5)* | |
| 24个月 | 41 | 104.70±33.93# | 2.20±0.16# | 1.07±0.19* # | 105(89.0~119.0)* | |
| 30个月 | 41 | 98.13±30.43* # | 2.16±0.15* # | 1.06±0.17* # | 110(95.5~120.5)* | |
| r值 | -0.137 | -0.27 | -0.366 | 0.247 | ||
| P值 | 0.032 | < 0.001 | < 0.001 | < 0.001 | ||
| GFR:肾小球滤过率,ALP:碱性磷酸酶.与0个月比较,*P < 0.05;与6个月比较,#P < 0.05. | ||||||
叠氮胸苷组治疗6个月时血磷、血钙浓度增加不明显(均P > 0.05),血ALP浓度增加(P < 0.05)。随着治疗时间延长,患者逐渐血钙、血ALP浓度增加(均P < 0.05),而血磷浓度无变化(P > 0.05)。治疗30个月,叠氮胸苷组比治疗前血钙、血磷、血ALP浓度增加(均P < 0.05),见表 4。说明叠氮胸苷组患者经过6个月抗病毒治疗后,其骨代谢未发生明显变化,随治疗时间延长,患者血钙浓度增加,血磷浓度无变化,血ALP浓度增加,提示含叠氮胸苷的方案对患者骨代谢影响不明显。
| [(x±s)或M(Q25~Q75)] | |||||
| 治疗时间(月) | n | GFR(mL/min) | 血钙(mmol/L) | 血磷(mmol/L) | 血ALP(U/L) |
| 0个月 | 41 | 120.31±28.61 | 2.24±0.11 | 1.11±0.21 | 72(59.0~93.5) |
| 6个月 | 41 | 121.30±24.69 | 2.25±0.12 | 1.15±0.21 | 82(68.0~93.5)* |
| 12个月 | 41 | 116.80±19.67 | 2.23±0.18 | 1.13±0.19 | 87(75.5~103.0)* |
| 18个月 | 41 | 113.60±18.40# | 2.31±0.15* | 1.16±0.17 | 85(71.5~109.5)* # |
| 24个月 | 41 | 114.42±19.41# | 2.30±0.12* # | 1.17±0.19 | 84(73.0~108.5)# |
| 30个月 | 41 | 112.67±17.93* # | 2.29±0.13* # | 1.18±0.17* | 86(73.5~105.0)* # |
| r值 | -0.139 | 0.163 | 0.102 | 0.139 | |
| P值 | 0.029 | 0.011 | 0.113 | 0.029 | |
| GFR:肾小球滤过率,ALP:碱性磷酸酶.与0个月比较,*P < 0.05;与6个月比较,#P < 0.05. | |||||
替诺福韦组治疗6个月时GFR未升高。随着治疗时间延长,患者GFR逐渐降低(P < 0.05)。该组患者在治疗18个月之后GFR较6个月时降低(P < 0.05),至治疗30个月,其GFR比治疗前降低(P < 0.05),见表 3。说明替诺福韦组患者经过抗病毒治疗6个月后,其肾功能改善、GFR未下降;但随着治疗时间延长,替诺福韦引起患者肾功能损害,GFR降低。治疗至18个月时,患者GFR较6个月降低,提示替诺福韦方案对患者的肾功能影响明显。
叠氮胸苷组治疗6个月GFR无升高(P > 0.05),随着治疗时间延长患者GFR逐渐降低(P < 0.05)。该组患者在治疗18个月后GFR较治疗6个月时降低(P < 0.05),至治疗30个月,GFR比治疗前降低(P < 0.05),见表 4。说明叠氮胸苷组患者经过抗病毒治疗6个月后,其肾功能得到改善,GFR未下降;但随着治疗时间延长,叠氮胸苷引起患者肾功能损害,GFR降低。治疗至18个月时,GFR较6个月时降低,提示叠氮胸苷方案对患者肾功能影响明显。
2.4 治疗各时点两组间骨代谢指标和GFR比较两组患者治疗各时点观测值比较:①患者血钙浓度变化与治疗时间及不同用药均无关;替诺福韦组血钙浓度在治疗24、30个月比叠氮胸苷组降低(均P < 0.05)。②患者血磷浓度变化与治疗时间相关,与不同用药无关;治疗前替诺福韦组血磷浓度较叠氮胸苷组高,但治疗24、30个月替诺福韦组血磷浓度较叠氮胸苷组减少明显(均P < 0.05)。③患者血ALP变化与治疗时间无关,与不同用药相关;治疗6个月开始替诺福韦组血ALP浓度均较叠氮胸苷组增加明显(P < 0.05)。④患者GFR值变化与治疗时间及不同用药均相关;治疗24个月后替诺福韦组GFR较叠氮胸苷组下降明显。见表 5、图 1。提示与叠氮胸苷比较,长期服用替诺福韦影响患者的肾功能及骨代谢更明显。
|
| 替诺福韦组与同一时点叠氮胸苷组比较,*P < 0.05;替诺福韦组与其0个月比较,#P < 0.05;该组数据趋势检验,△P < 0.05. 图 1 两组HAART过程中血钙、血磷、血ALP、GFR比较 Fig. 1 Comparison of the levels of Ca、P、ALP、GFR after treatment with HAART of two groups |
| GFR | 血钙 | 血磷 | 血ALP | CD4+T细胞 | |
| 用药时间 | |||||
| 变异系数(%) | 2.335 | 2.022 | 2.766 | 0.087 | 19.250 |
| P值 | 0.041 | 0.065 | 0.014 | 0.994 | < 0.001 |
| 不同用药 | |||||
| 变异系数(%) | 1.366 | 0.597 | 0.005 | 2.589 | 0.213 |
| P值 | 0.009 | 0.079 | 0.866 | < 0.001 | 0.263 |
| GFR:肾小球滤过率,ALP:碱性磷酸酶. | |||||
本研究观察不同HAART方案对中国HIV感染者长期骨代谢的影响,发现使用包含替诺福韦的方案对HIV感染者的骨代谢影响较大,主要影响患者GFR和血钙、血磷浓度,进而可能影响患者的骨密度。与国外文献报道核苷(酸)类转录酶抑制剂特别是替诺福韦可以引起接受HAART的艾滋病患者骨密度下降的结论一致[8-9]。
正常的血钙和血磷水平对于维持骨骼内骨盐的含量具有重要的作用,人体内钙、磷通过饮食摄入,由小肠吸收进入血液,再通过肾小管的重吸收维持体内正常的血磷、血钙水平。肾小管重吸收功能受损,引起尿磷增加、血磷减少和血肌酐浓度增加,最终导致骨密度降低。而骨密度降低会引起成骨指标骨ALP代偿性升高,因此本研究选择血磷、血钙、血ALP浓度作为骨代谢指标,其变化往往早于骨密度指标。
替诺福韦作为核苷类药物,通过影响线粒体DNA(mDNA)而抑制病毒,表现出线粒体毒性[10]。而该药主要聚集在肾近曲小管,这与该药上市后的临床试验主要表现为肾脏损伤相一致[11]。替诺福韦引起的肾脏损害主要是肾小管的损伤,肾近曲小管损伤早期即出现排磷异常,出现低磷、低钙血症;进展到肾小管性酸中毒,患者可出现血肌酐增加,GFR下降。骨代谢异常是替诺福韦所致的肾功能损伤的特殊形式。观察GFR变化有助于全面了解药物对肾小管、肾小球的影响。
本研究发现治疗前肝肾功能无明显差异的HIV感染者经过HAART,CD4+T细胞增加,增加与HAART时间有关,而与不同药物无关,说明我国目前的免费抗病毒治疗药物均有效,选择不同药物疗效无差异。
诸多报道提示,艾滋病患者由于HIV-1病毒感染、T淋巴细胞的异常免疫激活、低体质量、维生素D缺乏等导致骨密度较正常人群减低[12-16]。HAART能改善患者体质,纠正不良营养状况及低体质量,改善骨密度。本研究发现患者在HAART半年后,替诺福韦组与叠氮胸苷组患者骨代谢指标及GFR有一定改善,考虑与HAART改善患者体质,不良营养状况得到纠正有关。而血ALP在治疗6个月时未下降,考虑骨ALP约占40%血ALP,短期观察变化不显著之故。
本研究发现,随着HAART时间的延长,替诺福韦组患者逐渐出现血钙、血磷浓度和GFR值减少,血ALP浓度增加;其变化与HAART持续时间有关,在治疗18个月后GFR、血钙、血磷较6个月时明显减少,治疗30个月后上述指标较治疗前明显减少,这与国外研究长期使用替诺福韦可引起骨密度下降,且与服药时间有关的结果相一致[8-9, 17]。推测其发生机制系替诺福韦通过影响肾小管重吸收功能,引起血磷、血钙减少,导致肾功能损伤、GFR减少,骨密度降低,进而造成血ALP代偿性增加,出现骨折、范可尼综合征[3, 18]。而叠氮胸苷组患者逐渐出现GFR减少、血钙和血ALP浓度增加,血磷浓度变化不大。其GFR下降可能与长期服用HAART药物引起肾小球损害、出现慢性肾脏病有关[19],而未表现出明显肾小管损害症状;血ALP浓度增加可能与叠氮胸苷能增加破骨细胞形成[20],血ALP浓度代偿性增加有关。
本研究发现,两组患者GFR减少、血ALP浓度增加与不同用药相关,而血钙、血磷浓度变化虽然与不同用药无明显相关,但替诺福韦组患者治疗24、30个月血钙、血磷浓度较叠氮胸苷组患者降低明显(治疗前替诺福韦组血磷浓度较叠氮胸苷组高),说明替诺福韦较叠氮胸苷更能降低患者GFR和减少患者血钙、血磷浓度,增加血ALP浓度,即替诺福韦对骨密度影响更大,这与国外相关报道[8]一致。
我们发现,包含替诺福韦的HAART方案在患者治疗18个月后出现GFR、血钙、血磷浓度较治疗6个月减少,说明治疗18个月后替诺福韦开始显著影响骨代谢。由于替诺福韦引起的肾脏损害早期主要表现为近曲肾小管的损伤,而GFR不是反映早期肾损害的检测指标,肾小管标志性蛋白如α1-微球蛋白、β2-微球蛋白和高磷酸盐尿[21]可以了解替诺福韦引起的早期肾脏损害。因此,对于长期接受含替诺福韦的HAART方案的HIV感染者,建议治疗12个月后定期监测α1-微球蛋白、β2-微球蛋白、血钙、血磷,至18个月后加测25-OH维生素D,并建议富钙富磷饮食,加强锻炼,特别是负重锻炼。
本文研究有一定局限性,研究队列相对不足,观察指标及时间有限,进一步的结论有待于今后继续扩大样本,增加观察时间及完善骨代谢相关指标如25-OH维生素D、1型前胶原氨基端肽(PINP)、1型胶原交联羧基末端肽(CTXβ)、甲状旁腺激素(PTH)等的测定。
总之,我国目前的免费治疗药物对HIV感染者疗效显著,但长期使用含替诺福韦的HAART方案比不含替诺福韦的方案对HIV感染者的肾功能、骨骼代谢影响大。主要表现为患者GFR、血磷、血钙减少,血ALP浓度增加。因此对于使用含替诺福韦的HAART方案治疗1年以上的患者应当定期检测血钙、血磷、25-OH维生素D、α1-微球蛋白、β2-微球蛋白,若上述指标进行性变化,建议改用不含替诺福韦的HAART方案,避免病情加重导致患者肾功能不全、骨密度下降。
| [1] | LOHSE N, HANSEN A B, PEDERSEN G, et al. Survival of persons with and without HIV infection in Denmark, 1995-2005[J]. Ann Intern Med, 2007, 146 (2) :87–95. doi:10.7326/0003-4819-146-2-200701160-00003 |
| [2] | GRUND B, PENG G, GIBERT C L, et al. Continuous antiretroviral therapy decreases bone mineral density[J]. AIDS, 2009, 23 (12) :1519–1529. doi:10.1097/QAD.0b013e32832c1792 |
| [3] | TJEN-A-LOOI A, NASEER S N, WORTHING A B, et al. Hypophosphatemic osteomalacia associated with tenofovir use in HIV-infected patients: a case series and review of the literature[J]. J AIDS Clin Res, 2012, S4 :1–4. |
| [4] | BOLLAND M J, GREY A B, HOME A M, et al. Bone mineral density remains stable in HAART-treated HIV-infected men over 2 years[J]. Clin Endocrinol(Oxf), 2007, 67 (2) :270–275. doi:10.1111/j.1365-2265.2007.02875.x |
| [5] | AYDIN O A, KARAOSMANOGLU H K, KARAHASANOGLU R, et al. Prevalence and risk factors of osteopenia/osteoporosis in Turkish HIV/AIDS patients[J]. Braz J Infect Dis, 2013, 17 (6) :707–711. doi:10.1016/j.bjid.2013.05.009 |
| [6] | 郭伏平, 于晓波, 李太生, 等. 高效抗逆转录病毒治疗对人类免疫缺陷病毒感染患者骨密度的影响[J]. 中华内科杂志, 2010, 49 (8) : 649–652. GUO Fuping, YU Xiaobo, LI Taisheng, et al. The impact of highly active antiretroviral therapy on bone mineral density in human immunodeficiency virus infected patients[J]. Chinese Journal of Internal Medicine, 2010, 49 (8) :649–652. (in Chinese) |
| [7] | 中华医学会感染病学会艾滋病学组. 艾滋病诊疗指南(2011版)[J]. 中华传染病杂志, 2011, 29 (10) : 629–640. AIDS Group, Society of Infectious Diseases, Chinese Medical Association. Guideline of diagnosis and treatment for AIDS(2011)[J]. Chinese Journal of Infectious Diseases, 2011, 29 (10) :629–640. (in Chinese) |
| [8] | BROWM T T, QAQISH R B. Antiretroviral therapy and the prevalence of osteopenia and osteoporosis: a meta-analytic review[J]. AIDS, 2006, 20 (17) :2165–2174. doi:10.1097/QAD.0b013e32801022eb |
| [9] | LIU A Y, VITTINGHOFF E, SELLMEYER D E, et al. Bone mineral density in HIV-negative men participating in a tenofovir pre-exposure prophylaxis randomized clinical trial in San Francisco[J/OL]. PLoS One, 2011, 6(8): e23688. |
| [10] | CÔTÉ H C, MAGIL A B, HARRIS M, et al. Exploring mitochondrial nephrotoxicity as a potential mechanism of kidney dysfunction among HIV-infected patients on highly active antiretroviral therapy[J]. Antivir Ther, 2006, 11 (1) :79–86. |
| [11] | JABLONOWSKA E. Urine liver-type fatty acid-binding protein and kidney injury molecule-1 in HIV-infected patients receiving combined antiretroviral treatment based on tenofovir[J]. AIDS Res Hum Retroviruses, 2014, 30 (4) :363–369. doi:10.1089/aid.2013.0070 |
| [12] | FAKRUDDIN J M, LAURENCE J. HIV-1 Vpr enhances production of receptor of activated NF-kappaB ligand(RANKL) via potentiation of glucocorticoid receptor activity[J]. Arch Virol, 2005, 150 (1) :67–78. doi:10.1007/s00705-004-0395-7 |
| [13] | ZHAO B, GRIMES S N, LI S, et al. TNF-induced osteoclastogenesis and inflammatory bone resorption are inhibited by transcription factor RBP-J[J]. J Exp Med, 2012, 209 (2) :319–334. doi:10.1084/jem.20111566 |
| [14] | BOLLAND M J, GREY A B, GAMBLE G D, et al. Clinical review: low body weight mediates the relationship between HIV infection and low bone mineral density: a meta-analysis[J]. J Clin Endocrinol Metab, 2007, 92 (12) :4522–4528. doi:10.1210/jc.2007-1660 |
| [15] | YIN M T, LU D, CREMERS S, et al. Short-term bone loss in HIV-infected premenopausal women[J]. J Acquir Immune Defic Syndr, 2010, 53 (2) :202–208. doi:10.1097/QAI.0b013e3181bf6471 |
| [16] | GAZZOLA L, BELLISTRI G M, TINCATI C, et al. Association between peripheral T-lymphocyte activation and impaired bone mineral density in HIV-infected patients[J]. J Transl Med, 2013, 11 :51. doi:10.1186/1479-5876-11-51 |
| [17] | MCCOMSEY G A, O'RIORDAN M, CHOI J, et al. Mitochondrial function, inflammation, fat and bone in HIV lipoatrophy: randomized study of uridine supplementation or switch to tenofovir[J]. Antivir Ther, 2012, 17 (2) :347–353. |
| [18] | ROUSIERE M, BERENBAUM F. Didanosine/tenofovir:osteomalacia(first report with didanosine), and Fanconis syndrome:5 case reports[J]. Reactions Weekly, 2008, 1210 (1) :12. |
| [19] | ADEDEJI T A, ADEDEJI N O, ADEBISI S A, et al. Prevalence and pattern of chronic kidney disease in antiretroviral-naïve patients with HIV/AIDS[J]. J Int Assoc Provid AIDS Care, 2015, 14 (5) :434–440. doi:10.1177/2325957415587570 |
| [20] | MADEDDU G, SPANU A, SOLINAS P, et al. Different impact of NNRTI and PI-including HAART on bone mineral density loss in HIV-infected patients[J]. Eur Rev Med Pharmacol Sci, 2015, 19 (23) :4576–4589. |
| [21] | ZHANG L, SU Y, HSIEH E, et al. Bone turnover and bone mineral density in HIV-1 infected Chinese taking highly active antiretroviral therapy-a prospective observational study[J]. BMC Musculoskelet Disord, 2013, 14 :224. doi:10.1186/1471-2474-14-224 |




