2. 浙江省磐安中医院骨科, 浙江 金华 322300
2. Department of Orthopedics, Pan'an County TCM Hospital, Pan'an 322300, China
骨关节炎(osteoarthritis)是一种以软骨缺失、软骨下骨再建、关节间隙渐进性狭窄、骨刺形成以及滑膜炎症为主要特征的退行性关节病。其最终表现为软骨细胞和基质形态学、生物化学、分子生物学和生物力学的改变从而导致关节软骨的软化、纤维化和溃疡形成;软骨下骨的硬化、象牙化、囊肿和骨赘形成[1]。骨关节炎是中老年人最常见的关节疾病,随着社会的老龄化,骨关节炎的患病率逐渐升高。遗憾的是,目前临床所用的药物即便能够缓解症状,也无法逆转疾病发展的进程。
LR-90是一种新型的晚期糖基化终末产物抑制剂,最近证明其可以通过抑制氧化作用而抑制人类内皮细胞凋亡[2],同时可对抗糖尿病诱导的主动脉硬化,阻止心脏肥大等[3]。 另有研究证实,LR-90可以有效抑制人类单核细胞的促炎性细胞因子包括环氧化酶2及单核细胞趋化蛋白-1,阻断NF-κB信号通路以阻止糖尿病血管硬化[4]。骨关节炎以关节软骨的进行性破坏和滑膜炎症反应为特征。促炎性细胞因子IL-1β可以通过增加氧自由基和基质金属蛋白酶(matrix metalloproteinases,MMP)的表达,直接诱导软骨细胞凋亡和软骨基质破坏[5-6]。TNF-α和聚蛋白多糖酶(adisintegrin and metalloproteinase with thrombospondin motifs,ADAMTS)通过NF-κB信号通路的正反馈机制可以加速关节软骨的降解[7]。LR-90是否可以抑制骨关节炎炎性反应并保护关节软骨?目前国内外尚未有相关报道。本研究通过建立骨关节炎软骨细胞模型和骨关节炎动物模型,应用组织形态学评估、免疫组织化学检测、PCR检测等方法,探索在实验性骨关节炎发展过程中,LR-90对关节软骨基质的形态学保护作用以及对软骨细胞和软骨组织中的IL-1β、MMP-13和ADAMTS-5及其作用底物聚集蛋白聚糖(Aggrecan)、Ⅱ型胶原蛋白(Collagen Ⅱ)基因表达的影响。
1 材料与方法 1.1 仪器与试剂LR-90购于美国Sigma-Aldrich公司,溶于0.9 mg/L氯化钠溶液制成50 mg/L LR-90溶液[8]。番红(Saffranin-O)染色剂购于杭州皓天生物技术有限公司,Trizol购于美国Invitrogen公司,RevertAidTM First Strand cDNA Synthesis Kit(逆转录试剂盒)购于加拿大Fermentas公司,PCR试剂购于上海英骏生物技术有限公司。荧光定量PCR仪购于美国 Bio-Rad公司。
1.2 实验动物12个月龄新西兰大白兔25只,体质量2.5~3.0 kg,购自浙江省中医药研究院动物实验中心。本研究获得浙江省立同德医院伦理委员会批准。
1.3 体外实验 1.3.1 软骨细胞分离与培养将5只新西兰大白兔用3%戊巴比妥钠麻醉致死,75%乙醇溶液消毒10 min,在无菌条件下切取膝关节股骨髁软骨,PBS清洗2~3次。将软骨尽量切成1 mm3的碎片,收集在50 mL离心管中,加入0.25%的胰蛋白酶5 mL后放置于37 ℃细胞培养箱中消化30 min,倒掉消化液后加入5 mL PBS清洗2次。加入0.2%的Ⅱ型胶原蛋白酶10 mL,置于37 ℃ 5%二氧化碳细胞培养箱中消化4~5 h,将悬浊液过120目滤网滤去软骨组织,过滤后的液体以120×g离心10 min,轻轻吸除消化液,PBS漂洗1次,加入8 mL含有10%FBS和1%双抗的DMEM/F12完全培养基,振荡混匀种植于直径为30 mm的培养皿中。倒置显微镜下观察软骨细胞生长情况。分离的原代软骨细胞3~4 d后细胞增殖密度至90%左右进行传代。PBS清洗,胰酶消化,离心收集,细胞计数仪计数,按照6×106/mL种植于直径为30 mm的培养皿中。传代培养的第三代软骨细胞按照1×106/孔接种于6孔板。
1.3.2 细胞分组及干预接种于6孔板的软骨细胞培养1 d,细胞增殖密度大约100%,用含1%双抗、不含血清的DMEM/F12培养基培养24 h,每三孔细胞作为一组,分为两组。对照组:用含有10 ng/mL IL-1β的无血清培养基培养; LR-90组:用50 mg/L LR-90预处理后的含有10 ng/mL IL-1β的无血清培养基培养。
1.4 体内实验 1.4.1 动物模型的建立和分组采用3%戊巴比妥钠(1.0 mL/kg)静脉麻醉新西兰大白兔,双侧膝关节常规消毒铺巾后行前交叉韧带切断术,即经膝关节内侧切口进入关节腔,直视下切断前交叉韧带,行抽屉试验确认前交叉韧带完全断裂后,用生理盐水冲洗干净,逐层闭合关节腔。术后不固定,分笼饲养。术后3 d每只动物每天肌肉注射青霉素4×105 U预防感染。术后4周,于每只兔一侧膝关节腔内每周注射50 mg/L LR-90 0.3 mL/次(LR-90组),另一侧关节腔内注射相同剂量生理盐水(对照组),共注射5周。
1.4.2 肉眼观察股骨髁的大体组织学形态术后9周处死余下20只新西兰大白兔。依从盲法原则,1名高年资病理医师和1名高年资骨科医师在手术显微镜下观察大体标本股骨髁软骨表面退变情况,按以下标准进行评分[9]:关节面完整,色泽如常为0分;关节面粗糙,有小的裂隙且色泽灰暗为1分;关节面糜烂,软骨缺损深达软骨表中层为2分;关节面溃疡形成,缺损深达软骨深层为3分;软骨剥脱,软骨下骨质暴露为4分。若两人评分结果不一致,采用经过共同讨论并达成共识后的评分结果。大体组织学评分结束后标本用于组织病理学评估。
1.4.3 番红染色和免疫组织化学检测观察软骨组织的形态取股骨内髁关节面及骨组织,用10%的甲醛固定48 h,RapidCal.ImmunoTM快速脱钙液脱钙2 d,石蜡纵向包埋,然后切成5 μm厚的切片,软骨切片分别作番红染色和 Collagen Ⅱ 免疫组织化学检测。依从盲法原则,一名高年资病理医师和一名高年资骨科医师根据Mankin评分标准[10]对软骨切片进行定量评分。若两人评分结果不一致,采用经过共同讨论并达成共识后的评分结果。对免疫组织化学染色切片进行定性评估。
1.5 实时定量PCR检测IL-1β、MMP-13、ADAMTS-5、Aggrecan和Collagen Ⅱ mRNA表达分别培养对照组和LR-90组细胞48 h后收集各组细胞并提取总RNA。另取20只大白兔处死后获取膝关节40个,分为两组:LR-90组(n=20)及对照组(n=20),每个样本取股骨内髁软骨组织约10 mg置于1 mL Trizol中匀浆并提取总RNA。取2 μg RNA逆转录成cDNA,逆转录反应体系依照RevertAidTM First Strand cDNA Synthesis Kit逆转录试剂盒说明进行。做实时定量PCR,每个样本设置3个重复,以18S核糖体RNA为内参。使用iQTM SYBR Green supermix PCR试剂盒行PCR扩增反应(5 ng cDNA,45个循环:95 ℃ 10 s,60 ℃ 25 s)。IL-1β、MMP-13、ADAMTS-5、Aggrecan和Collagen Ⅱ 引物设计和合成由上海英骏生物技术有限公司完成,具体引物序列见表 1。运用2-ΔΔCt来分析基因相对表达水平,ΔΔCt=(Ct靶基因-Ct内参)LR-90组-(Ct靶基因-Ct内参)对照组。
| 基因 | 产物长度(bp) | 引物序列( 5’-3’) | 基因库编号 |
| 18S | 119 | 正:GACGGACCAGAGCGAAAGC,反:CGCCAGTCGGCATCGTTTATG | EU236696 |
| IL-1β | 127 | 正:TGACGGCCTGAGAACTTTCT,反:CATACGTGCCAGACAACACC | NM_001082201 |
| MMP-13 | 290 | 正:TCCTCTTCTTGAGCTGGACTC,反:GTTCCAGCCACGCATAGTCAT | NM1082037 |
| ADAMTS-5 | 68 | 正:CAGTGTTCTCGCTCTTGTGG,反:CTGGGTGCAGGGTTATTGC | AF247708 |
| Aggrecan | 127 | 正:ATGGCTTCCACCAGTGCG,反:CGGATGCCGTAGGTTCTCA | L38480 |
| Collagen Ⅱ | 323 | 正:GCACCCATGGACATTGGAGG,反:AGCCCCGCACGGTCTTGCTT | S83370 |
| MMP-13: 基质金属蛋白醇13;ADAMTS-5:聚蛋白多糖醇5;Aggrecan: 聚集蛋白聚糖;Collagen Ⅱ: Ⅱ型胶原蛋白. | |||
采用SPSS 15.0软件进行统计学分析,计量资料以均数±标准差(x±s)表示,大体评分及组织学评分、mRNA表达量的比较均采用两独立样本 t检验。P<O.05为差异有统计学意义。
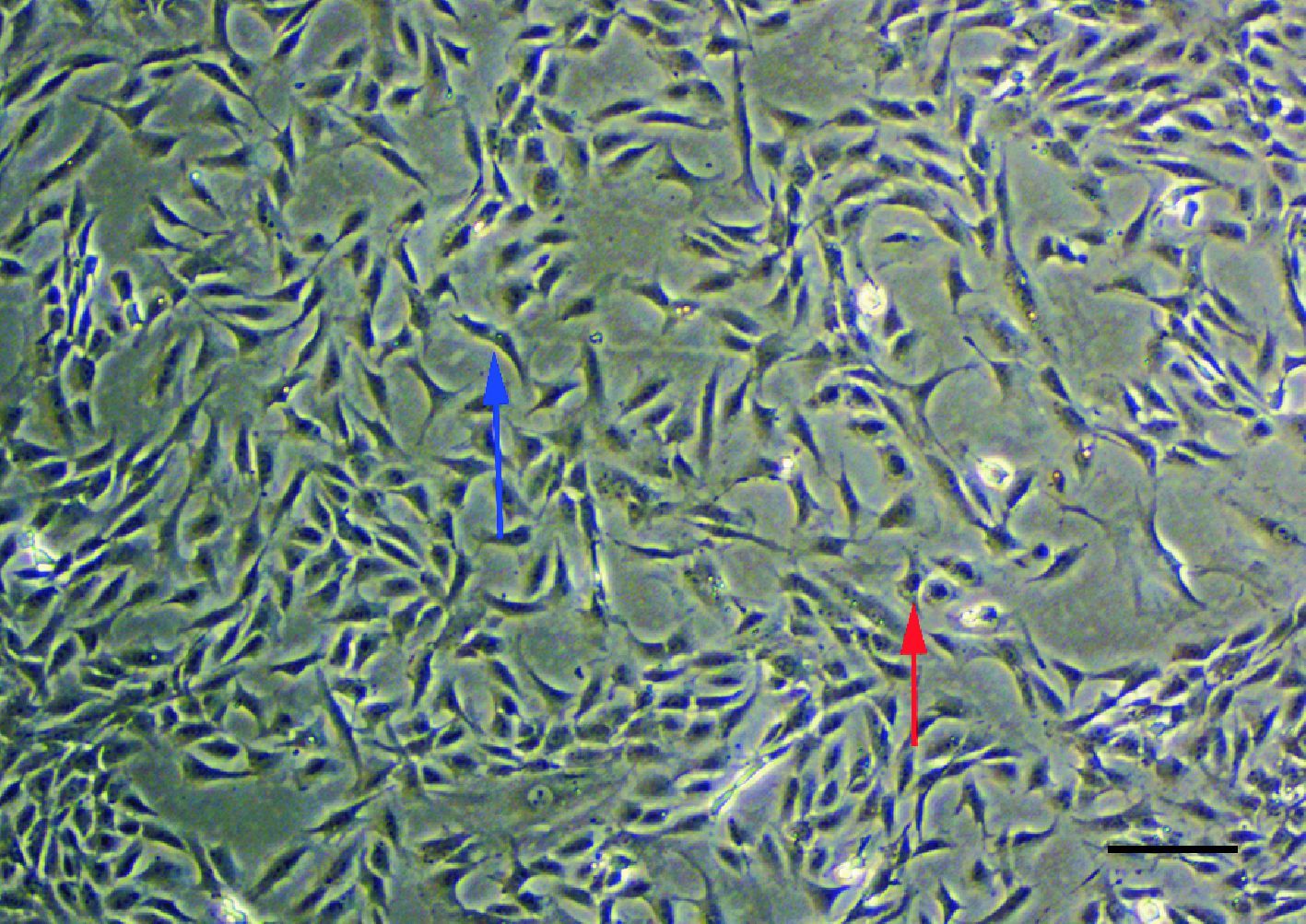
2 结 果 2.1 分离培养的软骨细胞形态第3代软骨细胞培养48 h后,于倒置显微镜下观察显示:软骨细胞生长良好,呈多角形、短梭形等形态,紧密排列(图 1)。提示软骨细胞生长良好,可作为体外实验的良好载体。
|
| 镜下可见,软骨细胞生长良好,呈多角形(红色箭头)、短梭形(蓝色箭头)等形态,紧密排列,标尺=100 μm 图 1 倒置显微镜下软骨细胞形态观察 Fig. 1 Morphology of chondrocytes under microscope |
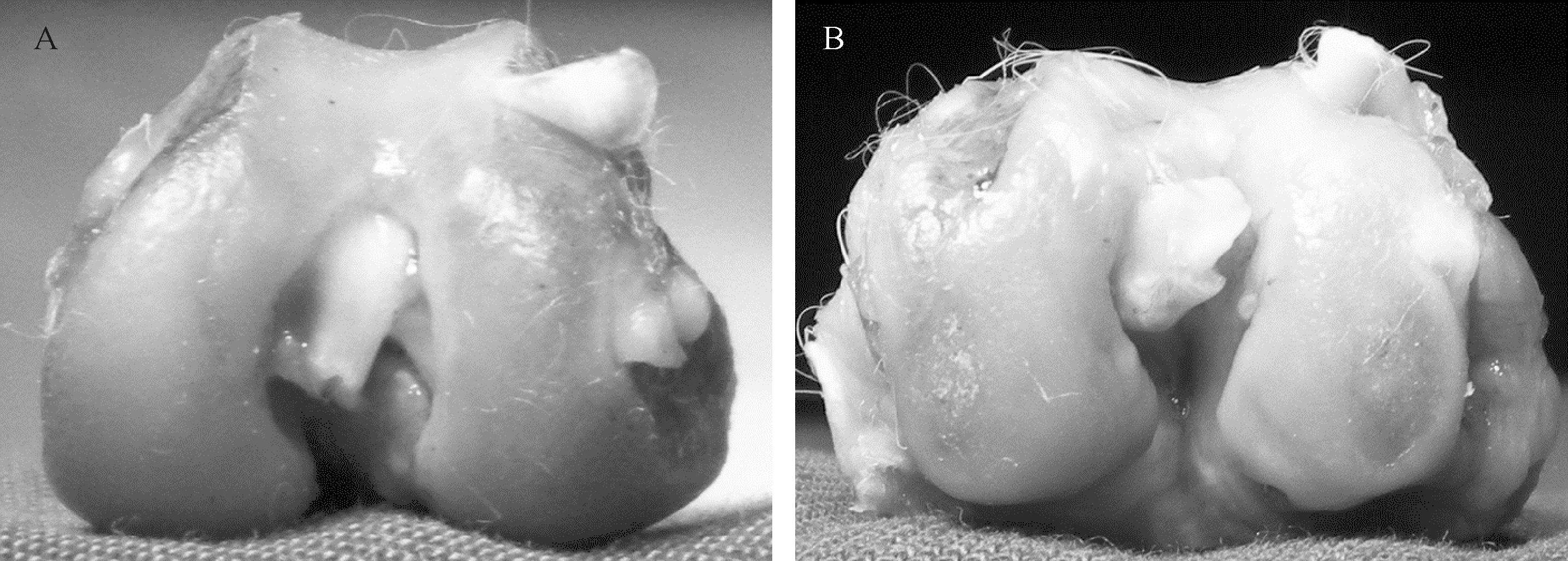
观察股骨髁大体形态结果:LR-90组可见股骨髁关节软骨色泽变暗,软骨退变程度较轻,范围较小,仅累及内髁,软骨下骨质尚未暴露(图 2A);对照组股骨髁关节软骨明显失去原有光泽,软骨退变程度重,范围广,内外髁均有累及,软骨下骨质外露,关节周围软组织增生肥厚明显(图 2B)。LR-90组及对照组各20个关节大体形态进行大体标本评分结果显示,对照组股骨髁软骨分值(3.05±0.75)高于LR-90组(2.15±0.75),差异具有统计学意义(P<0.01)。提示LR-90具有软骨形态学保护作用。
|
| A: LR-90组可见关节软骨色泽变暗,软骨退变程度较轻,范围较小,仅累及内髁,软骨下骨质尚未暴露;B:对照组关节软骨明显失去原有光泽,软骨退变程度重,范围广,内外髁均有累及,软骨下骨 质外露,关节周围软组织增生肥厚. 图 2 各组股骨髁关节软骨大体标本形态 Fig. 2 The gross morphology of femoral condyles in different groups |
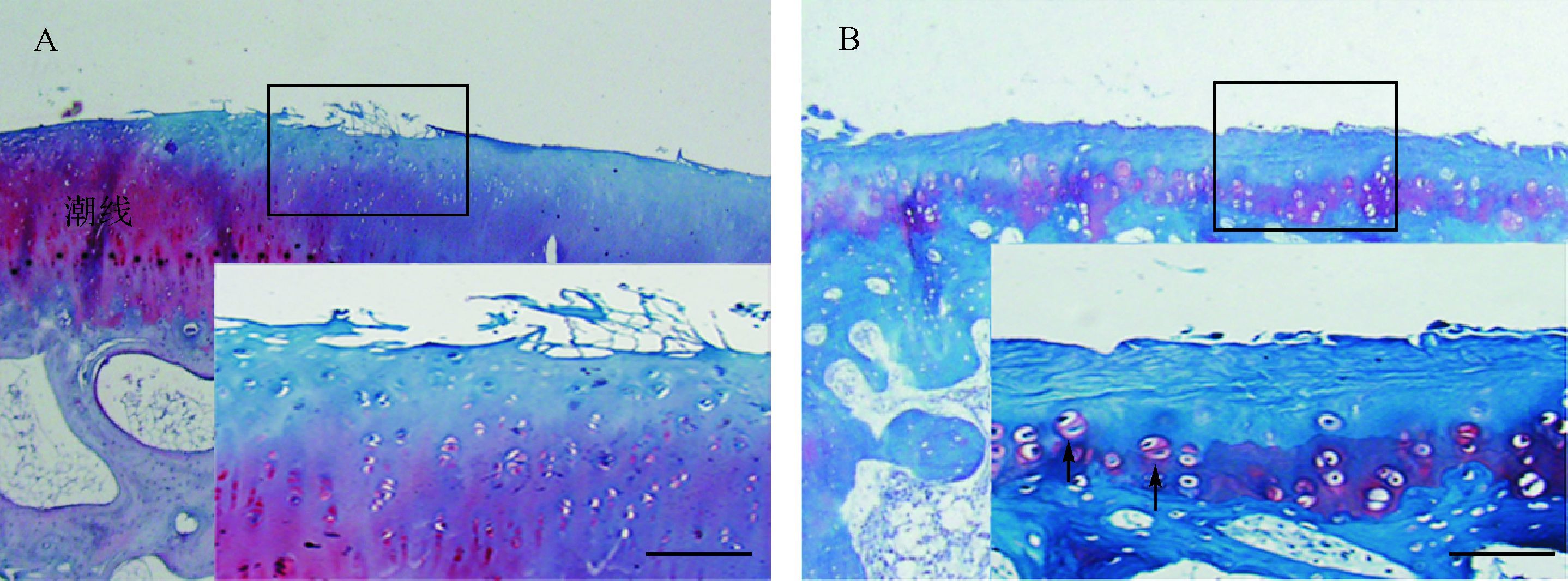
番红染色结果显示:LR-90组软骨组织分层无明显破坏,表层略不平整,潮线基本完整,偶见少量簇聚细胞,染色轻度减退尤以软骨表层明显(图 3A);对照组可见表层纤维化,细胞排列紊乱,潮线不规则,簇聚细胞出现频率增加,染色不均匀褪色明显(图 3B )。提示LR-90对软骨结构具有保护效应,可延缓软骨中蛋白多糖丢失。
|
| A: LR-90组软骨组织分层无明显破坏,可见表层略不平整,潮线基本完整,偶见少量簇巨细胞,染色轻度减退尤以软骨表层明显;B:对照组可见表层纤维化,细胞排列紊乱,潮线不规则,簇巨细胞(箭头处) 增多,染色不均匀褪色明显.标尺=50 μm. 图 3 各组软骨组织股骨内髁关节软骨番红染色结果 Fig. 3 Performance of medial femoral condyle articular cartilage by Saffranin-O staining |
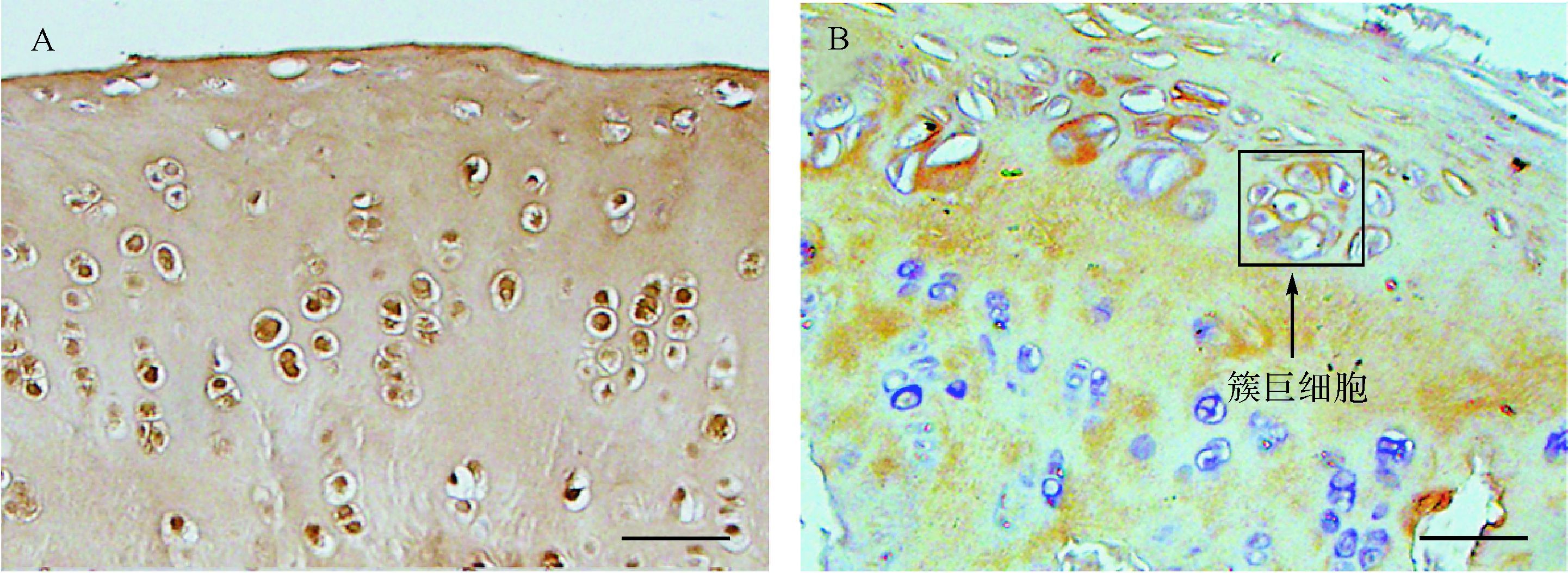
免疫组织化学检测结果显示:LR-90组中Collagen Ⅱ在软骨全层表达,呈棕色颗粒,颜色无明显减退(图 4A);对照组Collagen Ⅱ表达较LR-90组减少,软骨全层棕色减退尤以软骨上层退变处明显(图 4B)。提示IL-90可减少软骨中Collagen Ⅱ的丢失。
|
| A: LR-90组Collagen Ⅱ在软骨全层表达,呈棕色颗粒,颜色无明显减退;B:对照组Collagen Ⅱ表达较LR-90组减少,簇巨细胞增多,软骨全层棕色减退尤以软骨上层退变处明显.标尺=50 μm. 图4 各组软骨组织股骨内髁关节软骨Collagen Ⅱ免疫组织化学检测结果 图 4 各组软骨组织股骨内髁关节软骨悦燥造葬早藻灶域免疫组织化学检测结果 Fig. 4 Performance of medial femoral condyle articular cartilage by immunohistochemical staining |
Mankin评分结果显示:LR-90组在软骨结构、软骨细胞、潮线完整性、番红着色评分以及Mankin总分五个方面均低于对照组(均P<0.05),见图 5。LR-90组关节软骨番红染色在光镜下Mankin总分结果为8.75±1.71,对照组为5.70±1.70,提示LR-90可以延缓骨关节炎软骨结构破坏、抑制软骨基质中蛋白多糖及胶原成分的丢失,LR-90对骨关节炎关节软骨具有形态学改善效应。
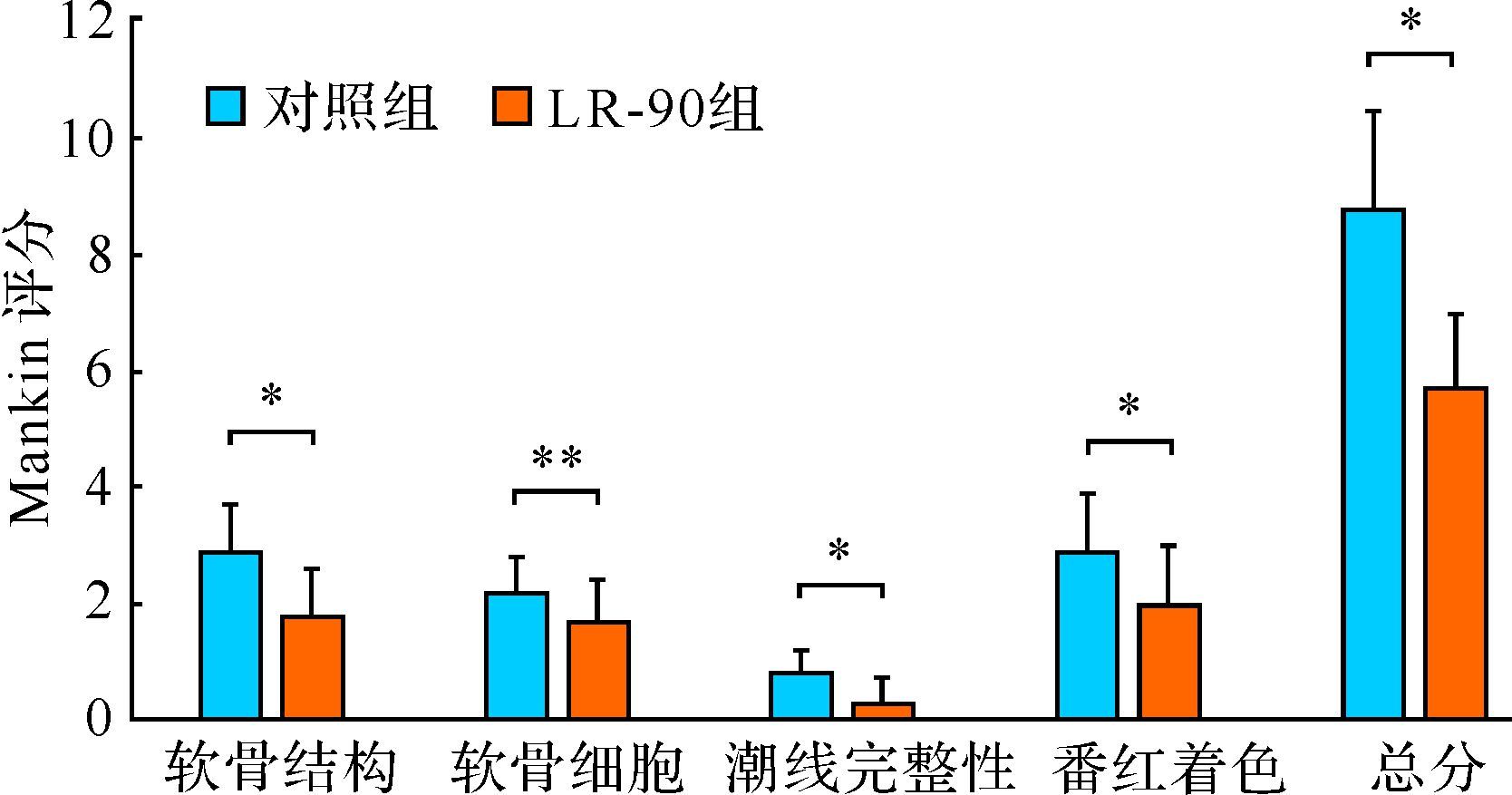
|
| 与对照组比较, *P<0.05,**P<0.01. 图 5 各组股骨内髁关节软骨Mankin评分比较 Fig. 5 Comparison of Mankin scores of medial femoral condyle articular cartilage |
体外实验结果显示: LR-90组软骨细胞MMP-13、ADAMTS-5的mRNA表达较对照组均减少(均P<0.01);Aggrecan及Collagen Ⅱ 的mRNA表达较对照组均增加(均P<0.01),见图 6。提示IL-90可以有效改善骨关节炎软骨细胞代谢,减少侵袭性因子的表达,增加细胞基质基因的表达。

|
| 与对照组比较, *P<0.05. 图 6 体外实验各组软骨细胞MMP-13、ADAMTS-5、Aggrecan及Collagen Ⅱ mRNA表达量比较 Fig. 6 Comparison of the mRNA expression of MMP-13,ADAMTS-5,Aggrecan and Collagen Ⅱ of chondrocytes in vitro |
体内实验结果显示:与对照级比较,LR-90组软骨组织IL-1β、MMP-13及ADAMTS-5的mRNA表达均降低(均P<0.01),Aggrecan及Collagen Ⅱ的mRNA表达均增加(均P<0.01),见图 7。提示LR-90可以改善软骨基质代谢,延缓软骨基质成分的丢失。
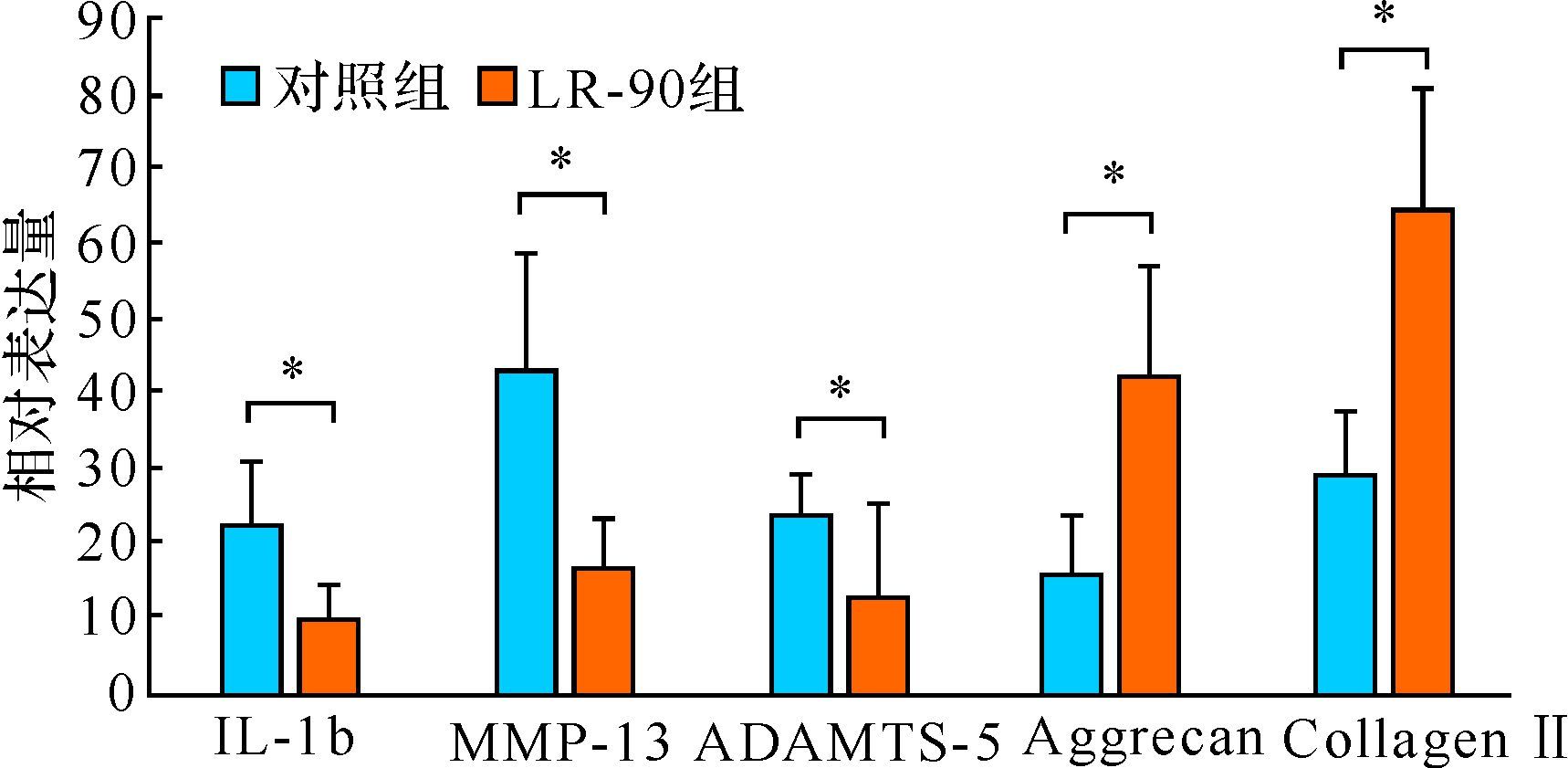
|
| 与对照组比较,*P<0.05. 图 7 体内实验各组软骨组织IL-1β、MMP-13、ADAMTS-5、Aggrecan及Collagen Ⅱ mRNA表达量比较 Fig. 7 Comparison of the mRNA expression of IL-1β,MMP-13,ADAMTS-5,Aggrecan and Collagen Ⅱ of Cartilage in vivo |
前交叉韧带切断术是近几年采用较多的兔实验模型造模方法,其软骨损伤和滑膜炎病程进展较大型动物(如犬类、羊类)更迅速,且适合对参与软骨降解的一些病理生理改变的研究,因此更适于抗骨关节炎制剂的实验研究[11]。本实验采用前交叉韧带切断术造成兔膝关节不稳定,导致骨关节炎的形成,并且通过关节腔内给药,提高局部药物浓度,减少全身不良反应。
目前对骨关节炎的药物治疗方法主要包括应用非甾体抗炎镇痛药、阿片类药物、曲马多、黏性补充或透明质酸钠的替代疗法及关节内糖皮质激素注射等[12-13]。这些药物大多具有缓解疼痛的作用,但无法从根本上延缓骨关节炎病程中关节软骨的渐进性退变。因此,绝大多数患者常常因为疾病发展到晚期无法忍受关节疼痛且无法进行一般的日常活动而不得不接受关节置换手术。
MMP家族及ADAMTS家族降解酶已经证实是分解软骨细胞外基质最为重要的两类侵袭性因子。软骨细胞外基质主要由Aggrecan和Collagen Ⅱ组成。MMP-13又名胶原酶 3(collagenase-3),其主要作用底物为软骨胶原蛋白[14],ADAMTS-5又名蛋白聚糖酶 2(aggrecanase-2),其主要作用底物为Aggrecan[15]。在骨关节炎的发生发展过程中ADAMTS-5是ADAMTS家族里发挥主要作用的蛋白聚糖酶,ADAMTS-5基因敲除可以有效阻止Aggrecan的降解,减轻骨关节炎的病变[16],而选择性抑制MMP-13的活性可以有效抑制Collagen Ⅱ的降解,维持软骨细胞外基质结构,减轻形态学损害[17]。
由于股骨内髁为膝关节着力的主要部位,该部位的软骨退变形态最能体现骨关节炎的病变特征[18],因此我们选取股骨内髁关节面软骨进行组织学检测评估。本研究利用Mankin软骨评分系统来评价LR-90对关节软骨的形态学保护作用,结果证实关节腔内注射LR-90可显著减轻股骨内髁关节软骨退行性改变。大体组织学观察结果,R-90组膝关节股骨髁标本评分低于对照组;病理组织学评分R-90组在软骨结构、软骨细胞、潮线完整性以及番红染色四方面评分也均低于对照组。番红特异性结合基质中的蛋白多糖,其着色深浅可以反映软骨基质中Aggrecan的含量[19]。本研究结果显示,与对照组比较,LR-90组给药后软骨基质的番红着色丢失显著减少,同时免疫组织化学检测结果显示软骨基质Collagen Ⅱ表达量增加,这说明LR-90可以有效抑制骨关节炎发展过程中软骨细胞外基质成分的丢失,阻止了实验性骨关节炎的发展。RT-PCR结果显示,与对照组比较,经LR-90处理后软骨组织内IL-1β、MMP-13及ADAMTS-5的mRNA表达量均减少,且两类分解性蛋白酶的作用底物Collagen Ⅱ及Aggrecan mRNA表达量均增加,体外实验数据与体内实验相符。组织病理学评估结果与体内外实验PCR检测结果一致,故进一步证实了LR-90对软骨基质的保护作用。
本研究的局限性在于仅仅观察了LR-90对关节软骨组织形态学的保护作用。而骨关节炎是一种全关节慢性疾病,组织学改变除软骨退变外还包括软骨下骨硬化和滑膜肥厚纤维化。最近有相关研究报道IL-1β作为骨关节炎发病过程中的上游促炎因子,可以诱导下游分解性因子MMP及ADAMTS的表达,进而加速软骨细胞外基质降解[20]。本实验虽然证实LR-90可以下调IL-1β、MMP-13、ADAMTS-5的表达,但其具体机制尚不清楚。LR-90对 MMP-13、ADAMTS-5的表达有直接抑制作用还是该抑制效应必须通过抑制IL-1β来实现?相关的作用机制还有待进一步研究。
综上所述,LR-90对骨关节炎关节软骨具有保护作用,可延缓疾病的进展,其对骨关节炎软骨的保护作用可能是通过抑制软骨中的侵袭因子IL-1β、MMP-13和ADAMTS-5的分泌,阻止细胞外基质主要成分Aggrecan及Collagen Ⅱ的降解来实现的。本研究结果期望为临床抗骨关节炎新药的研发提供一种新思路。
| [1] | GLYN-JONES S, PALMER A J, AGRICOLA R, et al. Osteoarthritis[J]. Lancet, 2015, 386 (9991) :376–387 . |
| [2] | FIGAROLA J L, SINGHAL J, RAHBAR S, et al. LR-90 prevents methylglyoxal-induced oxidative stress and apoptosis in human endothelial cells[J]. Apoptosis, 2014, 19 (5) :776–788 . |
| [3] | SATHEESAN S, FIGAROLA J L, DABBS T, et al. Effects of a new advanced glycation inhibitor, LR-90, on mitigating arterial stiffening and improving arterial elasticity and compliance in a diabetic rat model: aortic impedance analysis[J]. Br J Pharmacol, 2014, 171 (12) :3103–3114 . |
| [4] | FIGAROLA J L, SHANMUGAM N, NATARAJAN R, et al. Anti-inflammatory effects of the advanced glycation end product inhibitor LR-90 in human monocytes[J]. Diabetes, 2007, 56 (3) :647–655 . |
| [5] | LIM H, KIM H P. Matrix metalloproteinase-13 expression in IL-1β-treated chondrocytes by activation of the p38 MAPK/c-Fos/AP-1 and JAK/STAT pathways[J]. Arch Pharm Res, 2011, 34 (1) :109–117 . |
| [6] | ROUSSET F, NGUYEN M V, GRANGE L, et al. Heme oxygenase-1 regulates matrix metalloproteinase MMP-1 secretion and chondrocyte cell death via Nox4 NADPH oxidase activity in chondrocytes[J]. PLoS One, 2013, 8 (6) . |
| [7] | LAI Y, BAI X, ZHAO Y, et al. ADAMTS-7 forms a positive feedback loop with TNF-α in the pathogenesis of osteoarthritis[J]. Ann Rheum Dis, 2014, 73 (8) :1575–1584 . |
| [8] | FIGAROLA J L, SCOTT S, LOERA S, et al. LR-90 a new advanced glycation endproduct inhibitor prevents progression of diabetic nephropathy in streptozotocin-diabetic rats[J]. Diabetologia, 2003, 46 (8) :1140–1152 . |
| [9] | PELLETIER J P, JOVANOVIC D, FERNANDES J C, et a1. Reduced progression of experimental osteoarthritis in vivo by selective inhibition of inducible nitric oxide synthase[J]. Arthritis Rheum, 1998, 41 (7) :1275–1286 . |
| [10] | VAN DER SLUIJS J A, GEESINK R G, VAN DER LINDEN A J, et al. The reliability of the Mankin score for osteoarthritis[J]. J Orthop Res, 1992, 10 (1) :58–61 . |
| [11] | LAVERTY S, GIRARD C A, WILLIAMS J M, et al. The OARSI histopathology initiative-recommendations for histological assessments of osteoarthritis in the rabbit[J]. Osteoarthritis Cartilage, 2010, 18 . |
| [12] | CHAN F K, LANAS A, SCHEIMAN J, et al. Celecoxib versus omeprazole and diclofenac in patients with osteoarthritis and rheumatoid arthritis(CONDOR):a randomised trial[J]. Lancet, 2010, 376 (9736) :173–179 . |
| [13] | ZENG C, GAO S G, LEI G H. Viscosupplementation for osteoarthritis of the knee[J]. N Engl J Med, 2015, 372 (26) :2569–2570 . |
| [14] | NEUHOLD L A, KILLAR L, ZHAO W, et al. Postnatal expression in hyaline cartilage of constitutively active human collagenase-3(MMP-13) induces osteoarthritis in mice[J]. J Clin Invest, 2001, 107 (1) :35–44 . |
| [15] | ECHTERMEYER F, BERTRAND J, DREIER R, et al. Syndecan-4 regulates ADAMTS-5 activation and cartilage breakdown in osteoarthritis[J]. Nat Med, 2009, 15 (9) :1072–1076 . |
| [16] | GLASSON S S, ASKEW R, SHEPPARD B, et al. Deletion of active ADAMTS5 prevents cartilage degradation in a murine model of osteoarthritis[J]. Nature, 2005, 434 (7033) :644–648 . |
| [17] | LI N G, SHI Z H, TANG Y P, et al. New hope for the treatment of osteoarthritis through selective inhibition of MMP-13[J]. Curr Med Chem, 2011, 18 (7) :977–1001 . |
| [18] | JABERI F M. Osteochondritis dissecans of the weight-bearing surface of the medial femoral condyle in adults[J]. Knee, 2002, 9 (3) :201–207 . |
| [19] | SCHMITZ N, LAVERTY S, KRAUS V B, et al. Basic methods in histopathology of joint tissues[J]. Osteoarthritis Cartilage, 2010, 18 (3) :S113–S116 . |
| [20] | KATO T, MIYAKI S, ISHITOBI H, et al. Exosomes from IL-1β stimulated synovial fibroblasts induce osteoarthritic changes in articular chondrocytes[J]. Arthritis Res Ther, 2014, 16 (4) :163 . |



