2. 杭州领业医药科技有限公司, 浙江 杭州 310058 ;
3. 浙江大学医学院附属第一医院口腔科, 浙江 杭州 310006
2. Hangzhou Solipharma Co. Ltd, Hangzhou 310058,China ;
3. Department of Stomatology,the First Affiliated Hospital,Zhejiang University School of Medicine, Hangzhou 310009, China
感染、先天畸形、外伤、肿瘤等原因所造成的骨缺损在临床上十分常见,治疗难度大。如何促进骨缺损部位的快速愈合,一直是骨科领域亟待解决的医学难题。传统的治疗方法包括自体骨移植、同种异体骨移植和人工骨材料替代[1]。但是自体骨移植来源有限且会给患者带来创伤,异体骨移植容易产生免疫排斥反应,人工骨材料存在成骨性能不确定的缺陷。
1995年Crane等[2]提出的骨组织工程概念已成为目前大规模骨缺损修复的主流方向。近年来,随着生命科学、材料学和工程学的发展,骨组织工程研究越来越深入[3]。骨组织工程即应用生物组织工程技术,将种子细胞与支架材料复合,同时携载促种子细胞分化或组织修复的生长因子,最终形成与自体骨结构功能相似的人体组织工程骨,以修复缺损骨组织。种子细胞、生长因子、支架材料构成了组织工程的三要素,其中支架材料是骨组织工程的关键,可为种子细胞和新生细胞的黏附、生长、增殖、新陈代谢提供支撑,并为新生组织提供力学和生理学环境。理想的骨组织工程支架需具备良好的生物相容性、适当的生物可降解性、适宜的孔隙率和力学性能,能模拟天然骨的基质微环境、生物因子微环境及生物力学微环境[4-5]。
目前应用于骨组织工程中的支架材料主要为:天然高分子材料、合成高分子材料和无机材料。这三类材料在应用过程中均存在以下问题:天然高分子材料机械性能和电学性能不够理想;合成高分子材料亲水性、细胞相容性及力学性能较差;无机材料硬度过高,脆性过大[6-8]。上述单一材料难以满足理想骨组织支架的需求,而通过不同材料的组合,可以克服单一材料的缺点,制备出与骨组织天然构造更加吻合,具有良好的生物相容性、骨传导性以及骨诱导性的骨组织工程支架。纳米材料因其纳米尺度效应所表现出的特殊的物理、化学和生物学特性被广泛用于骨组织工程复合支架[9]。近年来研究发现,碳纳米管(carbon nanotube)是一种用于构建复合骨组织工程支架较为理想的纳米材料[10-11],具有优良的机械性能和力学性能,目前在骨组织支架的构建上有广泛应用[12-15]。本文对碳纳米管复合骨组织工程支架的现状与前景进行综述。
1 碳纳米管及其细胞生物学响应碳纳米管是日本科学家Iijima于1991年发现的由石墨片层按照一定螺旋角卷曲而成的直径为纳米级的空心小管[16]。按照石墨烯片的层数可分为:单壁碳纳米管(single-walled carbon nanotubes,SWCNT)和多壁碳纳米管(multi-walled carbon nanotubes,MWCNT)。碳纳米管碳环结构的sp2杂化形成的C=C共价键使其具有优良的力学性质,其杨氏模量高达1.8 TPa[17],强度约为钢的100倍;弹性应变可达5%~18%,约为钢的60倍;同时碳纳米管还具有极高的韧性,当外加压力超过其强度极限时,碳纳米管能大角度可逆性弯曲[18]。碳纳米管优良的机械性能和力学性能使其可作为一种补强材料,应用于骨组织工程,增加支架的强度和导电性,制备出强度高、韧性好的复合支架。
骨组织工程中种子细胞与支架材料的相互作用是支架构建的关键。如图 1,碳纳米管的高比表面积、纳米拓扑结构、表面修饰、力学性质能促进蛋白的吸附和细胞的黏附、增殖和分化[19]。研究发现,碳纳米管支架对成骨细胞[20]、软骨细胞[21]、骨髓间充质干细胞[22-23]的黏附、增殖和分化均有促进作用。
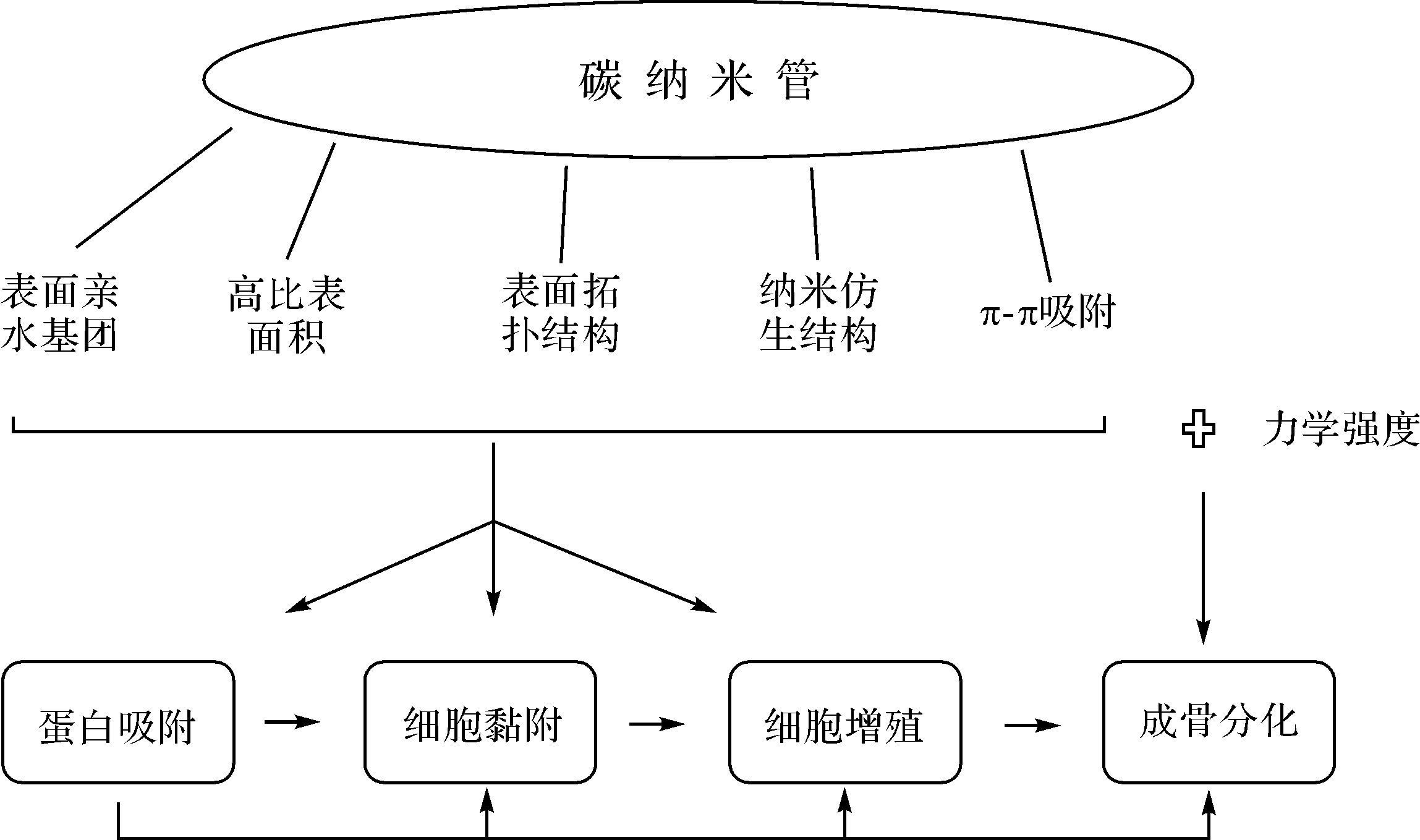
|
| 图 1 碳纳米管的细胞生物学效应 Fig. 1 Cell biological effect of carbon nanotubes |
碳纳米管作为骨组织工程支架材料具有可靠的理论支撑:第一,碳纳米管良好的强度、弹性、抗疲劳性使其成为骨组织工程复合支架中优良的补强材料,与复合物界面产生较强的结合,能够有效传递载荷,提高材料的强度和韧性[24-25];第二,碳纳米管三维多孔结构具有高比表面积,有利于更多的蛋白吸附和细胞黏附生长[26];第三,碳纳米管连通的纳米网状结构和适宜的孔隙率有利于骨组织细胞外基质的物质交换[27];第四,碳纳米管的导电性是可控的,通过调节管径、管长、碳管弯曲程度等参数可实现碳纳米管导电性的定向改变,从而调节细胞生理学行为[28]。但单一碳纳米管支架其轴向强度、韧性和弹性模量均远高于人体骨组织,与人体组织匹配性不佳;此外,碳纳米管还有潜在的毒副作用,可引发免疫反应。因此,单一碳纳米管支架并不适合培养再生骨组织,但通过与其他材料的复合应用,碳纳米管可发挥其独特的力学、电学以及表面性能,提高复合材料的力学性能和骨传导性[29- 30]。碳纳米管常与无机材料、天然可降解高分子材料、人工合成可降解高分子材料组合,构建复合骨组织工程支架。碳纳米管复合支架的构建和应用已成为目前骨组织工程领域的研究热点,见表 1。
| 种类 | 优点 | 缺点 | 参考文献 | |
| 无机材料 | 生物陶瓷类(磷酸钙、碳酸钙、硫酸钙陶瓷)、 | 化学组成、晶型结构与人体骨的无机成分相似,具有仿生性 | 脆性大 、抗弯强度低 | [31-34] |
| 生物活性玻璃 | 降解产物能够促进生长因子生成、促细胞增殖、增强成骨细胞的基因表达和骨组织的生长 | 其中的硅成分在体内不能完全降解;机械强度低、脆性大、抗弯强度低 | ||
| 天然可降解高分子 | 多孔金属(钛及钛合金、钴钛合金、记忆合金) | 强度和韧性好 | 结构和性质与骨组织相差很大,不能与骨组织发生化学键性的结合,生物相容性不佳 | [35-39] |
| 胶原、壳聚糖、藻酸盐、纤维蛋白 | 具有天然网孔结构,来源丰富,制作方便经济 | 机械强度低,降解快,电学性能弱 | ||
| 人工合成的可降解高分子 | 聚氨酯类、聚氨基酸、聚 酸酐等 | 生物相容性、可降解性、可吸收性 | 机械强度不足,对细胞吸附力较弱,表面缺乏细胞信号识别位点 | [40-44] |
| 无机材料/天然高分子复合支架 | 羟基磷灰石—明胶羟基磷灰石—壳聚糖等 | 无机材料的骨传导和骨诱导性,以及天然材料的生物相容性 | 尚不明确 | [45-48] |
| 无机材料/人工合成高分子复合支架 | 羟基磷灰石—聚已酸内 酯、羟基磷灰石—聚乳 酸等 | 无机材料的骨传导和骨诱导性以及人工合成高分子结构和降解时间可控 | 尚不明确 | [49-51] |
骨组织工程中常用的无机材料有生物陶瓷类、生物活性玻璃和多孔金属。其中羟基磷灰石(hydroxyapatite,HA)、珊瑚常与碳纳米管复合,构建骨组织工程支架。
HA的化学组成以及晶体结构与人体骨的无机成分相似,无毒副作用,界面活性优于各类医用钛合金,在骨组织工程应用中具有良好的生物活性。此外,纳米HA具有相互连通孔隙结构,利于骨组织的微循环和营养物质交换,能促进纤维组织和新生骨的结合与生长;与天然骨基质成分相似,其具有良好的骨引导性和骨融合性,在生物硬组织修复和替换方面一直倍受关注[31]。但纳米HA脆性大 、抗弯强度低,不能满足骨组织工程材料的力学性质要求;加入具有高强度、高韧性和良好稳定性的碳纳米管可以改善HA支架的机械性能。Balani等[32]应用静电纺丝技术将碳纳米管均匀分散在 HA涂层上,复合材料的断裂韧性提高了56%,结晶度提升了27%;人成骨细胞系hFOB 1.19在该碳纳米管—HA支架上生长增殖良好[33-34]。
2.2 碳纳米管—天然可降解高分子复合支架骨组织工程中常见的天然可降解高分子材料有胶原、壳聚糖、藻酸盐、纤维蛋白等。天然可降解高分子材料具有天然网孔结构,来源丰富,制作方便经济,但存在着机械强度低、降解快、电学性能弱等问题,碳纳米管的高强度和导电性可以很好地弥补天然高分子材料的缺陷。
Ⅰ型胶原和透明质胶是正常骨组织主要的有机成分,他们能与骨细胞表面特异性的抗体结合,通过激活细胞信号通路,促进骨细胞的黏附、增殖和分化,同时能诱导矿物质在骨组织支架表面的沉积,促进植入体内的支架与机体组织的融合。Bhattacharyya 等[35]将SWCNT分散于透明质酸水溶液中,交联得到SWCNT-HA水凝胶,水凝胶支架中2wt%(质量分数)碳纳米管明显提高了支架的机械性能,储能模量增强到300%。Da Silva等[36]制备了胶原蛋白和碳纳米管复合的三维支架,碳纳米管的加入明显改善了支架的机械强度,且促进了支架表面的矿化反应。Park等[37]制备了碳纳米管复合细菌纤维素的多孔三维支架,碳纳米管—细菌纤维素支架显示出更好的骨传导性和骨诱导性。壳聚糖(chitosan)是一种常见的天然多糖,与动物体内的糖胺聚糖结构类似,具有仿生性,可促进骨形成,无抗原性、无毒性,具有良好的组织相容性,在骨组织工程中的应用广泛[38]。Venkatesan等[39]采用冷冻干燥法制备了壳聚糖—碳纳米管复合支架,其孔隙率、吸水率均随着碳纳米管含量的增加而升高,且细胞在壳聚糖—碳纳半管复合支架上的增殖、蛋白含量、碱性磷酸酶活性、矿化水平均优于壳聚糖支架。
2.3 碳纳米管—人工合成可降解高分子复合支架人工合成可降解高分子具有良好的加工性能,降解速度可控,目前用于制备骨组织工程支架的人工合成高分子主要有聚氨酯类、聚氨基酸、聚酸酐等。其中聚乳酸、聚羟基乙酸及聚乳酸—羟基乙酸共聚物(poly lactic-co-glycolic acid,PLGA )应用最为广泛[40]。这类材料具有良好的生物相容性、可降解性、可吸收性;但材料机械强度不足,对细胞吸附力较弱,且表面缺乏细胞信号识别位点[41]。碳纳米管的加入可以改善人工合成可降解高分子支架的机械性能,增加支架与种子细胞的亲和力。
Mikael等[42]制备了含3%碳纳米管的PLGA多孔支架,碳纳米管的加入显著增强了支架的抗压强度和杨氏模量;体外细胞实验显示,碳纳米管与PLGA复合支架对细胞有良好的亲和性,能促进细胞增殖以及骨矿化。Das等[43]制备了蛋白修饰的MWCNT和超支化聚氨酯组合的纳米复合材料,其中蛋白修饰的MWCNT体内外都表现出很好的生物相容性,人成骨肉瘤MG63细胞在聚氨酯纳米复合材料上表现出更好的细胞黏附、细胞铺展和细胞增殖特性;植入30~45 d后90%~93%的骨缺损部位被新生骨组织填充;细胞因子表达分析、生化分析、血液相容性研究结果均表明:聚氨酯纳米复合材料无致敏反应和毒性反应。Cheng等[44]采用烧铸溶出法制备了碳纳米管—聚乳酸复合支架,检测结果显示,碳纳米管的加入明显改善了支架的机械性能,支架表面的拓扑结构的改变更有利于小鼠成骨细胞MC3T3-E1的黏附和增殖。
2.4 碳纳米管—无机材料—天然高分子复合支架碳纳米管—无机材料—天然高分子复合支架结合了碳纳米管良好的机械性能和导电性、无机材料的骨传导和骨诱导性以及天然材料的生物相容性。Wang等[45]应用静电纺丝技术制备了“明胶—碳纳米管—羟基磷灰石”纳米纤维多孔支架,支架强度达(7.90±0.32) MPa,孔隙率达91.2%,HA纳米颗粒对骨生成和骨矿化有较好的促进作用,碳纳米管与HA能协同促进磷灰石的形成,成骨细胞hFOBs在该支架上黏附生长增殖良好,细胞形态、细胞增殖都明显优于明胶支架和明胶—HA支架。Chen等[46]制备了壳聚糖—多壁碳纳米管—HA纳米复合材料,复合材料中碳纳米管掺入比例从0增加至5%,随之支架材料的弹性模量从509.9 MPa增加到1089.1MPa,抗压强度从33.2 MPa增加到105.5 MPa。Fonseca-García等[47]采用深度冷冻—层层自组装技术制备了仿生壳聚糖—碳纳米管—羟基磷灰石(CHI-CNT-HA)多孔三维支架,研究骨膜间充质干细胞与CHI-CNT-HA支架生物相容性,发现骨膜间充质干细胞免疫表型并未改变,支架与其有较好的生物相容性。
2.5 碳纳米管—无机材料—人工合成高分子复合支架碳纳米管—无机材料—人工合成高分子复合支架结合了碳纳米管良好的机械性能和导电性,无机材料的骨传导和骨诱导性以及人工合成高分子材料的结构和降解性可控的特点[48]。
Gonalves等[49]采用三维打印技术,制备了纳米HA—碳纳米管—聚已酸内酯(PCL)复合支架,该三维支架结合了碳纳米管良好的机械性能和导电性能以及HA良好的生物相容性和细胞黏附性。Siqueira 等[50] 应用电沉积方法制备了表面垂直排列碳纳米管复合外消旋聚乳酸—纳米HA骨组织工程支架,改善了HA的表面性质,增加支架材料对细胞的黏附,该支架有良好的细胞活性,无免疫炎症反应,体外有矿化作用,能诱导骨组织缺损部位的骨重建。Dorj等[51]制备了PCL-HA—离子键修饰的碳纳米管(imCNT)复合支架。imCNT的加入使支架整体的强度增加了1.5倍,弹性模量增加了2.5倍,支架在人工模拟体液中矿化良好,MC3T3-E1细胞在PCL-HA-imCNT和PCL-HA支架上的增殖率大于在PCL支架的增殖率;将PCL-HA-imCNT支架植入大鼠皮下组织,4周后发现支架孔隙通道有血管的形成和纤维软组织的长入,体内无炎症反应。
3 碳纳米管复合支架的制备方法目前碳纳米管复合支架的制备方法主要有粒子致孔法、热致相分离或冷冻干燥法、微球聚集法、静电纺丝和三维打印技术。
3.1 粒子致孔法粒子致孔法在碳纳米管组织工程支架的制备中有广泛运用[52],其原理是利用材料和致孔剂的溶解性和挥发性不同,将骨组织工程材料和致孔剂粒子制成均匀的混合物,除去混合物中致孔剂从而得到多孔支架。其中最常见的是溶液烧注—粒子浸滤,即利用盐晶作为致孔剂,将聚合物溶液与均一的盐晶混合,溶剂挥发后形成固体的聚合物—盐复合体,浸没在水中去除盐,一般制得的支架孔隙率达93%。
3.2 热致相分离或冷冻干燥法热致相分离或冷冻干燥法是将复合物支架材料在低温下冷冻,冷冻过程中发生相分离,然后冷冻干燥除去复合物支架材料中的溶剂成分而形成多孔结构,该方法在碳纳米管复合支架的制备中有广泛应用[47, 53]。热致相分离或冷冻干燥法制备的支架往往尺寸偏小,但制备过程避免了高温对材料的破坏。
3.3 微球聚集法微球聚集法是运用微球在热处理过程中相互接触,处于链运动的微球会相互连接,当停止热运动冷却至室温时微球间的连接结构被固定的原理,将支架材料微球加入到组织工程的模具中,加热至材料的玻璃化温度以上,再经过冷却、脱模、烧结,制备得到多孔微球支架[54-55]。该法的优点是孔相连通性好,孔尺寸易调控,微球可包裹药物、生长因子,可制备载药控释支架,且制备得到的支架力学强度大;缺点是孔尺寸偏小,孔隙率偏低。
3.4 静电纺丝技术随着纳米技术的发展,静电纺丝作为一种简便有效地生产纳米纤维的新型加工技术在生物医用材料和组织工程支架的构建上发挥着巨大的作用[56-57]。静电纺丝主要过程是高分子流体静电雾化时,分裂出聚合物产生的微小射流,可以运行相当长的距离最终固化成纤维。其优点是操作简单,缺点是制备过程耗时长,制备得到的静电纺丝纤维排布不规律[58]。
3.5 三维打印技术三维打印是通过计算机程序控制,将混合处理好的组织工程材料与三维打印黏合材料装入打印机喷嘴,通过预先输入的计算机程序,逐层打印构造支架[59]。目前三维打印在组织工程领域引起了研究热潮,在制备骨组织工程支架中,运用该技术将不同的材料混合,可制备出特定结构的骨支架[60-61]。三维打印支架的优点是成型时间短,利于大规模自动化生产,孔距大小、支架性状可调控,可根据不同组织和个体的临床治疗需求,制备出具有个体特征的骨组织工程支架;三维打印支架缺点是孔隙率通常偏低。Gonalaves等[49]采用三维打印技术制备了HA—碳纳米管—聚己酸内酯三维复合支架,该支架内部有相互连通的孔隙,孔径大小分布在450~700 μm,该三维复合支架的抗压强度约为4 MPa,与人体松质骨相当。2wt%(质量百分数)的碳纳米管改善了支架的机械性能和导电性能;在模拟人工体液中支架表面有钙离子、磷离子的沉积;碳纳米管成分可促进人成骨肉瘤MG63细胞的黏附、铺展,证明了该三维打印的三维混合材料是有潜力的骨组织工程支架材料。
4 问题与展望碳纳米管因其良好的机械性能和骨传导性,与上文论述的几种材料复合使用,在骨组织工程复合支架的制备上有很好的应用前景。但是应用中仍存在许多问题:第一,碳纳米管潜在的毒性是影响其在骨组织工程应用的一个主要因素;第二,碳纳米管种类繁多,不同管壁、长度、管径、比表面积和表面修饰均可影响其性质;第三,碳纳米管的分散性问题限制了其应用,如何改善其分散性也是碳纳米管作为骨组织工程支架材料亟须解决的问题。针对这些问题,在使用碳纳米管复合支架时,其生物相容性和生物安全性有待进一步研究。目前有研究报道碳纳米管在体内外的毒副作用,主要是由于制备过程中带入的金属催化剂引起的,尝试通过对碳纳米管进行纯化以减毒。也有不少研究者在研究比较不同类型碳纳米管的性质及其与细胞组织的相容性,日后可为骨组织工程支架应用时选择合适的碳纳米管类型提供参考。针对碳纳米管的分散性及分散性引起的生物相容性问题,研究者主要致力于通过共价修饰或非共价修饰的方法来改善碳纳米管的分散性和生物相容性[62]。另外,通过生物相容性良好的天然高分子(如胶原、丝素蛋白、壳聚糖等)对支架进行表面修饰,可改善碳纳米管在体内的降解性,使降解产物无毒副作用[63-64]。
此外,携载药物或生长因子的组织工程支架引起了研究者们的关注[65]。考虑到碳纳米管作为药物载体的潜力,将骨移植手术中用到的抗感染、治疗骨质疏松、促进骨生长等药物或生长因子通过碳纳米管的携载,赋予碳纳米管复合支架载药的功能,可更好地促进骨组织的修复与再生。此外,三维打印技术目前在组织工程领域研究广泛,该技术制备的支架宏观和微观结构均可控,有良好的仿生性,三维打印技术应用于碳纳米管复合骨组织支架的构建值得期待。目前有关碳纳米管复合支架的研究主要处于体外实验或动物实验阶段,临床应用还需要有更多的理论依据及临床实践的支撑。随着碳纳米管表面化学、毒理学研究的深入,生物相容性良好、具有一定降解性或降解产物安全的“人体友好型”碳纳米管有望诞生。在新型的骨组织工程支架制备技术驱动下,碳纳米管复合骨组织工程支架的应用将会有更完善的发展。
| [1] | CYPHER T J, GROSSMAN J P. Biological principles of bone graft healing[J]. J Foot Ankle Surg, 1996, 35 (5) :413–417 . |
| [2] | CRANE G M, ISHAUG S L, MIKOS A G. Bone tissue engineering[J]. Nat Med, 1995, 1 (12) :1322–1324 . |
| [3] | BLACK C R, GORIAINOV V, GIBBS D, et al. Bone tissue engineering[J]. Curr Mol Biol Rep, 2015, 1 (3) :132–140 . |
| [4] | GONG T, XIE J, LIAO J, et al. Nanomaterials and bone regeneration[J]. Bone Res, 2015, 3 :15029 . |
| [5] | BURG K J L, PORTER S, KELLAM J F. Biomaterial developments for bone tissue engineering[J]. Biomaterials, 2000, 21 (23) :2347–2359 . |
| [6] | SILVA G A, COUTINHO O P, DUCHEYNE P, et al. Materials in particulate form for tissue engineering. 2. Applications in bone[J]. J Tissue Eng Regen Med, 2007, 1 (2) :97–109 . |
| [7] | EARTHMAN J C, LI Y, VANSCHOIACK L R, et al. Reconstructive materials and bone tissue engineering in implant dentistry[J]. Dent Clin North Am, 2006, 50 (2) :229–244 . |
| [8] | 何创龙, 王远亮, 杨立华, 等. 骨组织工程天然衍生细胞外基质材料[J]. 中国生物工程杂志, 2003, 23 (8) : 11–17 . HE Chuanglong, WANG Yuanliang, YANG Lihua, et al. Recent advances in natural derived extracellular matrix materials in bone tissue engineering[J]. Journal of Chinese Biotechnology, 2003, 23 (8) :11–17 . |
| [9] | ZHANG L, WEBSTER T J. Nanotechnology and nanomaterials: promises for improved tissue regeneration[J]. Nano Today, 2009, 4 (1) :66–80 . |
| [10] | HOPLEY E L, SALMASI S, KALASKAR D M, et al. Carbon nanotubes leading the way forward in new generation 3D tissue engineering[J]. Biotechnol Adv, 2014, 32 (5) :1000–1014 . |
| [11] | ABARRATEGI A, GUTIÉRREZ M C, MORENO-VICENTE C, et al. Multiwall carbon nanotube scaffolds for tissue engineering purposes[J]. Biomaterials, 2008, 29 (1) :94–102 . |
| [12] | FERREIRA L, KARP J M, NOBRE L, et al. New opportunities: the use of nanotechnologies to manipulate and track stem cells[J]. Cell Stem Cell, 2008, 3 (2) :136–146 . |
| [13] | BARI S, CHU P P Y, LIM A, et al. Protective role of functionalized single walled carbon nanotubes enhance ex vivo expansion of hematopoietic stem and progenitor cells in human umbilical cord blood[J]. Nanomedicine, 2013, 9 (8) :1304–1316 . |
| [14] | ZHAO B, HU H, MANDAL S K, et al. A bone mimic based on the self-assembly of hydroxyapatite on chemically functionalized single-walled carbon nanotubes[J]. Chem Mater, 2005, 17 (12) :3235–3241 . |
| [15] | MATTSON M P, HADDON R C, RAO A M. Molecular functionalization of carbon nanotubes and use as substrates for neuronal growth[J]. J Mol Neurosci, 2000, 14 (3) :175–182 . |
| [16] | IIJIMA S. Helical microtubules of graphitic carbon[J]. Nature, 1991, 354 (6348) :56–58 . |
| [17] | TREACY M M J, EBBESEN T W, GIBSON J M. Exceptionally high Young's modulus observed for individual carbon nanotubes[J]. Nature, 1996, 381 (6584) :678–680 . |
| [18] | WONG E W, SHEEHAN P E, LIEBER C M. Nanobeam mechanics: elasticity, strength, and toughness of nanorods and nanotubes[J]. Science, 1997, 277 (5334) :1971–1975 . |
| [19] | VAGASKA B, BACAKOVA L, FILOVA E, et al. Osteogenic cells on bio-inspired materials for bone tissue engineering[J]. Physiol Res, 2010, 59 (3) :309–322 . |
| [20] | ANTONIOLI E, LOBO A O, FERRETTI M, et al. An evaluation of chondrocyte morphology and gene expression on superhydrophilic vertically-aligned multi-walled carbon nanotube films[J]. Mater Sci Eng C Mater Biol Appl, 2013, 33 (2) :641–647 . |
| [21] | CHAHINE N O, COLLETTE N M, THOMAS C B, et al. Nanocomposite scaffold for chondrocyte growth and cartilage tissue engineering: effects of carbon nanotube surface functionalization[J]. Tissue Eng Part A, 2014, 20 (17-18) :2305–2315 . |
| [22] | BARRIENTOS-DURÁN A, CARPENTER E M, ZUR NIEDEN N I, et al. Carboxyl-modified single-wall carbon nanotubes improve bone tissue formation in vitro and repair in an in vivo rat model[J]. Int J Nanomed, 2014, 9 :4277–4291 . |
| [23] | NAYAK T R, JIAN L, PHUA L C, et al. Thin films of functionalized multiwalled carbon nanotubes as suitable scaffold materials for stem cells proliferation and bone formation[J]. ACS Nano, 2010, 4 (12) :7717–7725 . |
| [24] | EDWARDS S L, WERKMEISTER J A, RAMSHAW J A. Carbon nanotubes in scaffolds for tissue engineering[J]. Expert Rev Med Devic, 2009, 6 (5) :499–505 . |
| [25] | SAHITHI K, SWETHA M, RAMASAMYA K, et al. Polymeric composites containing carbon nanotubes for bone tissue engineering[J]. Int J Biol Macromol, 2010, 46 (3) :281–283 . |
| [26] | GU M, LIU Y, CHEN T, et al. Is graphene a promising nano-material for promoting surface modification of implants or scaffold materials in bone tissue engineering?[J]. Tissue Eng Part B Rev, 2014, 20 (5) :477–491 . |
| [27] | MARTINS-JUNIOR P A, ALCANTARA C E, RESENDE R R, et al. Carbon nanotubes: directions and perspectives in oral regenerative medicine[J]. J Dent Res, 2013, 92 (7) :575–583 . |
| [28] | SHAO S, ZHOU S, LI L, et al. Osteoblast function on electrically conductive electrospun PLA/MWCNTs nanofibers[J]. Biomaterials, 2011, 32 (11) :2821–2833 . |
| [29] | GUO X, XU H. Research and development of biomedical application of carbon nanotubes and related composites[J]. J Biomed Eng, 2006, 23 (2) :438–441 . |
| [30] | SAHITHI K, SWETHA M, RAMASAMY K, et al. Polymeric composites containing carbon nanotubes for bone tissue engineering[J]. Int J Biol Macromol, 2010, 46 (3) :281–283 . |
| [31] | VENKATESAN J, NITHYA R, SUDHA P N, et al. Role of alginate in bone tissue engineering[J]. Adv Food Nutr Res, 2014, 73 :45–57 . |
| [32] | BALANI K, ANDERSON R, LAHA T, et al. Plasma-sprayed carbon nanotube reinforced hydroxyapatite coatings and their interaction with human osteoblasts in vitro[J]. Biomaterials, 2007, 28 (4) :618–624 . |
| [33] | LIU J, GAO C, FENG P, et al. A bioactive glass nanocomposite scaffold toughed by multi-wall carbon nanotubes for tissue engineering[J]. J Ceram Soc Jap, 2015, 123 (1438) :485–491 . |
| [34] | NEWMAN P, LU Z, ROOHANI-ESFAHANI S I, et al. Porous and strong three-dimensional carbon nanotube coated ceramic scaffolds for tissue engineering[J]. J Mater Chem B, 2015, 3 (42) :8337–8347 . |
| [35] | BHATTACHARYYA S, GUILLOT S, DABBOUE H, et al. Carbon nanotubes as structural nanofibers for hyaluronic acid hydrogel scaffolds[J]. Biomacromolecules, 2008, 9 (2) :505–509 . |
| [36] | DA SILVA E E, DELLA COLLETA H H M, FERLAUTO A S, et al. Nanostructured 3-D collagen/nanotube biocomposites for future bone regeneration scaffolds[J]. Nano Res, 2009, 2 (6) :462–473 . |
| [37] | PARK S, PARK J, JO I, et al. In situ hybridization of carbon nanotubes with bacterial cellulose for three-dimensional hybrid bioscaffolds[J]. Biomaterials, 2015, 58 :93–102 . |
| [38] | VENKATESAN J, KIM SK. Chitosan composites for bone tissue engineering-an overview[J]. Marine Drugs, 2010, 8 (8) :2252–2266 . |
| [39] | VENKATESAN J, RYU B, SUDHA P N, et al. Preparation and characterization of chitosan-carbon nanotube scaffolds for bone tissue engineering[J]. Int J Biol Macromol, 2012, 50 (2) :393–402 . |
| [40] | RAY S S. Polylactide-based bionanocomposites: a promising class of hybrid materials[J]. Acc Chem Res, 2012, 45 (10) :1710–1720 . |
| [41] | PAN L, PEI X, HE R, et al. Multiwall carbon nanotubes/polycaprolactone composites for bone tissue engineering application[J]. Colloid Surface B, 2012 (93) :226–234 . |
| [42] | MIKAEL P E, AMINI A R, BASU J, et al. Functionalized carbon nanotube reinforced scaffolds for bone regenerative engineering: fabrication, in vitro and in vivo evaluation[J]. Biomed Mater, 2014, 9 (3) :035001 . |
| [43] | DAS B, CHATTOPADHYAY P, MAJI S, et al. Bio-functionalized MWCNT/ hyperbranched polyurethane bionanocomposite for bone regeneration[J]. Biomed Mater, 2015, 10 (2) :025011 . |
| [44] | CHENG Q, RUTLEDGE K, JABBARZADEH E. Carbon nanotube-poly(lactide-co-glycolide) composite scaffolds for bone tissue engineering applications[J]. Ann Biomed Eng, 2013, 41 (5) :904–916 . |
| [45] | WANG H, CHU C, CAI R, et al. Synthesis and bioactivity of gelatin/multiwalled carbon nanotubes/hydroxyapatite nanofibrous scaffolds towards bone tissue engineering[J]. RSC Adv, 2015, 5 (66) :53550–53558 . |
| [46] | CHEN L, HU J, SHEN X, et al. Synthesis and characterization of chitosan-multiwalled carbon nanotubes/hydroxyapatite nanocomposites for bone tissue engineering[J]. J Mater Sci-Mater EL, 2013, 24 (8) :1843–1851 . |
| [47] | FONSECA-GARCÍA A, MOTA-MORALES J D, QUINTERO-ORTEGA I A, et al. Effect of doping in carbon nanotubes on the viability of biomimetic chitosan-carbon nanotubes-hydroxyapatite scaffolds[J]. J Biomed Mater Res A, 2014, 102 (10) :3341–3351 . |
| [48] | RAJESH R, DOMINIC RAVICHANDRAN Y. Development of a new carbon nanotube-alginate-hydroxyapatite tricomponent composite scaffold for application in bone tissue engineering[J]. Int J Nanomed, 2015, 10 (Suppl 1) :7–15 . |
| [49] | GONÜALVES E M, OLIVEIRA F J, SILVA R F, et al. Three-dimensional printed PCL-hydroxyapatite scaffolds filled with CNTs for bone cell growth stimulation[J]. J Biomed Mater Res B Appl Biomater, 2015 :33432 . |
| [50] | SIQUEIRA I A, CORAT M A, CAVALCANTI B, et al. In vitro and in vivo studies of novel poly(D,L-lactic acid), superhydrophilic carbon nanotubes, and nanohydroxyapatite scaffolds for bone regeneration[J]. ACS Appl Mater Inter, 2015, 7 (18) :9385–9398 . |
| [51] | DORJ B, WON J E, KIM J H, et al. Robocasting nanocomposite scaffolds of poly(caprolactone)/hydroxyapatite incorporating modified carbon nanotubes for hard tissue reconstruction[J]. J Biomed Mater Res A, 2013, 101 (6) :1670–1681 . |
| [52] | SHI X, SITHARAMAN B, PHAM Q P, et al. Fabrication of porous ultra-short single-walled carbon nanotube nanocomposite scaffolds for bone tissue engineering[J]. Biomaterials, 2007, 28 (28) :4078–4090 . |
| [53] | VENKATESAN J, QIAN Z J, RYU B, et al. Preparation and characterization of carbon nanotube-grafted-chitosan-natural hydroxyapatite composite for bone tissue engineering[J]. Carbohyd Polym, 2011, 83 (2) :569–577 . |
| [54] | BORDEN M, ATTAWIA M, KHAN Y, et al. Tissue engineered microsphere-based matrices for bone repair: design and evaluation[J]. Biomaterials, 2002, 23 (2) :551–559 . |
| [55] | GUPTA A, MAIN B J, TAYLOR B L, et al. In vitro evaluation of three-dimensional single-walled carbon nanotube composites for bone tissue engineering[J]. J Biomed Mater Res A, 2014, 102 (11) :4118–4126 . |
| [56] | ZHANG H, CHEN Z. Fabrication and characterization of electrospun PLGA/MWNTs/hydroxyapatite biocomposite scaffolds for bone tissue engineering[J]. J Bioact Compat Pol, 2010, 25 (3) :241–259 . |
| [57] | SHARMA Y, TIWARI A, HATTORI S, et al. Fabrication of conducting electrospun nanofibers scaffold for three-dimensional cells culture[J]. Int J Biol Macromol, 2012, 51 (4) :627–631 . |
| [58] | SAHAY R, KUMAR P S, SRIDHAR R, et al. Electrospun composite nanofibers and their multifaceted applications[J]. J Mater Chem, 2012, 22 (26) :12953–12971 . |
| [59] | JAKUS A E, SECOR E B, RUTZ A L, et al. Three-dimensional printing of high-content graphene scaffolds for electronic and biomedical applications[J]. ACS Nano, 2015, 9 (4) :4636–4648 . |
| [60] | BUTSCHER A, BOHNER M, HOFMANN S, et al. Structural and material approaches to bone tissue engineering in powder-based three-dimensional printing[J]. Acta Biomater, 2011, 7 (3) :907–920 . |
| [61] | KAO C T, LIN C C, CHEN Y W, et al. Poly(dopamine) coating of 3D printed poly(lactic acid) scaffolds for bone tissue engineering[J]. Mater Sci Eng C Mater Biol Appl, 2015, 56 :165–173 . |
| [62] | SOLEYMAN R, HIRBOD S, ADELI M. Advances in the biomedical application of polymer-functionalized carbon nanotubes[J]. Biomater Sci, 2015, 3 (5) :695–711 . |
| [63] | LI X, FAN Y, WATARI F. Current investigations into carbon nanotubes for biomedical application[J]. Biomed Mater, 2010, 5 (2) :3422–3428 . |
| [64] | LIN C, WANG Y, LAI Y, et al. Incorporation of carboxylation multiwalled carbon nanotubes into biodegradable poly(lactic-co-glycolic acid) for bone tissue engineering[J]. Colloid Surface B, 2011, 83 (2) :367–375 . |
| [65] | CIAPETTI G, GRANCHI D, DEVESCOVI V, et al. Enhancing osteoconduction of PLLA-based nanocomposite scaffolds for bone regeneration using different biomimetic signals to MSCs[J]. Int J Mol Sci, 2012, 13 (2) :2439–2458 . |




