2. 浙江大学医学院干细胞与再生医学系 浙江大学李达三·叶耀珍干细胞与再生医学研究中心 浙江省组织工程与再生医学技术重点实验室, 浙江 杭州 310058
2. Center of Stem Cell and Tissue Engineering, Dr. Li Dak Sum & Yip Yio Chin Center for Stem Cell and Regenerative Medicine, Key Laboratory of Stem Cell of Zhejiang Province, Zhejiang University School of Medicine, Hangzhou 310058, China
肌腱损伤是一种常见的运动损伤,占运动损伤的30%以上[1]。目前肌腱损伤的修复方法主要有直接缝合、假体材料移植、自体移植、同种异体移植、异种移植。然而这些方法都有其固有缺陷,如再次断裂、免疫排斥、供体部位并发症等[2-3]。因此,需要新的技术手段来提高肌腱损伤的修复。目前,再生医学组织工程的兴起为肌腱—韧带损伤的修复带来了新的选择和希望[4]。
支架作为肌腱组织工程三要素的重要组成之一,其在肌腱组织损伤修复中的作用越来越重要,尤其是对于那些缺损较大的损伤[5]。近年来,许多研究表明支架的拓扑结构作为初始条件,对细胞的形态、增殖、迁移、分布、分化有着重要的影响,同时对不同形态结构的组织具有不同的修复效果[6-8]。大量的体外研究显示,平行的结构能够使黏附在上面的细胞变得细长,诱导其向肌腱[9]、神经[10]和血管[11]方向分化,从而促进相应组织结构的修复;而紊乱的结构则对细胞骨化有促进作用[12]。同时,体内研究也证实这种平行结构在体内复杂环境中仍然存在明显的促进作用[13]。然而这些研究主要集中在体外的二维平面上进行,或者是薄片的简单叠加,而肌腱—韧带样组织修复需要的是具有一定力学的三维仿生结构的支架,因此需要进一步探究三维结构对细胞的影响。
胶原作为细胞外基质的重要组成部分,有着许多的优势,如来源普遍、较低的抗原性、良好的生物相容性以及可降解等[14]。经典的冻干技术能够得到紊乱的胶原支架[15]。而单向冰冻技术可以快速得到三维的平行胶原支架[16],制造出来的平行胶原支架在形态上与肌腱的脱细胞基质很相似。这两种方法在整个过程中均未涉及任何化学反应,尽可能保留了胶原的生物特性。近期,有研究将肌腱细胞分别种植在平行胶原支架和紊乱胶原支架上,结果显示三维平行结构对细胞增殖无明显促进作用,但是能够促进肌腱细胞的表型形成[17]。然而此研究没有探究三维结构对细胞形态、分布以及细胞外基质形成的影响,而细胞的形态、分布和细胞外基质对修复的整体功能有重要作用。本研究通过单向冰冻技术制作三维平行胶原支架,比较其与传统三维紊乱支架对肌腱干细胞的形态、分布和细胞外基质形成的影响,探究其在体内复杂环境中促进肌腱样细胞外基质形成的作用。
1 材料与方法 1.1 材料、试剂和仪器猪跟腱购于中国杭州三墩农贸市场;新西兰兔购于浙江省医学科学院实验动物中心,后在浙江大学医学院实验动物中心培养;胃蛋白酶购于美国Sigma-Aldrich公司;DMEM培养基、FBS、胰酶购于美国Gibco公司;甲醛、无水乙醇、二甲苯、中性树脂、石蜡、HE 染料购于上海生工生物工程股份有限公司;低温冻干机购于美国Thermo Fisher公司;扫描电镜购于日本日立公司。5543型力学测试仪购于美国英斯特朗公司。
1.2 冰冻法制备胶原支架通过醋酸抽提方法从猪跟腱中提取胶原[15]。将1%的胶原溶液置于有机玻璃模具中,一端通过金属条与装液氮的容器相连,即得到三维平行胶原支架。将1%的胶原溶液置于相同尺寸的有机玻璃模具中,依次放入4 ℃、-20 ℃和-80 ℃冰箱中各2 h,即得到三维紊乱胶原支架。将上述胶原支架放入冻干机中冷冻抽干,去除水分。最后进行真空干热交联(22 ℃放置1 d,110 ℃放置2 d,65 ℃放置1 d)。
1.3 力学测试检测胶原支架的力学性能将材料固定于力学测试仪的拉力固定器上,调整方向使标本竖直向下。当拉伸到材料断裂时停止拉伸,此时的应力为最大拉伸力(N),同时可以得到相应的硬度和弹性模量(MPa)。
1.4 肌腱来源干细胞的培养本实验室前期研究提供兔子肌腱来源干细胞[9]。前期细胞提取实验方法为:将兔子跟腱切碎,用0.25%胶原酶消化过夜,得到的细胞悬液在含有10%FBS的低糖培养基中培养,培养条件为37 ℃、5%二氧化碳、饱和湿度。培养获得的第二代细胞以2×106 /cm2密度种植于6 cm培养皿上,直至单克隆细胞长出,即得到肌腱来源干细胞。在光镜下观察细胞的培养形态。
1.5 扫描电镜检测胶原支架上肌腱来源干细胞的形态特征胶原支架用75%乙醇溶液浸泡1 h,然后用无菌的PBS洗三次,置于24孔板中。取增殖密度约为80%的肌腱来源干细胞,用胰酶消化后,调整细胞密度为2×106/mL,每个支架上滴入100 μL,培养箱中静置2 h后,加入培养基。每三天更换培养基,分别在细胞培养1 d和7 d后取出支架。将种有细胞的支架用2.5%戊二醛固定过夜,用PBS洗三次,加入锇酸固定1 h,PBS洗干净后用梯度丙酮脱水,然后加入乙酸异戊酯浸泡30 min,干燥后喷金,进行扫描电镜观察。
1.6 实验兔皮下异位种植胶原支架三只约2.5 kg的新西兰兔用于支架的皮下种植。动物的处理通过浙江大学医学部实验动物伦理审查。用10%水合氯醛麻醉后,将背部正中约8 cm×6 cm区域的毛剔除干净,沿着正中线切开约2 cm,深达肌膜,用血管钳分别向左右两侧钝性分离,将乙醇溶液浸泡并PBS洗过的支架放入,左边为紊乱胶原支架,右边为平行胶原支架,用缝线固定作为标记,然后逐层缝合。动物放入笼子中自由活动,予以水和食物。两周后取出支架,进行切片观察。
1.7 HE染色检测胶原支架的形态特征取标本,用4%多聚甲醛固定24 h,乙醇梯度脱水,二甲苯透明,浸蜡,石蜡包埋。7 μm厚连续切片,切片烤片后常规用二甲苯脱蜡,经逐级乙醇水化,苏木素染色15 min,水洗;盐酸乙醇分化2 s,水洗,镜检染色情况;伊红液染色10 s;常规乙醇脱水,二甲苯透明,中性树脂封片。
1.8 统计学方法采用SPSS 20.0软件进行统计学分析。各组数据经方差齐性检验呈正态分布,以均数±标准差(x±s)表示,采用Student t检验对两组数据进行差异性检验,P<0.05为差异有统计学意义。
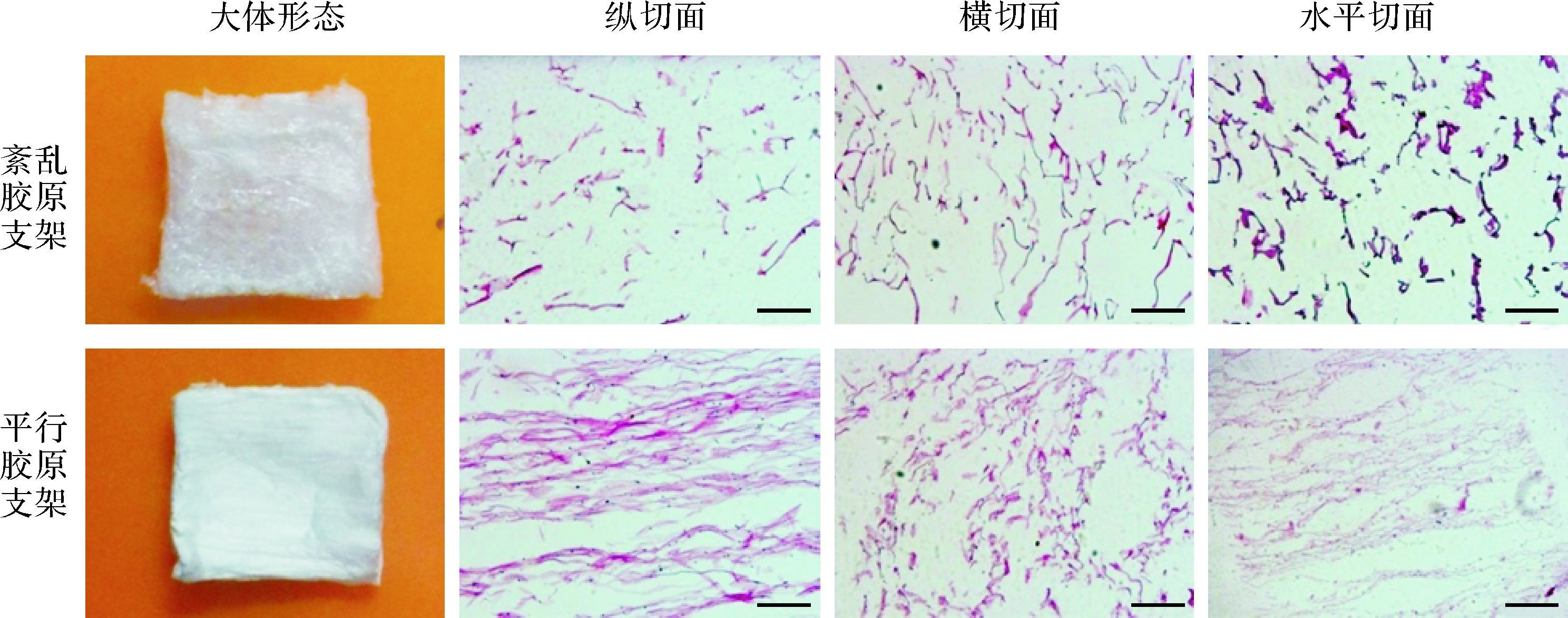
2 结 果 2.1 两种三维胶原支架的形态特征及其力学性能测定结果三维胶原支架制备成功。平行胶原支架显示出平行的结构,并且表面更加亮白,与正常肌腱组织结构相似;而紊乱胶原支架显示棉絮样的不规则蓬松结构。切片的HE染色可见,在纵切面和水平切面上,平行胶原支架的胶原纤维沿轴向有序排列,而紊乱胶原支架在三个面上都是紊乱排列的(图 1)。平行胶原支架的最大拉力、硬度和弹性模量均高于紊乱胶原支架(表 1),提示平行胶原支架的力学性能优于紊乱胶原支架。
|
| 紊乱胶原支架显示出棉絮样的不规则蓬松外观,三个切面上都显示紊乱结构;平行胶原支架有着更加亮白的外观,在纵切面和水平切面上沿轴向有序排列.标尺=200 μm. 图 1 两种三维胶原支架的大体图及光镜下切面的HE染色图 Fig. 1 Gross views and HE staining of three-dimensional collagen scaffolds |
| (x±s) | |||
| 组别 | 最大拉力值(N) | 最大硬度值 | 最大弹性模量值(MPa) |
| 紊乱胶原支架 | 1.26±0.22 | 1.61±0.21 | 0.50±0.10 |
| 平行胶原支架 | 16.24±3.30 | 20.56±2.50 | 22.42±1.39 |
| t值 | -7.841 | -13.078 | -27.295 |
| P值 | <0.05 | <0.01 | <0.01 |
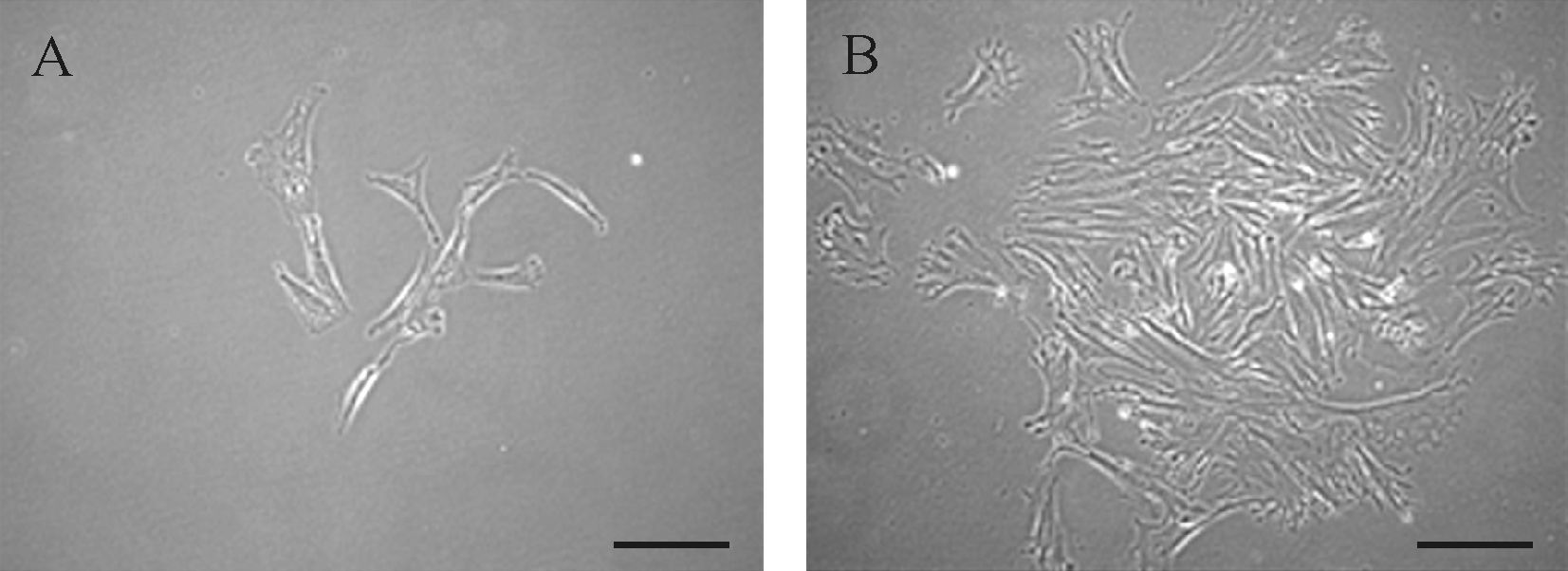
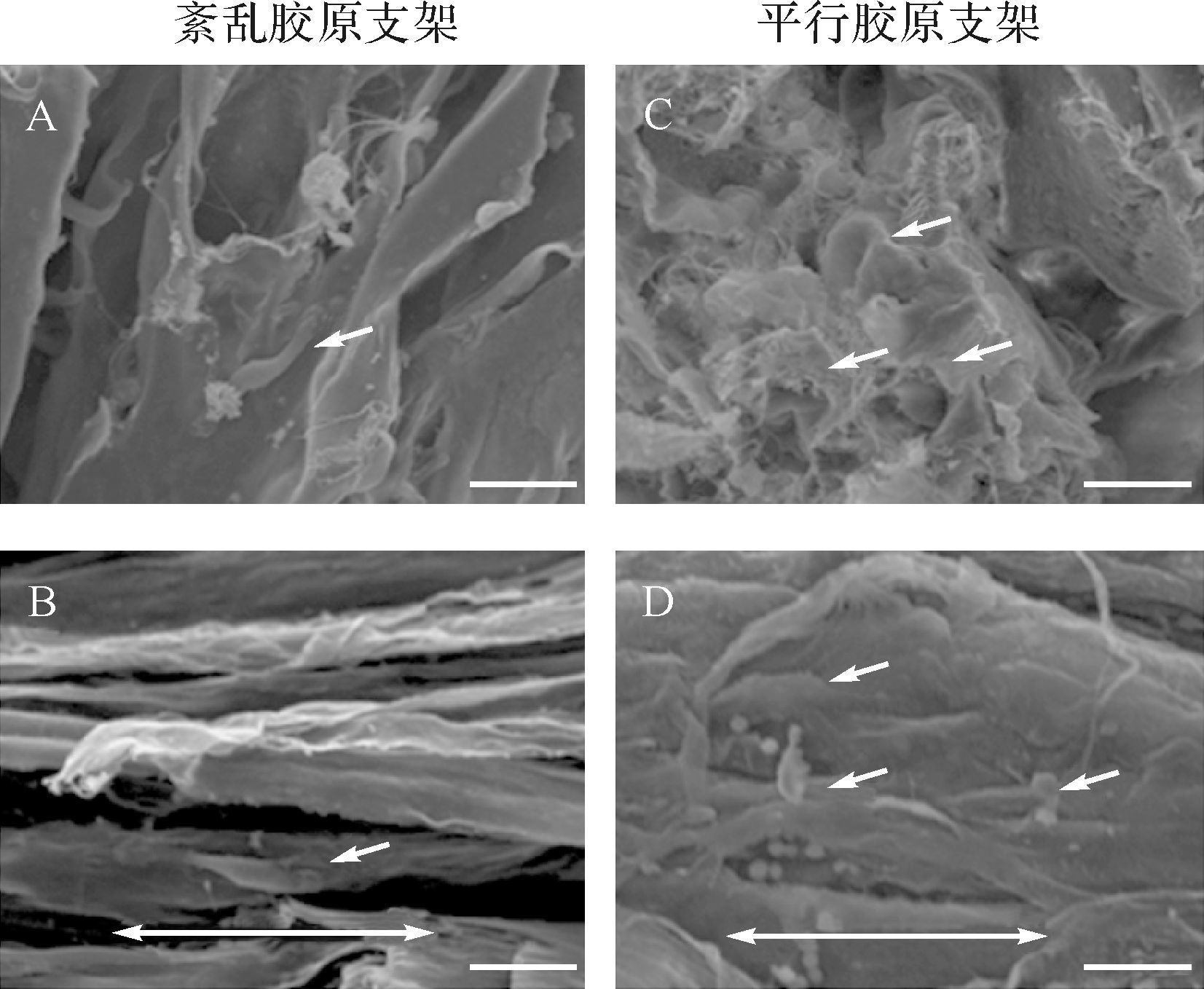
肌腱来源干细胞形态上与纤维样细胞相似(图 2)。两种胶原支架对肌腱干细胞均显示出良好的黏附性。种植细胞1 d后,肌腱干细胞在紊乱胶原支架上无统一方向地随意分布在胶原支架上(图 3A)。而在平行胶原支架上出现了细长的纺锤样细胞,并且细胞均沿着胶原纤维的方向排列(图 3B)。种植7 d后,细胞分泌出细胞外基质,细胞聚集物与相邻的细胞聚集物重叠,细胞开始重叠成一片。在紊乱胶原支架上,重叠形成的细胞层仍然呈紊乱分布(图 3C);而在平行胶原支架上,重叠形成的细胞层沿着胶原纤维的方向排列(图 3D)。
|
| A:肌腱来源干细胞单细胞克隆第3天,细胞形态与纤维样细胞相似,已增殖成多个细胞;B:单细胞克隆第7天,细胞数量较第3天时明显增多.标尺=200 μm. 图 2 肌腱来源干细胞单细胞克隆 Fig. 2 Colony formation of tendon stem/progenitor cells |
|
| A:种植第1天肌腱来源干细胞在紊乱胶原支架上随意分布;B:种植第7天肌腱来源干细胞在紊乱胶原支架上紊乱生长;C:种植第1天肌腱来源干细胞在平行胶原支架上沿胶原纤维的方向排列并出现了细长的纺锤样细胞;D:种植第7天肌腱来源干细胞在平行胶原支架上沿胶原纤维的方向重叠生长.小箭头指示肌腱来源干细胞.双箭头指示平行胶原方向.标尺=50 μm. 图 3 种植在两种胶原支架上的肌腱来源干细胞扫描电镜图 Fig. 3 SEM of tendon stem/progenitor cells in collagen scaffolds |
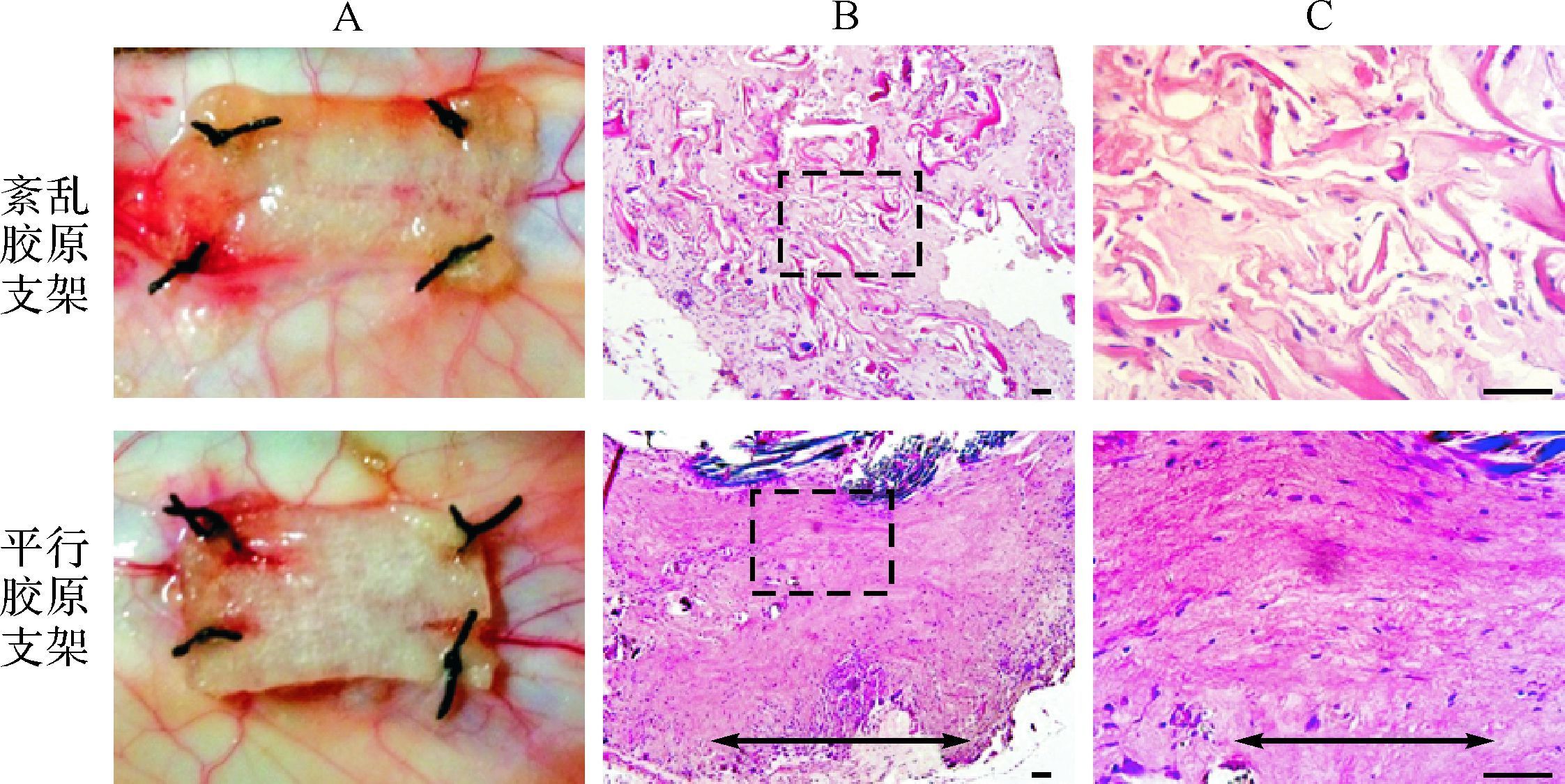
实验兔皮下种植两周后取支架进行组织学的观察,发现平行胶原支架和紊乱胶原支架依然存在,没有完全降解,两种支架中均有细胞进入,且未引起严重的炎症反应。细胞在紊乱胶原支架中散在分布,未呈现一致的方向;而平行胶原支架中的细胞大致沿着胶原方向排列,同时可以观察到一些长梭形的细胞(图 4)。
|
| A:大体图;B:光镜下胶原支架组织学形态;C: B图虚线框局部放大组织学形态. 双箭头指示平行胶原方向.两种支架均未引起严重的炎症反应,进入支架的细胞在 紊乱胶原支架中散在分布,而在平行胶原支架中的细胞沿着支架方向排列.标尺=50 μm. 图 4 皮下种植后胶原支架形态 Fig. 4 Ectopic implantation of collagen scaffolds |
本研究利用单向冰冻技术[16]成功制备了三维平行胶原支架,利用传统冻干技术[15]制备了三维紊乱胶原技术,两者在三维结构上明显不同。通过体外种植肌腱来源干细胞,发现三维平行胶原支架能够诱导细胞变得细长,且方向与胶原纤维的方向一致,同时形成的细胞外基质也与细胞一致呈平行排列;而三维紊乱胶原支架导致细胞形态多样,没有一定的排列方向。皮下种植支架显示了胶原支架的良好生物相容性,同时进入支架的成纤维样细胞在三维平行支架中沿着支架方向排列;而在三维紊乱支架的细胞大多为椭圆形的,且分布没有呈现一定的方向性。
传统冻干技术和单向冻干技术都是用低温将胶原溶液凝成固态,然后抽干水分,再进行交联。区别在于传统冻干技术是逐步将胶原溶液凝固,形成的冰晶是杂乱无方向的[15]。而单向冻干技术是从一个方向开始冷冻,冰晶在温度梯度的方向上形成,因而最后形成的胶原纤维沿着温度梯度方向排列[16]。从三个维度的切片上可以看出,传统冻干技术得到的紊乱胶原支架的组织分布在三个切面上都是紊乱的;而单向冻干技术得到的平行胶原支架的组织分布在水平切面和纵切面上是平行的,横切面上却是紊乱的。横切面上的冰晶差不多在同一时间形成,因此对于两种方法而言,在此平面上是相似的。
肌腱是平行结构的组织,肌腱来源干细胞具有良好的自我更新及多能分化的能力,能够促进肌腱的修复,对于研究细胞—基质相互作用及肌腱修复都是不错的选择[9, 18],因此本研究选择肌腱来源干细胞来探究支架三维结构的作用。肌腱来源干细胞有良好的单克隆形成能力,在胶原支架上依然具有良好的增殖能力。支架的拓扑结构作为初始条件,通过接触作用影响细胞[19]。在平面上,平行的结构能使细胞变得细长[19]。本研究结果显示,三维结构中,细胞黏附于基质上,依然沿着支架的拓扑结构进行排列。平行结构中,细胞平行排列;而紊乱结构中紊乱排列。而当细胞量增多,分泌细胞外基质,三维结构提供了细胞可分布、迁移的空间。在平行结构中,绝大部分细胞在平行方向分布、迁移,最后形成了沿着平行方向的细胞层。而紊乱结构上,细胞在各个结构上排列,在相连处的细胞也能接触相连,形成了与结构相似的细胞层。体内是一个复杂环境,许多因素,包括血管营养、细胞因子、力学刺激等,都会影响细胞的形态、分布[20]。本研究的体内研究结果显示,三维结构对细胞的形态、分布仍然有着重要作用。皮下种植的支架在两周后都有细胞进入,且进入的细胞在形态、分布上都与体外研究结果一致。
然而,肌腱和韧带是承受力学的组织,对支架的力学有很大的要求。虽然平行胶原支架比紊乱胶原支架在力学性能上有所提高,但是仍然无法满足肌腱修复所需的力学强度[15]。所以需在将来的研究中,对三维胶原支架进行进一步的改进,如复合具有良好力学性能的蚕丝支架,构建具有三维仿生结构且能承受肌腱力学需求的胶原—蚕丝复合支架。
综上所述,本研究构建了一种新型的三维平行胶原支架,并探讨了此支架对种植其表面的细胞形态、分布及细胞外基质形成的影响。研究结果显示新型的支架能够促进种植细胞的平行排列,并诱导这些细胞向腱系分化,同时产生大量的肌腱样胞外基质。该研究结果为将来进一步构建更加有效的肌腱—韧带组织工程支架提供了参考和借鉴。
| [1] | ANDARAWIS-PURI N, FLATOW E L, SOSLOWSKY L J. Tendon basic science: development, repair, regeneration, and healing[J]. J Orthop Res, 2015, 33 (6) :780–784 . |
| [2] | VOLETI P B, BUCKLEY M R, SOSLOWSKY L J. Tendon healing: repair and regeneration[J]. Annu Rev Biomed Eng, 2012, 14 :47–71 . |
| [3] | YANG G, ROTHRAUFF B B, TUAN R S. Tendon and ligament regeneration and repair: clinical relevance and developmental paradigm[J]. Birth Defects Res C Embryo Today, 2013, 99 (3) :203–222 . |
| [4] | CORREIA S I, PEREIRA H, SILVA-CORREIA J, et al. Current concepts: tissue engineering and regenerative medicine applications in the ankle joint[J]. J R Soc Interface, 2014, 11 (92) :20130784 . |
| [5] | JAIN A, BANSAL R. Applications of regenerative medicine in organ transplantation[J]. J Pharm Bioallied Sci, 2015, 7 (3) :188–194 . |
| [6] | KOLAMBKAR Y M, BAJIN M, WOJTOWICZ A, et al. Nanofiber orientation and surface functionalization modulate human mesenchymal stem cell behavior in vitro[J]. Tissue Eng Part A, 2014, 20 (1-2) :398–409 . |
| [7] | WHITED B M, RYLANDER M N. The influence of electrospun scaffold topography on endothelial cell morphology, alignment, and adhesion in response to fluid flow[J]. Biotechnol Bioeng, 2014, 111 (1) :184–195 . |
| [8] | GILCHRIST C L, RUCH D S, LITTLE D, et al. Micro-scale and meso-scale architectural cues cooperate and compete to direct aligned tissue formation[J]. Biomaterials, 2014, 35 (38) :10015–10024 . |
| [9] | YIN Z, CHEN X, CHEN J L, et al. The regulation of tendon stem cell differentiation by the alignment of nanofibers[J]. Biomaterials, 2010, 31 (8) :2163–2175 . |
| [10] | MOHTARAM N K, KO J, KING C, et al. Electrospun biomaterial scaffolds with varied topographies for neuronal differentiation of human-induced pluripotent stem cells[J]. J Biomed Mater Res A, 2015, 103 (8) :2591–2601 . |
| [11] | WANG Y, SHI H, QIAO J, et al. Electrospun tubular scaffold with circumferentially aligned nanofibers for regulating smooth muscle cell growth[J]. ACS Appl Mater Interfaces, 2014, 6 (4) :2958–2962 . |
| [12] | DALBY M J, GADEGAARD N, TARE R, et al. The control of human mesenchymal cell differentiation using nanoscale symmetry and disorder[J]. Nat Mater, 2007, 6 (12) :997–1003 . |
| [13] | YIN Z, CHEN X, SONG H X, et al. Electrospun scaffolds for multiple tissues regeneration in vivo through topography dependent induction of lineage specific differentiation[J]. Biomaterials, 2015, 44 :173–185 . |
| [14] | GLOWACKI J, MIZUNO S. Collagen scaffolds for tissue engineering[J]. Biopolymers, 2008, 89 (5) :338–344 . |
| [15] | CHEN X, QI Y Y, WANG L L, et al. Ligament regeneration using a knitted silk scaffold combined with collagen matrix[J]. Biomaterials, 2008, 29 (27) :3683–3692 . |
| [16] | MADAGHIELE M, SANNINO A, YANNAS I V, et al. Collagen-based matrices with axially oriented pores[J]. J Biomed Mater Res A, 2008, 85 (3) :757–767 . |
| [17] | PAWELEC K M, WARDALE R J, BEST S M, et al. The effects of scaffold architecture and fibrin gel addition on tendon cell phenotype[J]. J Mater Sci Mater Med, 2015, 26 (1) :5349 . |
| [18] | BI Y, EHIRCHIOU D, KILTS T M, et al. Identification of tendon stem/progenitor cells and the role of the extracellular matrix in their niche[J]. Nat Med, 2007, 13 (10) :1219–1227 . |
| [19] | IANNONE M, VENTRE M, FORMISANO L, et al. Nanoengineered surfaces for focal adhesion guidance trigger mesenchymal stem cell self-organization and tenogenesis[J]. Nano Lett, 2015, 15 (3) :1517–1525 . |
| [20] | CUKIERMAN E, PANKOV R, YAMADA K M. Cell interactions with three-dimensional matrices[J]. Curr Opin Cell Biol, 2002, 14 (5) :633–639 . |




