肌腱损伤在日常生活中和体育活动中相当常见,全世界范围内每年有超过3000万的肌腱损伤患者[1]。在美国每年有大约20万例修复肌腱、韧带手术[2]。据报道,急性跟腱损伤的发病率在0.018%,患者发病年龄多在20~50岁之间[3]。肌腱或韧带组织由于再生能力较差,损伤后无法完全再生修复,往往形成组织结构松散和机械性能较差的纤维瘢痕,导致患处慢性疼痛、关节活动受限等[4]。这些患者手术效果通常不佳,预后不良,严重影响其日常活动并危及运动员的职业生涯。
对于肌腱损伤患者,目前的治疗手段主要是口服消炎镇痛药物、物理疗法和手术等。手术主要针对急性损伤患者,且只能将断裂的肌腱组织人为地修复其生理结构,不能实现再生修复,而且手术会造成手术创伤、肌腱组织再损伤和异位钙化等多种不良后果;而口服消炎镇痛药物和物理疗法主要用于慢性肌腱损伤患者,只能暂时缓解症状,无法根治[4]。近年来,组织工程等新兴技术的迅猛发展给肌腱损伤修复带来希望。其将种子细胞种植于生物相容性好、可降解的人工生物材料载体中,利用特殊生物因子促进其定向分化,培养成肌腱组织后移植到患处,实现新生肌腱组织的长入,从而达到再生修复的目的[5]。目前种子细胞来源主要有肌腱干细胞( tendon-derived stem/progenitor cell,TDSC )[6]、骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)、自体肌腱细胞和成纤维细胞[5]。2007年美国学者从人和兔的肌腱中分离出一种具有自我更新能力的细胞,将其命名为TDSC。2010年香港学者从大鼠肌腱中也分离出TDSC [7]。TDSC和BMSC均具备多向分化能力,在组织修复及再生医学领域有着广泛的应用前景。已有研究表明,植入BMSC有形成异位骨化和肿瘤的风险[8-9],而植入TDSC尚未发现该问题。本实验将TDSC、BMSC分离培养后分别与纤维蛋白胶联合后移植到大鼠髌腱损伤模型中,从形态学、组织学和生物力学方面进行比较,研究两种干细胞在肌腱损伤修复中的作用[10]。
1 材料与方法 1.1 试剂和仪器氯化钠、氯化钾、磷酸二氢钾、磷酸氢二钠、碳酸氢钠、地塞米松、维生素C、β-甘油磷酸、丙酮酸钠均购自美国Sigma-Aldrich 公司,α-MEM粉、DMEM(低糖)粉、DMEM(高糖)粉、FBS、青霉素—链霉素—新霉素三抗(PSN)、胰蛋白酶购自美国Thermo Fisher公司,1.077 g/mL人淋巴细胞分离液购自挪威AXIS-SHIELD公司,结缔组织生长因子购自美国Peprotech公司,纤维蛋白胶(Beriplast P Combi-set)购自德国Behring公司,PBS离心机购自德国Eppendorf公司,细胞滤网购自美国BD Biosciences公司,Hounsfield H25KS力学测试仪购自美国Tinius Olsen公司,高分辨率Vevo770动物超声系统购自加拿大Visualsonics公司。
1.2 实验动物雄性SD大鼠60只,8周龄,体质量 150~220 g,由解放军医学院动物实验中心提供。本研究通过解放军总医院动物伦理委员会审查。
1.3 TDSC和BMSC的分离与培养取SD大鼠,腹腔注射过量麻醉药物处死后取出髌腱的中间组织,剔除骨—肌腱连接处及周围连接组织,将肌腱均匀剪碎,放入含3 mg/mL I型胶原酶的PBS中,并通过70 μm的细胞滤网产生单细胞悬液,经PBS漂洗,加入含10% FBS、100 U/mL的青霉素、100 μg/mL链霉素、2 mmol/L谷氨酰胺的DMEM(低糖)细胞培养液中,按500/cm2标准将有核细胞接种于培养基内,在37 ℃、5%二氧化碳的条件下培养24 h后,经PBS漂洗两次剔除非黏附细胞,第7~10天经胰蛋白酶消化后形成原代细胞,当增殖密度达到80%~90%时以4000/cm2细胞密度传代培养。每三天更换一次培养液。第四代细胞为实验所用细胞。实验用细胞均发现CD90、CD73的基因表达产物和Oct-4的mRNA表达产物[11],并且有集落生成能力及多方向分化潜能[12],故本实验成功分离并培养出TDSC。
取SD大鼠,腹腔注射过量麻醉药物处死后取出胫骨和股骨,用α-MEM细胞培养液将骨髓组织冲洗出来,收集含有骨髓组织的α-MEM细胞培养液,利用人淋巴细胞分离液进行密度梯度离心(800×g,20 min),收集中间白色絮状层,经PBS漂洗2次,按1×104/cm2密度接种至培养瓶中,加入10% FBS的α-MEM细胞培养液。在37 ℃、5%二氧化碳的条件下培养,每三天更换一次培养液。取第三代细胞按2×104/cm2密度接种至75 cm2培养瓶中,加含α-MEM、10%FBS、1%PSN、0.1 mmol/L维生素C及25 ng/mL结缔组织生长因子的成肌腱诱导培养液,在37 ℃、5%二氧化碳的条件下培养两周,每三天更换一次培养液。
1.4 髌腱缺损动物模型的建立及分组将氯胺酮∶甲苯噻嗪∶生理盐水以1∶1∶1混合后按2 mL/kg的剂量腹腔注射对SD大鼠进行浅麻醉。取右膝关节作为术侧,左膝关节作为健侧。术侧备皮后常规消毒、铺单。沿膝关节内侧做一纵行长约2 cm的切口,钝性分离筋膜组织,游离出髌腱,利用双刀片切除髌腱中央三分之一部分髌腱,上至髌骨,下至胫骨结节,造成髌腱中央缺损模型[13]。模型动物随机分为三个组:TDSC联合纤维蛋白胶组(TDSC组)、BMSC联合纤维蛋白胶组(BMSC 组)和纤维蛋白胶组(对照组)。
TDSC组:将1.6×107个TDSC融入800 μL纤维蛋白胶,后接种到35 mm的细胞培养皿上,纤维蛋白胶凝固后,切成长×宽×高=10 mm×2 mm×1 mm的纤维蛋白胶块(20 μL纤维蛋白胶,4×105个细胞),移植入大鼠髌腱缺损处,分层缝合筋膜及皮肤,纱布包扎。BMSC组:将1.6×107个BMSC融入800 μL纤维蛋白胶,后接种到35 mm的细胞培养皿上,纤维蛋白胶凝固后,切成上述同样大小的纤维蛋白胶块,移植入大鼠髌腱缺损处。对照组:植入纤维蛋白胶无其他成分。
植入实验材料后大鼠可笼内自由活动。术侧采取局部夹板固定1周后拆除,每天观察手术切口情况,记录愈合不良或渗出等现象,1、2、4、6、8周时每组分别处死四只大鼠,取出双侧髌腱(术侧及健侧)进行生态学观察和生物力学分析。
1.5 HE染色观察髌腱组织学形态将取下的组织材料用10%甲醛缓冲液浸泡48 h后经梯度酒精、二甲苯处理,包埋入石蜡后切成厚5 μm,HE染色,由两名高年资研究人员分别于普通光镜和偏光显微镜下观察组织学形态。
1.6 力学测试仪和动物超声系统测量髌腱愈合的生物力学指标保留髌腱及髌骨侧、经估测与之相连的骨组织,只保留实验植入的组织用于生物力学分析。将髌骨及胫骨分别固定于Hounsfield H25KS力学测试仪,采用50 N力学传感器、张力速度40 mm/min,预负荷0.1 N,记录负荷位移曲线。再生肌腱组织的横截面积(mm2)及长度(mm)通过高分辨率Vevo 770动物超声系统测得。最大应力=最大负荷/再生肌腱组织横截面积;弹性模量=最大应力/位移或再生肌腱组织长度;最大应力百分比=术侧最大应力/健侧最大应力;弹性模量百分比=术侧弹性模量/健侧弹性模量[10]。
1.7 统计学方法实验数据采用SPSS 16.0统计软件进行处理,生物力学测量数据用均数±标准差(x±s)表示,其他数据比较采用Kruskal-Wallis H检验,两两比较采用Mann-Whitney U检验。以P<0.05为差异有统计学意义。
2 结 果 2.1 三组修复髌腱的大体形态比较正常髌腱组织如图 1A。髌腱缺损动物模型(图 1B)膝关节处切口均未发生愈合不良、红肿渗出等不良现象。术后1周,各组大鼠可见一些毛细血管分布在髌腱损伤处周围,而TDSC组和BMSC组与对照组相比分布较少;术后2、4、6周时,髌腱损伤处边界TDSC组、BMSC组比较模糊,对照组较明显;术后8周时,各组损伤处边界消失(TDSC组、BMSC组)或模糊(对照组),见图 2。以上观察结果提示,TDSC组、BMSC组髌腱损伤处愈合时间更短,外观上更趋于正常。
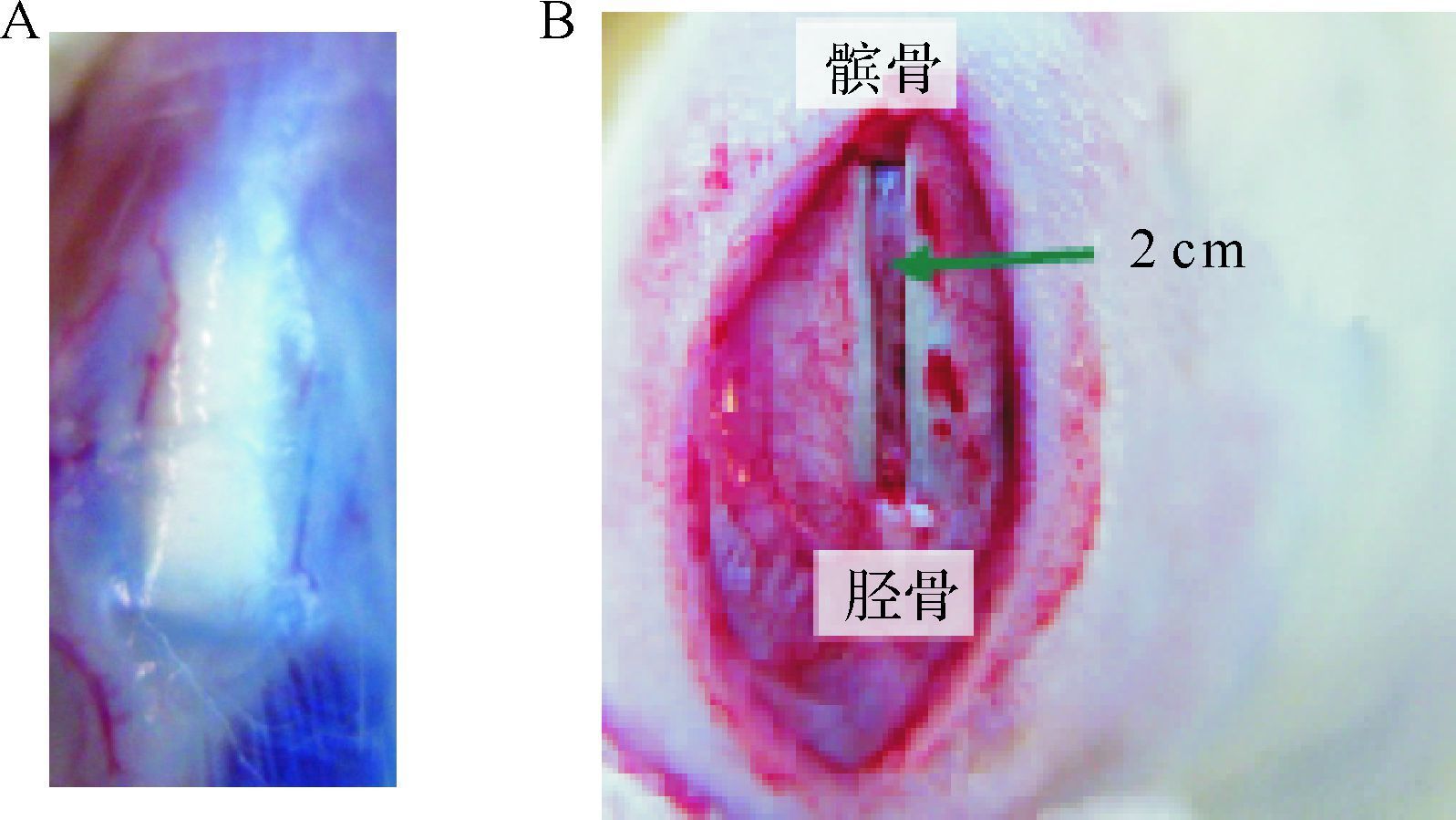
|
| A:健侧髌腱质韧色白,可见少量血管分布于髌腱周围; B:沿膝关节内侧做一纵行长约2 cm的切口,钝性分离筋膜组织,游离出髌腱,利用双刀片切除髌腱中央三分之一部分髌腱,上至髌骨,下至胫骨结节. 图 1 健侧髌腱和髌腱缺损模型大体形态 Fig. 1 Gross morphology of the normal patellar tendon of SD rat and the patellar tenden injure model |
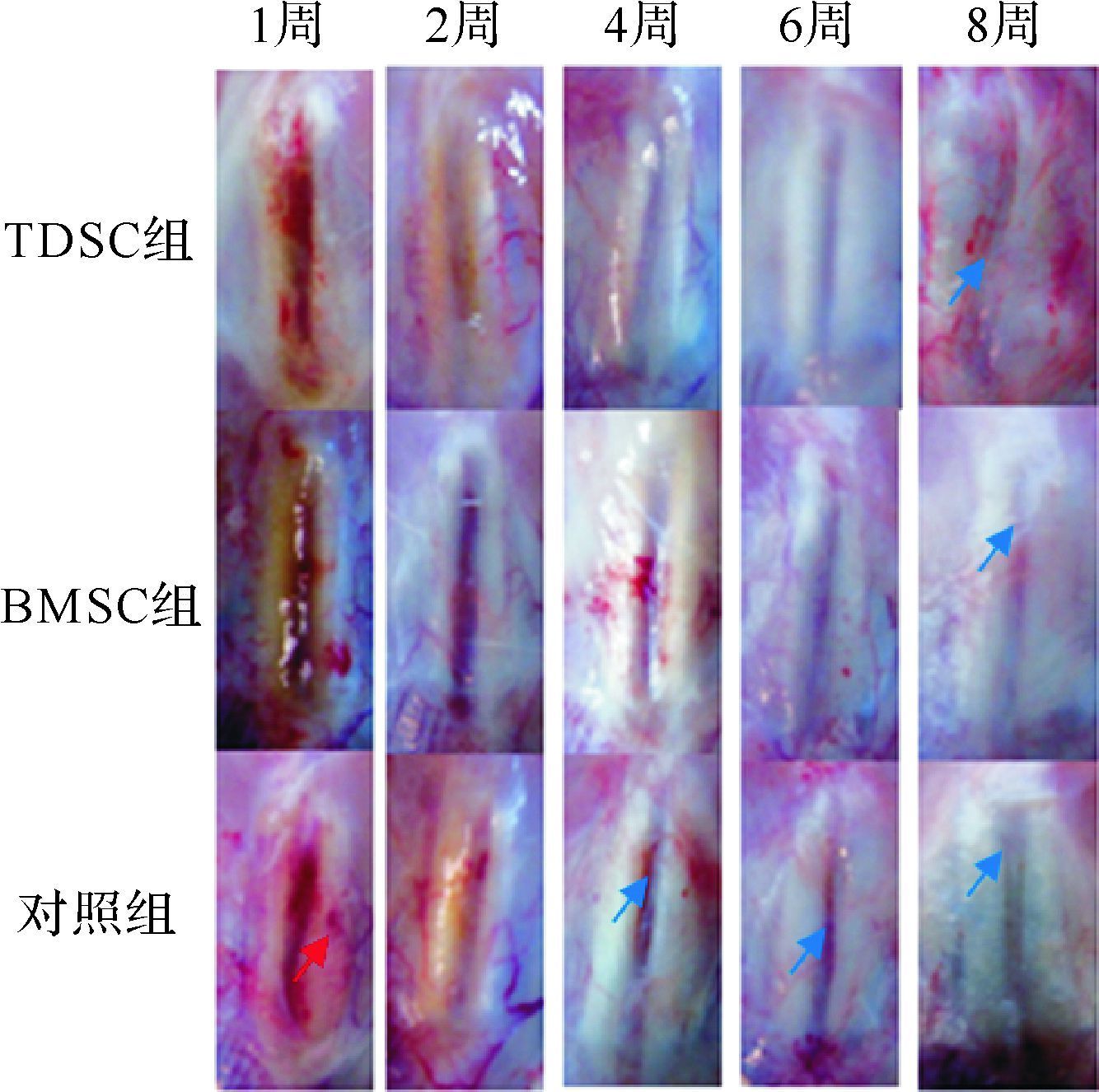
|
| 术后1周,各组大鼠可见一些毛细血管分布在髌腱损伤处周围(红箭头);术后2、4、6周时,TDSC组、BMSC组髌腱损伤处边界比较模糊,对照组较明显(蓝箭头);术后8周时,TDSC组、BMSC组损伤处边界消失,对照组损伤处边界模糊. 图 2 三组髌腱损伤模型术侧修复髌腱的大体形态 Fig. 2 Gross morphology of the patellar tendon of SD rat and the patellar tenden injure model at 1,2,4,6 and 8 weeks |
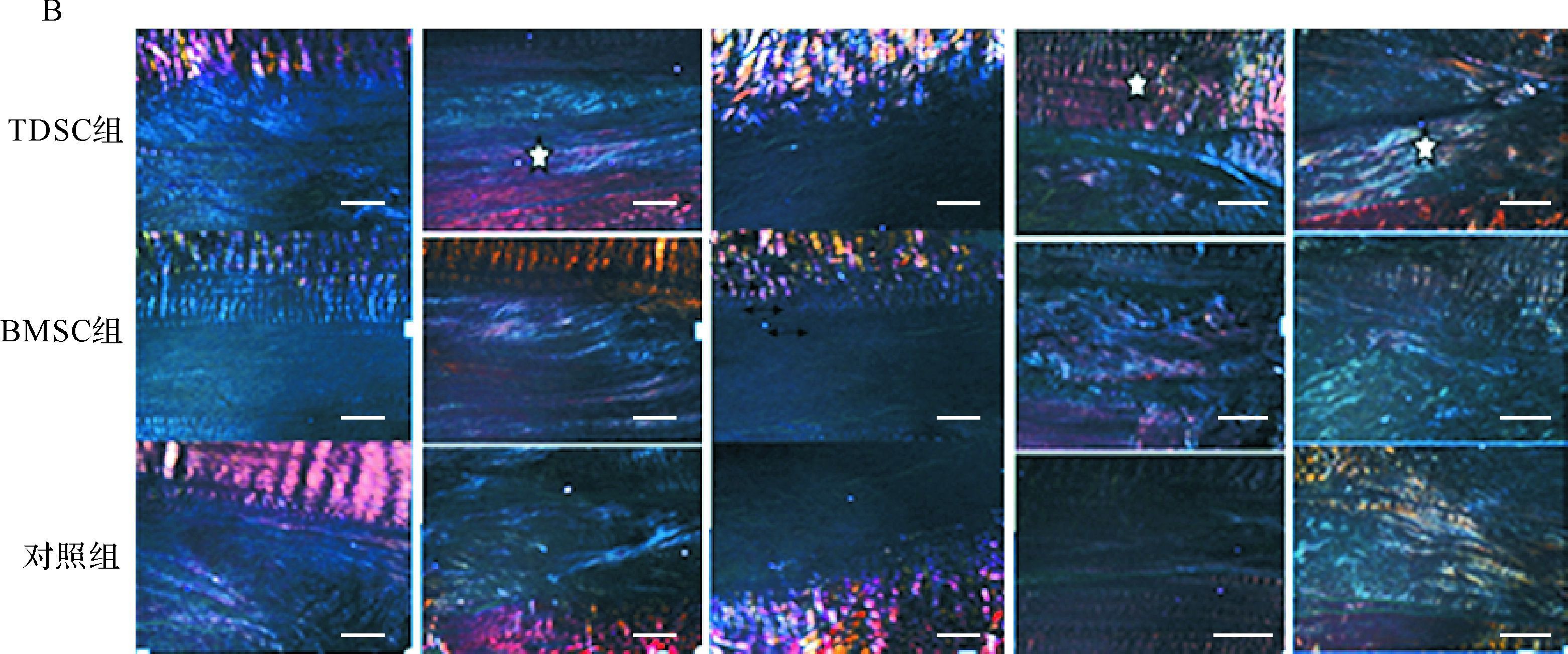
光镜下可见,与对照组和BMSC组比较,术后1周TDSC组损伤处细胞数量增多,细胞形态呈圆形,排列紊乱,细胞外基质增多;术后4周TDSC组损伤处细胞数量减少,细胞形态呈梭形,细胞外基质明显增多,并生成胶原纤维;术后6、8周TDSC组损伤处细胞数量继续减少,胶原纤维明显增多,可见沿肌腱纤维纵向排列的纺锤状细胞。偏光镜下可见,与对照组和BMSC组比较,术后1周TDSC组胶原蛋白双折射较低,但高于对照组和TDSC组,并随着时间推移逐渐增加;术后8周TDSC组可见胶原纤维沿张力方向致密排列、亮度高,可见肌腱组织的特异性结构:胶原纤维染色呈红色、密集平行排列,细胞沿张力方向纵行排列于胶原纤维之间,见图 3。以上形态学改变提示,与对照组和BMSC组比较,TDSC组肌腱组织分化程度更高、时间更短,说明在微观层面TDSC组肌腱组织更为接近正常肌腱组织。

|
| A:光镜下可见:术后1周TDSC组损伤处细胞数量增多,细胞形态呈圆形(红箭头),排列紊乱,细胞外基质增多(蓝箭头);术后4周TDSC组损伤处细胞数量下降,细胞形态呈梭形,细胞外基质明显增多,并生成胶原纤维(星形处);术后6、8周TDSC组损伤处细胞数量继续下降,胶原纤维明显增多,可见沿肌腱纤维纵向排列的纺锤状细胞(空心三角形处).B:偏光镜下可见:与对照组和BMSC组比较,术后1周TDSC组胶原蛋白双折射较低,但高于对照组,随着时间推移,其逐渐增加(四边形处);术后8周TDSC组可见胶原纤维沿张力方向致密排列,亮度高,可见肌腱组织的特异性结构,胶原纤维染色呈红色,密集平行排列,细胞沿张力方向纵行排列于胶原纤维之间(实心三角形处).标尺=100 μm. 图 3 三组修复髌腱的组织学形态表现 Fig. 3 Optical morphology of the repairing patellar tendon at 1,2,4,6 and 8 week |
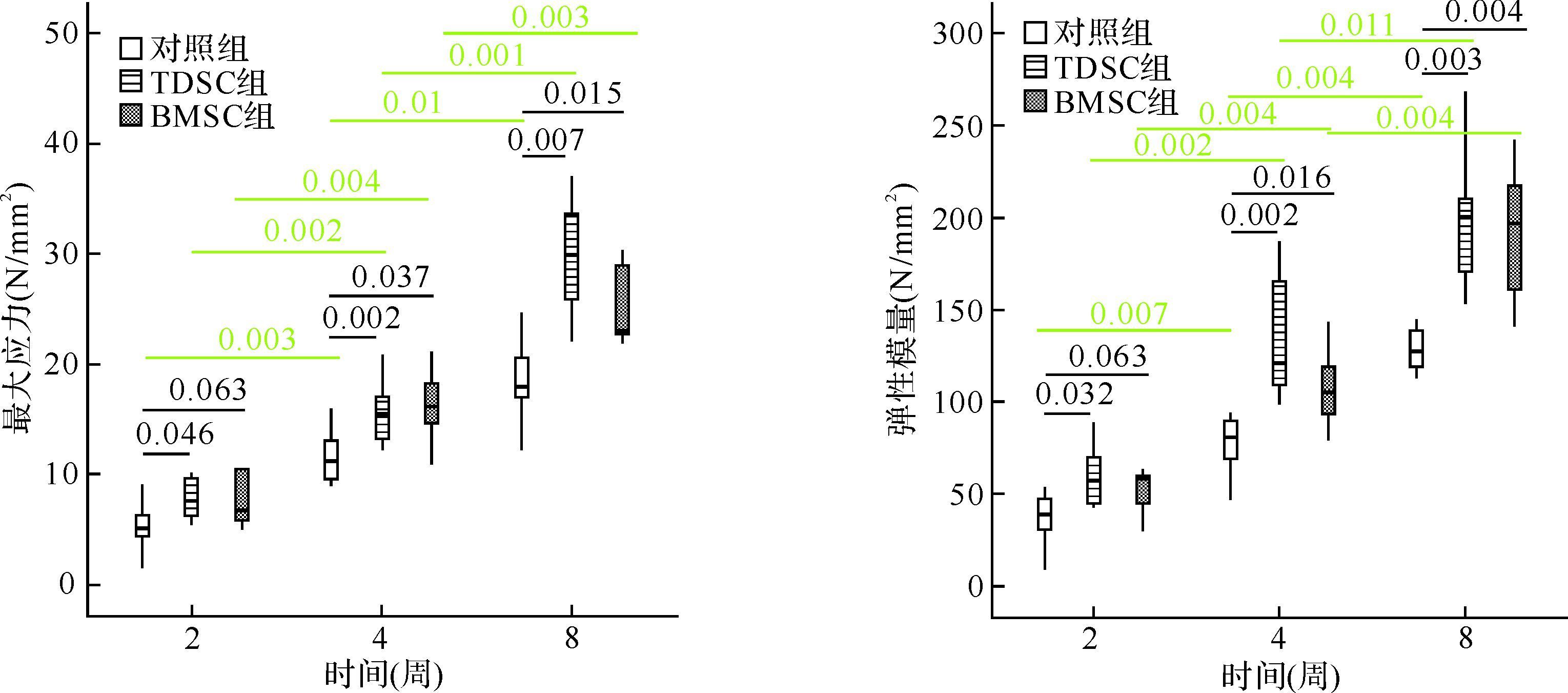
与对照组比较,在各个时间点TDSC组最大应力和弹性模量均增加(均P<0.05);在2周时,BMSC组的最大应力和弹性模量差异无统计学意义(均P>0.05),可能与愈合早期标本间差异较大有关;在第4、8周BMSC组最大应力和弹性模量均增加(均P<0.05)。TDSC组与BMSC组在各个时间点最大应力和弹性模量差异均无统计学意义(均P>0.05),见图 4。
|
| 组内比较结果显示随时间增长,各组的最大应力和弹性模量均增加(绿色标记).组间比较结果显示,各个时间点TDSC组最大应力和弹性模量均高于对照组(黑色标记);第4、8周BMSC组最大应力和弹性模量高于对照组(黑色标记);TDSC组与BMSC组在各个时间点最大应力和弹性模量差异无统计学意义. 图 4 三组修复髌腱的最大应力及弹性模量比较 Fig. 4 Comparsion of ultimate stress and Young Modulus among three groups |
与对照组比较,在2周时,TDSC组的最大应力百分比及弹性模量百分比差异均无统计学意义(均P>0.05),可能与愈合早期标本间差异较大有关;在第4、8周,TDSC组最大应力百分比及弹性模量百分比均增加(均P<0.05);在各个时间点BMSC组最大应力百分比及弹性模量百分比均增加(均P<0.05)。TDSC组与BMSC组在第2、4周的最大应力百分比及弹性模量百分比差异均无统计学意义(均P>0.05),但第2、4周两组间差异有增大的趋势;到8周时,两组最大应力百分比仍无差异(P>0.05),而弹性模量百分比差异则有统计学意义(P<0.05,红色标记)。见图 5。以上结果提示,与对照组比较,TDSC组和BMSC组肌腱抗拉能力越强,弹性变形越小;且第8周时,BMSC组比TDSC组弹性变形更小。
|
| 组内比较结果显示随时间增长,各组的最大应力百分比和弹性模量百分比均增加(绿色标记).组间比较结果显示,在2周时,TDSC组的最大应力百分比及弹性模量百分比与对照组差异无统计学意义,在第4、8周均大于对照组(黑色标记);在各个时间点BMSC组最大应力百分比及弹性模量百分比均大于对照组(黑色标记);TDSC组与BMSC组在第8周时弹性模量百分比差异有统计学意义(红色标记),其余时间点差异均无统计学意义. 图 5 三组修复髌腱的最大应力百分比及弹性模量百分比比较 Fig. 5 Comparsion of relative ultimate stress and relative Young Modulus among three groups |
组织工程包括种子细胞、生长因子和支架材料三大要素。不同时间和不同部位来源的种子细胞具有不同的生物学特性[5, 7, 14]。有文献报道,家兔髌韧带来源的TDSC在克隆的数量和大小以及在细胞增殖速度方面优于跟腱来源的TDSC[15]。不同龄大鼠肌腱提取的TDSC在自我更新和分化能力方面也存在差异。老龄大鼠肌腱组织来源的TDSC克隆形成能力差,增殖率低,细胞周期长[16]。肌腱组织修复的早期进行干预可能临床效果更好 [10-11]。与肌腱细胞相比,TDSC体型较小,多呈鹅卵石形,细胞核较大,其中CD90、CD73、Oct-4的mRNA表达产物均是其特征性表达产物,我们实验分离培养出的TDSC符合以上条件。由于机体在肌腱损伤后,无法诱导其TDSC向肌腱细胞增殖分化,故无法实现自身修复。因此,如何激活TDSC并诱导其定向分化为肌腱细胞是TDSC用于临床治疗的关键。既往研究已证明,生物活性因子、力学刺激、细胞外基质成分等均是激活TDSC、促进TDSC向肌腱细胞分化的重要因素[17]。我们前期实验也已证明,含α-MEM、10%FBS、1%PSN、0.1 mmol/L维生素C及CTGF25 ng/mL的肌腱诱导培养液在37 ℃、5%二氧化碳的特定条件下是TDSC定向分化的最佳条件[10]。本实验中,大鼠髌腱缺损动物模型建立后允许其自由活动,便是利用力学刺激促进其定向分化,但具体力学数值尚无法量化[18]。本实验选取8周龄大鼠髌腱组织作为TDSC的来源,并且将实验观察时间延长至8周,分别在1、2、4、6、8周时间点进行实验观察及数据分析,通过延长试验周期并增加观察点的次数,获取更多实验动物大体形态、组织学改变和生物力学改变的数据,为后续试验时间点的设定提供依据。
在本实验中,通过比较TDSC组、BMSC组与对照组的形态学改变发现:TDSC修复髌腱愈合的时间更短,外观上更趋于正常,这可能是由于TDSC定向增殖分化为肌腱细胞能力更强,产生的胶原纤维更接近正常肌腱组织,从而能更快地促进肌腱修复[10]。弹性模量可视为衡量材料产生弹性变形难易程度的指标,其值越大,材料发生一定弹性变形的应力也越大,即材料刚度越大;亦即在一定应力作用下,发生弹性变形越小。作为材料的一个属性,如果在线性范围内,应力应该等于弹性模量乘以应变。本研究结果显示,TDSC组、BMSC组最大应力及弹性模量越大,说明其肌腱组织抗拉能力越强,弹性变形越小;最大应力百分比和弹性模量百分比作为实验侧与健侧肌腱组织指标的比值,通过与正常肌腱组织的比较,TDSC组与BMSC组肌腱组织不仅在大体形态上与正常组织更为接近,在组织学分析及生物力学测试上均优于对照组;相比于BMSC组,TDSC组肌腱组织更为接近正常组织,实验8周时弹性变形更小,抗拉能力尽管有增大趋势但差异无统计学意义,可能与实验观察时间较短,动物模型数量较少有关,需进一步观察。BMSC促进肌腱损伤修复的研究较多[19-21],如在兔跟腱急性损伤模型中,植入BMSC组肌腱胶原纤维结构更加清晰,胶原蛋白表达更多,表明具有促进肌腱损伤修复的能力。但BMSC存在着潜在的肿瘤和异位骨化等问题[8-9],阻碍其在临床广泛应用。TDSC和BMSC在特殊环境下,经体外诱导分化成肌腱细胞并生成胶原纤维,在肌腱损伤处形成成熟的肌腱组织,从而修复肌腱,达到原有肌腱的生物力学性能[5, 10-11]。本研究表明,与BMSC比较,TDSC的定向分化能力更强,组织学更接近正常组织,生物力学性能更为优越,因此TDSC是较理想的修复损伤肌腱的干细胞[5]。
人工合成生物材料存在着生物相容性差、材料老化、生物力学特性不佳的诸多问题,导致其应用局限。纤维蛋白胶作为肌腱组织工程中干细胞的载体,其在1周内即降解[10],与人工合成生物材料比较,其生物相容性好,生物力学特性佳。而选择哪种干细胞联合纤维蛋白胶植入动物模型中?本研究中结果提示:TDSC组生物力学表现优于BMSC组,且无异位骨化和肿瘤发生危险。但是本研究动物模型数量较少,观察时间较短,有可能导致实验结果的偶然性,需进一步观察其长期结果;需对组织结构进行更全面的研究,如免疫组织化学检测及电镜下观察等;还需植入更多生物材料载体如聚乳酸—羟基乙酸共聚物、蚕丝、纤维蛋白胶等,比较他们与TDSC联合应用的效果。
综上所述,本研究通过将TDSC、BMSC分别与纤维蛋白胶联合植入大鼠髌腱损伤模型后进行组织学形态观察和生物力学检测表明,TDSC能更好地促进肌腱损伤的早期修复。
| [1] | REINHARDT K R, HETSRONI I, MARX R G, et al. Graft selection for anterior cruciate ligament reconstruction: a level I systematic review comparing failure rates and functional outcomes[J]. Orthop Clin North Am, 2010, 41 (2) :249–262 . |
| [2] | PENNISI E. Tending tender tentons[J]. Science, 2002, 295 (5557) :1011 . |
| [3] | LEPPILAHTI J, PURANEN J, ORAVA S, et al. Incidence of achilles tendon rupture[J]. Acta Orthop Scand, 1996, 67 (3) :277–279 . |
| [4] | MISYASHITA H, OCHI M, IKUTA Y, et al. Histological and biomechanimal observations of the rabbit patellar tendon after removal of its central one-third[J]. Arch Orthop Trauma Surg, 1997, 116 (8) :454–462 . |
| [5] | LUI P P, RUI Y F, NI M, et al. Tenogenic differentiation of stem cells for tendon repair—what is the current evidence?[J]. J Tissue Eng Regen Med, 2011, 5 (8) :e144–e163 . |
| [6] | BI Y, EHIRCHIOU D, KILTS T M, et al. Identification of tendon stem/progenitor cells and the role of the extracellular matrix in their niche[J]. Nat Med, 2007, 13 (10) :1219–1227 . |
| [7] | RUI Y F, LUI P P Y, LI G, et al. Isolation and characterization of multipotent rat tendon-derived stem cells[J]. Tissue Eng Part A, 2010, 16 (5) :1549–1558 . |
| [8] | AWAD H A, BOIVIN G P, DRESSLER M R, et al. Repair of patellar tendon injures using a cell-collagen composite[J]. J Orthop Res, 2003, 21 (3) :420–431 . |
| [9] | HARRIS M T, BUTLER D L, BOIVIN G P, et al. Mesenchymal stem cells used for rabbit tendon repair can form ectopic bone and express alkaline phosphatase activity in constructs[J]. J Orthop Res, 2004, 22 (5) :998–1003 . |
| [10] | NI M, LUI P P Y, RUI Y F, et al. Tendon-derived stem cells(TDSCs) promote tendon repair in a rat patellar tendon window defect model[J]. J Orthop Res, 2012, 30 (4) :613–619 . |
| [11] | LUI P P Y, RUI Y F, NI M, et al. Mechanical loading increased BMP-2 expression which promoted osteogenic differentiation of tendon-derived stem cell[J]. J Orthop Res, 2011, 29 (5) :390–396 . |
| [12] | TAN Q, LUI P P Y, RUI Y F, et al. Comparison of potentials of stem cells isolated from tendon and bone marrow for musculoskeletal tissue engineering[J]. Tissue Eng Part A, 2012, 18 (7-8) :840–851 . |
| [13] | LUI P P, CHEUK Y C, HUNG L K, et al. Increacing apoptosis at the late stage of tendon healing[J]. Wound Repair Regen, 2007, 15 (5) :702–707 . |
| [14] | PROCKOP D J. Marrow stromal cells as stem cells for nonhematopoietic tissues[J]. Science, 1997, 276 (5309) :71–74 . |
| [15] | ZHANG J, WANG J H. Characterization of differential properties of rabbit tendon stem cells and tenocytes[J]. BMC Musculoskelet Disord, 2010, 11 :10 . |
| [16] | ZHOU Z, AKINBIYI T, XU L, et al. Tendon-derived stem/pregenitor cell aging: defective self-renewal and altered fate[J]. Aging Cell, 2010, 9 (5) :911–915 . |
| [17] | CHAN B P, FU S C, QIN L, et al. Pyridinoline in relation to ultimate stress of the patellar tendon during healing: an animal study[J]. J Orthop Res, 1998, 16 (5) :597–603 . |
| [18] | ZHANG J, PAN T, LIU Y, et al. Mouse treadmill running enhances tendons by expanding the pool of tendon stem cells(TSCs) and TSC-related cellular production of collagen[J]. J Orthop Res, 2010, 28 (9) :1178–1183 . |
| [19] | ZHANG J, WANG J H. Mechanobiological response of tendon stem cells: implications of tendon homeostasis and pathogenesis of tendinopathy[J]. J Orthop Res, 2010, 28 (5) :639–643 . |
| [20] | LACITIGNOLA L, CROVACE A, ROSSI G, et al. Cell therapy for tendinitis,experimental and clinical report[J]. Vet Res Commun, 2008, 32 :S33–S38 . |
| [21] | CHONG A K, ANG A D, GOH J C, et al. Bone marrow-derived mesenchymal stem cells influence early tendo-healing in a rabbit achilles tendon model[J]. J Bone Joint Surg Am, 2007, 89 (1) :74–81 . |




