2. 浙江大学医学院附属第一医院中心实验室, 浙江 杭州 310003 ;
3. 北京大学口腔医学院口腔颌面外科, 北京 100081 ;
4. 中国医学科学院整形外科医院研究中心, 北京 100144 ;
5. 新加坡国立大学口腔医学院口腔科学系干细胞实验室, 新加坡 119083 ;
6. 澳大利亚昆士兰科技大学健康与生物医学研究所, 澳大利亚 布里斯班QLD 4059
2. Central Laboratory, the First Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310003, China ;
3. Department of Oral and Maxillofacial Surgery, Peking University School of Stomatology, Beijing 100081, China ;
4. Research Center of Plastic Surgery Hospital, Chinese Academy of Medical Sciences, Beijing 100144, China ;
5. Faculty of Dentistry Research Laboratories, National University of Singapore, Singapore 119083, Singapore ;
6. Institute of Health and Biomedical Innovation, Queensland University of Technology, Kelvin Grove QLD 4059, Australia
随着体育锻炼和竞赛活动明显增加和社会老龄化趋势明显,运动损伤越来越多,其中韧带肌腱损伤占50%以上[1]。目前,临床上对肌腱损伤的治疗尚停留在理疗、手术缝合以及肌腱移植修复阶段。由于成体肌腱不具备完全再生能力,修复后肌腱的质量远不如正常肌腱,即使是自体肌腱移植修复也只能达到正常肌腱力学性能的40%左右,常导致再修复断裂[2-4]。因此,寻找新型的、可促进肌腱生理性再生修复的方法具有极其重要的临床价值和社会意义。近年来,研究者开始尝试采用肌腱组织工程技术来治疗和修复肌腱缺损。目前用于肌腱组织工程研究的干细胞主要为成体间充质干细胞(mesenchymal stem cells,MSC)及肌腱干细胞(tendon stem cells)[5]。然而,已有研究发现,以上述干细胞作为种子细胞修复后的肌腱在力学性能,特别是在微观结构上与正常肌腱仍有显著区别:修复后的肌腱生成大量小直径胶原纤维,导致其愈后力学性能低下[6]。
已有研究结果表明,家畜或人体胚胎皮肤受损后,可以达到无疤痕的功能性愈合,而成体皮肤受损后很难完全愈合并恢复正常生理功能[7-10]。胚胎肌腱具有再生能力,移植于成体环境仍可再生,提示胚胎来源的肌腱细胞可能存在再生记忆功能[11]。胚胎干细胞(embryonic stem cells,ESC)作为一种来源于胚胎的亚全能性干细胞,不仅具有分化为不同类型细胞的能力和无限增殖的潜能,而且可能具有胚胎细胞的再生记忆能力。小鼠和人的ESC已广泛用于疾病模型研究[12-14]。本课题组前期实验结果证明ESC应用于肌腱组织工程可提供充足可再生的种子细胞来源[15-17]。
人ESC的生物学特性、体外培养方法及其质量控制见《人胚胎干细胞向成纤维细胞分化方法的专家共识》[18]。人ESC的肌腱组织工程的关键是将人ESC诱导分化为理想的肌腱细胞。为规范人ESC来源的肌腱细胞(ES-tenocytes,ES-T)的分化方法,提高人ES-T的纯度,保证分化方法的可重复性,使其更系统、规范和有效地应用于临床和生物安全性评价体系中,科技部国际科技合作专项重点项目“创建基于人胚胎干细胞的预测健康安全新体系”的专家经反复讨论,制定了《人胚胎干细胞向肌腱细胞分化方法共识》(以下简称《共识》)。《共识》建议通过两步法将人ESC诱导为ESC来源的间充质干细胞(hESC derived mesenchymal stem cells,hESC-MSC)及肌腱细胞,在体内和体外递进式诱导人ESC向肌腱分化,实现肌腱再生。因此建立的体外组织工程肌腱可作为检测评价模型,对小分子化合物、医用材料和药物进行肌腱相关的毒理学系统分析和安全性评价。
1 第一步:hESC-MSC的分化及鉴定方法 1.1 hESC-MSC培养和传代 1.1.1 hESC-MSC第1代培养培养孔用质量分数为0.1%明胶包被,将hESC接种在丝裂霉素处理过的小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)饲养层上,用细胞培养基[含80% DMEM/F-12,20% Knock-out血清替代品、1 mmol/L谷氨酰胺、0.1 mmol/L β-巯基乙醇、0.1 mmol/L非必需氨基酸、4 ng/mL碱性成纤维细胞生长因子2(fibroblast growth factor 2,FGF-2)]于条件为37 ℃和含5%二氧化碳的细胞培养箱内培养3~5 d,当细胞增殖密度为100%时刮下收集细胞。以增殖密度达到100%的两孔(孔径为34.8 mm)细胞为标准将hESC接种至0.1%明胶包被的T75培养瓶中,用低糖DMEM细胞培养基(含体积分数20%FBS、10 ng/mL FGF-2、100 U/mL青霉素、100 U/mL链霉素)培养细胞。
1.1.2 hESC-MSC第2代培养每三天换液一次。在接种后24~48 h内即可观察到hESC贴壁,48 h后可观察到在hESC周围出现克隆细胞生长(图 1A)。持续培养一周后细胞增殖密度可达到90%以上。细胞在高增殖密度状态下继续培养两周,可观察到培养瓶中含有多种不同形态的细胞混合生长。经胰酶消化后,按1∶3比例传代。

|
| A:第1代ESC细胞贴壁生长,呈现不同细胞形态(倒置相差显微镜观察,标尺=200 μm); B:第2代hESC-MSC呈长梭形或不规则三角形,细胞形态均一(倒置相差显微镜观察,标尺=50 μm). 图 1 ESC向MSC分化克隆形态 Fig. 1 solation and characterization of mesenchymal stem cells derived from human embryonic stem cells |
培养获得的第2~3代细胞(细胞呈较均一的成纤维样细胞)再以5×106/cm2密度接种至培养皿上,直至单克隆细胞长出,即得到MSC,命名该细胞为hESC-MSC,标记为P0代。经胰酶消化后,按1∶3比例传代,传代后贴壁的细胞标记为P1代,每三天换液一次。
1.1.4 hESC-MSC的传代当hESC-MSC细胞增殖密度达到90%及以上时进行传代,吸去培养液,每孔(孔径为34.8 mm)加入1 mL胰酶,37 ℃孵育2 min,吸去胰酶溶液,再加入1 mL hESC-MSC培养液(含体积分数10%FBS,100 U/mL青霉素,100 U/mL链霉素,低糖DMEM培养基),用1 mL移液枪吹打细胞,200×g离心5 min。吸除上清液后用人hESC-MSC培养液重悬细胞,按1∶6比例接种。次日观察人hESC-MSC贴壁情况,每三天更换hESC-MSC培养液。一般3~5 d可传代一次,hESC-MSC可稳定传代20次及以上。
1.2 hESC-MSC细胞冻存和复苏 1.2.1 细胞冻存当细胞增殖密度为70%~90%时冻存,冻存液(40%FBS,20%DMSO,低糖DMEM)从-20 ℃取出,4 ℃解冻。细胞如上述经胰酶消化离心后,去上清液,用hESC-MSC培养液将细胞重悬。细胞冻存密度为5×105~5×106 /mL及以上,每个冻存管分装1 mL,每管各加500 μL冻存液。将细胞放至梯度降温冻存盒内,-80 ℃冻存过夜,于液氮中长期保存。
1.2.2 细胞复苏提前将培养基加至培养皿上,置于37 ℃培养箱预热,将细胞冻存管从液氮罐中取出后,快速置于37 ℃水浴中,当hESC-MSC悬液融解至50%时(1 min之内),将悬液转移到离心管内,加入9倍体积的hESC-MSC培养液,200×g离心5 min后吸去上清液,加入适量hESC-MSC培养液重悬后接种于培养皿上。
1.3 hESC-MSC的质量控制 1.3.1 细胞形态ESC贴壁分化第1代时(图 1A),细胞应贴壁生长,呈现不同细胞形态;hESC-MSC传至第2代时,细胞应贴壁生长,形态均一(同质性超过95%),呈长梭形及不规则三角形(图 1B),形态与骨髓来源MSC(bMSC)及脂肪来源MSC(ADSC)类似。
1.3.2 标志基因的表达Trizol法提取人hESC-MSC及ESC总RNA,取1 μg总RNA用于RT-PCR及定量PCR检测。保持未分化状态的hESC-MSC高表达人MSC相关基因,表达Ⅰ型胶原(COL Ⅰ)基因、成纤维细胞标志基因波形蛋白(VIM)基因[16, 19],不表达或低表达ESC干性关键转录因子八聚体结合转录因子(OCT4)、同源结构域蛋白(NANOG)、端粒酶(TELOMERASE)基因(图 2)[15-17, 19],不表达分化基因Ⅱ型胶原(COL Ⅱ)基因、ALP基因、骨钙素(OCN)基因[19]。
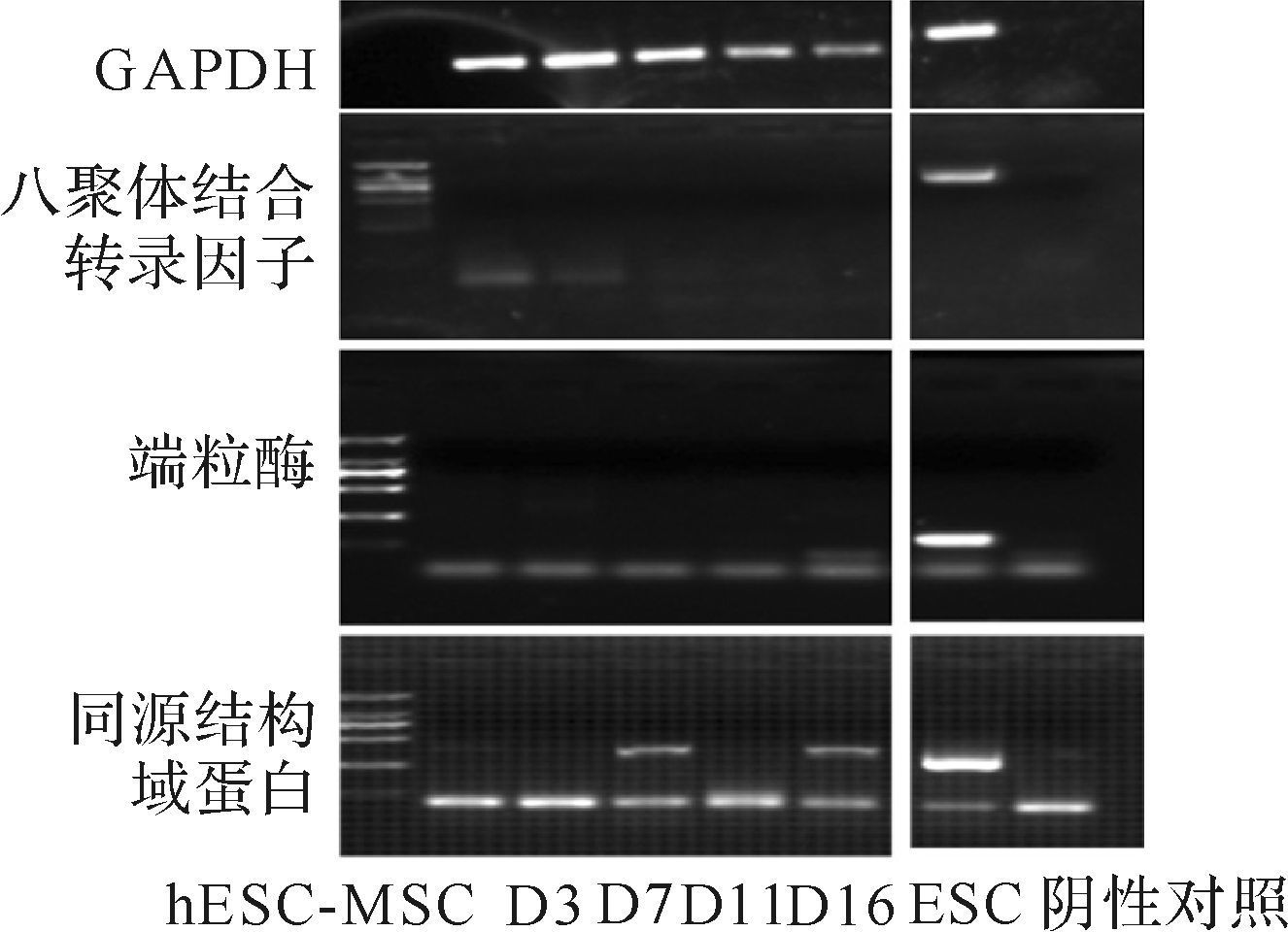
|
| D3~D16:诱导hESC-MSC形成细胞片的时间. 图 2 hESC-MSC向肌腱细胞分化标志物的基因检测 Fig. 2 human embryonic stem cells-mesenchymal stem cells engineered tendons do not express ESC markers |
将人hESC-MSC用4%多聚甲醛固定后做免疫荧光染色和流式细胞术分析,并以人bMSC作为阳性对照。已知正常人来源的MSC不表达OCT4、NANOG和造血细胞标志物CD45及CD34,高表达成纤维细胞标志物VIM[16, 19]和间充质干细胞标志物CD44、CD90和CD105[20]。与人MSC类似,hESC-MSC应不表达或低表达OCT4、NANOG[15]、CD45及CD34,高表达VIM、基质细胞抗原(STRO-1)、CD29、CD44、CD90、CD105和CD146[16, 19]。
1.3.4 单克隆形成能力检测hESC-MSC具有bMSC和ADSC类似的单克隆形成能力,使用第6~9代单层培养获得的hESC-MSC。细胞以2×103~10×103/cm2密度接种在直径为10 cm的培养皿中,并培养14~20 d,1%结晶紫染色可见hESC-MSC形成单克隆,见图 3A。计数其克隆形成效率,其克隆形成效率与bMSC类似[16]。
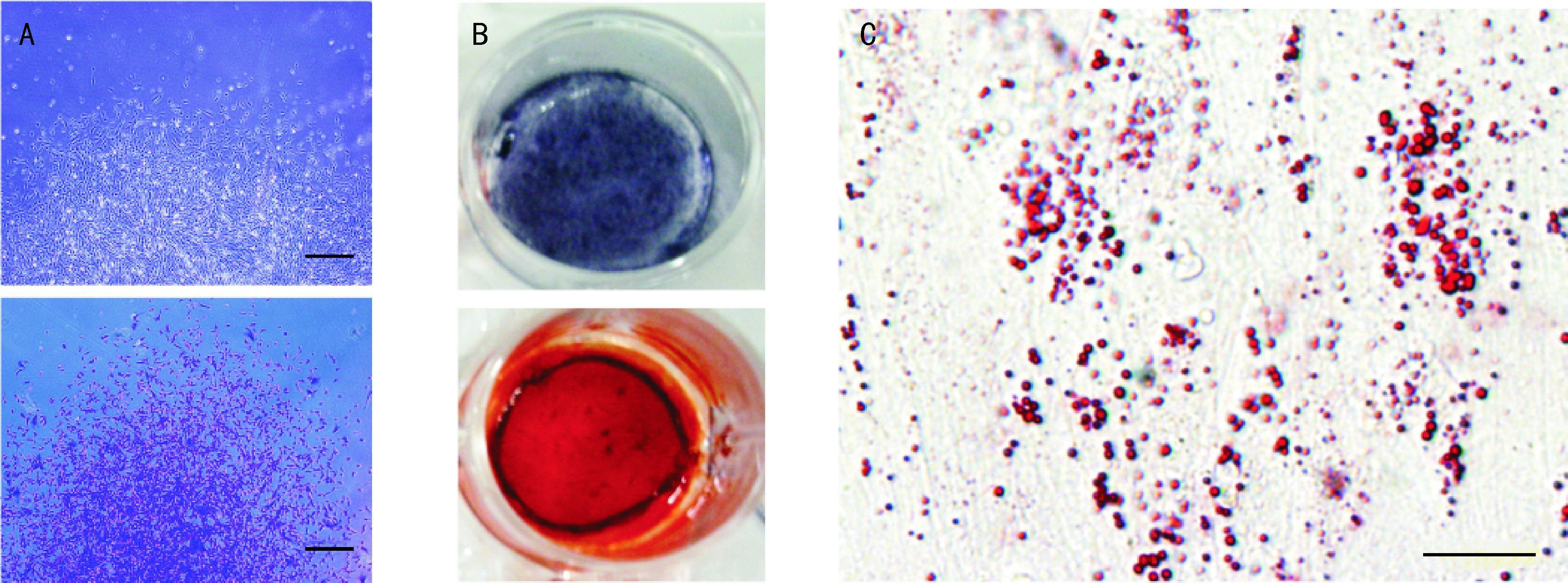
|
| A:hESC-MSC形成单克隆,细胞呈克隆样生长(倒置相差显微镜,标尺=500 μm);B:ALP及茜素红染色可见红色钙结节,显示成骨分化;C:油红O染色可见细胞内红色油滴,显示成脂分化(倒置相差显微镜,标尺=20 μm). 图 3 hESC-MSC增殖及多向分化潜能检测 Fig. 3 Proliferation and differentiation potential of human embryonic stem cells-mesenchymal stem cells |
① 鉴定成骨分化。收集消化后细胞,按5×103/cm2接种于24孔板,待细胞贴壁后,换用含10% FBS的高糖DMEM培养液,加入成骨诱导体系1×10-7mol/L地塞米松、10 mmol/L β-甘油磷酸钠、50 g/mL抗坏血酸磷酸盐),每三天换液一次,维持2~3周。用ALP试剂盒及茜素红染色检测成骨细胞分化(见图 3B),定量PCR检测骨分化相关基因Runx2、OCN的表达上调。
② 鉴定成脂分化。收集消化后细胞,按1.5×104 /cm2接种于24孔板,待细胞贴壁后,换用含10% FBS的高糖DMEM培养液,加入脂肪诱导液(0.5 mmol/L1-甲基-3-异丁基黄嘌呤,1 mmol/L地塞米松,10 g/mL胰岛素和200 μmol/L吲哚美辛),维持两周,每三天换液一次。油红O染色后倒置相差显微镜下观察细胞内脂肪小滴形成情况(图 3C)。
③ 鉴定成软骨分化。收集消化后细胞,2×105/cm2 MSC+0.5 mL含TGF-β1体系软骨诱导液(含胰岛素6.25 μg/mL,转铁蛋白6.25 μg/mL,亚硒酸6.25 μg/mL,1.25 μg/mL牛血清白蛋白,1 mmol/L丙酮酸盐,50 μg/mL抗坏血酸磷酸盐,1×10-7 mol/L地塞米松,2.5%FBS,10 ng/mL TGF-β1 ),加入15 mL聚丙烯管中,200×g离心5 min,将细胞置于37 ℃、5%二氧化碳培养24 h,2~3 d换液一次,3周后组织切片,用HE及番红染色。定量PCR检测软骨分化相关基因SRY促HMG盒9(Sox9)、聚集蛋白聚糖(aggrecan)的表达上调。
④ 微生物及内毒素测定。方法同人ESC测定方法。此外,如ES-T来源于使用MEF滋养层培养法培养的人ESC,则需进行小鼠源性病毒的全面检测;细胞培养过程中如使用FBS,需进行牛源特定病毒的检测;传代过程中如使用胰酶等猪源材料,至少应检测猪源细小病毒。
2 第二步:hESC-MSC向肌腱细胞的分化方法肌腱细胞的分化方法采用高密度种植形成无支架组织工程肌腱,并利用静态或动态力学刺激在体内外环境诱导成肌腱。
2.1 无支架组织工程肌腱的制备常规培养hESC-MSC,培养基中加入50 g/mL维生素C,防止细胞老化和促进细胞外基质分泌。三天更换一次培养基,培养2~3周后细胞分泌的细胞外基质逐渐累积和细胞一起在培养皿底部形成连续的细胞片。当细胞片形成后,可以从培养板上分离下来,用1 mL枪头尖部沿培养皿的一边,用向上剪切力慢慢卷起细胞片,形成长条形组织。继续培养一周,使细胞片光滑面与粗糙面充分融合形成组织工程肌腱。组织学检测组织工程肌腱的结构特征,透射电镜检测其胶原纤维形成情况。详见图 4。
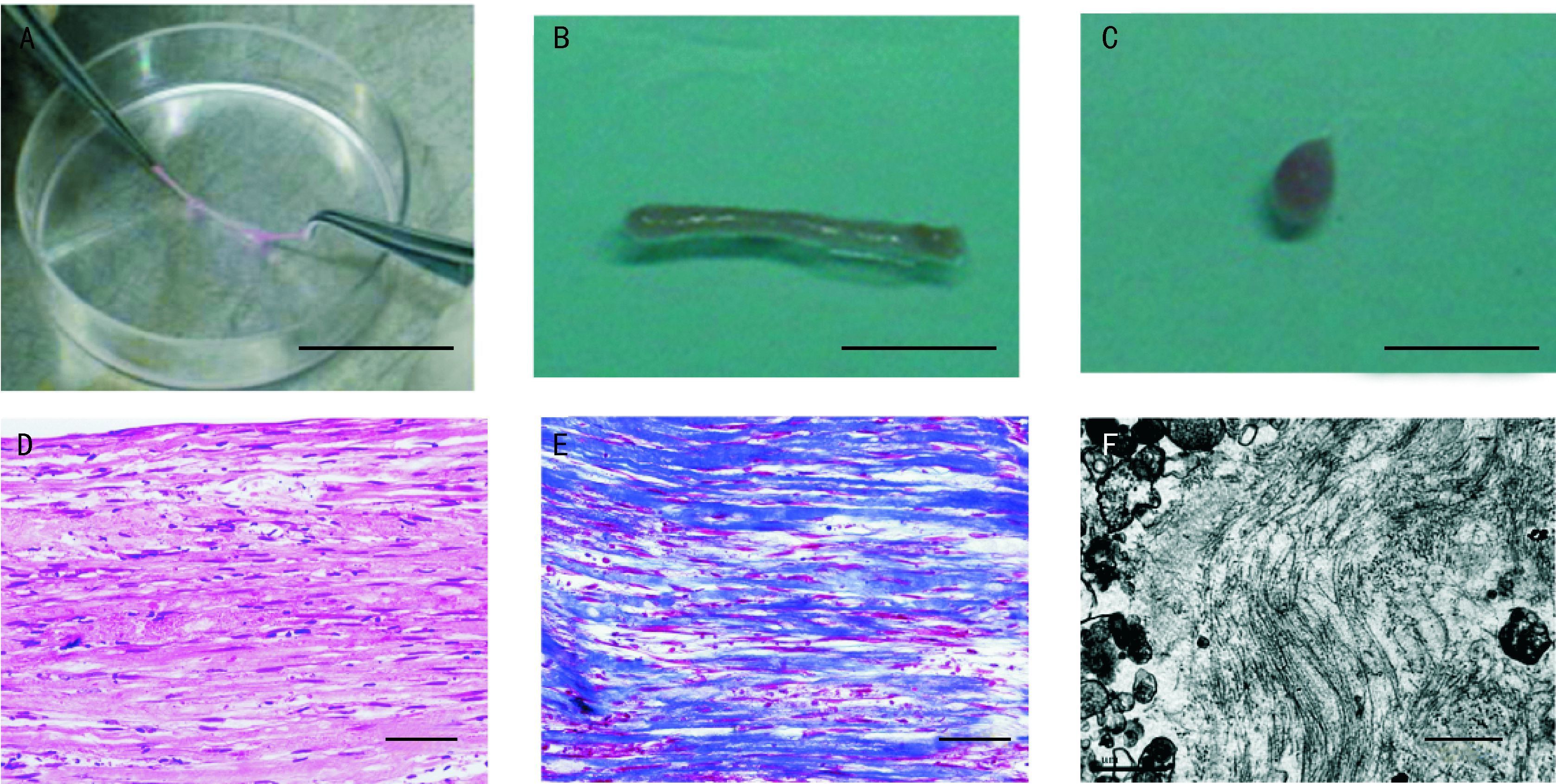
|
| A:卷起连续的细胞片构建组织工程肌腱;B:组织工程肌腱体外静态力学刺激两周后组织形态;C:组织工程肌腱体外未经力学刺激的大体形态;标尺=1 cm. D和E:光镜下观察力学刺激两周后组织工程肌腱经HE染色(D)和Masson三色染色(E)均可见大量梭形样细胞和胶原纤维束,标尺=50 μm.F:机械应力两周后,透射电镜下观察组织工程肌腱纵切面可见波浪状的胶原纤维,标尺=1 μm. 图 4 hESC-MSC向肌腱细胞的分化过程中大体形态和组织学表现[15] Fig. 4 In vitro construction of engineered tendon using human embryonic stem cells-mesenchymal stem cells |
将组织工程肌腱两端固定在架子两端,拉伸10%。以静态力学或者动态力学刺激培养14 d后,可形成长条形肌腱(图 4A,4B),未经力学刺激的大体形态见图 4C;组织化学染色结果显示该组织中胶原束和大量梭形细胞沿拉力方向排列(图 4D,4E),电镜下呈波浪状(图 4F)。
2.3 体内动态力学刺激诱导hESC-MSC肌腱分化将长约3 cm的组织工程肌腱两端缝合在裸鼠背部的脊上韧带,位于项筋膜的第10胸椎水平和骶棘肌筋膜的第2骶椎水平。鼠的活动可为组织工程肌腱提供体内循环机械刺激。4周后可见图 4D、4E、4F肌腱组织形态学表现。
2.4 hESC-MSC向肌腱分化的质量控制 2.4.1 细胞及组织形态细胞在体内外经过力学拉力刺激后变得更加紧密,形成了一条吊带样的组织(图 4B,5A)[15-16]。HE染色和Masson三色染色结果显示形成了致密的组织,其主要由纺锤形肌腱细胞和波浪状胶原纤维束构成(图 4D,5B)。透射电镜观察显示有类似肌腱组织波浪状的胶原纤维形成(图 4F,5C,5D)。
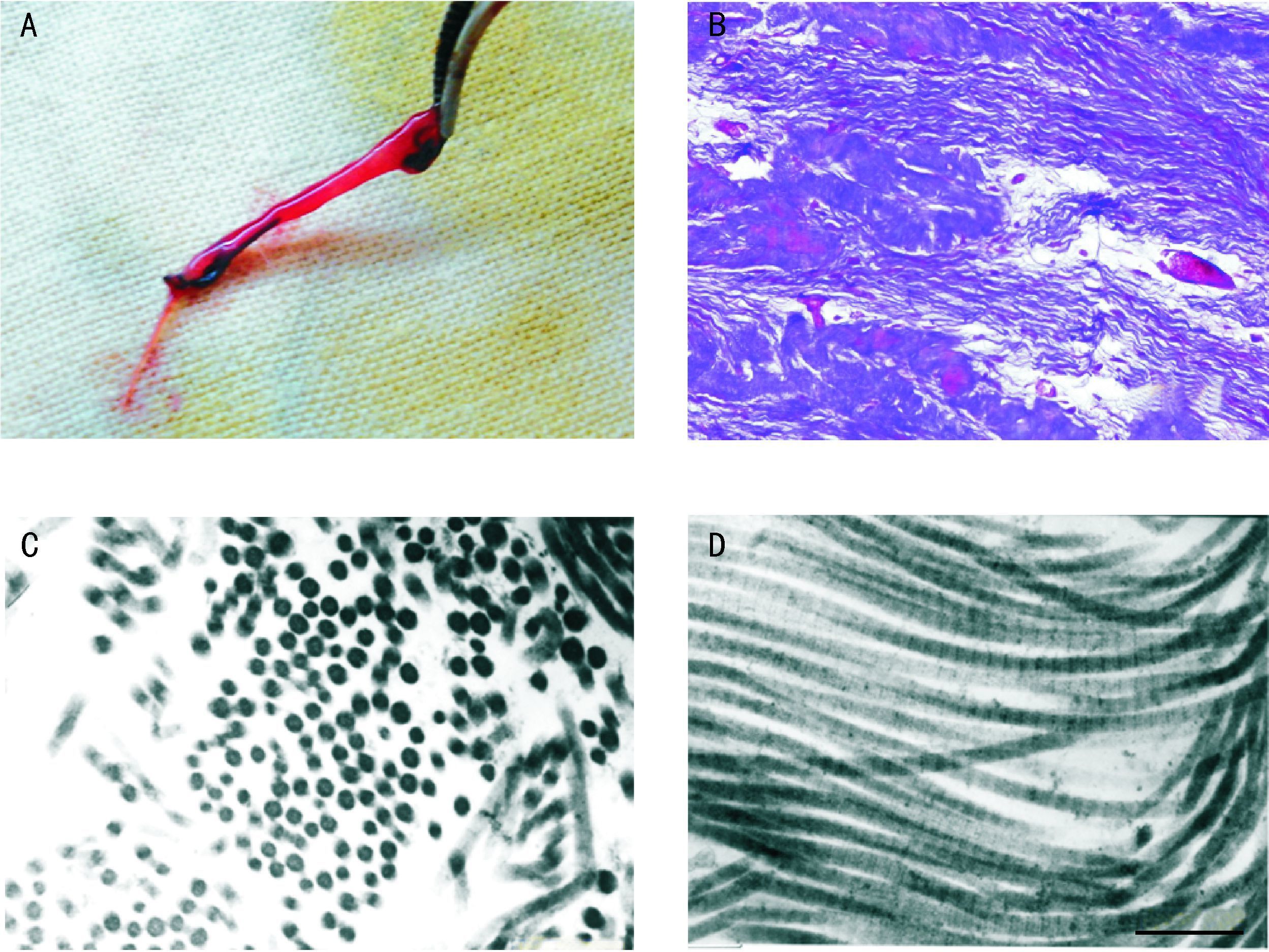
|
| A:力学刺激4周后体内异位组织工程肌腱大体形态;B:光镜下观察组织工程肌腱 中波浪型胶原纤维束形成;标尺=200 μm.C和D:透射电镜下观察体内组织工程肌腱横 切面(C)、纵切面(D)的胶原纤维,标尺=210 nm. 图 5 组织工程肌腱体内异位移植后大体形态和组织学表现[16] Fig. 5 In vivo remodeling of engineered tendons after ectopic subcutaneous implantation |
Trizol法提取诱导后总RNA用于定量PCR检测。肌腱主要由Ⅰ型胶原组成,肌腱细胞高表达Ⅰ型胶原,其特异表达基因包括肌腱调节素(tenomodulin)、碱性螺旋—环—螺旋转录因子SCLERAXIS(SCX)、同源异型盒基因SIX1、眼缺失蛋白2(EYA2)和Eph受体酪氨酸激酶A4(EPHA4)[21],不表达或低表达OCT4、NANOG、TELOMERASE基因(图 2)。因此,诱导后细胞高表达Ⅰa1型胶原、Ⅰa2型胶原、肌腱调节素、SCX、SIX1、EPHA4及EYA2基因。
2.4.3 标志蛋白的表达将体内外诱导后形成细胞片的细胞用4%多聚甲醛固定后做免疫荧光染色,以正常肌腱干细胞为阳性对照。与人肌腱细胞相似,诱导后细胞应表达Ⅰ型胶原、14型胶原、EPHA4及肌腱调节素,见图 6。
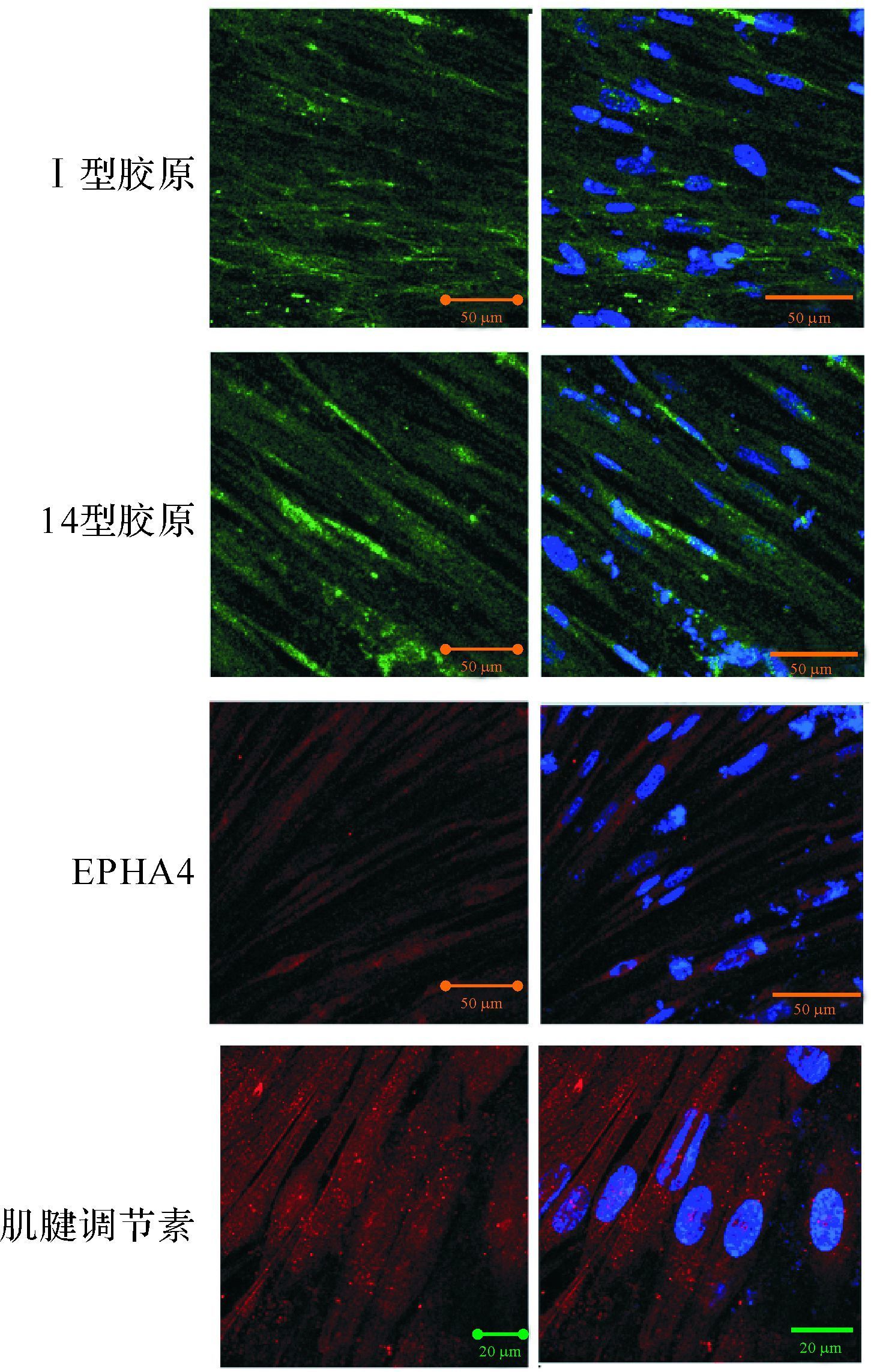
|
| 诱导后hESC-MSC表达Ⅰ型胶原、14型胶原、EPHA4及肌腱调节素,激光共聚焦显微镜下呈现绿色、红色荧光为目标蛋白,蓝色荧光为细胞核,标尺=50 μm.EPHA4:Eph受体酪氨酸激酶A4. 图 6 hESC-MSC细胞诱导后激光共聚焦显微镜下形态学表现 Fig. 6 human embryonic stem cells-mesenchymal stem cells engineered tendons expressed tendon related genes |
| [1] | LJUNGQVIST A, SCHWELLNUS M P, BACHL N, et al. International Olympic Committee consensus statement: molecular basis of connective tissue and muscle injuries in sport[J]. Clin Sports Med, 2008, 27 (1) :231–239 . |
| [2] | CHEN X, SONG X H, YIN Z, et al. Stepwise differentiation of human embryonic stem cells promotes tendon regeneration by secreting fetal tendon matrix and differentiation factors[J]. Stem Cells, 2009, 27 (6) :1276–1287 . |
| [3] | CHEN X, ZOU X H, YIN G L, et al. Tendon tissue engineering with mesenchymal stem cells and biografts: an option for large tendon defects?[J]. Front Biosci(Schol Ed), 2009, S1 :23–32 . |
| [4] | MURRAY M M. Current status and potential of primary ACL repair[J]. Clin Sports Med, 2009, 28 (1) :51–61 . |
| [5] | GASPAR D, SPANOUDES K, HOLLADAY C, et al. Progress in cell-based therapies for tendon repair[J]. Adv Drug Deliv Rev, 2015, 84 :240–256 . |
| [6] | LU P, ZHANG G R, SONG X H, et al. Col V siRNA engineered tenocytes for tendon tissue engineering[J]. PLoS One, 2011, 6 (6) :e21154 . |
| [7] | ROLFE K J, IRVINE L M, GROBBELAAR A O, et al. Differential gene expression in response to transforming growth factor-beta1 by fetal and postnatal dermal fibroblasts[J]. Wound Repair Regen, 2007, 15 (6) :897–906 . |
| [8] | HANTASH B M, ZHAO L, KNOWLES J A, et al. Adult and fetal wound healing[J]. Front Biosci, 2008, 13 :51–61 . |
| [9] | FANG Z, ZHU T, SHEN W L, et al. Transplantation of fetal instead of adult fibroblasts reduces the probability of ectopic ossification during tendon repair[J]. Tissue Eng Part A, 2014, 20 (13-14) :1815–1826 . |
| [10] | TANG Q M, CHEN J L, SHEN W L, et al. Fetal and adult fibroblasts display intrinsic differences in tendon tissue engineering and regeneration[J]. Sci Rep, 2014, 4 :5515 doi:10.1038/spep05515 . |
| [11] | FAVATA M, BEREDJIKLIAN P K, ZGONIS M H, et al. Regenerative properties of fetal sheep tendon are not adversely affected by transplantation into an adult environment[J]. J Orthop Res, 2006, 24 (11) :2124–2132 . |
| [12] | CARR A J, SMART M J, RAMSDEN C M, et al. Development of human embryonic stem cell therapies for age-related macular degeneration[J]. Trends Neurosci, 2013, 36 (7) :385–395 . |
| [13] | YANG G, SI-TAYEB K, CORBINEAU S, et al. Integration-deficient lentivectors: an effective strategy to purify and differentiate human embryonic stem cell-derived hepatic progenitors[J]. BMC Biol, 2013, 11 :86 doi:10.1186/1741-7007-11-86 . |
| [14] | MAROOF A M, KEROS S, TYSON J A, et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells[J]. Cell Stem Cell, 2013, 12 (5) :559–572 . |
| [15] | CHEN X, YIN Z, CHEN J L, et al. Force and scleraxis synergistically promote the commitment of human ES cells derived MSCs to tenocytes[J]. Sci Rep, 2012, 2 (12) :1411–1411 . |
| [16] | CHEN X, SONG X H, YIN Z, et al. Stepwise differentiation of human embryonic stem cells promotes tendon regeneration by secreting fetal tendon matrix and differentiation factors[J]. Stem Cells, 2009, 27 (6) :1276–1287 . |
| [17] | CHEN X, YIN Z, CHEN J L, et al. Scleraxis-overexpressed human embryonic stem cell-derived mesenchymal stem cells for tendon tissue engineering with knitted silk-collagen scaffold[J]. Tissue Eng Part A, 2014, 20 (11-12) :1583–1592 . |
| [18] | 傅歆, 邓旭亮, 李盛林, 等. 人胚胎干细胞向成纤维细胞分化方法的专家共识[J]. 中华医学杂志, 2014, 94 (40) : 3130–3134 . FU Xin, DENG Xuliang, LI Shenglin, et al. Expert consensus on differentiation of human embryonic stem cells into fibroblasts[J]. Nat Med J China, 2014, 94 (40) :3130–3134 . |
| [19] | BARBERI T, WILLIS L M, SOCCI N D, et al. Derivation of multipotent mesenchymal precursors from human embryonic stem cells[J]. PLoS Med, 2005, 2 (6) :554–560 . |
| [20] | BI Y, EHIRCHIOU D, KILTS T M, et al. Identification of tendon stem/progenitor cells and the role of the extracellular matrix in their niche[J]. Nat Med, 2007, 13 (10) :1219–1227 . |
| [21] | HOFFMANN A, PELLED G, TURGEMAN G, et al. Neotendon formation induced by manipulation of the Smad8 signalling pathway in mesenchymal stem cells[J]. J Clin Invest, 2006, 116 (4) :940–952 . |




