2. 浙江大学医学院附属第一医院病理科, 浙江 杭州 310003
2. Department of Pathology, the First Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310003, China
肾细胞癌(renal cell carcinoma)约占成人恶性肿瘤的3%,占肾脏肿瘤的90%[1],发病率逐年呈上升趋势[2]。全球每年新发病例约271 000例,死亡116 000例[3]。我国根据2005年至2009年登记,肾细胞癌的发生率逐年上升[4]。肾细胞癌对临床经典的放化疗均不敏感,根治性或部分肾切除是目前临床治疗肾细胞癌的主要手段。局限性肾细胞癌(Ⅰ/Ⅱ期)经外科手术即可治愈,无需进行辅助治疗。尽管手术疗效确切,但17%~30%的患者在确诊时已存在肿瘤转移[5],术后患者中20%~40%出现局部复发或远处转移[6, 7]。出现转移的肾细胞癌患者中位生存时间仅13个月,5年存活率约为12.3%[8]。因此,如何对局部进展期肾细胞癌及转移性肾细胞癌患者进行有效的治疗是一个临床亟待解决的难题。在临床工作中,对进展期肾细胞癌的治疗仍处于摸索阶段。转移性肾细胞癌患者对经典化疗药物普遍耐药。中、高剂量的IFN-α或(和)IL-2等以细胞周期为基础的免疫治疗一直作为转移性肾细胞癌术后的一线治疗方案,但免疫治疗的客观反应率仅为5%~27%[4]。随着分子遗传学研究的进展和靶向药物的成功研发,已有一些新药物能应用于进展期肾细胞癌患者的治疗,另一些新型的靶向药物正在临床试验中。外科术后对患者进行分层归类并施以个性化的全身综合治疗(精准治疗)是未来肾细胞癌治疗的方向,亟待探索。本文就近年来相关研究的进展和认识作一概述,供临床治疗和进一步研究参考。
1 肾细胞癌的组织病理学类型肾细胞癌有多种组织学类型,三种主要的病理类型占肾细胞癌总数的95%。其中,最常见的肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)占75%,乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)占15%(根据组织学特征可进一步分为Ⅰ型和Ⅱ型,其中以Ⅱ型多见),嫌色细胞肾细胞癌(chromophobe renal cell carcinoma,ChRCC)占5%。其余约5%的肾细胞癌为一些少见的组织学类型,包括黏液小管和梭形细胞癌、肾集合管癌、神经母细胞瘤相关肾细胞癌、管状囊状肾细胞癌、嗜酸细胞乳头状肾细胞癌、甲状腺滤泡样肾细胞癌、血管平滑肌瘤样肾细胞癌、透明细胞(管状)乳头状肾细胞癌、mit家族移位肾细胞癌[Xp11.2易位/TFE3基因融合肾细胞癌和t(6;11)移位肾细胞癌等]、获得性囊性疾病肾细胞癌和终末期肾疾病相关性肾细胞癌等[9, 10]。
ccRCC和PRCC起源自近曲小管,ChRCC和集合管癌起源自远端肾单位,可能来自集合管。而少见类型的肾细胞癌起源目前尚未明确。除了ccRCC外,其他组织学类型的肿瘤标本,只要有足够多的取材均可以发现数量不等的透明细胞存在。他们各自存在的组织病理学特征和分子生物学特征可以帮助病理医师做出明确的诊断。ccRCC和多数少见肾细胞癌有明确的分子生物学特征,但PRCC和ChRCC并没有公认的分子生物学特征。如前文所述,大部分肾细胞癌的病理类型是ccRCC,且几乎所有的转移性肾细胞癌病理类型为ccRCC[11]。因此,临床上真正具有开展靶向治疗价值的就是ccRCC。从这个意义上讲,现阶段如何准确诊断ccRCC是尤为重要的第一步。所幸的是,ccRCC的诊断已相对成熟,误诊极少。病理医师需要特别注意的是具有大量透明细胞的PRCC和ChRCC,切莫将这些类型的肾细胞癌误诊为ccRCC而导致错误地实施靶向治疗。
2 实施靶向治疗的分子生物学基础 2.1 ccRCC的分子生物学特征96%的ccRCC为散发性,4%为遗传性。ccRCC分子生物学特征的鉴定来自于希佩尔林道综合征(von Hippel-Lindau syndrome,VHL综合征)的研究启示。VHL综合征是一种遗传性多发肿瘤综合征,典型的病例包括ccRCC,颅、脊柱和眼的血管母细胞瘤,嗜铬细胞瘤,胰腺和肾囊肿。在30%~60%的ccRCC患者中可以发现VHL的基因突变,在邻近肿瘤的非肿瘤性囊肿组织中也可以发现VHL基因的突变。因而认为VHL是ccRCC的守门员基因(gatekeeper gene),其突变启动了ccRCC的形成。以此为基础引申到散发性ccRCC检测,可以发现90%以上散发性ccRCC具有VHL基因的突变,包括染色体3p的丢失(VHL定位于3p 25.3)、点突变、基因启动子的甲基化和基因重排[12]。根据几组测序研究的报道,三分之二散发性ccRCC有双等位基因的丢失,55%有点突变[13],10%~15%有基因启动子的甲基化[14],87%有3p杂合性缺失(loss of heterozygosity,LOH)[13],其他则为纯合性丢失和基因重排。在肾细胞癌的其他组织学类型中未出现以上VHL基因的改变,因此可以认为这些是ccRCC特异性和特征性的基因改变。
在非ccRCC肾细胞癌中存在一些生殖细胞的突变,如遗传性PRCC中有c-MET基因的突变活化,在散发性Ⅰ型PRCC中有c-MET基因的突变。遗传性平滑肌瘤病综合征的肾细胞癌中有延胡索酸水解酶(fumarate hydratase,FH)基因的突变。FH抑癌基因的突变也可发生于Ⅱ型PRCC,散发性PRCC中无此突变。Birt-Hogg-Dube综合征伴发肾细胞癌中有卵泡刺激激素(folliculin,FLCN)突变。然而这些在遗传性肾细胞癌中出现的突变类型很少在散发性肾细胞癌中发现,因此对肿瘤治疗的指导意义不大[12]。
近年来,二代测序技术的应用发现了一些与肾细胞癌相关的新的基因突变。染色体修饰相关基因的截断性体细胞突变发生频率较高,如组蛋白修饰基因聚溴蛋白(protein polybromo 1,PBRM1)基因、组蛋白赖氨酸甲基转移酶(histone-lysine N-methyltranferase 2,SETD2)基因、赖氨酸去甲基化酶(homo sapiens lysine (K)-specific demethylase 5C,KDM5C)基因、KDM6A[13, 15, 16, 17, 18, 19, 20, 21]。同时发现的还有泛素介导蛋白降解通路的基因突变如乳癌1号易感基因相关蛋白1(breast cancer susceptibility protein 1-associated protein 1,BAP1)基因,DNA修复蛋白基因如错配修复蛋白(DNA mismatch repair protein,PMS1)基因、解螺旋酶(Werner syndrome ATP-dependent helicase,WRN)基因和重组修复相关蛋白(nibrin,NBN)基因[13]。随着二代测序技术价格的降低及更广泛的应用,更多突变基因的发现指日可待。
基于目前对肾细胞癌已存在的大量分子遗传学研究,对三种主要组织学类型的肾细胞癌分子生物学改变归纳见表1[11]。目前为止,靶点基因分子改变明确且具有临床应用价值的仍只有ccRCC特异性的VHL相关通路的关键蛋白。
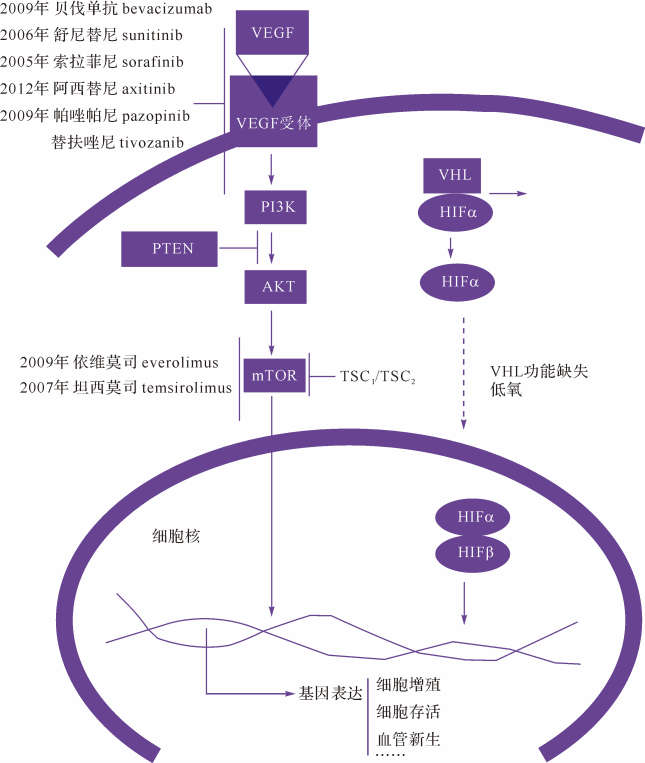
2.2 VHL基因突变后信号通路改变与靶向治疗目前针对肾细胞癌的靶向治疗方法有三种机制:①小分子酪氨酸激酶抑制剂,如舒尼替尼(sunitinib)、索拉菲尼(surafinib);②雷帕霉素靶蛋白(mammal target of rapamycin,mTOR)抑制剂,如依维莫司(everolinmus)、坦西莫司(temsirolimus);③单克隆抗体,如贝伐单抗(bevacizumab)通过对抗血管内皮生长因子(vascular endothelial growth factor,VEGF)抑制肿瘤血管生成(图1)。
|
| VEGF:血管内皮生长因子;HIF:缺氧诱导因子;PI3K:磷脂酰肌醇-3-激酶;VHL: 希佩尔林道综合征蛋白;mTOR雷帕霉素靶蛋白.通路1:血管内皮生长因子—磷脂酰 肌醇-3-激酶(phosphoinosmde-3-kinase,PI3K)—蛋白激酶B(protein kinase B,PKB,又 称AKT)—雷帕霉素靶蛋白(mTOR)信号通路,在该通路的不同靶点使用不同的靶向 药物进行阻断,发挥生物学效应;通路2:希佩尔林道(VHL)综合征蛋白结合缺氧诱导 因子α(HIFα)后可造成其降解,一旦VHL蛋白表达减少或缺失,未降解的HIFα进入 细胞核发挥效应. 图1 肾细胞癌靶向治疗的不同分子生物学机制[23] Fig.1 Molecular mechanisms of targeted therapies of renal cell carcinoma |
VHL基因产物是约30 000u分子量的蛋白,其作用是作为E3泛素连接酶复合物底物(E3 ubiquitin ligase complex)而发挥作用。这个复合物能结合缺氧诱导因子α(hypoxia-inducible factor alpha,HIFα)从而实现多泛素化并进入蛋白酶体降解途径降解。在VHL失活或低氧状态下,HIFα就无法降解并移位入细胞核内,与HIFβ形成复合物,从而活化肿瘤发生发展相关基因的转录[12]。
| 肾细胞癌种类 | 点突变 | 拷贝数改变 | mRNA表达 | 甲基化 | miRNA表达 |
| ccRCC | VHL 55% PBRM1 41% | -3p,+5q -6q,8p,9,10q,14q | GST-α上调 vimentin上调 | VHL RASSF1A TWIST | miR-141上调 miR-200c下调 miR-210下调 |
| PRCC | MET 5% | +7,+17,-Y,-6,8,9,14q | AMACR上调 | RASSF1A | 无 |
| ChRCC | p53 25% | -1,2,6,10,13,17,21 | CA-Ⅱ,c-Kit上调 | 无 | 无 |
| ccRCC:肾透明细胞癌,PRCC:乳头状肾细胞癌,ChRCC:嫌色细胞肾细胞癌. | |||||
VHL的失活引起诸多基因的改变。依据HIF1α和HIF2α的表达差异可将ccRCC分为两类[22]:一类是HIF1α和HIF2α表达均增高,称之为H1H2型;另一类则仅为HIF2α表达增高而HIF1α表达不高,称之为H2型。H1H2型ccRCC表现为mTOR和分裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)通路活性的增强,而H2型则主要是c-myc活性的增强。从其特征性分子改变可以推测,H1H2型的血管形成能力更强,因此对VEGF和mTOR抑制剂的反应更好。而H2型的细胞增殖更为旺盛,临床则应更偏重于细胞增殖的抑制性治疗。
3 进展期ccRCC的靶向治疗现状目前临床已有的进展期ccRCC的靶向治疗均依据信号通路靶点,一类已应用于临床治疗,另一类则尚处于试验阶段(试验方案见表2)。表2整理的临床试验绝大多数是针对经典通路靶分子的抑制,开发靶标明确,机制基本清楚。这些新的试验药物与临床已有的药物作用于相同靶点,但分子结构上有所不同,故需要进行有效性和副作用的比较。而小部分的试验方案则是针对新抗癌机制的,主要包括程序性死亡蛋白1(programmed death-1,PD-1)、抗体药物偶联物(antibody drug conjugates,ADC)药物和干细胞。
| NCT编号 | 制剂 | 试验阶段 | 分子生物学机制 |
| 01672775 | AGS-16C3F | Ⅰ | 抗-ENpp3抗体-药 物偶联物 |
| 01806064 | TRC-105 | Ⅰ | 抗CD105抗体 |
| 01497821 | AMG-172 | Ⅰ | 抗-CD70抗体-药 物偶联物 |
| 01677390 | SGN-75 | Ⅰ | 抗-CD70抗体-药 物偶联物 |
| 01283048 | BKM-120 | Ⅰ | PI3K抑制剂 |
| 01482156 | BEZ 235 | Ⅰ | PI3K/mTOR激酶 抑制剂 |
| 01480154 | MK22006 | Ⅰ | AKT抑制剂 |
| 01548482 | trebananib | Ⅰ | 血管生成素1、2中 和肽 |
| 01391143 | MGA 271 | Ⅰ | 抗B7-H3抗体 |
| 01460134 | CDX-1127 | Ⅰ | 抗CD27单克隆抗 体 |
| 01005797 | panobinostat (LBH 589) | Ⅰ | HDAC抑制剂 |
| 01038778 | entinostat | Ⅰ | HDAC抑制剂 |
| 01582009 | panobinostat(LBH 589) | Ⅰ/Ⅱ | HDAC抑制剂 |
| 00184015 | bortezomib | Ⅰ/Ⅱ | 蛋白酶体抑制剂 |
| 01762033 | sonepcizumab(LT1009) | Ⅱ | 抗1-磷酸-鞘氨 醇抗体 |
| 00357760 | ziv-aflibercept | Ⅱ | 结合VEGF-A,B和 PDGF的可溶性 受体 |
| 01835158 | cabozantinib | Ⅱ | c-MET和VEGFR-2 抑制剂 |
| 01688973 | tivanitinib | Ⅱ | c-MET抑制剂 |
| 01664182 | trebananib | Ⅱ | 血管生成素1、2中 和肽 |
| 01727089 | TRC 105 | Ⅱ | 抗CD105抗体 |
| 01441765 | CT-011 | Ⅱ | 抗PD-1抗体 |
| 01793636 | AZD 2014 | Ⅱ | mTOR抑制剂 |
| 00566995 | vandetanib | Ⅱ | VEGFR-2和EGFR 抑制剂 |
| 01524926 | crizotinib | Ⅱ | ALK抑制剂 |
| 01865747 | cabozantinib | Ⅱ | c-MET和VEGFR-2 抑制剂 |
| 01668784 | nivolumab(BMS-936558) | Ⅲ | 抗PD-1抗体 |
| HDAC: 组蛋白去乙酰酶;VEGFR: 血管内皮生长因子受体;PDGF: 血小板衍生生长因子;PD-1:程序性死亡蛋白-1;EGFR: 表皮生长因子受体;ALK: 间变淋巴瘤激酶. | |||
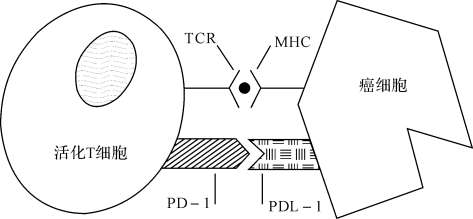
抗PD-1和程序性死亡蛋白配体1(PDL-1)的药物近年来颇为热门,其本质属于免疫调节治疗[24, 25]。但因其具有明确的靶分子,所以也同属分子靶向治疗的范畴(具体机制见图2)。PD-1(CD279)是表达于活化的T细胞、B细胞和髓系细胞上的抑制性受体,而PDL-1则是表达于癌细胞上的配体分子。一旦PD-1与PDL-1形成受体—配体复合物,T细胞的增殖和存活即受到抑制。相反的,如果阻断PDL-1,患者本身的T细胞即被活化,发挥抗肿瘤的效应。因此,如果靶向药物能针对PD-1或PDL-1,阻断其结合,即可以刺激免疫系统,发挥T细胞的肿瘤特异性细胞毒作用,从而杀死肿瘤细胞。
|
| TCR:T细胞受体;MHC:主要组织相容复合体 图2 T细胞与癌细胞通过PD-1-PDL-1的相互作用 Fig.2 T cell and cancer cell interacts through the PD-1 and PDL-1 conjugation |
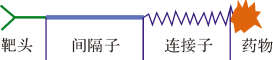
ADC近年来同样备受瞩目[26]。ADC药物由抗体和一个偶联的小分子药物构成,如图3所示。当抗体结合肿瘤细胞后,ADC复合物通过内吞作用进入癌细胞,从而发挥特异性杀伤作用。因而这类药物具有特异性高、副作用小的特点。
|
| 图3 抗体药物偶联的由抗体(或抗体片段)和有效载荷的小分子药物(通常为细胞毒性)组成 Fig.3 ADC drugs consist of an antibody (or antibody fragment) linked to a payload small molecular drug (often cytotoxic) |
尽管肿瘤干细胞的概念具有普适性,但肿瘤干细胞特异性分子标志尚不明确。目前比较一致的看法是不同组织来源的肿瘤,其干细胞的标志不尽相同。有关ccRCC的研究表明,表达CD105(endoglin)的癌细胞具有肿瘤干细胞的特征[27, 28]。基于这个原理,一些针对ccRCC肿瘤干细胞的药物也已进入临床试验。
4 展 望迄今,已有大量研究针对肾细胞癌的靶向治疗这一临床难题展开。尽管大剂量IL-2、干扰素、酪氨酸激酶抑制剂、mTOR抑制剂单独使用或联合应用在一部分进展期ccRCC患者中获得了疗效,但遗憾的是目前尚未有确切的能使大多数肾细胞癌患者受益且在临床上能广泛应用的治疗方案。由于药物毒副作用的显现而掩盖了实际有益的药物效应,部分用药的肾细胞癌患者并未因药物治疗而获得更长期的生存。问题的根源即在于肿瘤的异质性。病理组织学上,不同的肿瘤细胞成分具有不同的分子特征,故对药物的反应不同。在大量临床试验中,研究者对各种能预测预后和药物反应的生物标志物进行了系统研究,包括患者个体基因多态性、不同的组织病理学特征、基因表达和突变状态(CAIX、PTEN、VHL、Kras、HIF等)、血清标志物、微小RNA等,但目前得出的结论普适性较差,不具有推广意义[30]。因此,如何找出合适的生物标志物并对肿瘤患者进行分层治疗将是基础研究者和临床医师进一步探索的方向。
| [1] | GIRGIS H, MASUI O, WHITE N M, et al. Lactate dehydrogenase A is a potential prognostic marker in clear cell renal cell carcinoma[J]. Mol Cancer, 2014, 13:101. |
| [2] | SIEGEL R L, FEDEWA S A, MILLER K D, et al. Cancer statistics for Hispanics/Latinos, 2015[J]. CA Cancer J Clin, 2015, 65(6):457-480. |
| [3] | FERLAY J, SHIN H R, BRAY F, et al. Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12):2893-2917. |
| [4] | 吴阶平,那彦群,叶章群,等. 2014版中国泌尿外科疾病诊断治疗指南[M].北京:人民卫生出版社,2013:3-10. WU Jieping, NA Yanqun, YE Zhangqun, et al. Chinese association of urology guidelines the 2014 edition[M]. Beijing:People's Medical Publishing House, 2013:3-10.(in Chinese) |
| [5] | MOTZER R J, BANDER N H, NANUS D M. Renal-cell carcinoma[J]. N Eng J Med, 1996, 335(12):865-875. |
| [6] | TENG J, GAO Y, CHEN M, et al. Prognostic value of clinical and pathological factors for surgically treated localized clear cell renal cell carcinoma[J]. Chin Med J (Engl), 2014, 127(9):1640-1644. |
| [7] | YANG F, ZHOU X, DU S, et al. LIM and SH3 domain protein 1(LASP-1) overexpression was associated with aggressive phenotype and poor prognosis in clear cell renal cell cancer[J]. PLoS One, 2014, 9(6):e100557. |
| [8] | BABAIAN K N, MERRILL M M, MATIN S, et al. Partial nephrectomy in the setting of metastatic renal cell carcinoma[J]. J Urol, 2014, 192(1):36-42. |
| [9] | EBLE J N, SAUTER G, EPSTEIN J I, et al. Pathology and genetics of tumors of the urinary system and male genital organs[M]. Lyon:World Health Organization International Agencg of Reserch on Cancer, 2004:10-40. |
| [10] | 赵明, 滕晓东,孙柯,等. 新近认识的肾细胞癌[J]. 中华病理学杂志, 2013,42(7):478-482. ZHAO Ming, TENG Xiaodong, SUN Ke, et al. Recently identified renal cell carcinoma[J]. Chinese Journal of Pathology, 2013, 42(7):478-482. (in Chinese) |
| [11] | CAIRNS P. Renal cell carcinoma[J]. Cancer Biomark, 2010, 9(1-6):461-473. |
| [12] | SU D, SINGER E A, SRINIVAS A N R. Molecular pathways in renal cell carcinoma:recent advances in genetics and molecular biology[J]. Curr Opin Oncol, 2015, 27(3):217-223. |
| [13] | DALGLIESH G L, FURGE K, GREENMAN C, et al. Systematic sequencing of renal carcinoma reveals inactivation of histone modifying genes[J]. Nature, 2010, 463(7279):360-363. |
| [14] | DULAIMI E, IBANEZ DE CACERES I, UZZO R G, et al. Promoter hypermethylation profile of kidney cancer[J]. Clin Cancer Res, 2004,10(12 Pt 1):3972-3979. |
| [15] | VARELA I, TARPEY P, RAINE K, et al. Exome sequencing identifies frequent mutation of the SWI/SNF complex gene PBRM1 in renal carcinoma[J]. Nature, 2011, 469(7331):539-542. |
| [16] | Cancer Genome Atlas Research Network. Comprehensive molecular characterization of clear cell renal cell carcinoma[J]. Nature, 2013, 499(7456):43-49. |
| [17] | KAPUR P, PEÑA-LIOPIS S, CHRISTIE A, et al. Effects on survival of BAP1 and PBRM1 mutations in sporadic clear-cell renal-cell carcinoma:a retrospective analysis with independent validation[J]. Lancet Oncol, 2013, 14(2):159-167. |
| [18] | EDMUNDS J W, MAHADEVAN L C, CLAYTON A L. Dynamic histone H3 methylation during gene induction:HYPB/Setd2 mediates all H3K36 trimethylation[J]. EMBO J, 2008, 27(2):406-420. |
| [19] | LI F, MAO G, TONG D, et al. The histone mark H3K36me3 regulates human DNA mismatch repair through its interaction with MutSα[J]. Cell, 2013, 153(3):590-600. |
| [20] | PEÑA-LIOPIS S, VEGA-RUBÍN-DE-CELIS S, LIAO A, et al. BAP1 loss defines a new class of renal cell carcinoma[J]. Nat Genet, 2012, 44(7):751-759. |
| [21] | SATO Y, YOSHIZATO T, SHIRAISHI Y, et al. Integrated molecular analysis of clear-cell renal cell carcinoma[J]. Nat Genet, 2013, 45(8):860-867. |
| [22] | GORDAN J D, LAL P, DONDETI V R, et al. HIF-alpha effects on c-Myc distinguish two subtypes of sporadic VHL-deficient clear cell renal carcinoma[J]. Cancer Cell, 2008, 14(6):435-446. |
| [23] | MONZON J G, HENG D Y. Management of metastatic kidney cancer in the era of personalized medicine[J]. Crit Rev Clin Lab Sci, 2014, 51(2):85-97. |
| [24] | BRAHMER J R, DRAKE C G, WOLLNER I, et al. Phase Ⅰ study of single-agent anti-programmed death-1(MDX-1106) in refractory solid tumors:safety, clinical activity, pharmacodynamics, and immunologic correlates[J]. J Clin Oncol, 2010, 28(19):3167-3175. |
| [25] | ZHA Y Y, BLANK C, GAJEWSKI T F. Negative regulation of T-cell function by PD-1[J]. Crit Rev Immunol, 2004, 24(4):229-237. |
| [26] | LAW C L, GORDON K A, TOKI B E, et al. Lymphocyte activation antigen CD70 expressed by renal cell carcinoma is a potential therapeutic target for anti-CD70 antibody-drug conjugates[J]. Cancer Res, 2006, 66(4):2328-2337. |
| [27] | BUSSOLATI B, BROSSA A, CAMUSSI G. Resident stem cells and renal carcinoma[J]. Int J Nephrol, 2011, 2011:286985. |
| [28] | BUSSOLATI B, BRUNO S, GRANGE C, et al. Identification of a tumor-initiating stem cell population in human renal carcinomas[J]. FASEB J, 2008, 22(10):3696-3705. |
| [29] | KANESVARAN R, TAN M H. Targeted therapy for renal cell carcinoma:the next lap[J]. J Carcinog, 2014, 13:3. |
| [30] | SONPAVDE G, CHOUEIRI T K. Precision medicine for metastatic renal cell carcinoma[J]. Urol Oncol, 2014, 32(1):5-15. |




