2. 浙江大学医学院附属第一医院消化内科, 浙江 杭州 310003
2. Department of Gastroenterology, the First Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310003, China
门静脉高压是肝硬化患者的常见并发症[1, 2]。当门静脉压超过一定阈值时,门静脉系的血液会经门静脉及其属支与上、下腔静脉的属支形成侧支循环,通过侧支交通途径回流[3],即形成静脉曲张。在部分门静脉高压患者中,除了通过常见的胃底静脉、脾静脉和食管静脉曲张外,还可通过形成胃—肾分流、脾—肾分流等自发性分流来减轻门静脉压力[4, 5, 6, 7, 8, 9]。自发性分流在临床上并不十分常见,往往出现于门静脉高压十分严重时,尤其是当门静脉压力超过10 mm Hg时[5]。一旦发生,将对肝硬化的慢性病程不利,容易引起肝性脑病、败血症等并发症[8, 10];如患者进行内镜下注射硬化剂治疗(endoscopic injection sclerotherapy),则可增加异位栓塞以及肝移植后异位栓塞的发生率[11, 12, 13]。了解门静脉高压自发性分流患者特点有助于启发临床决策思路。
本研究回顾性分析浙江大学医学院附属第一医院2012年1月至2015年8月间118例肝硬化门静脉高压患者的资料,分析门静脉CT血管造影成像(computed tomographic angiography,CTA)检查与内镜检查的数据和资料,了解自发性分流患者门静脉、胃底静脉和食管曲张静脉的特点,并结合患者消化道出血史、内镜治疗史、合并肝癌史、脾切除断流手术史、肝功能Child-Pugh分级等情况,进一步探究自发性分流患者的静脉曲张情况。
1 对象与方法 1.1 对 象浙江大学医学院附属第一医院2012年1月至2015年8月间在消化内科住院和2014年1月至2015年8月间在感染科住院的118例患者,其中男性97例,女性21例,平均年龄(55.16±10.05)岁。其中有消化道出血史108例、脾切除手术史39例、内镜治疗史39例、合并肝癌11例。分析患者血常规、胆红素、白蛋白、转氨酶、血清氨、凝血功能、肾功能等多项指标,计算Child-Pugh评分。其中Child-Pugh A级80例、Child-Pugh B级32例、Child-Pugh C级5例。所有患者均进行门静脉CTA检查和胃镜检查。
1.2 门静脉CTA检查采用Aquilion 64排螺旋CT(日本东芝公司)进行扫描[14, 15, 16],术前禁食禁水4 h,行碘过敏试验,扫描前30 min服用2%泛影葡胺500~800 mL,充盈胃腔及小肠。患者仰卧位,平静呼吸。肘静脉注射非离子性增强剂碘海醇,剂量1.5~2.0 mL/kg,注射速率3~4 mL/s。扫描肝顶到双肾动脉水平,层厚、层间距均为1.25 mm。肝门水平腹主动脉层面,扫描时间20~25 s,阈值设置为80 HU。髂嵴至食管下段层面,层厚、层间距为2.5 mm,扫描开始时间为动脉期结束后30~35 s。仔细观察门静脉及门体侧支循环血管并测量门静脉、脾静脉直径,着重观察食管和胃有无静脉曲张并记录其部位及深浅,观察曲张静脉来源,观察有无自发性分流发生,若有则记录其具体分类(如胃—肾分流、脾—肾分流等)。
1.3 胃镜检查采用GIF-H260奥林巴斯电子胃镜检查。检查前禁食12 h,在口服盐酸利多卡因胶浆10 mL进行口咽部局部麻醉后,通过胃镜检查食管、胃及十二指肠球部,仔细观察有无静脉曲张、门静脉高压性胃病、溃疡和其他疾病。测量胃底静脉横截面积。食管静脉曲张参考中华医学会消化内镜学分会内镜下食管静脉曲张分级标准进行分级[17]。
1.4 统计学方法
应用SPSS 18.0统计分析软件,计量资料呈正态分布者用均数±标准差(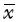 ±s)表示,不呈正态分布者用中位数(最小值~最大值)[M(min~max)]表示。对存在分流与无分流患者的门静脉直径、胃底曲张静脉横截面积、食管静脉曲张范围和严重程度等指标进行差异性检验。其中对连续变量采用t检验,对非连续变量采用χ2检验,非正态分布变量、等级变量进行Wilcoxon 秩和检验。考察消化道出血史、内镜治疗史、脾切除断流手术史、Child-Pugh分级等因素,自发性分流患者的静脉曲张特点采用方差分析进行统计检验,P<0.05为差异具有统计学意义。
±s)表示,不呈正态分布者用中位数(最小值~最大值)[M(min~max)]表示。对存在分流与无分流患者的门静脉直径、胃底曲张静脉横截面积、食管静脉曲张范围和严重程度等指标进行差异性检验。其中对连续变量采用t检验,对非连续变量采用χ2检验,非正态分布变量、等级变量进行Wilcoxon 秩和检验。考察消化道出血史、内镜治疗史、脾切除断流手术史、Child-Pugh分级等因素,自发性分流患者的静脉曲张特点采用方差分析进行统计检验,P<0.05为差异具有统计学意义。
门静脉CTA检查结果,24例存在脾—肾或胃—肾分流,94例不存在自发性分流,分流发生率为20.33%。两组患者的主要临床指标见表1。其中分流组不存在肝癌患者,无分流组接受脾切除断流手术显著多于分流组。分流组胃底曲张静脉面积大于无分流组;分流组与无分流组食管静脉曲张范围和程度分布差异均有统计学意义,分流组食管静脉曲张分布范围较小,且曲张程度较轻。
[n(%)或(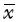 ±s)或M(min~max)] ±s)或M(min~max)] | ||
| 指标 | 分流(n=24) | 无分流(n=94) |
| 男性 | 19(79.17) | 78(82.98) |
| 平均年龄(岁) | 55.00±10.13 | 55.20±10.09 |
| 消化道出血史 | 20(83.33) | 88(93.62) |
| 内镜治疗史 | 7(29.17) | 32(34.04) |
| 合并肝癌 | 0(0) | 11(11.70) |
| 脾切除手术史* | 3(12.5) | 36(38.30) |
| Child-Pugh分级 | ||
| A | 15(62.50) | 65(69.15) |
| B | 8(33.33) | 24(25.53) |
| C | 1(4.17) | 4(4.26) |
| 门静脉直径(mm) | 12.48±2.79 | 13.58±3.46 |
| 胃底曲张静脉 面积(mm2)** | 294.00(0.00~2400.00) | 26.00(0.00~1620.00) |
| 食管静脉曲张范围** | ||
| 无 | 6(25.00) | 2(2.13) |
| 下段 | 4(16.67) | 15(15.96) |
| 中下段 | 12(50.00) | 60(63.83) |
| 全程 | 2(8.33) | 17(18.09) |
| 食管静脉曲张程度** | ||
| 无 | 6(25.00) | 2(2.13) |
| 轻度 | 4(16.67) | 5(5.32) |
| 中度 | 3(12.50) | 6(6.38) |
| 重度 | 11(45.83) | 81(86.17) |
| 平均年龄、门静脉直径采用t检验;性别、消化道出血史、内镜治疗史、脾切除手术史、Child-Pugh分级采用χ2检验;胃底曲张静脉面积、食管静脉曲张范围和程度采用Wilcoxon 秩和检验.分流与无分流比较,* P<0.05,**P<0.001. | ||
无论有无消化道出血史,分流组胃底曲张静脉面积均大于无分流组(均P<0.05)。门静脉直径指标上未发现显著的交互作用。
2.2.2 内镜治疗史无内镜治疗史的患者中,分流组胃底曲张静脉面积大于无分流组(P<0.001)。有内镜治疗史的患者中,分流组与无分流组的胃底曲张静脉面积无差异(P>0.05)。在门静脉直径指标上未发现显著的交互作用。
2.2.3 脾切除手术史无脾切除手术史的患者中,分流组胃底曲张静脉面积大于无分流组(P<0.001),有脾切除手术史的患者中,分流组与无分流组胃底曲张静脉面积无差异(P>0.05)。无脾切除手术史的患者中,分流组的门静脉直径小于无分流组(P<0.05),有脾切除手术史的患者门静脉直径无差异(P>0.05)。
2.2.4 Child-Pugh分级Child-Pugh A、B级的患者中,分流组胃底静脉面积均大于非分流组(P<0.05、0.001)。在Child-Pugh C级患者中,分流组与无分流组的胃底静脉面积无差异(P>0.05)。同样,在门静脉直径上未发现显著的交互作用。
3 讨 论我国是肝炎病毒感染率较高的地区,门静脉高压症是肝炎后肝硬化患者的主要并发症,随之发生的侧支循环和自发性分流是门静脉高压的主要表现之一。对食管胃底静脉曲张的研究非常多,但是对自发性分流的特点却知之甚少。
本文资料118例肝硬化门静脉高压患者中,经肝脏CTA检查共发现24例存在脾—肾或胃—肾分流,占20.34%,与以往的研究结果相似[4, 6, 8, 18]。比较分流组和无分流组的患者资料,其基本情况如性别、年龄等均无明显差异。自发性分流患者消化道出血的风险与无分流组相似(83.33%与93.62%),两组在内镜治疗史上也无显著差异。国外学者认为自发性分流与消化道出血并没有显著的联系,本文资料亦支持这一观点[8]。本文资料分流组与无分流组在Child-Pugh分级上也没有差异,以往有研究发现自发性分流患者属Child-Pugh B、C级者较多[4, 5, 18],与本文结果不一致,可能与本文资料内镜治疗时纳入Child-Pugh B、C级患者较少有关。分流组中有脾切除手术史的患者少于无分流组,可能由于自发性分流能使血流流向下方的肾静脉等血管,从而缓解门静脉系统的压力[5, 9, 18],减轻了门静脉高压,因而分流组需要脾切除手术治疗的患者少于无分流组。有研究认为,自发性脾—肾分流改善门静脉高压的效果可等同于实际手术的效果[7]。
本研究中,分流患者与无分流患者门静脉直径无明显差异。而以往研究则认为分流是反映门静脉高压严重情况的指标[6],这可能与分流部分缓解了门静脉压力,从而减小了门静脉直径有关[5, 7]。分析内镜下所见食管静脉曲张范围和程度可知,分流患者中食管曲张静脉位置更低、程度更轻。说明自发性分流能缓解食管静脉曲张[4]。在胃底静脉面积上,分流患者多表现出胃底有巨大扭曲的曲张静脉,通过胃镜检查测量分流组胃底曲张静脉面积大于无分流患者。自发性分流的存在虽然能缓解门静脉压力,但这种作用未能体现在胃底曲张静脉的面积减少。
静脉曲张是门静脉高压的直接后果,对于门静脉高压患者,采取外科手术干预可以缓解门静脉高压,改善静脉曲张,从而使门静脉直径和胃底曲张静脉面积减小。本文研究资料中两组门静脉和胃底静脉的差异可能是脾切除手术史的差异造成的,非分流患者接受了脾切除手术使胃底曲张静脉面积减小。因此我们进一步分析,无脾切除手术史的患者分流组门静脉直径小于无分流组,分流患者的胃底静脉面积仍大于非分流患者,这个结果支持分流可部分缓解门静脉压力的推测,也说明非分流组胃底曲张静脉面积较小并非脾切除手术引起,而是因为非分流组患者本身门静脉高压症状较轻。本文资料无论是否有消化道出血史,分流患者的胃底曲张静脉面积均大于无分流患者。在肝功能为Child-Pugh A、B级患者中,分流组胃底曲张静脉面积也大于无分流组。说明无论门静脉高压程度是否严重,分流均不能有效缓解胃底静脉曲张,也进一步说明消化道出血与自发性分流无关[8]。在无内镜治疗史的患者中,分流患者的胃底曲张静脉面积大于无分流患者,即在未采取内镜治疗等干预措施的情况下,自发性分流不能改善胃底静脉曲张。可见自发性分流对门静脉压力的缓解作用是十分有限的,这与以往研究结论不尽相同[4]。
本文资料的主要结果部分支持了以往研究中自发性分流可缓解门静脉高压的观点,同时提出这种缓解作用可能是有限的。由于门静脉、胃底静脉、食管静脉的分布位置、静脉血流量、具体功能等方面不同,其伴随门静脉高压发生的概率和时间也不尽相同,因此,自发性分流对于不同位置的静脉曲张的缓解也会不同,这或许是解释胃底静脉并未表现出曲张缓解的一个原因。进一步考察需要探究不同位置的静脉曲张和分流发生的时间次序等其他因素。另外,本文资料样本数量在某些分组中稍显不足,因此不能对更多因素进行考察。此外,在考察静脉曲张的指标时,食管曲张静脉条数可以作为一个指标,同时,本文仅纳入了胃—肾分流和脾—肾分流两种情况,没有考虑其他形式的分流。自发性分流还能够细分为更多不同的类型[4, 8],他们之间或许存在着具体特征上的差异,这些都将是后续研究的方向。
当门静脉高压导致静脉曲张时,继而发生的急性静脉曲张破裂出血是肝硬化患者致命的并发症。据统计,近50%初诊肝硬化患者已存在静脉曲张[19],每年有7%的肝硬化患者发现静脉曲张或静脉曲张程度进一步加重[20, 21],每年有12%的肝硬化患者发生首次消化道出血[10]。了解分流患者的特点,对于指导急性静脉曲张破裂出血患者急诊内镜治疗有重要的意义[22]。一般建议静脉曲张出血患者在12 h内尽快进行内镜治疗[23, 24]。但有文献报道,存在分流的患者不宜行内镜下硬化剂治疗,因硬化剂产生的固化物漂移可经分流道流至体循环而堵塞肺、脑、心等重要器官的血管,从而导致异位栓塞等严重并发症[11]。因此行内镜下注射硬化剂治疗前需要了解患者是否存在自发性分流。根据本文研究的结论,可以方便基层医院在患者出现急性静脉曲张破裂出血时,及时结合既往的内镜检查结果判断是否存在自发性分流,从而指导胃静脉曲张行内镜下黏合剂治疗。当内镜发现较大胃底曲张静脉,尤其是当门静脉直径并没有显著增大,而胃底曲张静脉面积较大时,要高度警惕患者存在自发性分流的可能。对此类患者需建议其进一步行门静脉CTA检查,排除自发性分流后再行内镜下注射硬化剂治疗,避免盲目治疗而导致异位栓塞。
综上所述,本研究对于临床疑诊门静脉高压食管胃静脉曲张的患者,均行门静脉CTA检查和胃镜检查,综合内镜下胃底静脉曲张和食管静脉曲张的情况,可以认为自发性分流能在一定程度上缓解门静脉压力,表现为未接受脾切除手术的分流患者具有更小的门静脉直径,且所有分流患者的食管静脉曲张位置较低、程度较轻。但这种作用是十分有限的,自发性分流的患者仍表现出胃底有较大扭曲的曲张静脉等特点。
| [1] | SUK K T, KIM D J. Staging of liver fibrosis or cirrhosis:the role of hepatic venous pressure gradient measurement[J]. World J Hepatol, 2015, 7(3):607-615. |
| [2] | SUK K T. Hepatic venous pressure gradient:clinical use in chronic liver disease[J]. Clin Mol Hepatol, 2014, 20(1):6-14. |
| [3] | PILLAI A K, ANDRING B, PATEL A, et al. Portal hypertension:a review of portosystemic collateral pathways and endovascular interventions[J]. Clin Radiol, 2015, 70(10):1047-1059. |
| [4] | WU Q, SHEN L, CHU J, et al. Characterization of uncommon portosystemic collateral circulations in patients with hepatic cirrhosis[J]. Oncol Lett, 2015, 9(1):347-350. |
| [5] | ZARDI E M, UWECHIE V, CACCAVO D, et al. Portosystemic shunts in a large cohort of patients with liver cirrhosis:detection rate and clinical relevance[J]. J Gastroenterol, 2009, 44(1):76-83. |
| [6] | VON HERBAY A, FRIELING T, HAUSSINGER D. Color Doppler sonographic evaluation of spontaneous portosystemic shunts and inversion of portal venous flow in patients with cirrhosis[J]. J Clin Ultrasound, 2000, 28(7):332-339. |
| [7] | WIND P, ALVES A, CHEVALLIER J M, et al. Anatomy of spontaneous splenorenal and gastrorenal venous anastomoses, review of the literature[J]. Surg Radiol Anat, 1998, 20(2):129-134. |
| [8] | CULAFIC D, PERISIC M, VOJINOVIC-CULAFIC V, et al. Spontaneous splenorenal shunt in a patient with liver cirrhosis and hypertrophic caudal lobe[J]. J Gastrointestin Liver Dis, 2006, 15(3):289-292. |
| [9] | ELLIOTT S P, YEH B, STOLLER M L. Radiologic appreciation of a spontaneous splenorenal shunt[J]. Urology, 2004, 63(4):776-777. |
| [10] | D'AMICO G, PAGLIARO L, BOSCH J. Pharmacological treatment of portal hypertension:an evidence-based approach[J]. Semin Liver Dis, 1999, 19(4):475-505. |
| [11] | 朱磊,卢焕元,孙宁杰.内镜组织粘合剂注射术治疗胃底静脉曲张出血并发症的防治[J].现代医药卫生,2009,25(4):518. ZHU Lei, LU Huanyuan, SUN Ningjie. The prevention of complications of endoscopic tissue glue injection in the treatment of gastric varices bleeding[J]. Journal of Modern Medicine & Health, 2009,25(4):518.(in Chinese) |
| [12] | ARAKAWA M, MASUZAKI T, OKUDA K. Pathomorphology of esophageal and gastric varices[J]. Semin Liver Dis, 2002, 22(1):73-82. |
| [13] | GOLSE N, BUCUR PO, FAITOT F, et al. Spontaneous splenorenal shunt in liver transplantation:results of left renal vein ligation versus renoportal anastomosis[J]. Transplantation, 2015, 99(12):2576-2585. |
| [14] | 祝玉芬,王小玲.CT血管造影(CTA)的方法及临床应用[J].实用放射学杂志,2003,19(4):381. ZHU Yufen, WANG Xiaoling. Method and clinical application of CT angiography[J]. Journal of Practical Radiology, 2003, 19(4):381. (in Chinese) |
| [15] | MATSUMOTO A, KITAMOTO M, IMAMURA M, et al. Three-dimensional portography using multislice helical CT is clinically useful for management of gastric fundic varices[J]. AJR Am J Roentgenol, 2001, 176(4):899-905. |
| [16] | FISHMAN E K. From the RSNA refresher courses:CT angiography:clinical applications in the abdomen[J]. Radiographics, 2001, 21(Suppl 1):S3-S16. |
| [17] | 中华医学会消化内镜学分会食管胃静脉曲张学组.消化道静脉曲张及出血内镜诊断和治疗规范试行方案(2009年)[J].中华消化内镜杂志,2010,27(1):1-4. Committee of Esophageal Varicosity,Society of Digestive Endoscopy of Chinese Medical Association. Tentative guidelines for endoscopic diagnosis and treatment of varicosity and variceal bleeding in digestive Tract(2009)[J]. Chinese Journal of Digestive Endoscopy, 2010,27(1):1-4. (in Chinese) |
| [18] | TARANTINO G, CITRO V, CONCA P, et al. What are the implications of the spontaneous spleno-renal shunts in liver cirrhosis[J]. BMC Gastroenterol, 2009, 9:89. |
| [19] | KOVALAK M, LAKE J, MATTEK N, et al. Endoscopic screening for varices in cirrhotic patients:data from a national endoscopic database[J]. Gastrointest Endosc, 2007, 65(1):82-88. |
| [20] | GROSZMANN R J, GARCIA-TSAO G, BOSCH J, et al. Beta-blockers to prevent gastroesophageal varices in patients with cirrhosis[J]. N Engl J Med, 2005, 353(21):2254-2261. |
| [21] | MERLI M, NICOLINI G, ANGELONI S, et al. Incidence and natural history of small esophageal varices in cirrhotic patients[J]. J Hepatol, 2003, 38(3):266-272. |
| [22] | KIM T, SHIJO H, KOKAWA H, et al. Risk factors for hemorrhage from gastric fundal varices[J]. Hepatology, 1997, 25(2):307-312. |
| [23] | MIYAAKI H, ICHIKAWA T, TAURA N, et al. Endoscopic management of esophagogastric varices in Japan[J]. Ann Transl Med, 2014, 2(5):42. |
| [24] | TRIANTOS C, KALAFATELI M. Endoscopic treatment of esophageal varices in patients with liver cirrhosis[J]. World J Gastroenterol, 2014, 20(36):13015-13026. |




