神经内分泌肿瘤(neuroendocrine neoplasm,NEN)属于一组起源于弥散神经内分泌系统的异质性肿瘤,根据肿瘤的分化程度、形态学和增殖活性分为神经内分泌瘤(neuroendocrine tumor,NET)和神经内分泌癌(neuroendocrine carcinoma,NEC),目前的观点认为前者为恶性或至少具有恶性潜能,具有相对惰性的生物学行为[1];而后者属于高度恶性肿瘤。NEN细胞可产生不同类型的肽类和生物胺激素,一部分肽类激素最初从消化系统中分离得到;另一部分首先发现于神经系统,之后证实消化系统中也存在。与内分泌系统中激素直接释放到血液中不同,神经内分泌系统所分泌的激素多通过神经元发生作用,因此而得名。神经内分泌系统中同一种细胞可分泌不同的激素,如肠嗜铬细胞可分泌胃动素和五羟色胺,在肿瘤中亦保持了这一特征,即同一肿瘤可分泌不同的激素,甚至在复发和转移前后也可分泌不同的激素。按照病变发生的部位和系统,NEN分为胃肠胰神经内分泌肿瘤(gastroenteropancreatic NEN,GEP-NEN)、肺和胸腺神经内分泌肿瘤、肾上腺皮质肿瘤、嗜铬细胞瘤/副神经节瘤、分化差的神经内分泌肿瘤/小细胞或大细胞神经内分泌癌、Merkel细胞癌、多发性神经内分泌肿瘤Ⅰ型(MEN-1)、MEN-2等[2,3],其中胃肠胰神经内分泌瘤(gastroeuteropancreatie NET,GEP-NET)最为常见。本文就该类肿瘤的命名、流行病学、分类、分级、分期、组织病理以及分子病理等方面的内容进行综述。
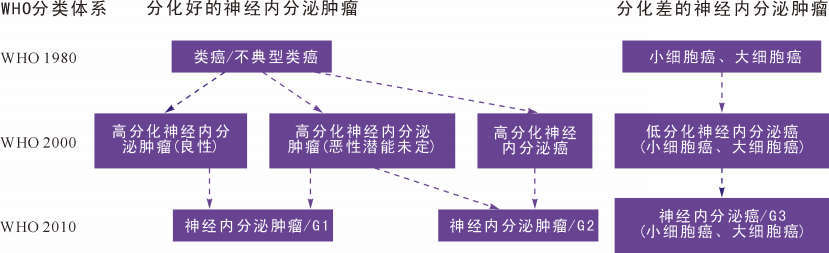
1 NEN的命名及分类演变GEP-NEN分别起源于肠嗜铬细胞和胰岛神经内分泌细胞(朗格汉斯细胞),约占所有内分泌肿瘤的54.5%[4]。由于其具有独特的形态学特征和相对惰性的生物学行为,Oberndorfer在1907年首次将其命名为“类癌”。之后在1963年,Williams和Sandler根据胚胎发生的特点将其分为前肠(肺、胃、十二指肠、上段空肠和胰腺)、中肠(下段空肠、回肠、阑尾和盲肠)以及后肠(结肠和直肠)类癌三种不同类型。中肠的肿瘤因分泌五羟色胺和其他血管活性物质,尤其是在发生转移后,容易出现典型的类癌综合征,表现为面色潮红、腹泻和右侧心瓣膜病[5]。1980年WHO有关NEN分类中将类癌定义为除了胰腺和甲状腺神经内分泌肿瘤、副神经节瘤、小细胞肺癌和皮肤Merkel细胞癌外其他大多数NEN。但是类癌这一名词并不能很好地提示这类肿瘤的自然病程和临床特征,且容易导致临床医师的曲解,以后WHO试图以NEN替代“类癌”,但该名词目前依旧被广泛使用。在2000年WHO分类中,首次出现NET和NEC这两个概念,并根据肿瘤的分化和分期参数分为高分化NET(良性及低度恶性潜能,大致相当于类癌)、高分化NEC(大致相当于不典型类癌)和低分化NEC(小细胞癌或大细胞癌)。之后2010年WHO分类中采用了欧洲神经内分泌肿瘤协会(European Neuroendocrine Tumor Society,ENETS)的分级系统,进一步将上述分类简化,并去除了“良性”和“低度恶性潜能”的分类,认为所有的NEN至少为潜在恶性,根据增殖活性将其分为三级:1级和2级为高分化(低或中间级别)肿瘤,而3级相当于NEC(小细胞型和大细胞型),为低分化(高级别)肿瘤[6]。大规模的病例研究证实上述分级系统具有很好的预后相关性[7,8]。一个单中心研究结果显示,中肠低级别和中级别肿瘤患者的5年存活率分别为79%和74%,而高级别肿瘤患者的5年存活率仅为40%。与此类似,胰腺的低级别、中级别和高级别肿瘤患者的5年存活率分别为75%、62%和7%。
2010年WHO分类中另外一个更新是肿瘤分级仅考虑增殖活性这一参数,同时提出与之互补的部位特异性分期系统。不同部位的NET均有独立的TNM分期,其中肿瘤分期同时考虑侵犯深度和肿瘤大小两种因素,但不同部位肿瘤的分期标准略有不同,以更好地提示预后;而NEC的TNM分期则参照相应部位腺癌的标准,此举旨在从以下几个方面改进2000年WHO分类系统:①肿瘤异质性,即不同部位起源的肿瘤性质不同;②分化差异性,即肿瘤细胞在不同分化状态时差异较大;③恶性特征,即长期随访资料显示神经内分泌肿瘤属于恶性肿瘤范畴,因此采用相应的分级和分期系统。
NEN命名和分类的演变见图1。
|
| 图1 神经内分泌肿瘤的命名和分类演变 Fig.1 Terms and classification evolving of NEN |
作为一种“罕见病”,GEP-NET实际上是第二常见的消化系统恶性肿瘤[9,10],美国监测、流行病学和最终结果项目(Surveillance,Epidemiology,and End Result,SEER)最新的流行病学调查结果显示,GEP-NET每年的发病率为5.25/10万[10,11],年龄校正后的发病率在过去的40年中上升了3.6倍(美国)和3.8~4.8倍(欧洲)[9]。其中胃NET在英国和美国的发病率在过去的40年中分别上升了15倍和11倍[10,12],小肠NET在西方国家过去一直是最为常见的,其发病率分别上升了3.8倍和2.9倍。但来自美国最新的资料显示小肠NET的上升速度已被直肠NET超过[11,12],而十二指肠NET通常合并入小肠NET,因此,对十二指肠NET的自然病史和临床分层知之甚少。SEER的资料显示,十二指肠NET的发病率从1983年的0.27/10万上升到2010年的1.1/10万,2005至2010年期间的病例与1983至2005年期间相比,Ⅰ期病变所占的比例升高(69.9%与57.5%)。胰腺NET的发病率从1973年至1977年的0.17/10万上升至2003年至2007年的0.43/10万[11]。上述现象产生的确切原因并不知晓,这些数字是否代表了疾病真实的发病情况还是由于人们认识的提高,亦或是使用了不同的疾病诊断名词所致也不得而知,内镜和影像技术的发展导致检出率增高可能是其中的重要因素之一。目前SEER的资料显示,在所有的GEP-NET中,小肠和直肠NET最为常见,分别占30.8%和26.3%;而结肠、胰腺和阑尾NET分别占17.6%、12.1%和5.7%[13]。以每10万人口计数,胃、十二指肠、空回肠、阑尾、结肠、直肠NET发病率分别为0.30、0.19、0.67、0.15、0.20、0.86[10]。胰腺NET病例以百万人口计数,胃泌素瘤、胰岛素瘤、胰高血糖素瘤、血管活性肠肽瘤、生长抑素瘤、肾上腺皮质激素瘤、生长激素释放因子瘤的发病率分别为1.0~1.5、1.0~2.0、0.01~0.1、0.10、<0.10、<0.1、<0.1[14]。而不同种族和性别,上述不同部位肿瘤、不同的组织学类型、不同的时期以及不同的国家和地区之间报道相似[9, 11]。中国NEN病理调研2009年至2011年资料显示,GEP-NET 中胰腺、直肠、胃、十二指肠、食道、结肠、阑尾和小肠分别占31.7%、21.5%、21.0%、5.2%、5.0%、3.8%、1.0%和0.9%,该组数据与欧美的数据有一定的差异,可能与数据采集的方式及我国GEP-NET分布特征有一定关系,尚有待于进一步的大规模病例研究证实[11, 15, 16, 17, 18, 19]。
NEC占消化系统NEN的10%~20%[20],多位于食道、胰腺、壶腹部和结肠,回肠少见[21,23]。
3 GEP-NEN及增生性病变的分级及分类标准目前主要采用WHO 2010年的命名和分级系统,其判定标准如下:
神经内分泌瘤/NET G1 (类癌) :肿瘤分化良好,直径>0.5 mm,或侵犯至黏膜下,核分裂数<2/10HPF和/或Ki-67增殖指数≤2%;
神经内分泌瘤/NET G2:肿瘤分化良好,直径>0.5 mm,或侵犯至黏膜下,核分裂数2~20/10HPF和/或Ki-67增殖指数3%~20%;
神经内分泌癌/NEC G3(大细胞型或小细胞型):肿瘤分化差,小细胞型或大细胞型,核分裂数>20/10HPF和/或Ki-67增殖指数>20%;
混合性腺—神经内分泌癌(MANEC):每种成分不少于30%。
《中国胃肠胰神经内分泌肿瘤病理诊断共识(2013版)》[24]采用WHO 2010年的分类和分级标准,利用Ki-67增殖指数和核分裂数进行分级的判定,均选择增殖活性高的区域进行计数。一般情况下两个指标均为平行的关系,如出现不一致的情况,则以数值或分级高者为准;在活检标本等难以或无法计数核分裂数的情况下,则采用Ki-67增殖指数作为分级标准。理论上讲,计数细胞数量越多,准确性越高,但考虑到在实际工作中的可行性,建议至少计数500个细胞。Ki-67增殖指数计数方法目前尚无标准,可通过肉眼镜下计数、计算机辅助图像分析计数等方法。前者需要一定的经验,且存在一定的主观性和不同观察人员之间的偏差;而图像分析的方法亦依赖于人工辅助识别肿瘤细胞。两种方法均应避免计数混杂在肿瘤区域内的非肿瘤细胞,以免造成计数的不准确,同时需考虑切片厚度、免疫组织化学染色质量、免疫组织化学显色强弱等因素对计数产生影响。核分裂则计数单位为2 mm2,相当于20 mm目镜的10个高倍镜视野,如采用其他孔径的目镜,则需进行相应换算[25,26]。由于核分裂象的识别存在一定的主观性,因此有研究者开始尝试利用磷酸化组蛋白H3(phosphohistone H3,PHH3)免疫组织化学染色并计数来代替核分裂计数,研究结果提示该指标与核分裂数之间具有良好的相关性,但在临床常规应用前还有待于进一步大规模病例的验证[27]。
与其他肿瘤相似,GEP-NET也存在相应的前驱病变,相应的研究主要集中在胃部的病变,在其他部位的适用性还有待于进一步确认。胃的神经内分泌细胞增生性病变和瘤前病变判定标准如下[28]:
单纯性增生:腺体内单个细胞数量增多;
线性增生:≥5个细胞连成串,≥2串/mm;
微结节增生:≥5个细胞形成结节状,依旧位于腺体或隐窝内,且直径不超过所在的腺体;
腺瘤样增生:≥5个结节状病灶;
异型增生:结节融合、增大,<0.5 mm,细胞轻度异型,可有微浸润和促间质反应。
4 GEP-NEN的分期系统与患者预后GEP-NEN具有较大的异质性,相同分级的肿瘤在不同的解剖部位可表现不同的临床病理学特征和生物学行为,因此具有不同的恶性潜能。例如小肠肿瘤的恶性潜能较高,但进展相对缓慢;胃和直肠的肿瘤多为表浅的低度恶性潜能肿瘤,但一旦发生转移则进展迅速[4, 10],因此除了肿瘤的分级外,尚需考虑肿瘤的分期。目前大多采用ENETS和美国癌症联合委员会(AJCC)的分期系统。 ENETS于2006年建立工作组,并建立了肠NET的TNM分期,2007年建立了中肠和后肠NET的TNM分期,AJCC/UICC则是在2010年发布第7版指南时更新了NET相应的TNM分期系统。两者采用的术语基本一致,使用相同的TNM术语,但略有差别,同一术语可能指代不同的类型和病变范围,因此存在两个系统之间的混淆和互译,而哪个分期系统与预后更相关目前尚无明确的观点。但总体而言,两者与患者生存和预后之间均具有良好的相关性[29]。Ⅰ期和Ⅱ期GEP-NEN患者的5年总存活率均为100%,而Ⅲ期和Ⅳ期GEP-NEN患者的5年存活率分别为91%和73%;亦有学者认为对于胰腺NEN而言ENETS的分期系统优于AJCC分期系统[30],但两者均应用广泛。Ⅰ、Ⅱ、Ⅲ和Ⅳ期GEP-NEN患者的5年总存活率在ENETS系统中分别为100%、88%、85%和57%,而在AJCC系统中分别为92%、84%、81%和57%[7, 30, 31]。ENETS的预后分层及治疗原则见表1。
| 预后 | 组织学类型 | 分级 | 分期 | 潜在治疗 |
| 局限性肿瘤 转移风险非常低 | 分化好 | G1 | T1 | 内镜下切除 |
| 低危 | 分化好 | G1 | T2 | 手术 |
| 中危 | 分化好 | G2 | T1 | 手术 |
| 高危 | 分化好 | G1/2 | T2 | 手术 |
| 高危 | 分化差 | G3 | T1/2/3 | 手术,生物治疗和/或化疗 |
| 淋巴结转移 缓慢生长 | 分化好 | G1 | T1/2/3 | 手术 |
| 生长速度中等 | 分化好 | G2 | T1/2/3 | 手术,生物治疗和/或化疗 |
| 快速生长 | 分化差 | G3 | T1/2/3 | 手术,生物治疗和/或化疗 |
| 淋巴道和血道转移 缓慢生长 | 分化好 | G1 | 任何T | 手术,生物治疗和/或化疗 |
| 生长速度中等 | 分化好 | G2 | 任何T | 手术,生物治疗和/或化疗 |
| 快速生长 | 分化差 | G3 | 任何T | 化疗 |
GEP-NEN患者5年存活率随着肿瘤的分级升高和分期的进展而降低,有G1/G2病变、局限性病变和远处转移的病变患者5年存活率分别为82%和35% [10]。此外,有研究显示将近40%的患者在转移后出现肿瘤分级升高的现象,除肝脏以外,远处转移较局部转移的病灶更容易出现这种现象[32]。G3肿瘤有局限性病变和远处转移病变者5年存活率分别为38%和4%,50%~70%的NEC患者在诊断时即存在转移性病变[33,34],不同部位的病变预后也不尽相同。胰腺的进展期NEC患者中位生存时间为15~21个月[7, 22],而整个胃肠胰NEC患者的中位生存时间为11个月;小细胞型NEC和大细胞型NEC之间并无差异[22],Syn和CgA均为阳性表达的患者预后较好[35,36],而CD117阳性、血管侵犯则提示预后不良[37]。目前的研究显示NEC中亦存在一定异质性,Ki-67增殖指数<55%或形态学分化良好的患者对化疗不敏感,预后则好于分化差的NEC[33, 38]。
总体而言,肿瘤的分级和大小与转移密切相关,正确的诊断、分级和分期对于治疗方案的制定意义重大。直径小于1 cm的NET转移概率小于15%,直径大于2 cm的肿瘤转移概率可升至95%,大部分肿瘤的临床症状不特异或呈现不定期性,以至于难以早期发现。诊断主要依赖于复杂的实验室检查和病理学检查,仅有不到10%的患者会出现类癌综合征。类癌综合征患者以小肠肿瘤为多见,多出现在肿瘤肝转移之后。因为转移之前所分泌的激素大多被肝脏分解,而肝转移灶肿瘤细胞所分泌的激素则直接进入外周血,进而导致相应的临床症状。人群筛查有助于发现早期病变并改善患者预后,但实施人群筛查较为困难[10, 39, 40, 41]。
5 GEP-NEN的形态及免疫表型大部分GEP-NEN具有典型的组织病理学形态。其中,NET光镜下肿瘤细胞可排列成巢团状、岛状、梁索状、条带状和腺样结构;细胞异型性小,形态较一致,细胞为圆形、类圆形或多边形;胞浆较丰富,嗜酸性或嫌色,核圆形或卵圆形,形态规则;染色质呈细颗粒状或“椒盐样”外观,大部分没有明显的核仁;瘤巢周边多有丰富的血窦和多少不等的纤维间质,一般没有促纤维性间质反应,间质亦可出现淀粉样变性、黏液样变性和砂砾体结构,少数情况下可表现出显著的多形性或其他特殊的形态[24, 28, 42]。
NEC包括小细胞型(简称小细胞癌)和大细胞型,形态与肺的相应肿瘤相同。小细胞型NEC瘤细胞直径多小于三个淋巴细胞,但也有例外,瘤细胞片状或巢团状排列,可有菊形团样结构形成,瘤细胞呈圆形、卵圆形或短梭形,胞浆稀少,细胞核深染,形似裸核,染色质细腻或呈“椒盐样”外观,核仁不明显,核分裂象多见,可见到Azzopardi现象,即嗜碱性的染色质成分沉积于血管壁,坏死易见,活检标本中易见到挤压现象。大细胞型NEC的瘤细胞多大于三个淋巴细胞,呈片状、器官样结构、菊形团状排列或弥漫分布,胞浆丰富,染色质呈粗颗粒状,核仁明显,坏死和核分裂象易见[24, 28, 42]。
绝大部分NEN可表达至少一个神经内分泌标志物,包括Syn、CgA、CgB、NSE、CD56和Pgp9.5等,其中CgA和CgB特异性好,但后肠NEN多不表达CgA,在分化差的肿瘤中CgA也可能为阴性,Syn、CD56、NSE和Pgp9.5敏感性好,但其不仅仅在神经内分泌细胞中表达,特异性稍差。此外,大部分的肿瘤表达一种或多种角蛋白标志物,而且其角蛋白表达特征与相应部位的腺癌类似,诸如结直肠NEN可表达CK20。此外,小细胞型NEC亦可表达CD117。不同类型的肿瘤尚可表达或分泌某种特定的激素,诸如五羟色胺、胃泌素、胰高血糖素样肽、胰多肽、酪酪肽、生长抑素、胰高血糖素、胰岛素、血管活性肠肽等,并根据肿瘤细胞是否分泌激素并产生相应临床症状分为功能性和非功能性。需要注意的是这些激素免疫组织化学检测阳性并不一定提示其为功能性肿瘤,尚需结合是否有相应的临床症状,如仅有免疫组织化学检测阳性结果而无临床表现,称之为NET伴有相应激素的表达;两者同时存在,则根据其产生的激素命名,诸如胃泌素瘤、胰岛素瘤等[31, 42, 43, 44, 45]。
近年来不断出现针对特定器官NET的标志物,尤其是对于转移性病变的原发部位判断有很好的提示意义,诸如NKX6-1是胰岛内分泌功能调节过程的一个重要转录因子,在82%的胰腺和67%的十二指肠NET中呈阳性表达,而在肺、胃、阑尾的肿瘤中鲜有表达,可作为鉴别该部位NET的一个有用的标志物[46]。干细胞标志物CD24在胰腺和十二指肠NET极少表达,而多见于中肠起源的NET,对于空回肠NET的诊断和治疗靶点研究有一定提示意义[47],部分标志物的分布部位见表2。
| 标志物 | 阳性部位 | 阴性部位 |
| CDX2 | 胃肠道、胰腺 | 肺 |
| TTF-1 | 肺、食道 | 胃肠道、胰腺 |
| Pax8 | 直肠、胰腺 | 回肠、肺 |
| PDX1 | 胃肠道(回肠除外)、胰腺 | 回肠、肺 |
| Isl1 | 胰腺、直肠 | 肺 |
| Claudin4* | 直肠 | 胰腺 |
| NKX6-1 | 胰腺、十二指肠 | 肺、胃、阑尾 |
| CD24 | 空、回肠 | 胰腺、十二指肠 |
| *以表达+++为阳性判读标准 | ||
除了上述依据形态学和增殖活性的GEP-NET分类外,尚存在一种特殊的NEN,即形态学分化良好,但其中含有增殖活性高于G1/G2的肿瘤成分(Ki-67>20%,核分裂数>20/10HPF),可出现于原发灶,也可存在于转移灶中。其临床表现、影像学特征、标志物和表型均与G1/G2的肿瘤类似,预后显著好于NEC。这部分肿瘤按照现有的系统无法进行归类,采用何种治疗方法尚无定论。为了进一步认识和研究这些特殊病例,《中国胃肠胰神经内分泌肿瘤病理诊断共识(2013版)》建议在临床病理诊断时予以特别关注和重视,并提议将这部分NEN命名为“高增殖活性的NET”,以区别于NEC G3,同时提示属于G3的肿瘤并非完全是传统的小细胞型或大细胞型NEC,尚存在一部分分化较好的肿瘤类型[24, 54, 55]。
混合性腺—神经内分泌癌为腺癌和NEC两种成分混合存在,其中单一成分不少于30%,遗传学分析显示两种成分具有相似或重叠的遗传学改变谱系。这提示两者为相同的克隆起源。在食道亦可出现NEC和鳞状细胞癌混合存在的情况。此外,在阑尾中杯状细胞类癌亦属于这一类型。该类型大多属于高级别肿瘤,预后较一般的NET差。需要注意的是在消化道腺癌中经常可以见到散在的神经内分泌细胞,这种情况并不属于混合性腺—神经内分泌癌的范畴。同时,也需排除两种不同类型肿瘤相互独立存在(碰撞瘤),必要时需要行分子生物学检测协助鉴别。此外,在临床诊断中不建议使用“腺癌伴神经内分泌分化”的诊断名称,以免导致临床医师概念混淆和治疗疑惑[24, 56, 57]。
6 不同部位的GEP-NEN不同部位的GEP-NEN在形态学方面并无大的差异,但具有各异的临床和分子病理学特征,同时其生物学行为和患者预后也不尽相同。
6.1 食道NEN很少见,多为个例或小系列报道;肿瘤位于食道下段多见,大多患者在诊断时已发生转移,转移部位以肝脏最为常见;几乎均为小细胞癌,与肺的小细胞癌免疫表型重叠,有时可同时存在鳞状细胞癌或癌前病变,提示肿瘤来源于多潜能干细胞[58]。
6.2 胃NEN胃的NEN目前认为起源于肠嗜铬细胞,属于分泌非肽类激素的神经内分泌细胞,分布于胃底和胃体,在胃泌素刺激下可分泌组胺。根据发病机制和临床病理特征分为四种不同的类型,不同类型的胃NEN生物学行为、预后及治疗原则均有所不同。
1型胃NEN 1型胃NEN多在自身免疫性胃炎的基础上发生,女性常见,多为非功能性。其发生机制如下:自身免疫性萎缩性胃炎导致壁细胞破坏,胃酸缺乏,进而胃窦部G细胞增生,分泌大量胃泌素,并刺激胃底/体部肠嗜铬细胞增生,最终发生NEN[17]。内镜下表现为萎缩性胃炎并伴有胃底/体多发息肉样隆起,病灶较小,直径为0.2~1.5 cm,组织学多为分化良好的NET G1,可伴有胃底/体部神经内分泌细胞及胃窦G细胞增生。本型NEN属于易复发疾病,罕见转移,少见肿瘤相关死亡[17, 19]。
2型胃NEN 2型胃NEN多发生于卓—艾综合征,23%~29%为MEN-1 患者(散发胃泌素瘤仅有1%~3%为MEN-2患者)。男女性比例相似,多为无功能性,约35%的患者在诊断时已发生转移。伴发的胃泌素瘤常见于胰腺和十二指肠,胃窦及其他部位少见,其发病机制为胃泌素瘤/MEN-1导致肠嗜铬细胞增生,血清胃泌素升高,胃酸水平升高。胃镜检查肿瘤表现与1型类似,胃底/体部可见多发的小息肉样隆起,同时可有胃溃疡或十二指肠溃疡,组织学多为NET G1或NET G2,伴有壁细胞、主细胞增生,胃窦G细胞无增生,有别于1型胃NEN。10%~30%的患者可发生转移,肿瘤相关病死率低于10%[17, 19]。
3型胃NEN 3型胃NEN属于散发型病例,约半数患者在确诊时已发生转移。无萎缩性胃炎、高胃泌素血症或肠嗜铬细胞增生,也无胃泌素瘤/MEN-1,胃酸分泌正常,3%~8%的患者可伴有不典型类癌综合征。肿瘤可发生于胃的任何部位,多为单发,呈息肉样或溃疡型,多数情况下病灶直径超过2 cm。组织学多为NET G2或G3,少数为NET G1。转移率50%~100%,肿瘤相关病死率25%~30%[19]。
4型胃 NEN 4型胃NEN主要见于老年男性,临床表现与腺癌无差别。肿瘤体积较大(直径5~7 cm),多为单发、巨大溃疡或球形息肉,病灶直径超过5 cm,可发生于胃的任何部位,组织学为NEC G3或混合性腺—神经内分泌癌。转移率80%~100%,肿瘤相关病死率>50%,患者生存期 8~10个月[17, 19]。
6.3 胰腺NEN胰腺的NEN中大部分为NET,NEC仅占少数,其中大部分(61%)为大细胞型NEC[58]。胰腺NET较其他部位而言具有相对独特的生物学特性。一方面,胰岛素瘤、胃泌素瘤、血管活性肠肽瘤、胰高血糖素瘤和生长抑素瘤均可由于分泌特定的激素而导致特异的临床表现,约有50%的肿瘤为非功能性或仅分泌低生物活性肽类激素(诸如胰多肽和神经降压素)。而不同免疫表型的肿瘤其生物学行为有很大的差异,表达胰岛素和胰高血糖素样肽1的肿瘤多属低级别,肿瘤体积小,病理分期较低,少有淋巴管侵犯和淋巴结转移,预后较好,其中5%左右的患者与MEN-1相关;而表达胃泌素的肿瘤则具有相反的特征,50%~60%表现为恶性,20%患者与MEN-1相关;分泌胃泌素水平的高低可作为负性的预测因子[59]。胰高血糖素瘤和血管活性肠肽瘤的病灶体积多比较大(肿瘤直径大于5 cm),大多呈侵袭性生物学行为;生长抑素瘤最为少见,可作为Ⅰ型神经纤维瘤病的表现之一,病变体积较大,常有转移。上述与MEN-1相关的肿瘤多表现为多灶性病变,且体积较大[60]。胰腺NET中激素表达的种类越多,预后越好。此外,尚有研究显示囊性NET比实性NET生物学行为更好[61,63]。另一方面,大量研究显示5%作为Ki-67增殖指数的临界值对于胰腺NET的预后提示更有意义,因此建议应与其他部位NET分开研究[25, 64, 65, 66]。新近尚有研究提示生长抑素受体SSTR-2a的表达对于预后的提示作用甚至超过Ki-67增殖指数[67],其是否能应用于临床还有待于进一步证实。
6.4 十二指肠NEN大多数研究中将十二指肠的NET与其他部位小肠的NET放在一起,因此导致对于这一特殊部位NET生物学行为的了解比较欠缺。但实际上十二指肠NET的临床生物学特征与小肠其他部位并不相同,而与胰腺的NET具有一定的类似性。约三分之二的十二指肠NET表现为惰性生物学行为,尤其是肿瘤直径小于2 cm和无固有肌层侵及者,转移风险<5%;反之,如果肿瘤直径>2 cm或侵及固有肌层,淋巴结转移的风险上升至20.8%[68,69]。来自SEER的资料显示,在过去的30年中,十二指肠NET发病率上升了3倍,推测与早期病变检出率提高有关[69]。
十二指肠NET可表达胃泌素、生长抑素、降钙素、五羟色胺和胰多肽,也有少量副节瘤和未分化型肿瘤,60%的肿瘤产生胃泌素。其中三分之一表现为卓—艾综合征,属于MEN-1,且多表现为黏膜下多灶性结节,球部和降部最常见,易发生转移,但内镜检查易漏诊,部分患者是以转移性病变为初发表现。产生生长抑素的肿瘤约占15%~20%,多位于壶腹部,组织学可表现为腺样结构,可出现砂砾体,诊断时大多有肌层浸润,与胰腺不同,多为非功能性肿瘤,约三分之一与Bon Recklinghausen病相关。副节瘤为第三常见,多位于壶腹部或周围区域。十二指肠NET肿瘤体积多大于2 cm,肌层侵犯常见,表达五羟色胺、降钙素和胰多肽的肿瘤则十分少见,多位于远离壶腹部区域,惰性生物学行为,而未分化肿瘤则更为少见,多位于壶腹部。
6.5 小肠NEN空回肠NET占胃肠道NET的20%~30%,回肠末端为最常见的发病部位,可产生五羟色胺和P物质,有症状的肿瘤直径多大于1 cm,40%的肿瘤为多发,发生肝转移者易表现类癌综合征。
6.6 阑尾NEN阑尾NEN的发病率在消化系统中仅次于小肠和直肠,其生物学特征与空回肠的NET类似,三分之二位于阑尾末端,体积多小于2 cm。有研究表明阑尾肿瘤可表达S-100t,提示阑尾的肿瘤可能来源于上皮—神经内分泌复合体(epithelial neuroendocrine complexes),而非上皮内的内分泌细胞。阑尾中另外一类肿瘤是产生肠高血糖素、胰多肽和酪酪肽的肿瘤,预后较好,转移的概率低。阑尾NET如侵犯阑尾系膜,多提示转移,位于阑尾根部的肿瘤且切缘阳性者需行右半结肠切除。类癌综合征少见。出现类癌综合征多提示肝脏和/或后腹膜转移[70]。一般而言,肿瘤大小、系膜侵犯、Ki-67增殖指数以及神经和血管侵犯均为提示预后不良的独立因素[71]。
阑尾除了典型的NET外,尚可发生混合型神经内分泌肿瘤,即杯状细胞类癌,并依据细胞异型、促间质反应和实性生长方式等形态学特征分为低级别和高级别杯状细胞类癌(包括印戒细胞癌和低分化阑尾腺类癌)。亦有研究者称之为典型杯状细胞类癌和发生于杯状细胞类癌中的腺癌(印戒细胞型和低分化腺癌型),两组病变的生物学行为迥异,前者的发病年龄小,预后明显好于后者,同时认为其属于同一谱系病变的不同分化阶段[72,75]。
6.7 结直肠NEN与其他部位类似,结直肠NET的生物学行为与肿瘤直径密切相关,小于1 cm的肿瘤转移概率低于<3%,当肿瘤直径大于1 cm和1.5 cm,淋巴结转移的概率跃升为24%和100%。直肠NET大多为分化良好的肿瘤,直径多小于1 cm且局限于黏膜下的孤立性病变,大部分偶然发现,患者总体存活率超过90%。根据免疫表型分为L细胞免疫表型(80%)和非L细胞免疫表型,前者可表达胰高血糖素样肽1、胰多肽、酪酪肽,2010年WHO分类将其界定为交界性生物学行为;后者多为恶性,有研究显示肿瘤直径大于1 cm和非L细胞免疫表型是独立的预后判断因素。但亦有研究显示单纯的免疫表型在预后判断方面作用有限,而肿瘤的大小、分级、分期才是决定性的预后判断因素。基于免疫表型的分类与肿瘤生物学行为和预后的关系尚有待于进一步确认[76,78]。
7 GEP-NEN的分子生物学机制研究GEP-NEN的发病机制和高危因素尚不明确,但是一级亲属患病的患者,其发病风险增加3.6倍[79]。在过去的10年中,NEN的生物治疗领域进展迅猛,但目前还缺乏比较系统的GEP-NEN发病机制和遗传学特征研究。有研究显示染色体不稳定在胰腺NEN的发病中发挥着重要作用,遗传物质缺失较染色体获得更为常见[80],同时,MEN1、DAXX/ATRX和mTOR等信号通路蛋白编码基因的驱动突变在胰腺NET的发病中均为十分关键的分子事件[81],其中,MEN-1作为一个抑癌基因,其编码蛋白menin可与组蛋白H3甲基转移酶相互作用并导致转录的表观调控和细胞增殖出现异常,而DAXX/ATRX的突变可影响组蛋白H3.3复合体与端粒的结合,进而导致端粒长度的改变和染色体不稳定。尚有研究显示大约在15%的胰腺NET中可出现包括PTEN或PIK3CA等在内的mTOR通路相关基因突变[81,82],亦有研究提示胰腺NET中存在FAK过表达和过磷酸化,进而导致AKT过表达和AKT/mTOR 通路的突变[83]。其他研究也提示mTOR通路相关基因的突变在NET中并不常见,但mTOR和/或其下游靶点的过表达却是频发事件,与高增殖活性和预后不良密切相关。因此将来FAK 抑制剂和mTOR 抑制剂有可能成为潜在的靶向治疗手段[84]。在小肠NET中约有74%患者可检测到18号染色体的缺失,同时可出现4、5、14和20号染色体的获得[85,86],但并未发现特定基因的改变。最近也有研究显示CDKN1B的突变和缺失在小肠NET的发生中发挥一定的作用[87]。此外,FOXM1(forkheadbox protein M1)也是NET中的一个重要转录因子,与肿瘤细胞的分化和增殖密切相关,体外研究显示抑制其活性后可导致肿瘤细胞生长抑制及凋亡增加,因此有望成为NEN靶向治疗的靶点[88]。
在表观遗传学方面,有研究显示GEP-NEN中不同的类型之间存在不同的DNA甲基化方式,提示不同的肿瘤具有不同的分子生物学和临床特征。胰岛素瘤、胃泌素瘤、非功能性胰腺NET及小肠NET中均有各自特征性的DNA甲基化方式,但其与形态学之间并无关联。相对胃泌素瘤和非功能性胰腺NET而言,胰岛素瘤细胞中可出现更多的高甲基化基因,而发生于胰腺和十二指肠的胃泌素瘤亦表现为不同的DNA甲基化特征,在小肠肿瘤中也可根据甲基化的特征分为两组,但其与形态学及其他分类方法之间并无关联。更深入的机制还有待于进一步的研究[89]。
近年来,有研究显示肿瘤微环境的改变在NET中发挥重要的作用,GEP-NEN患者可出现血管内皮细胞生长因子、成纤维细胞生长因子、血小板衍生生长因子等血管生成相关因子的过表达[90,91],与之相对应的是在组织学上这些肿瘤大多富血管。但是在去分化的胰腺NEN中却发现血管化程度下降的现象,这种现象的生物学和临床意义还有待于进一步研究[92]。NET中CD3+T淋巴细胞浸润也是十分常见的现象,至少在中—低级别的肿瘤中提示预后较好[93]。在中肠NET研究中,人们发现T淋巴细胞增殖下调可导致系统性FOXP3+T淋巴细胞功能下调或丧失[94],肿瘤浸润肥大细胞亦可调控炎症和血管反应,如果抑制其脱颗粒,可导致血管塌陷和肿瘤消退[95]。
关于NET和NEC究竟是同一谱系病变的不同分化阶段还是两类不同的肿瘤也是一个由来已久的话题。在胰腺NEC的研究中,发现p53和RB基因的突变十分常见,而Smad4/Dpc4、DAXX和ATRX l未见改变;与之相反,DAXX和ATRX在45%的NET中缺失,而p53和RB并无变化。BCL-2的过表达也主要出现于NEC中,并与增殖活性相关,而NET更多与MEN-1和11q杂合性缺失相关。此外,胰腺NET患者中SOX-2表达率仅为13.0%,而在NEC中的表达率高达71%,同时,SOX-2阳性的NET患者预后较差。此外,NET中Pdx1表达增多,而在NEC中并无表达。这些研究均提示小细胞癌和大细胞癌具有类似的遗传学变化特征,而两者与分化好的NET之间具有很大的差别。因此,在NET和NEC的研究中,目前认为两者并非疾病谱系里的连续过程,而是具有不同分子生物学机制的两种不同类型的疾病[96,97]。
在治疗方面,研究显示生长抑素受体(somatostatin receptor)下游信号对肿瘤分泌激素和生长具有重要的调节作用,进而人们利用生长抑素类似物(somatostatin analogs)控制肿瘤进展。与此同时,血管生成异常和mTOR通路异常激活的研究结果也通过了产品研发和临床试验,为此极大地改善了转移性肿瘤患者的生存[10, 88]。而上述治疗模式的进展和多元化也对NET的病理诊断模式提出了新的要求,包括通过免疫组织化学和分子检测等手段对具有指导治疗和判断预后意义的分子标志物进行检测。
8 结 语GEP-NEN属于一组具有特定形态学表现但生物学特征各异的肿瘤,临床处置不同部位及不同类型肿瘤时需考虑各自的特点。目前的认识以及分类和分级标准尚存在一定的局限性,随着NEN研究的不断深入,对于其遗传学特征和分子生物学机制的理解会逐步细化,进而为更加规范和有效的临床诊治提供坚实的基础。
| [1] | MODLIN I M, CHAMPANERIA M C, BORNSCHEIN J, et al. Evolution of the diffuse neuroendocrine system-clear cells and cloudy origins[J]. Neuroendocrinology, 2006, 84(2):69-82. |
| [2] | KULKE M H, SHAH M H, BENSON A B, et al. NCCN Practice Guidelines in Oncology:Neuroendocrine Tumors. V.1. 2015[EB/OL]. (2014-11-11/14)[2015-9-27]. http://www.nccn.org/professionals/physician_gls/pdf/neuroendocrine.pdf. |
| [3] | MODLIN I M, KIDD M, LATICH I, et al. Current status of gastrointestinal carcinoids[J]. Gastroenterology, 2005, 128(6):1717-1751. |
| [4] | MAGGARD M A, O'CONNELL J B, KO C Y. Updated population-based review of carcinoid tumors[J]. Ann Surg, 2004, 240(1):117-122. |
| [5] | WILLIAMS E D, SANDLER M. The classification of carcinoid tumours[J]. Lancet, 1963, 281(7275):238-239. |
| [6] | STROSBERG J, NASIR A, COPPOLA D, et al. Correlation between grade and prognosis in metastatic gastroenteropancreatic neuroendocrine tumors[J]. Hum Pathol, 2009, 40(9):1262-1268. |
| [7] | STROSBERG J R, CHEEMA A, WEBER J, et al. Prognostic validity of a novel American Joint Committee on Cancer staging classification for pancreatic neuroendocrine tumors[J]. J Clin Oncol, 2011, 29(22):3044-3049. |
| [8] | STROSBERG J R, WEBER J M, FELDMAN M, et al. Prognostic validity of the American Joint Committee on Cancer staging classification for midgut neuroendocrine tumors[J]. J Clin Oncol, 2013, 31(4):420-425. |
| [9] | FRAENKEL M, KIM M, FAGGIANO A, et al. Incidence of gastroenteropancreatic neuroendocrine tumours:a systematic review of the literature[J]. Endocr Relat Cancer, 2014, 21(3):R153-R163. |
| [10] | YAO J C, HASSAN M, PHAN A, et al. One hundred years after "carcinoid":epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States[J]. J Clin Oncol, 2008, 26(18):3063-3072. |
| [11] | LAWRENCE B, GUSTAFSSON B I, CHAN A, et al. The epidemiology of gastroenteropancreatic neuroendocrine tumors[J]. Endocrinol Metab Clin North Am, 2011, 40(1):1-18, vii. |
| [12] | ELLIS L, SHALE M J, COLEMAN M P. Carcinoid tumors of the gastrointestinal tract:trends in incidence in England since 1971[J]. Am J Gastroenterol, 2010, 105(12):2563-2569. |
| [13] | FRILLING A, AKERSTROM G, FALCONI M, et al. Neuroendocrine tumor disease:an evolving landscape[J]. Endocr Relat Cancer, 2012, 19(5):R163-R185. |
| [14] | KALTSAS G A, BESSER G M, GROSSMAN A B. The diagnosis and medical management of advanced neuroendocrine tumors[J]. Endocr Rev, 2004, 25(3):458-511. |
| [15] | 朱雄增. 胃肠神经内分泌瘤病理学诊断共识与争议.第17届全国临床肿瘤学术大会. 厦门,2014. ZHU Xiongzeng. Consensus and controversy of pathological diagnosis of gastrointestinal neuroendocrine neoplasms. CSCO 17th Annual Conference Xiamen,2014. (in Chinese) |
| [16] | CHO M Y, KIM J M, SOHN J H, et al. Current trends of the incidence and pathological diagnosis of gastroenteropancreatic neuroendocrine tumors (GEP-NETs) in Korea 2000-2009:multicenter study[J]. Cancer Res Treat, 2012, 44(3):157-165. |
| [17] | DELLE FAVE G, KWEKKEBOOM D J, VAN CUTSEM E, et al. ENETS consensus guidelines for the management of patients with gastroduodenal neoplasms[J]. Neuroendocrinology, 2012, 95(2):74-87. |
| [18] | NIEDERLE M B, HACKL M, KASERER K, et al. Gastroenteropancreatic neuroendocrine tumours:the current incidence and staging based on the WHO and European Neuroendocrine Tumour Society classification:an analysis based on prospectively collected parameters[J]. Endocr Relat Cancer, 2010, 17(4):909-918. |
| [19] | SCHERUBL H, CADIOT G, JENSEN R T, et al. Neuroendocrine tumors of the stomach (gastriccarcinoids) are on the rise:small tumors, small problems?[J]. Endoscopy, 2010, 42(8):664-671. |
| [20] | LEPAGE C, CICCOLALLO L, DE ANGELIS R, et al. European disparities in malignant digestive endocrine tumours survival[J]. Int J Cancer, 2009, 126(12):2928-2934. |
| [21] | BRENNER B, TANG L H, KLIMSTRA D S, et al. Small-cell carcinomas of the gastrointestinal tract:a review[J]. J Clin Oncol, 2004, 22(13):2730-2739. |
| [22] | SORBYE H, WELIN S, LANGER S W, et al. Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma (WHO G3):the NORDIC NEC study[J]. Ann Oncol, 2013, 24(1):152-160. |
| [23] | BRENNER B, SHAH M A, GONEN M, et al. Small-cell carcinoma of the gastrointestinal tract:a retrospective study of 64 cases[J]. Br J Cancer, 2004, 90(9):1720-1726. |
| [24] | 2013年中国胃肠胰神经内分泌肿瘤病理诊断共识专家组. 中国胃肠胰神经内分泌肿瘤病理诊断共识(2013版). 中华病理学杂志, 2013, 42(10):691-694. Chinese Pathologic Consensus Group for Gastrointestinal and Pancreatic Neuroendocrine Neoplasms. Standardization in diagnosis of gastrointestinal and pancreatic neuroendocrine neoplasms:the Chinese consensus(2013)[J]. Chinese Journal of Pathology, 2013, 42(10):691-694. (in Chinese) |
| [25] | SCARPA A, MANTOVANI W, CAPELLI P, et al. Pancreatic endocrine tumors:improved TNM staging and histopathological grading permit a clinically efficient prognostic stratification of patients[J]. Mod Pathol, 2010, 23(6):824-833. |
| [26] | TANG L H, GONEN M, HEDVAT C, et al. Objective quantification of the Ki67 proliferative index in neuroendocrine tumors of the gastroenteropancreatic system:a comparison of digital image analysis with manual methods[J]. Am J Surg Pathol, 2012, 36(12):1761-1770. |
| [27] | VOSS S M, RILEY M P, LOKHANDWALA P M, et al. Mitotic count by phosphohistone H3 immunohistochemical staining predicts survival and improves interobserver reproducibility in well-differentiated neuroendocrine tumors of the pancreas[J]. Am J Surg Pathol, 2015, 39(1):13-24. |
| [28] | FENOGLIO-PREISER C M NOFFSINGER A E, STEMMERMANN G N, et al. Gastrointestinal pathology:an atlas and text[M]. 3rd ed. Philadelphia:Wolters Kluwer/Lippincott Williams & Wilkins, 2008:1099-1155. |
| [29] | RINDI G, WIEDENMANN B. Neuroendocrine neoplasms of the gut and pancreas:new insights[J]. Nat Rev Endocrinol, 2011, 8(1):54-64. |
| [30] | RINDI G, FALCONI M, KLERSY C, et al. TNM staging of neoplasms of the endocrine pancreas:results from a large international cohort study[J]. J Natl Cancer Inst, 2012, 104(10):764-777. |
| [31] | KLOPPEL G, COUVELARD A, PERREN A, et al. ENETS consensus guidelines for the standards of care in neuroendocrine tumors:towards a standardized approach to the diagnosis of gastroenteropancreatic neuroendocrine tumors and their prognostic stratification[J]. Neuroendocrinology, 2009, 90(2):162-166. |
| [32] | GRILLO F, ALBERTELLI M, BRISIGOTTI M P, et al. Grade increases in gastro-entero-pancreatic neuroendocrine tumor metastases compared to the primary tumor[J]. Neuroendocrinology, 2015. Epub ahead of print. |
| [33] | SORBYE H, STROSBERG J, BAUDIN E, et al. Gastroenteropancreatic high-grade neuroendocrine carcinoma[J]. Cancer, 2014, 120(18):2814-2823. |
| [34] | LEPAGE C, CICCOLALLO L, DE ANGELIS R, et al. European disparities in malignant digestive endocrine tumours survival[J]. Int J Cancer, 2010, 126(12):2928-2934. |
| [35] | WELIN S, SORBYE H, SEBJORNSEN S, et al. Clinical effect of temozolomide-based chemotherapy in poorly differentiated endocrine carcinoma after progression on first-line chemotherapy[J]. Cancer, 2011, 117(20):4617-4622. |
| [36] | FAGGIANO A, SABOURIN J C, DUCREUX M, et al. Pulmonary and extrapulmonary poorly differentiated large cell neuroendocrine carcinomas:diagnostic and prognostic features[J]. Cancer, 2007, 110(2):265-274. |
| [37] | LA ROSA S, MARANDO A, FURLAN D, et al. Colorectal poorly differentiated neuroendocrine carcinomas and mixed adenoneuroendocrine carcinomas:insights into the diagnostic immunophenotype, assessment of methylation profile, and search for prognostic markers[J]. Am J Surg Pathol, 2012, 36(4):601-611. |
| [38] | VELAYOUDOM-CEPHISE F L, DUVILLARD P, FOUCAN L et al. Are G3 ENETS neuroendocrine neoplasms heterogeneous?[J]. Endocr Relat Cancer, 2013, 20(5):649-657. |
| [39] | BEGER H G, BUCHLER M, KOZAREK R, et al. The pancreas:an integrated textbook of basic science, medicine, and surgery[M]. 2nd ed. Oxford:Blackwell, 2008, 566-651. |
| [40] | MASSIRONI S, SCIOLA V, PERACCHI M, et al. Neuroendocrine tumors of the gastro-entero-pancreatic system[J]. World J Gastroenterol, 2008, 14(35):5377-5384. |
| [41] | HAUSO O, GUSTAFSSON B I, KIDD M, et al. Neuroendocrine tumor epidemiology:contrasting Norway and North America[J]. Cancer, 2008, 113(10):2655-2664. |
| [42] | BOSMAN F T, CARNEIRO F, HRUBAN RH, et al. WHO classification of tumours of the digestive system[M]. 4th ed. Lyon:International Agency for Research on Cancer, 2010:322-326. |
| [43] | CHETTY R. An overview of practical issues in the diagnosis of gastroenteropancreatic neuroendocrine pathology[J]. Arch Pathol Lab Med, 2008, 132(8):1285-1289. |
| [44] | TAUPENOT L, HARPER K L, O'CONNOR D T. The chromogranin-secretogranin family[J]. N Engl J Med, 2003, 348(12):1134-1149. |
| [45] | CAI Y C, BANNER B, GLICKMAN J, et al. Cytokeratin 7 and 20 and thyroid transcription factor 1 can help distinguish pulmonary from gastrointestinal carcinoid and pancreatic endocrine tumors[J]. Hum Pathol, 2001, 32(10):1087-1093. |
| [46] | TSENG I C, YEH M M, YANG C Y, et al. NKX6-1 is a novel immunohistochemical marker for pancreatic and duodenal neuroendocrine tumors[J]. Am J Surg Pathol, 2015, 39(6):850-857. |
| [47] | SALARIA S, MEANS A, REVETTA F, et al. Expression of CD24, a stem cell marker, in pancreatic and small intestinal neuroendocrine tumors[J]. Am J Clin Pathol, 2015, 144(4):642-648. |
| [48] | TSIKITIS V L, WERTHEIM B C, GUERRERO M A. Trends of incidence and survival of gastrointestinal neuroendocrine tumors in the United States:a seer analysis[J]. J Cancer, 2012, 3:292-302. |
| [49] | KÖRNER M, WASER B, REUBI J C. Does somatostatin or gastric inhibitory peptide receptor expression correlate with tumor grade and stage in gut neuroendocrine tumors?[J]. Neuroendocrinology, 2015, 101(1):45-57. |
| [50] | LONG K B, SRIVASTAVA A, HIRSCH M S, et al. PAX8 expression in well-differentiated pancreatic endocrine tumors:correlation with clinicopathologic features and comparison with gastrointestinal and pulmonary carcinoid tumors[J]. Am J Surg Pathol, 2010, 34(5):723-729. |
| [51] | SANGOI A R, OHGAMI R S, PAI R K, et al. PAX8 expression reliably distinguishes pancreatic well-differentiated neuroendocrine tumors from ileal and pulmonary well-differentiated neuroendocrine tumors and pancreatic acinar cell carcinoma[J]. Mod Pathol, 2010, 24(3):412-424. |
| [52] | SCHMITT A M, RINIKER F, ANLAUF M, et al. Islet 1(Isl1) expression is a reliable marker for pancreatic endocrine tumors and their metastases[J]. Am J Surg Pathol, 2008, 32(3):420-425. |
| [53] | CHAN E S, ALEXANDER J, SWANSON P E, et al. PDX-1, CDX-2, TTF-1, and CK7:a reliable immunohistochemical panel for pancreatic neuroendocrine neoplasms[J]. Am J Surg Pathol, 2012, 36(5):737-743. |
| [54] | TANG L H, UNTCH B R, REIDY D L, et al. Well-differentiated neuroendocrine tumors with a morphologically apparent high grade component:a pathway distinct from poorly differentiated neuroendocrine carcinomas[J]. Clin Cancer Res, 2015. Epub ahead of print. |
| [55] | BASTURK O, YANG Z, TANG L H, et al. The high-grade (WHO G3) pancreatic neuroendocrine tumor category is morphologically and biologically heterogenous and includes both well differentiated and poorly differentiated neoplasms[J]. Am J Surg Pathol, 2015, 39(5):683-690. |
| [56] | SCARDONI M, VITTORIA E, VOLANTE M, et al. Mixed adenoneuroendocrine carcinomas of the gastrointestinal tract:targeted next-generation sequencing suggests a monoclonal origin of the two components[J]. Neuroendocrinology, 2014, 100(4):310-316. |
| [57] | LA ROSA S, INZANI F, VANOLI A, et al. Histologic characterization and improved prognostic evaluation of 209 gastric neuroendocrine neoplasms[J]. Hum Pathol, 2011, 42(10):1373-1384. |
| [58] | NAYAL B, VASUDEVAN G, RAO A C, et al. Primary small cell carcinoma of the esophagus-an eight year retrospective study[J]. J Clin Diagn Res, 2015, 9(5):EC04-EC06. |
| [59] | BASTURK O, TANG L, HRUBAN R H, et al. Poorly differentiated neuroendocrine carcinomas of the pancreas:a clinicopathologic analysis of 44 cases[J]. Am J Surg Pathol, 2014, 38(4):437-447. |
| [60] | ALEXAKIS N, NEOPTOLEMOS J P. Pancreatic neuroendocrine tumours[J]. Best Pract Res Clin Gastroenterol, 2008, 22(1):183-205. |
| [61] | OBERG K, ERIKSSON B. Endocrine tumours of the pancreas[J]. Best Pract Res Clin Gastroenterol, 2005, 19(5):753-781. |
| [62] | RIDTITID W, HALAWI H, DEWITT J M, et al. Cystic pancreatic neuroendocrine tumors:outcomes of preoperative endosonography-guided fine needle aspiration, and recurrence during long-term follow-up[J]. Endoscopy, 2015, 47(7):617-625. |
| [63] | HALFDANARSON T R, RUBIN J, FARNELL M B, et al. Pancreatic endocrine neoplasms:epidemiology and prognosis of pancreatic endocrine tumors[J]. Endocr Relat Cancer, 2008, 15(2):409-427. |
| [64] | KIM J Y, KIM M S, KIM K S, et al. Clinicopathologic and prognostic significance of multiple hormone expression in pancreatic neuroendocrine tumors[J]. Am J Surg Pathol, 2015, 39(5):592-601. |
| [65] | RICCI C, CASADEI R, TAFFURELLI G, et al. WHO 2010 classification of pancreatic endocrine tumors. is the new always better than the old?[J]. Pancreatology, 2014, 14(6):539-541. |
| [66] | CARLINFANTE G, BACCARINI P, BERRETTI D, et al. Ki-67 cytological index can distinguish well-differentiated from poorly differentiated pancreatic neuroendocrine tumors:a comparative cytohistological study of 53 cases[J]. Virchows Arch, 2014, 465(1):49-55. |
| [67] | GOODELL P P, KRASINSKAS A M, DAVISON J M, et al. Comparison of methods for proliferative index analysis for grading pancreatic well-differentiated neuroendocrine tumors[J]. Am J Clin Pathol, 2012, 137(4):576-582. |
| [68] | MEHTA S, DE REUVER P R, GILL P, et al. Somatostatin receptor SSTR-2a expression is a stronger predictor for survival than Ki-67 in pancreatic neuroendocrine tumors[J]. Medicine (Baltimore), 2015, 94(40):e1281. |
| [69] | KACHARE S D, LINER K R, VOHRA N A, et al. A modified duodenal neuroendocrine tumor staging schema better defines the risk of lymph node metastasis and disease-free survival[J]. Am Surg, 2014, 80(8):821-826. |
| [70] | FITZGERALD T L, DENNIS S O, KACHARE S D, et al. Increasing incidence of duodenal neuroendocrine tumors:incidental discovery of indolent disease?[J]. Surgery, 2015, 158(2):466-471. |
| [71] | MOERTEL C G, WEILAND L H, NAGORNEY D M, et al. Carcinoid tumor of the appendix:treatment and prognosis[J]. N Engl J Med, 1987, 317(27):1699-1701. |
| [72] | ALEXANDRAKI K I, KALTSAS G A, GROZINSKY-GLASBERG S, et al. Appendiceal neuroendocrine neoplasms:diagnosis and management[J]. Endocr Relat Cancer, 2015, 23(1):R27-R41. |
| [73] | SHAIB W, KRISHNA K, KIM S, et al. Appendiceal neuroendocrine, goblet and signet-ring cell tumors:a spectrum of diseases with different patterns of presentation and outcome[J]. Cancer Res Treat, 2015. Epub ahead of print. |
| [74] | LEE L H, MCCONNELL Y J, TSANG E, et al. Simplified 2-tier histologic grading system accurately predicts outcomes in goblet cell carcinoid of the appendix[J]. Hum Pathol, 2015, 46(12):1881-1889. |
| [75] | TANG L H, SHIA J, SOSLOW R A, et al. Pathologic classification and clinical behavior of the spectrum of goblet cell carcinoid tumors of the appendix[J]. Am J Surg Pathol, 2008, 32(10):1429-1443. |
| [76] | HOLT N, GRONBAEK H. Goblet cell carcinoids of the appendix[J]. Scientific World Journal, 2013, 2013:543696. |
| [77] | KIM J Y, KIM K S, KIM K J, et al. Non-L-cell immunophenotype and large tumor size in rectal neuroendocrine tumors are associated with aggressive clinical behavior and worse prognosis[J]. Am J Surg Pathol, 2015, 39(5):632-643. |
| [78] | Gastrointestinal Pathology Study Group of Korean Society of Pathologists, SOHN J H, CHO M Y, et al. Prognostic significance of defining L-cell type on the biologic behavior of rectal neuroendocrine tumors in relation with pathological parameters[J]. Cancer Res Treat, 2015, 47(4):813-822. |
| [79] | LEE S H, KIM B C, CHANG H J, et al. Rectal neuroendocrine and L-cell tumors:diagnostic dilemma and therapeutic strategy[J]. Am J Surg Pathol, 2013, 37(7):1044-1052. |
| [80] | HEMMINKI K, LI X. Incidence trends and risk factors of carcinoid tumors:a nationwide epidemiologic study from Sweden[J]. Cancer, 2001, 92(8):2204-2210. |
| [81] | ASA S L. Pancreatic endocrine tumors[J]. Mod Pathol, 2011, 24 Suppl 2:S66-S77. |
| [82] | JIAO Y, SHI C, EDIL B H, et al. DAXX/ATRX, MEN1, and mTOR pathway genes are frequently altered in pancreatic neuroendocrine tumors[J]. Science, 2011, 331(6021):1199-1203. |
| [83] | MARINONI I, KURRER A S, VASSELLA E, et al. Loss of DAXX and ATRX are associated with chromosome instability and reduced survival of patients with pancreatic neuroendocrine tumors[J]. Gastroenterology, 2014, 146(2):453-460. |
| [84] | FRANCOIS R A, MAENG K, NAWAB A, et al. Targeting focal adhesion kinase and resistance to mTOR inhibition in pancreatic neuroendocrine tumors[J]. J Natl Cancer Inst, 2015, 107(8).pii:djv123. doi:10.1093/jnci/djv123. |
| [85] | QIAN Z R, TER-MINASSIAN M, CHAN J A, et al. Prognostic significance of MTOR pathway component expression in neuroendocrine tumors[J]. J Clin Oncol, 2013, 31(27):3418-3425. |
| [86] | ANDERSSON E, SWARD C, STENMAN G, et al. High-resolution genomic profiling reveals gain of chromosome 14 as a predictor of poor outcome in ileal carcinoids[J]. Endocr Relat Cancer, 2009, 16(3):953-966. |
| [87] | KULKE M H, FREED E, CHIANG D Y, et al. High-resolution analysis of genetic alterations in small bowel carcinoid tumors reveals areas of recurrent amplification and loss[J]. Genes Chromosomes Cancer, 2008, 47(7):591-603. |
| [88] | FRANCIS J M, KIEZUN A, RAMOS A H, et al. Somatic mutation of CDKN1B in small intestine neuroendocrine tumors[J]. Nat Genet, 2013, 45(12):1483-1486. |
| [89] | BRIEST F, BERG E, GRASS I, et al. FOXM1:a novel drug target in gastroenteropancreatic neuroendocrine tumors[J]. Oncotarget, 2015, 6(10):8185-8199. |
| [90] | HOW-KIT A, DEJEUX E, DOUSSET B, et al. DNA methylation profiles distinguish different subtypes of gastroenteropancreatic neuroendocrine tumors[J]. Epigenomics, 2015, 7(8):1245-1258. |
| [91] | OBERG K, CASANOVAS O, CASTANO J P, et al. Molecular pathogenesis of neuroendocrine tumors:implications for current and future therapeutic approaches[J]. Clin Cancer Res, 2013, 19(11):2842-2849. |
| [92] | TERRIS B, SCOAZEC J Y, RUBBIA L, et al. Expression of vascular endothelial growth factor in digestive neuroendocrine tumours[J]. Histopathology, 1998, 32(2):133-138. |
| [93] | SCOAZEC J Y. Angiogenesis in neuroendocrine tumors:therapeutic applications[J]. Neuroendocrinology, 2012, 97(1):45-56. |
| [94] | KATZ S C, DONKOR C, GLASGOW K, et al. T cell infiltrate and outcome following resection of intermediate-grade primary neuroendocrine tumours and liver metastases[J]. HPB (Oxford), 2010, 12(10):674-683. |
| [95] | VIKMAN S, SOMMAGGIO R, DE LA TORRE M, et al. Midgut carcinoid patients display increased numbers of regulatory T cells in peripheral blood with infiltration into tumor tissue[J]. Acta Oncol, 2009, 48(3):391-400. |
| [96] | SOUCEK L, BUGGY J J, KORTLEVER R, et al. Modeling pharmacological inhibition of mast cell degranulation as a therapy for insulinoma[J]. Neoplasia, 2011, 13(11):1093-1100. |
| [97] | YACHIDA S, VAKIANI E, WHITE C M, et al. Small cell and large cell neuroendocrine carcinomas of the pancreas are genetically similar and distinct from well-differentiated pancreatic neuroendocrine tumors[J]. Am J Surg Pathol, 2012, 36(2):173-184. |
| [98] | AKIYAMA T, SHIDA T, YOSHITOMI H, et al. Expression of sex determining region Y-Box 2 and pancreatic and duodenal homeobox 1 in pancreatic neuroendocrine tumors[J]. Pancreas, 2015. Epub ahead of print. |



