2. 浙江大学医学院附属第二医院神经内科, 浙江 杭州 310009
2. Department of Neurology, the Second Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310009, China
急性缺血性卒中患者病灶局部在弥散加权成像(diffusion weighted imaging,DWI)上呈高信号,表观弥散系数(apparent diffusion coefficient,ADC)图呈低信号。动物研究证实ADC值小于0.55×10-3 mm2/s区域与病理组织中的梗死区域符合,因此,我们认为ADC值小于0.55×10-3 mm2/s区域为核心梗死区[1],早期ADC值下降的机制也已被证实为能量代谢紊乱引起钠钾泵功能异常导致的细胞毒性水肿[2, 3, 4, 5, 6, 7]。随着卒中时间的延长,在起病后第3~7天处于病灶中靠外周区域的组织ADC信号率先出现升高,ADC值开始增加[4];在1周以后至1个月,大部分病灶的ADC信号都逆转至与正常组织信号相似,呈“假正常化”现象[8, 9]。大多数研究认为梗死病灶上述现象可能与血管源性水肿有关,其病理生理变化可能与细胞组织结构的破坏、组织再灌注、血脑屏障破坏有关[9, 10, 11]。故DWI高信号病灶中可存在不同ADC值并处于不同组织状态的区域,即核心梗死区(ADC≤0.55×10-3 mm2/s)和核心周围区(ADC>0.55×10-3 mm2/s)。然而,导致核心周围区ADC值增加的原因并不确切,传统DWI-ADC技术也无法提供关于上述改变的具体特征。
体素内不相干运动(intravoxel incoherent motion,IVIM)是一种无创、无注射对比剂的多b值DWI成像技术,可提供三个参数:慢弥散系数(slow diffusion coefficient,D)、快弥散系数(fast diffusion coefficient,D*)和灌注分数(perfusion fraction,f)[12]。D和D*分别反映脑实质内血管外和血管内水分子的弥散速度,f可反映微循环内灌注体积的改变[13, 14],因此,IVIM不仅能提供脑组织内微结构的水分子弥散信息,而且能提供脑组织内微循环的灌注信息。本研究利用该技术来评价亚急性期缺血性卒中患者DWI高信号病灶内核心梗死区和核心周围区的D值、D*值和f值,探究DWI高信号病灶内ADC信号不均质的可能原因。
1 对象与方法 1.1 对 象回顾性分析2014年6月9日至2015年7月5日在浙江大学医学院附属第二医院神经内科住院的亚急性期大脑中动脉供血区缺血性卒中患者临床资料。对象纳入标准:①年龄大于等于18岁;②大脑中动脉区域缺血性梗死;③症状首次发作到MRI检查时间为3~7天;④美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分4~21分;⑤无合并脑出血。对象排除标准:①任何对MRI扫描有禁忌者;②既往有卒中病史者(包括出血性及缺血性);③发生卒中前有肢体残疾者[改良Rankin量表(mRS)评分>1];④已接受溶栓治疗的患者;⑤同时存在其他神经系统或精神疾病,包括周围神经病。患者信息以及心血管危险因素(年龄、性别、糖尿病、高血压、高血脂、心脏病、吸烟及酗酒史)均已记录。NIHSS和mRS由一名高年资神经内科医师进行评估。本研究经浙江大学医学院附属第二医院伦理委员会批准,所有患者均知情同意并签署知情同意书。
1.2 影像学检查和参数所有患者均接受美国通用电器公司3.0 T 磁共振仪器扫描,所用线圈为8通道头颅线圈。扫描序列和参数如下:IVIM序列扫描采用16个b值(0、10、20、30、50、70、90、110、130、150、170、200、500、800、1000、1500 s/mm2),TR/TE=3000/73 ms,翻转角=90°,层厚=4 mm,无层间距,矩阵大小=256×256,视野=24 cm×24 cm。常规DWI序列扫描参数如下:TR/TE=5000/86 ms,翻转角=90°,层厚=4 mm,无层间距,矩阵大小=128×128,视野=24 cm×24 cm,b值=1000 s/mm2,沿着3个正交方向。
1.3 图像后处理IVIM图像首先用FSL(FMRIB Software Library)软件进行涡流矫正、去头皮处理,然后用MITK软件通过公式(1)、(2)计算得到D、D* 和f图。S(0)为b=0时的信号强度;S(b)为b值不为0时,每个b值对应的信号强度[15]。

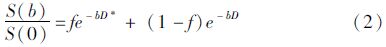
DWI图像传入GE工作站(ADW4.6)进行后处理,DWI根据以下公式计算:Sb=S0 exp(-bADC)在工作站自动计算生成ADC图。病灶体积以DWI图像上高信号的范围大小进行计算得到,DWI高信号强度以大于对侧镜像平均信号强度+2倍标准差为阈值[16]。
1.4 核心梗死区和核心周围区的界定根据DWI-ADC图上ADC值0.55×10-3 mm2/s为阈值,将DWI高信号区域分为核心梗死区(ADC≤0.55×10-3 mm2/s)和核心周围区(ADC>0.55×10-3 mm2/s)两个感兴趣区(region of interest,ROI),再经镜像处理在对侧得到相应的两个ROI(图1)。再分别测出这四个ROI内的ADC值、D值、D*值、f值,并计算校正后的核心梗死区和核心周围区的比值ADC(rADC)值、比值D(rD)值、比值D*(rD*)值、比值f(rf)值[rADC(核心梗死区)=核心梗死区的ADC/对侧镜像区的ADC,同理得核心梗死区的rD值、rD*值和rf值以及核心周围区的rADC值、rD值、rD*值和rf值]。

|
| 左图为弥散加权图像(DWI),右图为表观弥散系数(ADC)图像。左右两图均左侧为正常侧、右侧病灶侧。在DWI上高信号病灶内(黄色ROI),以ADC值0.55×10-3 mm2/s为阈值,将病灶分割为核心梗死区(红色ROI)和核心周围区(红色和黄色ROI交界区). 图1 核心梗死区和核心周围区示意图 Fig.1 The ROIs of infarction core and peri-core |
统计分析采用SPSS 19.0软件,所得的计量数据资料符合正态分布,以均数±标准差(x±s)表示。采用配对t检验分析核心梗死区与对侧镜像之间以及核心周围区与对侧镜像之间ADC值、D值、D*值和f值差异。同样采用配对t检验分析核心梗死区与核心周围区之间rADC值、rD值、rD*值和rf值有无差异。在核心梗死区和核心周围区内,rADC值与rD值之间的比较采用配对t检验。核心梗死区与核心周围区中rADC值和rD值、rD*值和rf值之间的相关性采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结 果 2.1 患者一般情况本研究共纳入20例亚急性期缺血性卒中患者,其中男性7例(35%)、女性13例(65%),平均年龄(62±12)岁(年龄范围39~81岁),平均基线NIHSS评分(8±3)分(评分范围4~14分),平均梗死体积(8.4±8.8)mL(梗死体积范围1.1~38.8 mL)。
2.2 核心梗死区、核心周围区与正常侧的参数比较在核心梗死区中,病灶内下列参数较对侧镜像区降低,ADC值[(0.46±0.03)×10-3 mm2/s 与 (0.83±0.03)×10-3 mm2/s,P<0.001]、D值[(0.35±0.06)×10-3 mm2/s 与 (0.61±0.04)×10-3 mm2/s,P<0.001]、f值[(8.5±1.9)% 与 (12.3±1.8)%,P<0.001],下降比例分别为ADC值45%、D值42%、f值32%。而D*值较正常侧无降低[(9.3±6.3)×10-3 mm2/s与 (6.6±1.7)×10-3 mm2/s,P=0.069]。
在核心周围区中,病灶内下列参数较对侧镜像区降低,ADC值[(0.67±0.02)×10-3 mm2/s 与 (0.87±0.06)×10-3 mm2/s,P<0.001]、D值[(0.43±0.05)×10-3 mm2/s 与 (0.63±0.05)×10-3 mm2/s,P<0.001]、f值[(11.4±2.0)% 与 (12.5±2.1)%,P=0.009],下降比例分别ADC值22%、D值32%、f值8%,降低幅度较核心梗死区少。D*值较正常侧无下降[(8.9±4.6)×10-3 mm2/s 与(7.9±2.9)×10-3 mm2/s,P=0.389]。
2.3 校正后核心梗死区和核心周围区各参数的比较核心梗死区rADC值、rD值和rf值显著低于核心周围区,其中rADC值低41.8%,rD值低19.2%,rf值低35.1%,而rD*值与核心周围区差异无统计学意义。在核心周围区,rADC值高于rD值;而在核心梗死区,rADC值与rD值差异无统计学意义。结果详见表1。
| 病灶区别 | rADC值 | rD值 | rD*值 | rf值 |
| 核心周围区 | 0.78±0.06 | 0.68±0.09 | 1.27±0.79 | 0.92±0.13 |
| 核心梗死区 | 0.55±0.04 | 0.58±0.09 | 1.45±0.95 | 0.68±0.09 |
| P值 | <0.001 | <0.001 | 0.161 | <0.001 |
Pearman相关性分析结果显示:核心梗死区和核心周围区的rADC值与rD值均呈正相关(r=0.626 ,P=0.003;r=0.688,P=0.001)。核心梗死区的rADC值与rf值与rD*值均无相关性(r=0.163,P=0.492;r=-0.378,P=1.000)。核心周围区的rADC值与rf值呈正相关性(r=0.467,P=0.038),但rADC值与rD*值无相关性(r=-0.049,P=0.838)。
3 讨 论本研究通过IVIM技术得到反映组织内水分子弥散情况的D值和反应血管内水分子弥散情况的D*值以及微循环内灌注体积情况的f值,发现在亚急性期缺血性卒中患者DWI高信号病灶中,核心梗死区和核心周围区的D值和f值较对侧均有下降,但下降幅度不同。根据对侧校正后,核心梗死区较核心周围区的下降幅度更大。进一步分析发现核心周围区ADC值与D值、f值呈正相关,提示核心周围区内ADC值的增加可能与D值、f值的改变有关。
核心梗死区的病理生理机制较为明确。缺血发生后,缺血缺氧引起细胞能量代谢紊乱和钠钾泵功能异常,导致细胞去极化,大量水分子从细胞外转移到细胞内,继而发生细胞毒性水肿[9, 17],细胞外水分子减少而且弥散受限,导致水分子弥散速度明显减慢。本研究结果发现D值较对侧降低了42%,且f值较对侧降低32%,可能提示微血管破坏和部分红细胞堆积,导致有效的微循环容量减少。早期Wirestam等[18]发现缺血性卒中患者急性期病灶主要表现为低f值和低D值,也支持本研究核心梗死区的分析结果。
在核心梗死区周围还存在相对核心梗死区ADC值增加的区域。以往大部分研究报道关于ADC值的增加发生在缺血性卒中1周以后[19],这种改变与血管源性水肿有关[9, 20]。但在缺血性卒中患者急性期后的1周内[21],与血管源性水肿相关的病理生理机制并没有得到更深入的认识,也可能受限于以往DWI-ADC技术不能提供足够的影像学证据。我们发现尽管核心周围区与对侧镜像区的比较类似于核心梗死区,同样有D值和f值下降,但两个参数减少的百分比(分别为32%和8%)都小于核心梗死区(分别为42%和32%),以f值更明显,而且进一步与镜像侧进行校正后发现核心周围区的D值和f值与核心梗死区相比均有明显增加。D值增加可能是在与组织血流灌注增加的基础上,大量水分子从肿胀的细胞内外移到细胞间隙,细胞水肿可逆性消退有关。但我们难以推断D值是否与细胞组织结构破坏相关。f值增加正好提示了微循环内有血容量增加,这种增加可能是由机体的自身调节改变引起。一些研究发现核心周围区内仍有功能血管存留,通过机体自身调节作用,微血管扩张,增加血供和氧供。另外,近期研究发现在亚急性期患者病灶内部分区域可出现碱性分离,即细胞内的pH值增加,这同样反映了病灶局部急性缺血后的自身代偿机制[22]。因此,缺血性卒中患者在亚急性期核心周围区存在的微循环代偿机制可以通过与微循环灌注相关的f参数来反映。
另外,本研究发现rD值和rADC值在核心梗死区和核心周围区均呈高度相关,说明ADC值的变化主要与组织内水分子弥散运动有关。同时,我们发现核心梗死区rf值与rADC值无差异,符合在没有任何血管源性水分子弥散的情况下D值等同于ADC值的认识。但在核心周围区rADC值明显大于rD值,说明核心周围区的ADC值可能还包含有血管内弥散运动增加的成分。rADC值与rf值高度相关的结果也支持ADC值内含有血管灌注增加引起的血流速度增加的信息。可惜的是,本研究D*值在核心梗死区和核心周围区的病灶侧和正常侧未得到差异性的结果。近期研究表明D*值受图像信噪比影响明显,可重复性差[23],在定量分析上准确性不如D和f参数[24, 25]。因此,我们认为D*值的结果可能并未真实反映病灶内微循环的流速改变。
总之,本研究表明,亚急性期缺血性卒中的DWI高信号病灶中,核心周围区与核心梗死区相比,在IVIM参数图上反映微结构的水分子弥散速度的D值增加以及反映微循环血容量灌注的f值增加,提示核心周围区内ADC值增加可能与微结构内细胞水肿消退、微循环自动调节引起的血容量增加有关。
| [1] | DARDZINSKI B J, SOTAK C H, FISHER M, et al. Apparent diffusion coefficient mapping of experimental focal cerebral ischemia using diffusion-weighted echo-planar imaging[J]. Magn Reson Med, 1993,30(3):318-325. |
| [2] | LOVBLAD K O, LAUBACH H J, BAIRD A E, et al. Clinical experience with diffusion-weighted MR in patients with acute stroke[J]. Am J Neuroradiol, 1998,19(6):1061-1066. |
| [3] | WARACH S, GAA J, SIEWERT B, et al. Acute human stroke studied by whole brain echo planar diffusion-weighted magnetic resonance imaging[J]. Ann Neurol, 1995, 37(2):231-241. |
| [4] | YANG Q, TRESS B M, BARBER P A, et al. Serial study of apparent diffusion coefficient and anisotropy in patients with acute stroke[J]. Stroke, 1999, 30(11):2382-2390. |
| [5] | MINTOROVITCH J, YANG G Y, SHIMIZU H, et al. Diffusion-weighted magnetic resonance imaging of acute focal cerebral ischemia:comparison of signal intensity with changes in brain water and Na+,K(+)-ATPase activity[J]. J Cereb Blood Flow Metab, 1994, 14(2):332-336. |
| [6] | CARANO R A, LI F, IRIE K, et al. Multispectral analysis of the temporal evolution of cerebral ischemia in the rat brain[J]. J Magn Reson Imaging, 2000, 12(6):842-858. |
| [7] | WINBECK K, BRUCKMAIER K, ETGEN T,et al.Transient ischemic attack and stroke can be differentiated by analyzing early diffusion-weighted imaging signal intensity changes[J]. Stroke, 2004, 35(5):1095-1099. |
| [8] | COPEN W A, SCHWAMM L H, GONZALEZ R G, et al. Ischemic stroke:effects of etiology and patient age on the time course of the core apparent diffusion coefficient[J]. Radiology, 2001, 221(1):27-34. |
| [9] | FIEHLER J, FOTH M, KUCINSKI T, et al. Severe ADC decreases do not predict irreversible tissue damage in humans[J]. Stroke, 2002, 33(1):79-86. |
| [10] | NEUMANN-HAEFELIN T, KASTRUP A, DE C A, et al. Serial MRI after transient focal cerebral ischemia in rats:dynamics of tissue injury, blood-brain barrier damage, and edema formation[J]. Stroke, 2000, 31(8):1965-1973. |
| [11] | LI F, LIU K F, SILVA M D, et al. Transient and permanent resolution of ischemic lesions on diffusion-weighted imaging after brief periods of focal ischemia in rats:correlation with histopathology[J]. Stroke, 2000, 31(4):946-954. |
| [12] | UEHARA R, YAMASHITA K, HIWATASHI A, et al. Intravoxel incoherent motion magnetic resonance imaging findings in the acute phase of MELAS:a case report[J]. Brain Behav, 2014, 4(6):798-800. |
| [13] | LE BIHAN D, BRETON E, LALLEMAND D, et al. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging[J]. Radiology, 1988, 168(2):497-505. |
| [14] | DIXON W T. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging:a modest proposal with tremendous potential[J]. Radiology, 1988, 168(2):566-567. |
| [15] | KINGSLEY P B, MONAHAN W G. Selection of the optimum b factor for diffusion-weighted magnetic resonance imaging assessment of ischemic stroke[J]. Magn Reson Med, 2004, 51(5):996-1001. |
| [16] | NEUMANN-HAEFELIN T, WITTSACK H J, FINK G R, et al. Diffusion-and perfusion-weighted MRI:influence of severe carotid artery stenosis on the DWI/PWI mismatch in acute stroke[J]. Stroke, 2000, 31(6):1311-1317. |
| [17] | LIU K F, LI F, TATLISUMAK T, et al. Regional variations in the apparent diffusion coefficient and the intracellular distribution of water in rat brain during acute focal ischemia[J]. Stroke, 2001, 32(8):1897-1905. |
| [18] | WIRESTAM R, BROCKSTEDT S, LINDGREN A, et al.The perfusion fraction in volunteers and in patients with ischaemic stroke[J]. Acta Radiol, 1997, 38(6):961-964. |
| [19] | SCHLAUG G, SIEWERT B, BENFIELD A, et al. Time course of the apparent diffusion coefficient (ADC) abnormality in human stroke[J]. Neurology, 1997,49(1):113-119. |
| [20] | HOEHN-BERLAGE M, NORRIS D G, KOHNO K, et al. Evolution of regional changes in apparent diffusion coefficient during focal ischemia of rat brain:the relationship of quantitative diffusion NMR imaging to reduction in cerebral blood flow and metabolic disturbances[J]. J Cereb Blood Flow Metab, 1995, 15(6):1002-1011. |
| [21] | KARIBE H, ZAROW G J, GRAHAM S H, et al. Mild intraischemic hypothermia reduces postischemic hyperperfusion, delayed postischemic hypoperfusion, blood-brain barrier disruption, brain edema, and neuronal damage volume after temporary focal cerebral ischemia in rats[J]. J Cereb Blood Flow Metab, 1994, 14(4):620-627. |
| [22] | ZÖLLNER J P, HATTINGEN E, SINGER O C, et al. Changes of pH and energy state in subacute human ischemia assessed by multinuclear magnetic resonance spectroscopy[J]. Stroke, 2015, 46(2):441- 446. |
| [23] | LEE Y, LEE S S, KIM N, et al. Intravoxel incoherent motion diffusion-weighted MR imaging of the liver:effect of triggering methods on regional variability and measurement repeatability of quantitative parameters[J]. Radiology, 2015, 274(2): 405-415. |
| [24] | WU W C, CHEN Y F, TSENG H M, et al. Caveat of measuring perfusion indexes using intravoxel incoherent motion magnetic resonance imaging in the human brain[J]. Eur Radiol, 2015, 25(8): 2485-2492. |
| [25] | FILLI L, WURNIG M C, LUECHINGER R, et al. Whole-body intravoxel incoherent motion imaging[J]. Eur Radiol, 2015, 25(7): 2049-2058. |




