2. 浙江省人民医院麻醉科, 浙江杭州 310014
2. Department of Anesthesiology, Zhejiang Provincial People's Hospital, Hangzhou 310014, China
脓毒症是指由感染引起的全身炎症反应综合征,其进一步可发展为多器官功能障碍综合征。肺是脓毒症病理过程中最容易受累的靶器官,研究表明脓毒症患者急性肺损伤(acute lung injury)或急性呼吸窘迫综合征(acute respiratory distress syndrome)的患病率高达25%~50%[1, 2]。因此探究脓毒症致肺损伤的有效治疗措施具有重要的临床意义。
病原微生物入侵机体后,机体首先动员其固有免疫系统做出快速有效的防御反应来抗击感染。脓毒症状态下,促炎/抗炎反应失衡,循环中细菌组分如脂多糖 (lipopolysaccharide,LPS) 等病原相关分子模式作用于单核细胞表面Toll样受体(Toll-like receptors,TLRs),通过激活“TLR4-核因子κB(nuclear factor-κB,NF-κB)”炎症信号通路,启动单核细胞经典活化程序,释放大量TNF-α、IL-6等炎症因子[3, 4],同时分泌单核细胞趋化因子1(monocyte chemotactic protein-1,MCP-1)、IL-8等趋化因子[5];后者可以募集大量的单核细胞及中性粒细胞到肺组织中,产生蛋白水解酶、白三烯、活性氧簇等物质进一步扩大炎症反应,导致组织损伤。过度的炎症反应造成血气屏障完整性受损、毛细血管通透性增加、肺间质充血水肿、肺泡萎陷,最终导致气体交换障碍,引起急性肺损伤或急性呼吸窘迫综合征[6, 7, 8]。因此,早期适当干预、调控机体过度炎症反应,对于防治脓毒症致急性肺损伤具有重要的临床意义。
苏拉明是一种对称的多磺酸基萘脲药物,具有多种药理学作用,尤其是在抗炎、抗凋亡等免疫调节中的重要作用颇受关注。迄今,苏拉明已用于类风湿性关节炎、肾损伤、心肌炎等的临床治疗研究中[9, 10, 11, 12, 13, 14],基于脓毒症系机体炎症反应和免疫功能异常所致,本研究采用LPS建立小鼠和细胞脓毒症模型观察苏拉明对脓毒症小鼠肺组织和循环炎症反应的抑制作用及其分子生物学机制。
1 材料与方法 1.1 主要试剂及仪器LPS和苏拉明购自美国Sigma公司; TNF-α和IL-6 ELISA试剂盒购自美国eBioscience公司;NE-PER试剂盒购自Thermo Fisher Scientific公司;P65、磷酸化P65(pP65)、IκB、磷酸化IκB (pIκB)抗体均购自美国Cell Signaling Technology公司;HRP标记的山羊抗兔抗体购自Thermo Fisher Scientific公司;人单核细胞系THP-1细胞购自美国模式培养物保藏所。多功能酶标仪购自美国Bio-Rad公司;ABI7500实时定量PCR仪购自美国ABI公司。
1.2 体内实验 1.2.1 动物及分组8~10周龄雄性C57BL/6小鼠24只购自上海斯莱克实验动物有限公司,体质量20~25 g,采用数字表法将小鼠随机分为6组:苏拉明对照组、生理盐水对照组、生理盐水+LPS 24 h组、苏拉明+LPS 24 h组、生理盐水+LPS 72 h组和苏拉明+LPS 72 h组,每组各4只。小鼠饲养在无特殊病原菌环境,温度22~25 ℃,相对湿度约40%,每日12 h/12 h昼夜交替,自由饮食、饮水。所有实验过程均经浙江大学实验动物管理委员会批准。
1.2.2 建立脓毒症小鼠模型LPS溶于0.9%氯化钠溶液,以5 mg/kg静脉注射建立脓毒症小鼠模型。苏拉明对照组将苏拉明溶于0.9%氯化钠溶液,以5 mg/kg静脉注射;生理盐水对照组采用等体积0.9%氯化钠溶液150 μL静脉注射。其他4组分别在上述0.9%氯化钠溶液或苏拉明预处理30 min后建立脓毒症模型,检测建模24 h、72 h后小鼠肺和血清炎症因子TNF-α、IL-6水平。
1.2.3 ELISA法检测肺组织和血清炎症因子LPS干预后24 h和72 h,取右肺上叶组织低温研磨匀浆,RIPA裂解液裂解,蛋白定量,采用ELISA法检测肺组织TNF-α、IL-6水平;同时分别取小鼠外周血,EDTA抗凝,分离血浆,采用ELISA方法检测外周血TNF-α、IL-6水平。操作按照试剂盒说明书进行。
1.3 体外实验 1.3.1 THP-1细胞培养人单核细胞系THP-1细胞用10%FBS的RPMI-1640培养基培养于37 ℃恒温二氧化碳培养箱。苏拉明或0.9%氯化钠溶液预处理30 min后,用100 ng/mL LPS刺激细胞30 min、60 min、90 min进行后续实验。
1.3.2 RT-PCR检测单核细胞THP-1炎症因子的表达收集细胞,Trizol法提取总RNA,并逆转录为cDNA,根据基因库中人的基因序列,使用Primer 5.0软件设计β-actin、TNF-α和IL-6的引物,具体序列为β-actin:上游引物5′-AGAAAATCTGGCACCACACC-3′,下游引物5′-AGAGGCGTACAGGGATAGCA-3′; TNF-α:上游引物5′-CCAGGGACCTCTCTCTAAT-3′,下游引物5′-CTACTTTCACCTCCATCCAT-3′;IL-6:上游引物5′-CTCACCTCTTCAGAACGAAT-3′,下游引物5′-CTCTTTGCTGCTTTCACAC-3′。采用ABI7500实时定量PCR仪检测,并进行分析,以2-ΔΔCT计算TNF-α和IL-6 mRNA的表达水平。ΔΔCT=CT值(实验组靶基因-实验组β-actin)-CT值(对照组靶基因-对照组β-actin)。
1.3.3 蛋白质印迹法检测NF-κB活性收集上述各组细胞,RIPA常规裂解蛋白,提取总蛋白。采用NE-PER试剂盒分离细胞浆及细胞核蛋白,蛋白质印迹法检测NF-κB活性:上样蛋白总质量20 μg,SDS-PAGE电泳120 V恒压60 min;PVDF膜转膜,5%脱脂奶粉室温封闭60 min,分别加抗P65、pP65、IκB、pIκB抗体(工作浓度均为1∶1000)4 ℃孵育过夜,次日洗膜后加二抗(工作浓度为1∶1000),室温孵育1 h,TBST洗脱并显影。
1.4 统计学方法采用SPSS 17.0统计软件进行数据分析,计量资料采用均数±标准差(x±s)表示,多组比较采用多因素方差分析,以P<0.05 为差异具有统计学意义。
2 结 果 2.1 各组肺组织TNF-α和IL-6水平比较生理盐水+LPS 24 h、72 h组肺组织TNF-α和IL-6水平较生理盐水对照组升高(均P<0.001),表明LPS致脓毒症肺损伤造模成功。
生理盐水对照组与苏拉明对照组肺组织炎症因子TNF-α、IL-6水平差异无统计学意义(均P>0.05)。与生理盐水+LPS 24 h组比较,苏拉明+LPS 24 h组肺组织TNF-α和IL-6的水平降低,差异均有统计学意义(均P<0.01);而生理盐水+LPS 72 h组与苏拉明+LPS 72 h组肺组织TNF-α和IL-6水平差异无统计学意义(均P>0.05),见图1。提示苏拉明可减轻LPS致脓毒症肺损伤模型早期肺组织的炎症。

|
| 与生理盐水对照组比较,**P<0.01;与生理盐水+LPS 24 h组比较,##P<0.01. 图1 各组小鼠肺组织TNF-α和IL-6的水平比较 Fig.1 The level of TNF-α and IL-6 in pulmonary tissue in LPS-induced septic mice |
生理盐水+LPS 24 h、72 h组外周血TNF-α和IL-6水平较生理盐水对照组增加(均P<0.01),表明LPS致脓毒症模型成功。
生理盐水对照组与苏拉明对照组外周血TNF-α和IL-6水平差异无统计学意义(均P>0.05)。与生理盐水+LPS 24 h组比较,苏拉明+LPS 24 h组外周血TNF-α和IL-6水平减少,差异有统计学意义(均P<0.01);生理盐水+LPS 72 h组与苏拉明+LPS 72 h组外周血TNF-α和IL-6水平差异均无统计学意义(均P>0.05),见图2。提示苏拉明可减轻LPS致肺损伤模型早期全身炎症。

|
| 与生理盐水对照组比较,** P<0.01;与生理盐水+LPS 24 h组比较,##P<0.01. 图2 各组小鼠血浆TNF-α及IL-6的水平比较 Fig.2 The level of TNF-α and IL-6 in plasma in LPS-induced septic mice |
RT-PCR检测结果显示,LPS刺激THP-1细胞60 min后,生理盐水+LPS组TNF-α和 IL-6水平增加(均P<0.01),表明体外脓毒症造模成功。
苏拉明组在LPS刺激60 min后THP-1细胞TNF-α和IL-6水平比生理盐水组降低(均P<0.01),见图3。表明苏拉明可抑制THP-1细胞炎症因子TNF-α和 IL-6的表达。

|
| 与生理盐水对照组比较,**P<0.01; 与生理盐水+LPS组比较,##P<0.01. 图3 各组THP-1细胞TNF-α和IL-6表达水平比较 Fig.3 The pro-inflammatory cytokine production in human mononuclear THP-1 cells |
蛋白质印迹法检测结果显示,与生理盐水组比较,苏拉明组LPS刺激30 min、60 min和90 min均可以抑制THP-1细胞NF-κB活化,主要表现为细胞浆P65水平增加,pP65和pIκB水平降低;细胞核P65及pP65水平降低,见图4。
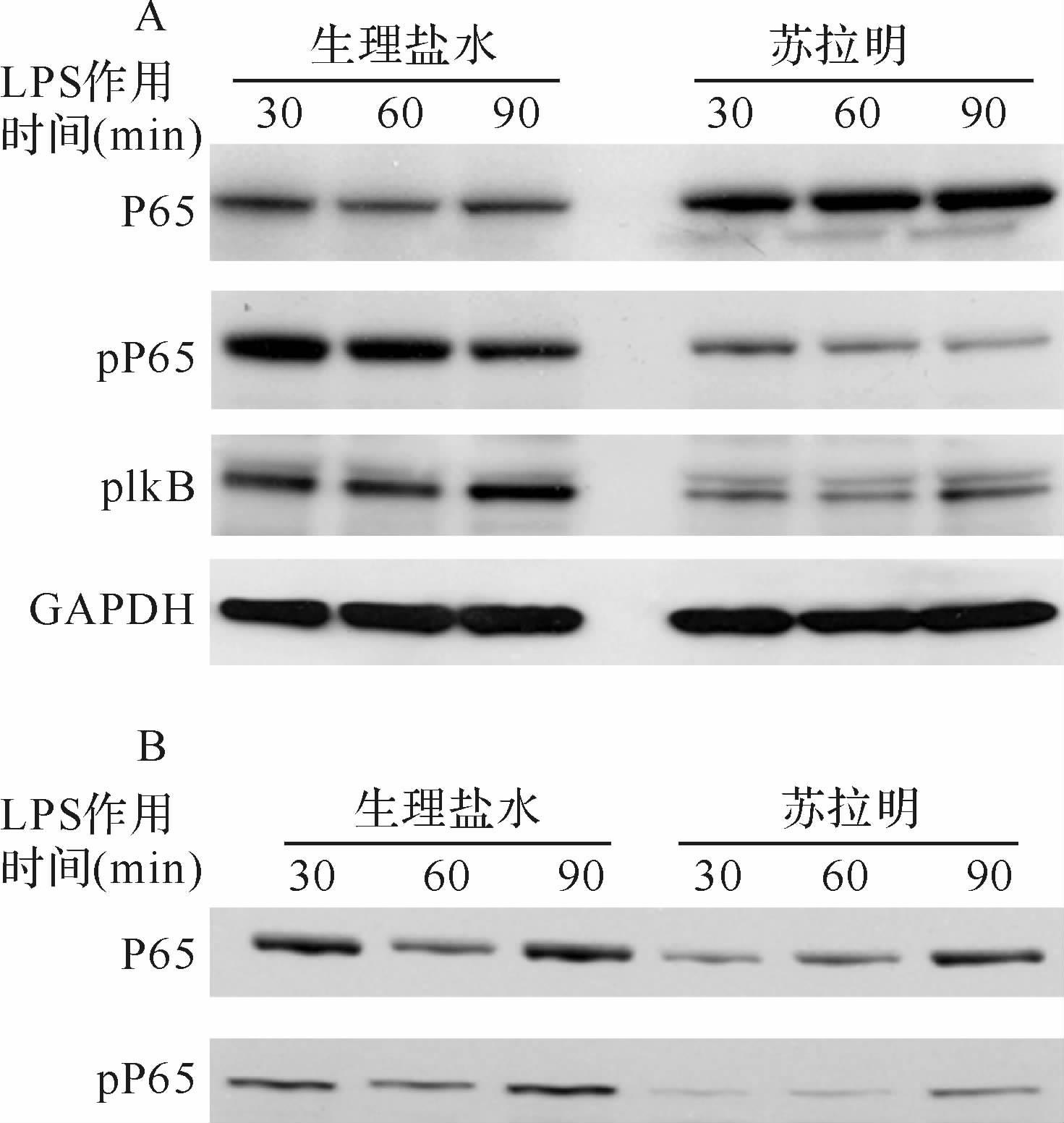
|
| A:蛋白质印迹法检测胞浆蛋白P65、pP65、pIκB,苏拉明组较生理盐水组胞浆P65增多,pP65、pIκB减少; B:蛋白质印迹法检测细胞核蛋白P65、pP65,苏拉明组较生理盐水组细胞核P65和pP65减少. 图4 苏拉明对单核细胞NF-κB活性的调节作用 Fig.4 The effect of suramin on NF-κB activity |
目前,静脉给予LPS是应用最广泛的脓毒症模型[15, 16]。本实验采用5 mg/kg LPS静脉注射建立脓毒症致急性肺损伤模型。实验结果表明,脓毒症建模24 h和72 h后,肺组织及外周血促炎因子TNF-α、IL-6表达较对照组显著增加,提示脓毒症模型建立成功。建模前苏拉明预处理可明显下调早期(建模后24 h)肺组织和外周血TNF-α、IL-6的水平,表明苏拉明对LPS诱导的脓毒症致急性肺损伤有保护作用。
NF-κB又称κ基因结合因子,是一组真核细胞转录因子,包括NF-κB 1(P50,前体P105)、NF-κB 2(P52,前体P100)、RelA(P65)、RelB(P68)和cRel(P75)五个亚单位,以同源或异源二聚体形式组成[17]。通常所说的NF-κB是P50/P65二聚体,发现最早且分布和作用最广[18]。在静息细胞中,大多数NF-κB与其抑制蛋白(IκB)以三聚体的形式存在于细胞质中,不具有转录活性。经典的NF-κB活化过程中,IκB因磷酸化降解,NF-κB与IκB解离并迅速移位到细胞核,进一步诱导多种促炎细胞因子如TNF-α、IL-6和NF-κB转录。目前研究表明,NF-κB的激活是脓毒症炎症反应的中枢性环节。因此,调控NF-κB活性对治疗脓毒症具有重要意义[19]。
单核巨噬细胞作为循环中最主要的固有免疫细胞,其免疫功能状态参与脓毒症早期病理生理改变[20]。在本研究中,采用人单核细胞系THP-1细胞探讨苏拉明抑制炎症作用的分子生物学机制,研究结果显示,苏拉明预处理THP-1细胞后,LPS刺激30 min、60 min和90 min细胞浆中P65水平增加,pP65和pIκB水平降低;同时胞核P65及pP65水平降低,提示苏拉明可能通过抑制IκB磷酸化减少P65向pP65的转化,从而抑制NF-κB的异常活化,减轻组织炎症因子的表达水平。
综上所述,苏拉明通过抑制单核细胞NF-κB过度活化,减少脓毒症小鼠促炎因子TNF-α和IL-6的表达,从而减轻全身及肺组织炎症反应,保护脓毒症小鼠肺功能。本研究为苏拉明在脓毒症致急性肺损伤的治疗应用提供了实验基础。
| [1] | SADOWITZ B, ROY S, GATTO L A, et al. Lung injury induced by sepsis:lessons learned from large animal models and future directones for treatment[J].Expert Rev Anti Infect Ther, 2011,9(12):1169-1178. |
| [2] | DUSHIANTHAN A, GROCOTT M P, POSTLE A D, et a1. Acute respiratory distress syndrome and acute lung injury[J]. Postgrad Med J, 2011,87(1031):612-622. |
| [3] | SMITH P D, SHIMAMURA M, MUSGROVE L C, et al. Cytomegalovirus enhances macrophage TLR expression and MyD88-mediated signal transduction to potentiate inducible inflammatory responses[J]. J Immunol, 2014,193(11):5604-5612. |
| [4] | JENKE A, WILK S, POLLER W, et al. Adiponectin protects against toll-like receptor 4-mediated cardiac inflammation and injury[J]. Cardiovasc Res, 2013,99(3):422-431. |
| [5] | MANTOVANI A, SICA A, SOZZANI S, et al. The chemokine system in diverse forms of macrophage activation and polarization[J]. Trends Immunol, 2004,25(12):677-686. |
| [6] | ZEMANS R L, COLGAN S P, DOWNEY G P. Transepithelial migration of neutrophils:mechanisms and implications for acute lung injury[J]. Am J Respir Cell Mol Biol, 2009,40(5):519-535. |
| [7] | MEDURI G U, ANNANE D, CHROUSOS G P, et al. Activation and regulation of systemic inflammation in ards:rationale for prolonged glucocorticoid therapy[J]. Chest, 2009,136(6):1631-1643. |
| [8] | SAPRU A, FLORI H, QUASNEY M W, et al. Pathobiology of acute respiratory distress syndrome[J]. Pediatr Crit Care Med, 2015,16(5 Suppl 1):S6-22. |
| [9] | SAHU D, SAROHA A, ROY S, et a1. Suramin ameliorates collagen induced arthritis[J]. Int Immunopharmacol, 2012,12(1):288-293. |
| [10] | LIU N, HE S, TOLBERT E, et al. Suramin alleviates glomerular injury and inflammation in the remnant kidney[J]. PLoS One, 2012,7(4):e36194. |
| [11] | LIU N, TOLBERT E, PONNUSAMY M, et a1. Delayed administration of suramin attenuates the progression of renal fibrosis in obstructive nephropathy[J]. J Pharmacol Exp Ther, 2011,338(3):758-766. |
| [12] | ZHUANG S, LU B, DAUBERT R A, et a1. Suramin promotes recovery from renal ischemia/reperfusion injury in mice[J]. Kidney Int, 2009,75(3):304-311. |
| [13] | LIU N, ZHUANG S. Tissue protective and anti-fibrotic actions of suramin:new uses of an old drug[J]. Curr Clin Pharmacol, 2011,6(2):137-142. |
| [14] | EICHHORST S T, KRUEGER A, MUERKOSTER S, et al. Suramin inhibits death receptor-induced apoptosis in vitro and fulminant apoptotic liver damage in mice[J]. Nat Med, 2004,10(6):602-609. |
| [15] | SKIRECKI T, KAWIAK J, MACHAJ E, et al. Early severe impairment of hematopoietic stem and progenitor cells from the bone marrow caused by CLP sepsis and endotoxemia in a humanized mice model[J]. Stem Cell Res Ther, 2015,6:142. |
| [16] | BURAS J A, HOLZMANN B,SITKOVSKY M. Animal models of sepsis:setting the stage[J].Nat Rev Drug Discov,2005,4(10):854-865. |
| [17] | DIAMANT G, DIKSTEIN R. Transcriptional control by NF-κB:elongation in focus[J]. Biochim Biophys Acta, 2013,1829(9):937-945. |
| [18] | NAPETSCHNIG J, WU H. Molecular basis of NF-κB signaling[J]. Annu Rev Biophys, 2013,42:443-468. |
| [19] | BAKER R G, HAYDEN M S, GHOSH S. NF-κB, inflammation, and metabolic disease[J]. Cell Metab, 2011,13(1):11-22. |
| [20] | 刘艳存,柴艳芬,姚咏明. 巨噬细胞在脓毒症发病机制中的作用研究进展[J]. 中国危重病急救医学, 2013,25(4):247-250. LIU Yan-cun, CAI Yan-fen, YAO Yong-ming. Advance in the roles of macrophages in the pathogenesis of sepsis research[J]. Chinese Critical Care Medicine, 2013,25(4):247-250.(in Chinese) |




