2. 浙江大学药学院药理系, 浙江杭州 310058;
3. 浙江中医药大学基础医学院, 浙江杭州 310053
2. Department of Pharmacology, College of Pharmaceutical Science, Zhejiang University, Hangzhou 310058, China;
3. College of Basic Medical Science, Zhejiang Chinese Medical University, Hangzhou 310053, China
癫痫是一种常见的慢性神经系统疾病,影响全世界超过0.5%~1.0%的人口健康。即使经过系统的药物治疗,仍有约30%的癫痫患者发作因不能完全控制而发展成为难治性癫痫[1]。目前,这些患者的治疗方案主要包括服用新型抗癫痫药物治疗和手术治疗,但效果并不理想。因此,迫切需要寻找能有效预防和治疗癫痫的新方法。
深部脑刺激作为一种新型抗癫痫治疗方法,已引起越来越多学者的关注。与癫痫手术比较,它具有可逆性和可调节性等优点[2]。一些研究表明,高频率电刺激能够通过发挥去同步化机制达到治疗癫痫的效果[3, 4, 5]。然而,长期的高频率电刺激可能会干扰刺激脑区的正常生理活动[6],或者造成组织损伤[7, 8]。最近,有文献报道用低频率电刺激(low-frequency stimulation,LFS)作用某些脑区能够抑制动物的癫痫发作。我们前期研究也发现,在大鼠电点燃癫痫模型中给予中央梨状皮质、小脑顶核、内嗅皮层和海马CA3区LFS都取得了显著的抗癫痫效果[9, 10, 11, 12]。
LFS抑制癫痫的机制尚不清楚,刺激模式是影响其作用的主要因素。临床研究中主要有开环刺激和闭环刺激两种模式。开环刺激是通过给予预定刺激缓慢地降低皮质兴奋性,而闭环刺激则是通过探测癫痫的发生并给予刺激以即时阻断癫痫发作。如何选择最佳的刺激模式,使其既发挥抗癫痫效果又能够减少长期反复刺激导致的不良影响是临床医师关注的问题。目前,关于LFS刺激模式的研究相对较少,甚至还存在一些相互矛盾的结果。Goodman等[13]曾报道在闭环模式下给予大鼠1 Hz的正弦波30 s可以延长癫痫大发作的潜伏时间。Weiss等[14]发现在完全点燃大鼠,持续给予开环模式的LFS 7 d可以抑制大鼠癫痫大发作。但我们前期研究发现在海马CA3区,每天1次预给LFS(即开环模式)对癫痫发作没有保护作用。然而,以上有限的研究数据多是针对完全点燃状态的大鼠,并且选择的刺激参数、刺激靶点及动物模型都有差异。本研究旨在探讨大鼠杏仁核电点燃癫痫的形成过程中,采用相同的刺激参数和靶点,选取不同刺激模式的LFS对其抗癫痫作用的影响,期望能为LFS应用于难治性癫痫的临床治疗提供参考。
1 材料与方法 1.1 实验动物Sprague-Dawley雄性大鼠为浙江大学医学院动物实验中心提供,证书号22-9601018。大鼠体质量220~300 g,清洁级为II级。动物饲养在可控温度的环境下,温度维持在21~23 ℃之间。给予饲养环境12 h明暗循环(光照时间09∶00至21∶00),自由饮食和饮水。每笼1只单独饲养。动物实验于09∶00~18∶00之间进行。实验遵循浙江大学实验动物中心的动物伦理学条例。
1.2 大鼠电点燃模型建立及行为学评估大鼠给予腹腔注射35 mg/kg戊巴比妥钠麻醉后,固定于脑固定台(SR-5,Narishinge,日本东京)上,根据大鼠脑图谱坐标[15],垂直将一根直径约0.125 mm的三叉电极插入大鼠右侧基底节旁杏仁核(从前囟算起,AP:-2.4 mm,L:-4.8 mm,V:-8.8 mm)。电极由三根包裹Teflon绝缘层的不锈铜丝(A.M.Systems Inc,美国)螺旋组成,两头间距0.5~1.0 mm,顶端保留约0.5 mm的无绝缘层段。用牙科水泥将电极固定于大鼠颅骨上,尾端连接微型插座。
术后大鼠休息10 d,然后采用恒流电刺激仪(SEN-7203,SS-202J,日本东京)进行电刺激,测定后放电阈值(afterdischarge threshold),脑电信号被信号放大器(Synamps RT,Neuroscan System,美国)采集并存储。刺激器刺激参数为60 Hz、1 ms脉冲的单相方波,持续1 s。刺激电流初始设定为50 μA,以后每次增加20 μA,直到脑电图上可引出后放电(图1)并持续至少5 s,两次刺激之间至少间隔30 min。此时得到的最小刺激电流被认定为该大鼠的后放电阈值,并被用作该大鼠每天的电点燃刺激(kindling,以下组别中用K表示给予电点燃刺激)电流值(100~300 μA)。实验中每天给予大鼠1次电点燃刺激,记录过程中行为学发作情况并测量脑电图上后放电持续时间。实验结束后统计大鼠电点燃癫痫形成过程中在每个发作等级停留的天数和到达各个发作等级所需的刺激天数。
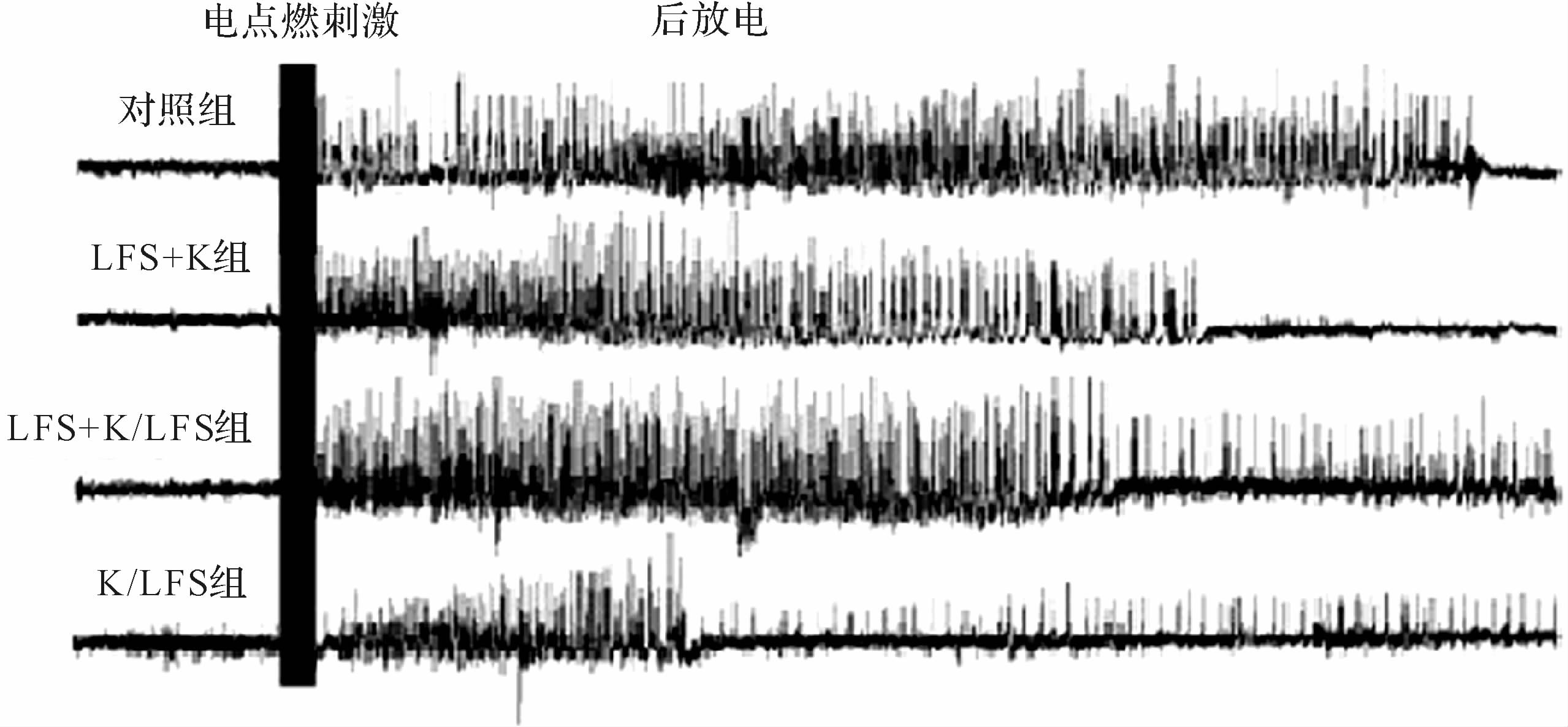
|
| 脑电图上频率异常的尖波代表后放电. 图1 杏仁核电点燃过程中各组大鼠的脑电图表现 Fig.1 The electroencephalogram of rats in amygdaloid-kindling acquisition |
癫痫发作的严重程度使用Racine[16]在1972年提出的标准判断。1级:面部抽动,咀嚼明显;2级:点头;3级:单侧前肢阵挛抬起;4级:双侧前肢阵挛和站立;5级:双侧前肢阵挛站立,以及失去平衡跌倒。癫痫级别中的1~3级表示复杂部分性癫痫(即癫痫形成早期),而4~5级则表示癫痫大发作。
1.3 分组及干预方法为研究开环刺激模式的LFS对大鼠后放电阈值的影响,将测得后放电阈值后的大鼠分为LFS组和对照组。干预方法:LFS组每天给予LFS(1 Hz,100 μA,单脉冲 0.1 ms)15 min;对照组只连接刺激器,不给予LFS。5 d后再次测两组后放电阈值。
为研究不同刺激模式的LFS对大鼠电点燃癫痫形成过程的影响,将大鼠分为 LFS+K组(开环模式组)、K/LFS组(闭环模式组)、LFS+K/LFS组(开环与闭环同时存在组)和对照组。干预方法:LFS+K组在第1~5天每天给予大鼠1次LFS 15 min ,第6~20天每天给予1次电点燃刺激。K/LFS组在第1~5天只连接刺激器,在第6~20天每天给予1次电点燃刺激,电点燃刺激后立即给予LFS 15 min。LFS+K/LFS组在第1~5天每天给予大鼠1次LFS 15 min ,第6~20天每天给予1次电点燃刺激,电点燃刺激后立即给予LFS 15 min。对照组在第1~5 天只连接刺激器,第6~20天每天给予1次电点燃刺激 。
为研究不同形式的闭环刺激模式LFS对大鼠电点燃癫痫形成过程的影响,将大鼠分为K/LFS全程组、K/LFS早期组和对照组。干预方法:K/LFS全程组第1~20天每天给予大鼠1次电点燃刺激,电点燃刺激后立即给予LFS 15 min。K/LFS早期组第1~5天每天给予1次电点燃刺激 ,电点燃刺激 后立即给予LFS 15 min,第6~20天每天给予1次电点燃刺激 。对照组第1~20天每天给予1次电点燃刺激。
1.4 统计学方法采用Windows SPSS 16.0统计软件进行分析。全部数据以均数±标准差(±s)表示。比较各组大鼠电点燃癫痫形成过程中癫痫发作等级、后放电持续时间的差异用两因素方差分析,比较后放电阈值的差异、癫痫发作在各等级停留天数及到达各等级所需的刺激天数的差异用非参数Mann-Whitney U检验。P<0.05时被认为差异具有统计学意义。
2 结 果 2.1 开环模式的LFS对大鼠后放电阈值的影响开环模式LFS作用第1天和第5天,LFS组与对照组后放电阈值差异均无统计学意义(P>0.05),提示开环刺激模式没有降低大鼠后放电阈值的作用,见图2。
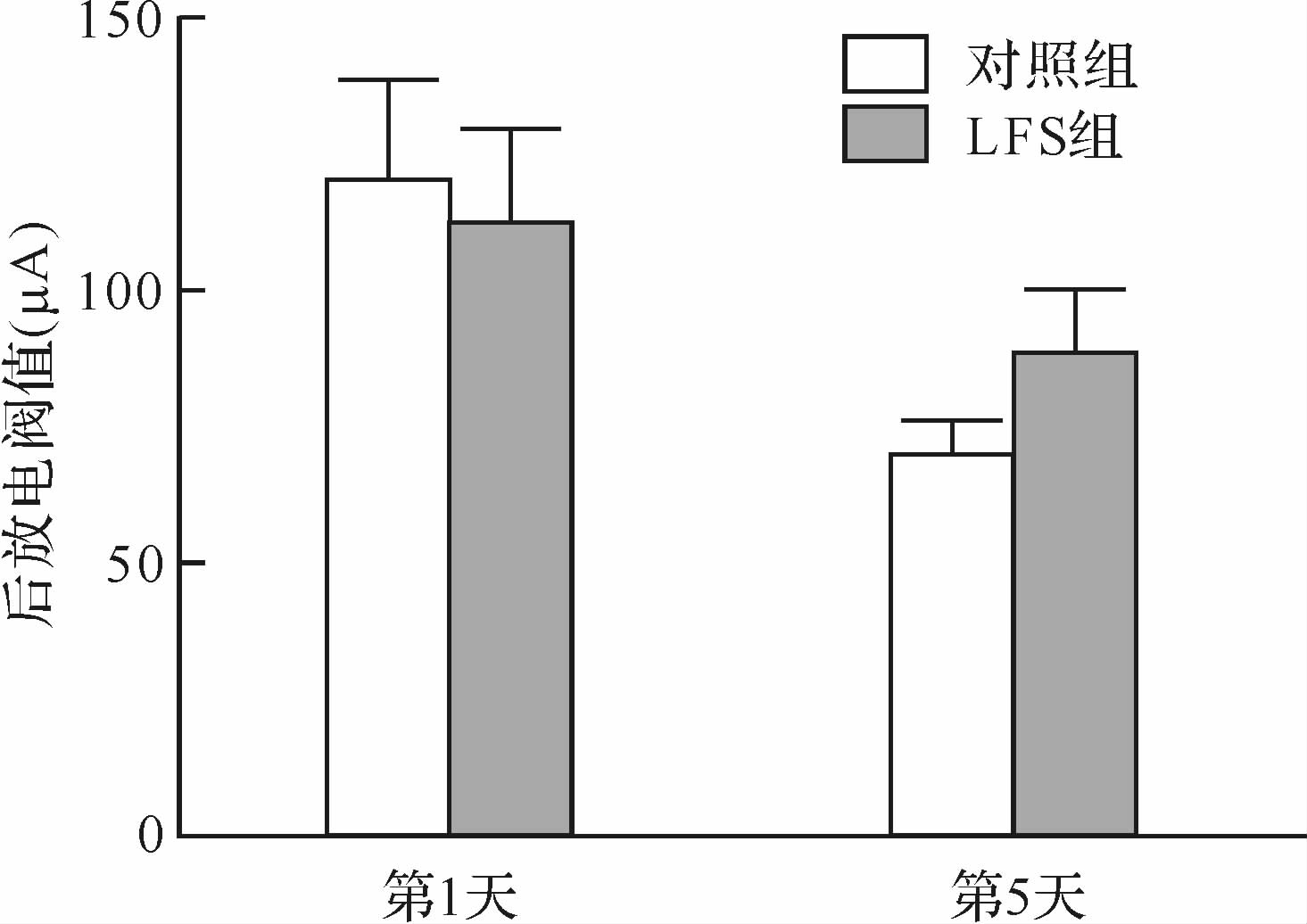
|
| 图2 开环刺激模式的LFS作用后大鼠后放电阈值的变化 Fig.2 Effect of open loop LFS at the kindling focus on ADT |
与对照组比较,K/LFS组能显著降低大鼠电点燃形成过程中的癫痫发作等级(P<0.01)及缩短后放电持续时间(P<0.05),而LFS+K组、LFS+K/LFS组没有抑制癫痫发作的效果,见图3、4。提示在大鼠杏仁核电点燃癫痫的形成过程中,闭环刺激模式能抑制癫痫发作,而开环刺激模式及开环模式与闭环模式并存时均不能降低癫痫发作的等级。
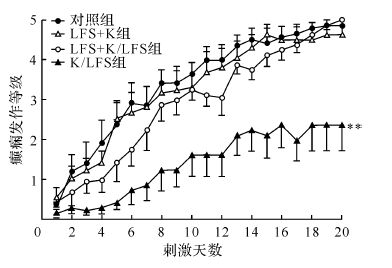
|
| 与对照组比较,**P<0.01. 图3 不同刺激模式的LFS作用后各组癫痫形成过程中癫痫发作等级的变化 Fig.3 Effects of LFS with different stimulation patterns at the kindling focus on behavioral stage in amygdaloid-kindling acquisition |
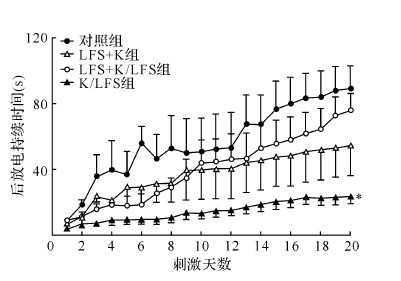
|
| 与对照组比较,*P<0.05. 图4 不同刺激模式的LFS作用后各组癫痫形成过程中后放电持续时间的变化 Fig.4 Effects of LFS with different stimulation patterns at the kindling focus on afterdischarge duration in amygdaloid-kindling acquisition |
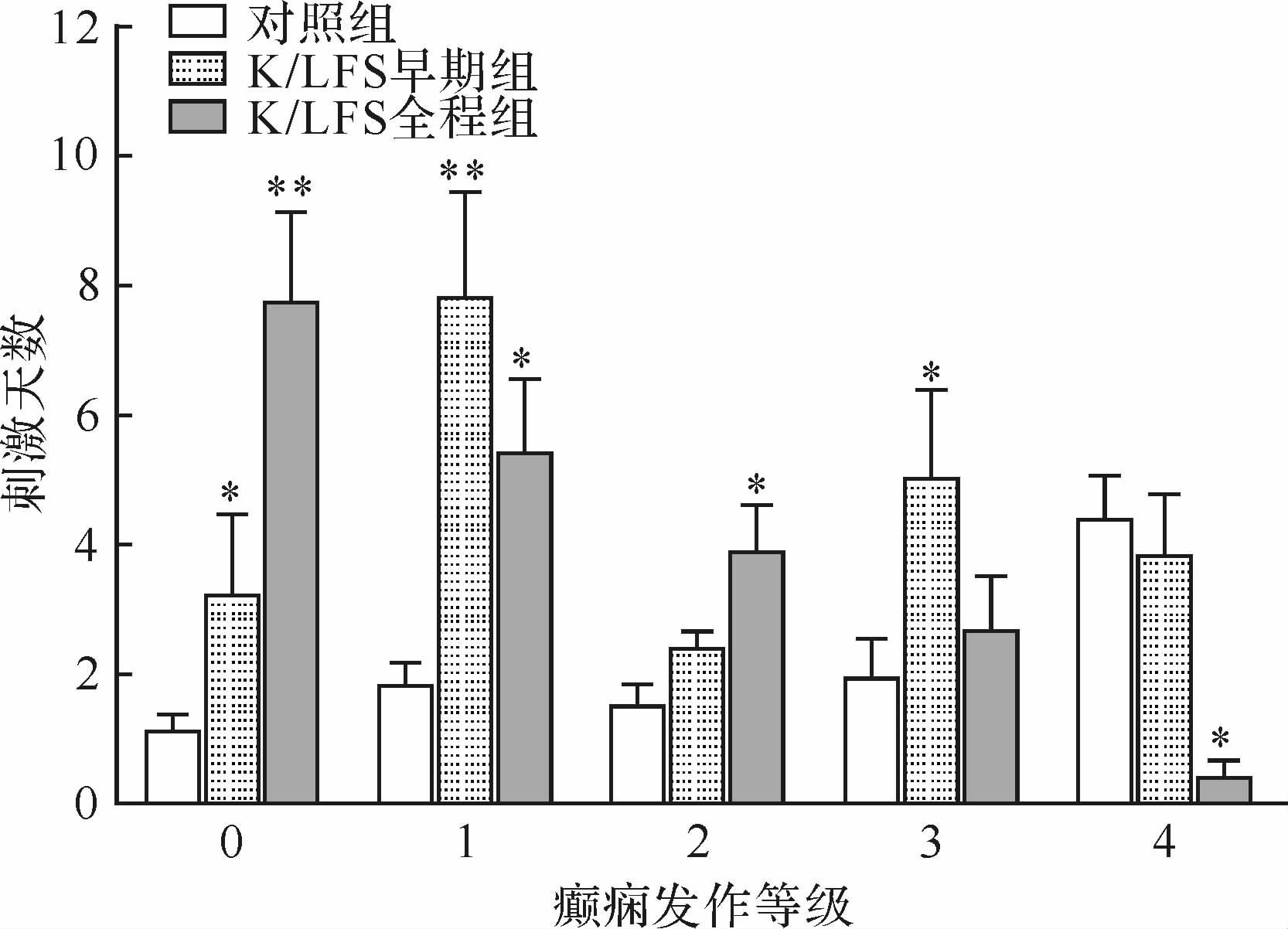
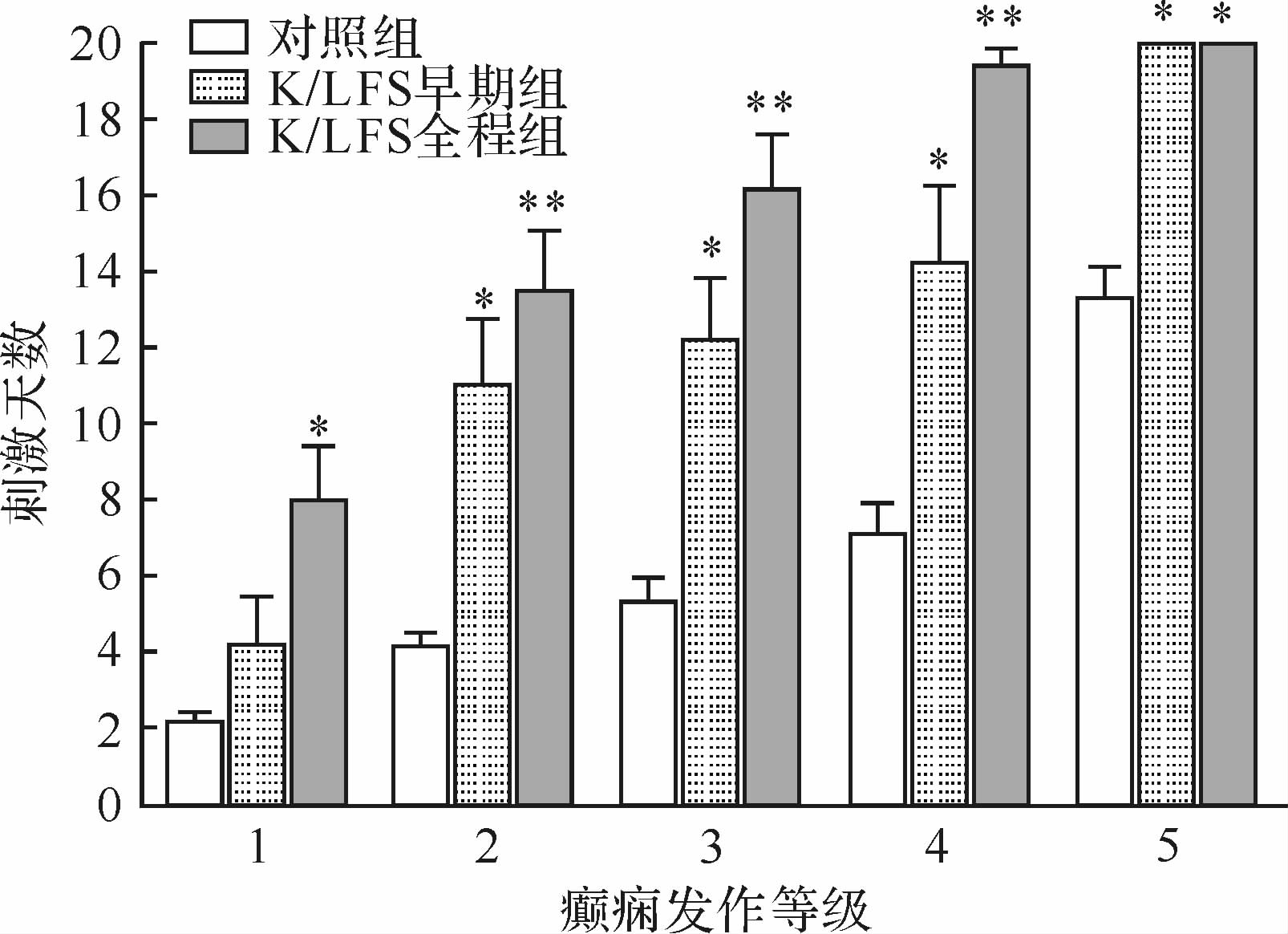
与对照组比较,闭环模式时K/LFS全程组大鼠电点燃形成过程中的癫痫发作等级降低(P<0.01,图5),后放电持续时间缩短(P<0.05,图6)。主要表现在大鼠癫痫发作停留在0~2级的天数增加(均P<0.05),停留在4级的天数减少(P<0.05),见图7;到达各个等级(1~5级)所需的刺激天数增多(均P<0.05),见图8。K/LFS早期组能降低电点燃癫痫形成过程中的癫痫发作等级(P<0.05,图5),主要表现在大鼠癫痫发作停留在0、1、3级的天数延长(均P<0.05,图7),到达2~5级的刺激天数增多(均P<0.05,图8)。提示闭环刺激模式的抗癫痫作用主要表现在对癫痫形成早期(癫痫发作处于1~3级)的抑制,在早期给予LFS即能获得抗癫痫效果。

|
| 与对照组比较,*P<0.05,**P<0.01. 图5 不同的闭环刺激模式LFS作用后各组癫痫形成过程中癫痫发作等级的变化 Fig.5 Effects of LFS with different closed loop stimulation patterns at the kindling focus on behavioral stage in amygdaloid-kindling acquisition |

|
| 与对照组比较,*P<0.05. 图6 不同的闭环刺激模式LFS作用后各组癫痫形成过程中后放电持续时间的变化 Fig.6 Effects of LFS with different closed loop stimulation patterns at the kindling focus on afterdischarge duration in amygdaloid-kindling acquisition |
|
| 与相对应癫痫发作等级的对照组比较,*P<0.05,**P<0.01. 图7 大鼠在各癫痫发作等级(0~4级)停留的刺激天数比较 Fig.7 Effects of LFS with different closed loop stimulation patterns at the kindling focus on the number of stimulations remains in each seizure stage (0~4) in amygdaloid-kindling acquisition |
|
| 与相对应癫痫发作等级的对照组比较,*P<0.05,**P<0.01. 图8 大鼠到达各癫痫发作等级(1~5级)所需刺激天数比较 Fig.8 Effects of LFS with different closed loop stimulation patterns at the kindling focus on the number of stimulations required to reach each seizure stage (1~5) in amygdaloid-kindling acquisition |
本研究发现在大鼠杏仁核电点燃癫痫模型中,闭环刺激模式的LFS能抑制癫痫发作,而开环刺激模式的LFS不能降低癫痫的发作等级。我们推测产生这种结果的原因可能与LFS对靶点脑区神经元突触的作用机制有关。目前普遍认为LFS抗癫痫的作用可能通过引起突触长时程抑制或去强化效应来对抗电点燃引起的长时程增强效应[14, 17],在缺乏电点燃刺激的情况下单独给予LFS可能无法发挥去强化效应以对抗电点燃引起的长时程增强。为进一步验证推测,我们设立了LFS+K/LFS组,这是开环模式与闭环模式并存的刺激模式,结果亦无抗癫痫效果。这表明LFS的开环模式对癫痫发作不仅没有保护作用,甚至还可能产生一种负性作用。虽然没有更多的数据来解释这一现象,但这可能与电刺激前后全脑电生理状态改变相关。有研究报道,在海马[18, 19]、小脑[20]、视皮质[21]及纹状体[22]等脑区,电刺激引起的持久性的突触强度变化取决于刺激的频率和持续时间。他们在双侧杏仁核脑片实验中发现,LFS(1 Hz,15 ms)在杏仁核引出的持久的突触改变主要取决于起始状态的突触活性,而不依赖于刺激频率[23]。我们认为在本实验中,电点燃刺激引起刺激靶点脑区神经元突触活性改变,从而改变大脑电生理状态,因此在伴有或不伴有电点燃刺激的情况下LFS产生了不同的作用。另一方面,在开环模式与闭环模式并存时,开环模式的LFS可能激活了脑内特定区域的神经元,引起特殊的神经递质释放和突触可塑性改变,使大脑兴奋性及抑制性网络的平衡破坏,影响闭环模式发挥抗癫痫作用。
另外,本实验中我们比较了开环刺激模式的LFS对大鼠后放电阈值的影响。后放电代表着癫痫活动的产生,后放电能够随着癫痫活动的增强逐渐扩散,它由原始的灶点逐步扩散到灶点外区域,再进一步播散至全脑,引起行为学上的全身性癫痫发作。在动物实验中,曾有文献报道海马或者杏仁核电点燃癫痫模型中给予LFS刺激癫痫灶点可以提高后放电阈值,并且能够持续到刺激结束后的5~12 d[24]。临床上使用的一些抗癫痫药物例如卡马西平或丙戊酸钠等,均能够提高动物的后放电阈值。然而,我们在本实验中发现LFS的开环刺激模式并没有提高大鼠后放电阈值的作用。虽然没有更多数据解释这一现象,但研究结果直接提示无法提高后放电阈值可能是影响开环刺激模式发挥抗癫痫作用的关键因素。
实验中我们还发现在闭环刺激模式时,即使只给予LFS 5 d,依然能显著降低大鼠癫痫形成过程中的癫痫发作等级,并且这种抑制作用主要表现为大鼠癫痫发作停留在0、1、3级的时间延长。在电点燃癫痫形成过程中1~3级代表癫痫部分性发作,这是灶点电点燃癫痫形成的早期,放电只局限于一侧大脑灶点附近,还未向全脑播散。我们的结果一方面提示闭环刺激模式的LFS在癫痫形成的早期即可产生抗癫痫作用(主要抑制部分性发作),另一方面也表明早期给予靶点LFS对干预癫痫形成过程的重要性。曾有报道指出,LFS的抗癫痫机制可能与诱导靶点神经元突触长时程减弱,逆转苔藓纤维突触和海马等神经元的长时程增强[25, 26]有关。另外LFS诱导的γ-氨基丁酸A型受体和μ受体亲和力的改变[27]、腺苷受体[28]和加兰肽[29]受体的激活等都可能参与了抑制突触传递,这些机制可能参与了早期癫痫形成。虽然我们没有更多的数据来解释这一现象,但本研究的结果提示在癫痫发病的早期给予LFS治疗即能产生显著的抗癫痫效果,这将为临床应用LFS时选择刺激时机提供参考,在癫痫治疗领域具有一定的临床价值。
综上所述,我们的研究结果表明LFS抗癫痫的作用存在模式依赖效应。另外,闭环模式下给予LFS的保护作用可能还存在着“早期现象”。因此提示在临床选择LFS治疗癫痫时,发病早期就给予LFS治疗可能效果更好,而当面临LFS刺激模式的选择时,需充分考虑刺激靶点、刺激参数等不同条件,对于开环模式的应用更需谨慎。
| [1] | KWAN P, BRODIE M J. Early identification of refractory epilepsy[J]. N Engl J Med, 2000,342(5):314-319. |
| [2] | GUBELLINI P, SALIN P, KERKERIAN-LE G L, et al. Deep brain stimulation in neurological diseases and experimental models:from molecule to complex behavior[J]. Prog Neurobiol, 2009,89(1):79-123. |
| [3] | KERRIGAN J F, LITT B, FISHER R S, et al. Electrical stimulation of the anterior nucleus of the thalamus for the treatment of intractable epilepsy[J]. Epilepsia, 2004,45(4):346-354. |
| [4] | VELASCO F, VELASCO M,JIMENEZ F, et al. Stimulation of the central median thalamic nucleus for epilepsy[J]. Stereotact Funct Neurosurg, 2001,77(1-4):228-232. |
| [5] | BENABID A L, MINOTTI L, KOUDSIE A, et al. Antiepileptic effect of high-frequency stimulation of the subthalamic nucleus(corpus luysi) in a case of medically intractable epilepsy caused by focal dysplasia:a 30-month follow-up:technical case report[J]. Neurosurgery, 2002,50(6):1385-1391. |
| [6] | FEDDERSEN B, VERCUEIL L, NOACHTAR S, et al. Controlling seizures is not controlling epilepsy:a parametric study of deep brain stimulation for epilepsy[J]. Neurobiol Dis, 2007,27(3):292-300. |
| [7] | GRILL W M, SNYDER A N, MIOCINOVIC S. Deep brain stimulation creates an informational lesion of the stimulated nucleus[J]. Neuroreport, 2004,15(7):1137-1140. |
| [8] | BURBAUD P, VITAL A, ROUGIER A, et al. Minimal tissue damage after stimulation of the motor thalamus in a case of chorea-acanthocytosis[J]. Neurology, 2002,59(12):1982-1984. |
| [9] | YANG L X, JIN C L, ZHU-GE Z B, et al. Unilateral low-frequency stimulation of central piriform cortex delays seizure development induced by amygdaloid kindling in rats[J]. Neuroscience, 2006,138(4):1089-1096. |
| [10] | WANG S, WU D C, DING M P, et al. Low frequency stimulation of cerebellar fastigial nucleus inhibits amygdaloid kindling acquisition in Sprague-Dawley rats[J]. Neurobiol Dis, 2008,29(1):52-58. |
| [11] | XU Z H, WU D C, FANG Q, et al. Therapeutic time window of low-frequency stimulation at entorhinal cortex for amygdaloid-kindling seizures in rats[J]. Epilepsia, 2010,51(9):1861-1864. |
| [12] | SUN H L, ZHANG S H, ZHONG K, et al. Mode-dependent effect of low-frequency stimulation targeting the hippocampal CA3 subfield on amygdala-kindled seizures in rats[J]. Epilepsy Res, 2010,90(1-2):83-90. |
| [13] | GOODMAN J H,BERGER R E,TCHENG T K. Preemptive low-frequency stimulation decreases the incidence of amygdala-kindled seizures[J]. Epilepsia, 2005,46(1):1-7. |
| [14] | WEISS S R, LI X L, ROSEN J B, et al. Quenching:inhibition of development and expression of amygdala kindled seizures with low frequency stimulation[J]. Neuroreport, 1995,6(16):2171-2176. |
| [15] | PAXINOS G, WATSON C. The rat brain in stereotaxic coordinates[M]. 3rd ed. New York:Academic Press,2004:73. |
| [16] | RACINE R J. Modification of seizure activity by electrical stimulation. II. Motor seizure[J]. Electroencephalogr Clin Neurophysiol, 1972,32(3):281-294. |
| [17] | VELASCO M, JIMENEZ F, VELASCO A L, et al. Centromedian nucleus stimulation for epilepsy clinical, electroencephalographic, and behavioral observations[J]. Thalamus & Related Systems, 2002,1(4):387-398. |
| [18] | MALENKA R C. Synaptic plasticity in the hippocampus:LTP and LTD[J]. Cell, 1994,78(4):535-538. |
| [19] | BEAR M F, ABRAHAM W C. Long-term depression in hippocampus[J]. Annu Rev Neurosci, 1996,19:437-462. |
| [20] | LINDEN D J, CONNOR J A. Long-term synaptic depression[J]. Annu Rev Neurosci, 1995,18:319-357. |
| [21] | ARTOLA A, BROCHER S, SINGER W. Different voltage-dependent thresholds for inducing long-term depression and long-term potentiation in slices of rat visual cortex[J]. Nature, 1990,347(6288):69-72. |
| [22] | CALABRESI P, PISANI A, CENTONZE D, et al. Synaptic plasticity and physiological interactions between dopamine and glutamate in the striatum[J]. Neurosci Biobehav Rev, 1997,21(4):519-523. |
| [23] | LI H,WEISS S R,CHUANG D M, et al. Bidirectional synaptic plasticity in the rat basolateral amygdala:characterization of an activity-dependent switch sensitive to the presynaptic metabotropic glutamate receptor antagonist 2S-alpha-ethylglutamic acid[J]. J Neurosci, 1998,18(5):1662-1670. |
| [24] | FEDDERSEN B, VERCUEIL L, NOACHTAR S, et al. Controlling seizures is not controlling epilepsy:a parametric study of deep brain stimulation for epilepsy[J]. Neurobiol Dis, 2007,27(3):292-300. |
| [25] | CHEN Y L, HUANG C C, HSU K S, et al. Time-dependent reversal of long-term potentiation by low-frequency stimulation at the hippocampal mossy fiber-CA3 synapses[J]. J Neurosci, 2001,21(11):3705-3714. |
| [26] | KOBAYASHI K, MANABE T, TAKAHASHI T, et al. Presynaptic long-term depression at the hippocampal mossy fiber-CA3 synapse[J]. Science, 1996,273(5275):648-650. |
| [27] | GHORBANI P, MOHAMMAD-ZADEH M, MIRNAJAFI-ZADEH J, et al. Effect of different patterns of low-frequency stimulation on piriform cortex kindled seizures[J]. Neurosci Lett, 2007,425(3):162-166. |
| [28] | SADEGH M, MIRNAJAFI-ZADEH J, JAVAN M, et al. The role of galanin receptors in anticonvulsant effects of low-frequency stimulation in perforant path-kindled rats[J]. Neuroscience, 2007,150(2):396-403. |
| [29] | MOHAMMAD-ZADEH M, MIRNAJAFI-ZADEH J, FATHOLLAHI Y, et al. The role of adenosine A(1) receptors in mediating the inhibitory effects of low frequency stimulation of perforant path on kindling acquisition in rats[J]. Neuroscience, 2009,158(4):1632-1643. |




