急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)是髓系细胞发育停止在早幼粒细胞阶段的一类急性髓系白血病。全反式维甲酸(all-trans retinoid acid,以下简称维甲酸)常规用于APL的治疗后,APL患者的预后有了显著改善,90%以上的患者可达完全缓解[1, 2]。但单用维甲酸后耐药问题也日益严重,特别是对一些缓解后复发的患者,维甲酸治疗无效。因此,探索对维甲酸耐药APL的治疗显得尤为重要。依维莫司(everolimus)是一种新型雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂,为雷帕霉素的衍生物,具有免疫抑制、抗肿瘤、抗病毒等多种作用[3]。联合新型药物治疗克服耐药问题以提高疗效是近些年关注的热点。前期研究提示,依维莫司联合维甲酸可增强维甲酸敏感细胞NB4的分化[4]。本研究主要通过观察依维莫司联合维甲酸对耐药细胞分化的影响以及相关蛋白的表达变化,旨在探讨依维莫司联合维甲酸对APL耐药作用的影响及相关机制。
1 材料与方法 1.1 细胞株APL耐药细胞珠NB4-R1细胞由上海瑞金医院血液病研究所赠送。
1.2 主要试剂维甲酸、6-氨基-3甲基嘌呤(3-methyladenine,3-MA)、硝基四唑氮蓝(nitroblue tetrozolium,NBT)购自美国Sigma公司;依维莫司为瑞士诺华公司惠赠;鼠抗人CD11b抗体购自美国Biolegend公司;微管结合蛋白轻链3(microtublule-associated protein light chain 3,LC3)、Beclin 1、早幼粒白血病—维甲酸受体融合蛋白(promyelocytic leukemia-retinoic acid receptor-α,PML-RARα)、β肌动蛋白(β-actin)、磷酸化的核糖体S6激酶(phosphorylation of ribosomal protein S6 kinase,P-P70S6K)、磷酸化的4E结合蛋白1(phosphorylation of 4E-binding protein 1,P-4EBP1)抗体购自美国Cell Signaling Technology公司;细胞周期试剂盒购自中国联科生物公司;Annexin V/碘化丙啶(PI)细胞凋亡试剂盒购自美国BD Pharmingin 公司。
1.3 细胞培养NB4-R1细胞采用含10% FBS的RPMI 1640培养基在5%二氧化碳、37 ℃的培养箱中培养。维持适宜的细胞密度以保证细胞处于最佳生长状态,取对数期细胞用于实验。
1.4 流式细胞术和NBT还原实验检测细胞分化 1.4.1 CD11b检测细胞以1×105接种于六孔板培养,经1 μmol/L维甲酸(维甲酸组)、不同浓度(1 nmol/L、 10 nmol/L和100 nmol/L)的依维莫司(依维莫司组)和1 μmol/L维甲酸联合(联用组)处理,对照组细胞不作任何处理,收集处理后细胞和对照组细胞,取细胞1×106个,预冷PBS洗涤2次,4 ℃ 300×g 离心6 min,弃上清液,50 μL PBS重悬细胞,加5 μL PE-CD11b抗体,4 ℃避光孵育30 min,PBS洗涤2次,500 μL PBS重悬细胞,用流式细胞仪检测CD11b阳性细胞,FlowJo软件分析结果。
1.4.2 NBT还原实验收集细胞,PBS洗涤2次,以5×105接种于平底96孔板,每孔100 μL,加入等体积的含1 mg/mL NBT和1 μg/mL TPA的RPMI 1640培养基,37 ℃温育30 min,光学显微镜下观察细胞质内有紫蓝色沉积物的细胞为阳性细胞,随机计数200个细胞,计算NBT还原阳性率。
1.5 流式细胞术检测细胞凋亡细胞凋亡检测采用Annexin V/PI凋亡试剂盒。收集细胞,预冷PBS洗涤2次,4 ℃ 300×g离心6 min,弃上清液,100 μL 1×结合缓冲液重悬细胞,加5 μL FITC Annexin V和5 μL PI,混匀,室温避光孵育15 min,加400 μL 1×结合缓冲液,用流式细胞仪检测,FlowJo软件分析结果。
1.6 流式细胞术检测细胞周期细胞周期检测采用细胞周期试剂盒。收集细胞,预冷PBS洗涤2次,弃上清液,加1 mL预冷PBS,边振荡边加3 mL预冷无水乙醇,最后吹打,-20 ℃保存。300×g 离心6 min 弃上清液,加2~5 mL PBS室温水化15 min,300×g离心6 min弃上清液,加500 μL PI/RNAase,涡旋5~10 s,室温孵育30 min,用流式细胞仪检测。
1.7 蛋白质印迹法检测自噬相关蛋白收集1×106细胞,预冷PBS洗涤2次,4 ℃ 300×g离心6 min,弃上清液,加入100 μL SDS裂解液,反复吹打,冰上裂解1 h,4 ℃ 12 000×g离心10 min 取上清液,BCA法测蛋白质浓度,100 ℃变性10 min,-20 ℃保存。取100 μg蛋白质经10%或12% SDS-PAGE电泳分离后,转移至硝酸纤维素膜上,5%脱脂奶粉摇床封闭1 h,然后分别加LC3、PML-RARα、β-actin、P-P70S6K、P-4E-BP1抗体,4 ℃过夜,洗膜,加荧光二抗,室温孵育1 h,洗膜,曝光显影。
1.8 统计学方法采用SPSS 21.0 统计软件进行数据分析。数据以均数±标准差(x±s)表示,多组均数的比较采用单因素方差分析,多组均数间的多重比较采用q检验。以P<0.05表示差异具有统计学意义。
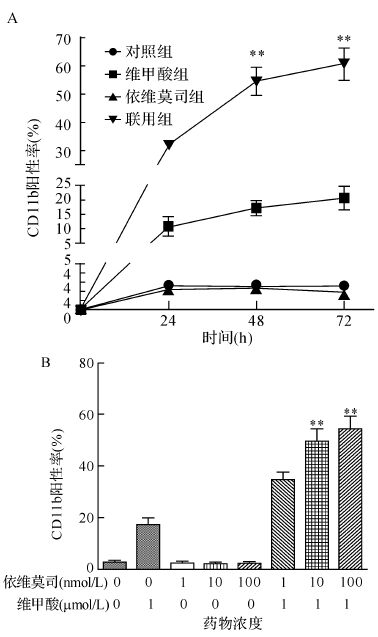
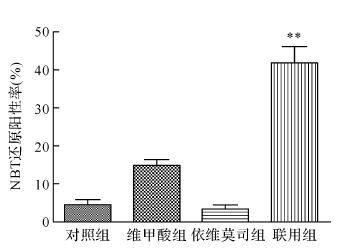
2 结 果 2.1 依维莫司联合维甲酸诱导NB4-R1细胞分化用1 nmol/L、10 nmol/L、100 nmol/L的依维莫司和1 μmol/L的维甲酸分别或联合处理NB4-R1细胞株24 h、48 h、72 h后,联用组NB4-R1细胞CD11b阳性率增加,见图1A。依维莫司组、维甲酸组、联用组、对照组处理NB4-R1细胞48 h后CD11b阳性率分别为(2.29±0.57)%、(17.06±2.65)%、(54.47±4.91)%、(2.54±0.53)%,见图1B。联用组CD11b阳性率较维甲酸组和对照组升高(均P<0.01)。为进一步验证上述细胞的分化情况,用1 nmol/L、10 nmol/L、100 nmol/L依维莫司和1 μmol/L维甲酸分别或联合处理NB4-R1细胞48 h后,NBT还原实验检测细胞的分化,依维莫司组、 维甲酸组、联用组和对照组细胞NBT还原阳性率分别为(3.33±1.04)%、(14.83±1.53)%、(41.83±4.25)%、(4.50±1.32)%,结果显示联用组相对于各单用依维莫司和维甲酸者NBT还原阳性率增加(均P<0.01),见图2。提示单用依维莫司或维甲酸并不能有效引起NB4-R1细胞的分化,而联合用药能够诱导NB4-R1细胞分化,逆转NB4-R1细胞的耐药。
|
| A:100 nmol/L依维莫司和1 μmol/L维甲酸分别或联合处理NB4-R1细胞24 h、48 h、72 h后CD11b阳性率变化;B:1 nmol/L、10 nmol/L、100 nmol/L依维莫司和1 μmol/L维甲酸分别或联合处理NB4-R1细胞48 h后CD11b阳性率变化.与维甲酸组比较,**P<0.01. 图1 维甲酸单用及联用依维莫司后各组NB4-R1细胞CD11b阳性率比较 Fig.1 Differentiation in NB4-R1 cells after treatment of ATRA and/or everolimus |
|
| 与维甲酸组比较,**P<0.01. 图2 维甲酸、依维莫司单用及联用48 h对NB4-R1细胞NBT还原阳性率的影响 Fig.2 Differentiation in NB4-R1 cells after treatment of ATRA and/or everolimus for 48 h |
用100 nmol/L 依维莫司和1 μmol/L 维甲酸分别或联合处理NB4-R1细胞48 h后,依维莫司组、维甲酸组、联用组和对照组处于G1期的细胞百分率分别为(35.20±11.97)%、(33.54±6.25)%、(53.70±8.73)%和(27.40±6.01)%;处于S期的细胞百分率分别为(53.74±11.16)%、(54.92±7.16)%、(35.75±8.77)%和(59.47±11.89)%。结果显示,与依维莫司组和维甲酸组比较,联用组G1期细胞增多,而S期细胞减少(均P>0.05)。提示100 nmol/L 依维莫司与1 μmol/L 维甲酸联用可将NB4-R1细胞增殖阻止在G1期。
2.3 依维莫司联用维甲酸对NB4-R1细胞凋亡的影响同上述处理细胞后,依维莫司组、维甲酸组、联用组和对照组凋亡细胞百分率分别为(2.30±0.14)%、(2.25±0.21)%、(2.40±0.28)%和(1.95±0.07)%,差异无统计学意义(P>0.05)。提示无论是单药还是联用,NB4-R1细胞都有95%以上Annexin V和 PI双阴性,所以联合用药并不影响细胞的凋亡。
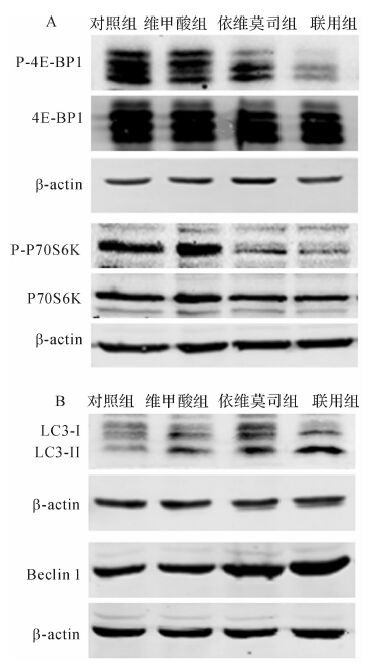
2.4 依维莫司联合维甲酸抑制mTOR通路诱导NB4-R1细胞发生自噬依维莫司作为一种新型的mTOR通路抑制剂,通过蛋白质印迹法证实依维莫司联合维甲酸可抑制mTOR的底物P70S6K、4E-BP1磷酸化,见图3A。抑制PI3K/AKT/mTOR信号通路是诱导细胞产生自噬现象最为主要的途径之一,100 nmol/L依维莫司和1 μmol/L维甲酸联合处理48 h后,NB4-R1细胞LC3-II和Beclin 1蛋白表达明显增加,见图3B。结果提示依维莫司联合维甲酸能够诱导NB4-R1细胞发生自噬。
|
| 图3 维甲酸单用及联用依维莫司作用NB4-R1细胞48 h对P-4E-BP1、P-P70S6K、 LC3-II和Beclin 1蛋白表达的影响 Fig.3 Expression of P-4E-BP1,P-P70S6K,LC3-II and Beclin 1 protein in NB4-R1 cells after treatment of ATRA and/or everolimus for 48 h |
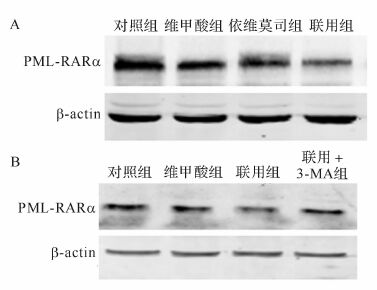
同上述处理细胞后,联用组能部分降解APL关键致病蛋白PML-RARα融合蛋白,见图4A。在联用基础上加入10 mmol/L的自噬抑制剂3-MA处理NB4-R1细胞48 h后发现PML-RARα融合蛋白的表达水平比联用组有所升高,见图4B。提示抑制自噬可以逆转联合用药对PML-RARα融合蛋白的降解作用。
|
| 图4 维甲酸联用依维莫司以及加3-MA后作用NB4-R1细胞48 h对PML-RARα蛋白表达的影响 Fig.4 Expression of PML-RARα protein in NB4-R1 cells after treatment of ATRA combined with everolimus and/or additional treatment of 3-MA for 48 h |
加用自噬抑制剂后细胞CD11b表达明显下降,100 nmol/L 依维莫司组、1 μmol/L 维甲酸组、联用组、对照组和联用加10 mmol/L 3-MA组细胞CD11b阳性率分别为(2.96±0.86)%、(18.60±1.84)%、(49.20±4.67)%、(4.42±0.93)%和(16.10±0.42)%,加用3-MA 的细胞CD11b阳性率较联用组降低(均P<0.01)。同样NBT实验也证实了加用3-MA后NBT还原阳性率下降(均P<0.01),同上述分组的各组NBT还原阳性率分别为(3.33±1.04)%、(14.83±1.53)%、(41.83±4.25)%、(4.50±1.32)%和(19.33±2.84)%。
以上结果提示依维莫司联合维甲酸通过诱导NB4-R1细胞发生自噬从而降解PML-RARα融合蛋白参与诱导NB4-R1的分化,逆转细胞耐药。
3 讨 论APL作为一种急性髓系白血病的特殊类型,具备特有的细胞形态和分子生物学特征,在治疗前和治疗早期有严重的出血风险,常伴有弥散性血管内凝血。但自从维甲酸用于APL的常规治疗后,APL患者的预后大为改观[1, 2]。然而,单用维甲酸治疗后耐药问题随之而来,特别是对部分复发患者,单用维甲酸治疗无效。因此,寻找新的治疗药物或治疗方案显得尤为重要,联合用药的方案被认为是预防和克服疾病耐药问题的一种非常有效的手段[5]。
依维莫司是一种新型mTOR抑制剂,有免疫抑制、抗肿瘤、抗病毒、血管保护等多种作用[3]。多项研究和临床试验显示,依维莫司对白血病、淋巴瘤等血液系统肿瘤有很好的治疗效果,且依维莫司具有良好的口服耐受性和生物利用度[6, 7, 8, 9]。相关研究表明,依维莫司能增强维甲酸诱导敏感细胞NB4的分化[10]。那么依维莫司联合维甲酸是否能诱导NB4-R1细胞的分化,从而实现逆转APL的耐药?本文研究发现,依维莫司联合维甲酸可以诱导NB4-R1细胞的分化,而单独使用依维莫司和维甲酸均无此作用。联合用药可抑制细胞周期但并不影响细胞的活性。这些研究表明,依维莫司联合维甲酸可逆转NB4-R1的耐药,这为治疗耐药APL提供了一种新的途径。
有95%以上的APL患者存在由15号染色体与17号染色体互相易位形成的PML-RARα融合基因,该融合基因可以抑制转录激活因子或募集转录抑制因子,抑制与分化发育有关的基因表达,同时其编码所形成的PML-RARα融合蛋白具有抑制早幼粒细胞向成熟粒细胞分化的过程的作用,从而介导了APL的发生。因此PML-RARα融合基因成了APL的标志性靶基因,也是治疗的关键靶点。维甲酸主要通过降解PML-RARα融合蛋白来诱导APL 的缓解。目前研究表明,维甲酸作用PML-RARα融合蛋白主要通过泛素—蛋白酶体途径和半胱天冬酶途径[11, 12],而维甲酸的广泛应用带来的耐药问题中发现无论哪条途径都不能彻底有效地降解PML-RARα融合蛋白,提示可能存在其他途径参与降解该融合蛋白。自噬是真核细胞内进化保守的生物现象,主要通过双层膜结构包裹细胞内异常损坏的细胞器或蛋白质等生物大分子形成自噬体,与细胞内的溶酶体结合形成自噬溶酶体,降解所包裹的内容物,以此达到细胞本身代谢需求和一些细胞器的更新,在维持细胞稳态中发挥重要的作用[13, 14]。在降解蛋白质的过程中相对于泛素蛋白酶体途径自噬作用更有利于降解易形成聚合物的蛋白质,而PML-RARα融合蛋白具有形成聚合物的倾向,正是自噬作用的理想降解底物。Isakson等[15]研究报道自噬作用可以降解PML-RARα蛋白,并且Wang等[16]发现这一过程可能是通过p62/SQSTM1介导实现的。抑制mTOR信号通路是诱导自噬作用的重要途径,本文研究发现,依维莫司联合维甲酸可抑制mTOR底物4E-BP1和P70S6K的磷酸化,联合用药后NB4-R1自噬作用明显增强且能部分降解PML-RARα融合蛋白;而抑制自噬作用后,细胞分化水平明显下降,同时对PML-RARα融合蛋白的降解作用也减弱,说明自噬是逆转NB4-R1细胞耐药的关键因素。这为临床上两药联用提供了理论依据。然而联合用药的具体分子机制如何?在患者体内原代耐药细胞上的作用效果又如何?这些均需进一步研究。
| [1] | HUANG M E, YE Y C, CHEN S R, et al. Use of all-trans retinoic acid in the treatment of acute promyelocytic leukemia[J]. Haematol Blood Transfus, 1989,32:88-96. |
| [2] | GE D Z, SHENG Y, CAI X. Combined staurosporine and retinoic acid induces differentiation in retinoic acid resistant acute promyelocytic leukemia cell lines[J]. Sci Rep, 2014,4:4821. |
| [3] | POWELL J D, POLLIZZI K N, HEIKAMP E B, et al. Regulation of immune responses by mTOR[J]. Annu Rev Immunol, 2012,30:39-68. |
| [4] | NISHIOKA C, IKEZOE T, YANG J, et al. Inhibition of mammalian target of rapamycin signaling potentiates the effects of all-trans retinoic acid to induce growth arrest and differentiation of human acute myelogenous leukemia cells[J]. Int J Cancer, 2009,125(7):1710-1720. |
| [5] | WITCHER M, SHIU H Y, GUO Q, et al. Combination of retinoic acid and tumor necrosis factor overcomes the maturation block in a variety of retinoic acid-resistant acute promyelocytic leukemia cells[J]. Blood, 2004,104(10):3335-3342. |
| [6] | NERI L M, CANI A, MARTELLI A M, et al. Targeting the PI3K/Akt/mTOR signaling pathway in B-precursor acute lymphoblastic leukemia and its therapeutic potential[J]. Leukemia, 2014,28(4):739-748. |
| [7] | RENNER C, ZINZANI P L, GRESSIN R, et al. A multicenter phase II trial(SAKK 36/06) of single-agent everolimus(RAD001) in patients with relapsed or refractory mantle cell lymphoma[J]. Haematologica, 2012,97(7):1085-1091. |
| [8] | WITZIG T E, REEDER C B, LAPLANT B R, et al. A phase II trial of the oral mTOR inhibitor everolimus in relapsed aggressive lymphoma[J]. Leukemia, 2011,25(2):341-347. |
| [9] | YEE K W, ZENG Z, KONOPLEVA M, et al. Phase I/II study of the mammalian target of rapamycin inhibitor everolimus(RAD001) in patients with relapsed or refractory hematologic malignancies[J]. Clin Cancer Res, 2006,12(17):5165-5173. |
| [10] | NISHIOKA C, IKEZOE T, YANG J, et al. Blockade of mTOR signaling potentiates the ability of histone deacetylase inhibitor to induce growth arrest and differentiation of acute myelogenous leukemia cells[J]. Leukemia, 2008,22(12):2159-2168. |
| [11] | ZHANG X W, YAN X J, ZHOU Z R, et al. Arsenic trioxide controls the fate of the PML-RARalpha oncoprotein by directly binding PML[J]. Science, 2010,328(5975):240-243. |
| [12] | NSR R, GUILLEMIN M C, FERHI O, et al. Eradication of acute promyelocytic leukemia-initiating cells through PML-RARA degradation[J]. Nat Med, 2008,14(12):1333-1342. |
| [13] | LOOS B, ENGELBRECHT A M, LOCKSHIN R A,et al. The variability of autophagy and cell death susceptibility:unanswered questions[J]. Autophagy, 2013,9(9):1270-1285. |
| [14] | YANG Z, KLIONSKY D J. Eaten alive:a history of macroautophagy[J]. Nat Cell Biol, 2010,12(9):814-822. |
| [15] | ISAKSON P, BJORAS M, BOE S O, et al. Autophagy contributes to therapy-induced degradation of the PML/RARA oncoprotein[J]. Blood, 2010,116(13):2324-2331. |
| [16] | WANG Z, CAO L, KANG R, et al. Autophagy regulates myeloid cell differentiation by p62/SQSTM1-mediated degradation of PML-RARalpha oncoprotein[J]. Autophagy, 2011,7(4):401-411. |




