2. 蚌埠医学院第一附属医院病理科, 安徽蚌埠 233004
2. Department of Pathology, the First Affiliated Hospital of Bengbu Medical College, Bengbu 233004, China
肝癌是临床最常见的恶性肿瘤之一,其中约90%为肝细胞癌(hepatocellular carcinoma,HCC)。在全球癌症发病率中,HCC居于第六位,病死率却高居第三位[1]。我国是全球HCC发病和死亡人数最多的国家,均占全球的50%以上,且有其自身特点[2]>。尽管近年来在肝癌治疗上有了许多突破,但HCC患者预后仍然很差。目前HCC的发病机制仍不十分清楚。在肝癌与非癌肝组织(正常与良性肿瘤组织)中鉴别特异性上调或下调基因,并比较其特征,将有利于了解HCC发生的分子生物学改变,并可能产生新的诊断标志物。
细胞缝隙连接(gap junction)是位于两个相邻细胞之间的一种蛋白质连接通道,其主要功能是直接介导相邻细胞之间的信号转导,从而对细胞的新陈代谢、内环境稳定、增殖和分化等生理过程起重要的调控作用。缝隙连接由特殊的通道蛋白——缝隙连接蛋白(connexin,Cx)组成。在肝脏组织中,Cx26和Cx32是组成其缝隙连接的主要组分[3]。有研究报道,在人类肝癌组织中Cx32表达下调,并可观察到其定位存在异常[4, 5]。Cx32蛋白表达的下调及定位的异常和由此产生的信号传导通路的紊乱将导致相邻细胞间缝隙连接的异常,这可能是导致HCC发生的重要机制之一[6]。不同Cx组成的通道及所传递的细胞信号不尽相同[7],Cx26与HCC发生发展之间的关系目前不得而知。为此,我们应用免疫组织化学染色法检测了76份HCC及83份非癌肝组织中Cx26的表达和定位。由于组织学样本上缝隙连接功能检测方法学的缺陷,我们在体外使用同种族来源的人正常肝细胞株LO2和肝癌细胞株SMMC-7721进行研究,以进一步证实肝细胞癌变后Cx26及其组成缝隙连接的功能状态。本研究将为揭示HCC发生发展的病理生理过程和探索新的治疗靶点提供参考依据。
1 材料与方法 1.1 材料来源收集蚌埠医学院第一附属医院2008年1月至2013年12月经手术切除的HCC组织标本76份。患者术前均未进行任何治疗,且有完整临床资料,按Edmondson-Steiner病理分级标准I~Ⅱ级48例,Ⅲ~Ⅳ级28例,其中男性61例,女性15例;年龄22~76岁,中位年龄50岁。同期收集肝硬化组织标本33份,患者男性23例,女性10例;年龄20~77岁,中位年龄47岁。慢性肝炎组织标本30份,患者男性21例,女性9例;年龄18~49岁,中位年龄33.5岁,均来源于我院活组织病理检查标本。外伤性肝切除患者正常肝组织20份,其中男性11例,女性9例;年龄21~73岁,中位年龄54.5岁。人正常肝细胞株LO2购自南京凯基生物科技发展有限公司;人肝癌细胞株SMMC-7721购自上海中国科学院细胞库。
1.2 主要试剂Cx26单克隆抗体、4,6-二脒基-2-苯基吲哚(DAPI)、钙黄绿素及DiI-CM购于美国Invitrogen公司;辣根过氧化物酶(HRP)及异硫氰酸荧光素 (FITC)标记的二抗购自英国Amersham公司;ECL-plus化学发光试剂盒购自美国Millipore公司;SP试剂盒购自中国福州迈新生物技术开发公司。
1.3 细胞培养及标本制备细胞均培养于含10% FBS和1%青链霉素的DMEM培养液中,并置于37 ℃、含5%二氧化碳及饱和湿度的细胞培养箱中培养。组织样本均经10%甲醛溶液固定,常规石蜡包埋。病理切片厚度4 μm,每个样本连续切片2张,分别用于HE染色和Cx26免疫组织化学染色。
1.4 免疫组织化学SP法检测肝组织中Cx26蛋白的表达159份石蜡切片脱蜡水化,置于柠檬酸缓冲液(pH值为6.0)中电炉上加热进行抗原修复,然后进行免疫组织化学SP法染色。具体步骤严格按照试剂盒说明书进行。用PBS代替一抗作为阴性对照。光学显微镜下观察Cx26染色情况及细胞定位。免疫组织化学染色结果判断:Cx26阳性定位于细胞质或细胞膜。细胞内出现棕黄色颗粒为阳性细胞。每张切片在高倍镜视野下计数500个肝细胞,阳性细胞<5%为阴性(-),5%~25%为阳性(+),26%~50%为阳性(++),>50%为阳性(+++)。Cx26蛋白离开细胞膜出现细胞质定位定义为内化(internalization)[4],内化率(%)=蛋白发生内化的样本数/蛋白表达阳性样本总数×100%。
1.5 蛋白质印迹法检测Cx26蛋白表达收集对数生长期的LO2和SMMC-7721细胞,冰上裂解,提取细胞全蛋白后以12 000×g 4 ℃离心30 min,取上清液。制作蛋白标准曲线后测定样品蛋白实际浓度。每孔取50 μg蛋白,加上样缓冲液,在约90 ℃水浴变性后进行SDS-PAGE电泳。电泳完毕后,电转印至PVDF膜上。用脱脂奶粉室温封闭2 h,加入Cx26单克隆抗体(1∶1000),β-actin作为内参照,置摇床4 ℃振荡过夜。洗膜后加入HRP标记的羊抗小鼠二抗(1∶2000),室温振摇2 h;洗膜后用ECL-plus试剂盒化学发光,X 胶片显影。
1.6 免疫荧光细胞化学法检测Cx26蛋白定位收集对数生长期的细胞爬片,4%多聚甲醛室温下固定30 min,滴加Cx26抗体(工作浓度1∶200,以2% 牛血清白蛋白稀释),室温下孵育3 h,PBS轻柔冲洗3次,加入FITC标记的羊抗小鼠二抗(工作浓度1∶200,以2% 牛血清白蛋白稀释),室温下避光孵育2 h,PBS轻柔冲洗3次。加DAPI染色5 min,PBS轻柔冲洗3次,95%甘油封片剂封闭,倒置荧光显微镜下观察。
1.7 细胞接种荧光示踪法测定细胞间缝隙连接功能[8, 9]细胞接种至6孔板,生长至80%~85%融合。取10 μL 25 μmol/L 钙黄绿素和50 μmol/L CM-DiI,加入1 mL无血清培养基混匀。在培养板中一孔加入上述荧光负载液体1 mL,置于5% 二氧化碳、37 ℃培养箱中培养30 min,使荧光指示剂进入细胞。吸去负载液,PBS冲洗3次,每次1 min。用胰酶消化,加入无血清培养基中止消化。进行细胞计数,稀释至500 个/mL,负载荧光的单个悬浮细胞即为“供体细胞”。在显微镜下观察已培养48 h的细胞,挑选生长良好、有缝隙连接形成(已融合)的细胞作为“受体细胞”。移去“受体细胞”培养液,PBS冲洗1次。向对应的“受体细胞”加入“供体细胞”液1 mL/孔,置于5%二氧化碳、37 ℃培养箱中培养4 h。待形成稳定的缝隙连接后,小分子的钙黄绿素(发绿色荧光)可以通过缝隙连接进入相邻的“受体细胞”。在倒置荧光显微镜下,计数一个“供体细胞”周围内含钙黄绿素的“受体细胞”的数目,作为缝隙连接功能指标。“供体细胞”周围荧光传递细胞数目的多少即间接反映缝隙连接的功能大小。
1.8 统计学方法采用SPSS 17.0统计软件对相关的数据进行统计学处理。各组间样本率差异的比较视数据类型采用χ2检验、Fisher精确检验、Kruskal-Wallis H检验和Mann-Whitney U检验。以P<0.05为差异有统计学意义。
2 结 果 2.1 Cx26在HCC及非癌肝组织中的表达比较如表1所示,正常肝组织Cx26蛋白表达均呈阳性(100%),肝炎(33.33%)、肝硬化(36.36%)及HCC组阳性表达率(47.37%)显著下调(均P<0.01),但Cx26蛋白的阳性表达率在肝炎、肝硬化及HCC组之间差异无统计学意义(P>0.05)。正常肝组织、肝炎及肝硬化组Cx26多呈+~++,而HCC组表达阳性的Cx26蛋白染色多呈++~+++(P<0.01)。
| (n) | |||||
| 组 别 | n | 阴性 | 阳性 | ||
| + | ++ | +++ | |||
| 正常肝组织 | 20 | 0 | 18 | 2 | 0 |
| 慢性肝炎*△ | 30 | 20 | 10 | 0 | 0 |
| 肝硬化*△ | 33 | 21 | 9 | 3 | 0 |
| HCC | 76 | 40 | 5 | 11 | 20 |
| 合计 | 159 | 81 | 42 | 16 | 20 |
| 与正常肝组织比较,*P<0.01;与HCC组织比较,△P<0.05. | |||||
Cx26组织背景非特异性反应微弱,定位清晰,阳性呈细线状或颗粒状。正常肝组织Cx26阳性颗粒呈线状分布于细胞膜上,未见细胞质着色,细胞膜表达明显(图1A);慢性肝炎组和肝硬化组大部分Cx26阳性位于细胞膜,其中慢性肝炎组6例见肝细胞胞质着色(图1B),9例肝硬化组肝细胞胞质也出现阳性染色(图1C)。而在HCC组织中,阳性染色颗粒均可见分布于细胞质(图1D),仅有2例同时可见部分细胞膜着色(图1E和1F),即发生了“内化”现象。内化率在正常肝组织、肝炎、肝硬化及HCC组分别是0%、60%、75%和100%。经统计学分析表明,从正常肝细胞、慢性肝炎、肝硬化向HCC演变的过程,Cx26蛋白内化率逐渐增强(χ2=73.669,P=0.000)。见表2。

|
| A:正常肝组织中Cx26蛋白均质分布于细胞膜;B:肝炎组织中Cx26细胞膜表达也较明显,但偶见同时有细胞质定位;C:肝硬化组织中阳性表达的Cx26同时可见定位于细胞膜和细胞质;D~F:HCC组织中阳性表达的Cx26主要位于细胞质(D),偶见同时有细胞质和细胞膜定位(E~F).标尺=50 μm. 图1 HCC及非癌肝组织中Cx26免疫组织化学染色结果 Fig.1 Immunohistochemical staining of Cx26 protein in sections of HCC and non-carcinomatous liver tissues |
| [n(%)] | |||
| 组 别 | n | 无内化 | 内化 |
| 正常肝组织 | 20 | 20 (100) | 0 (0) |
| 慢性肝炎 | 10 | 4 (40) | 6 (60)*△ |
| 肝硬化 | 12 | 3 (25) | 9 (75)*△ |
| HCC | 36 | 0 (0) | 36 (100)* |
| 与正常肝组织比较,*P<0.01;与HCC组织比较,△P<0.05. | |||
HCC组织中Cx26蛋白表达与临床病理因素的关系见表3。Cx26蛋白的表达与HCC年龄、性别、肿瘤病理分级、TNM分期、基础肝病史、淋巴结转移、脉管癌栓均无关(均P>0.05),而与肿瘤的长径有关(P<0.05)。Cx26蛋白表达阳性率在肿块长径≤5 cm的HCC组织低于肿块长径>5 cm的HCC组织(χ2=6.191,P=0.020)。但进一步统计学分析显示两者在蛋白表达强度分布上差异无统计学意义(U=540.000,P=0.052),见表4。
| (n) | |||||
| 临床病理特征 | n | Cx26 | χ2值 | P值 | |
| 阴性 | 阳性 | ||||
| 年龄(岁) <60 | 60 | 33 | 27 | 0.641 | 0.574 |
| ≥60 | 16 | 7 | 9 | ||
| 性别 男性 | 61 | 32 | 29 | 0.004 | 1.000 |
| 女性 | 15 | 8 | 7 | ||
| 肿瘤长径(cm) ≤5 | 43 | 28 | 15 | 6.191 | 0.020 |
| >5 | 33 | 12 | 21 | ||
| 肿瘤病理分级 I~Ⅱ | 48 | 27 | 21 | 0.684 | 0.479 |
| Ⅲ~Ⅳ | 28 | 13 | 15 | ||
| TNM分期 I~Ⅱ | 54 | 30 | 24 | 0.640 | 0.458 |
| Ⅲ~Ⅳ | 22 | 10 | 12 | ||
| 基础肝病 有 | 60 | 32 | 28 | 0.056 | 1.000 |
| 无 | 16 | 8 | 8 | ||
| 淋巴结转移 阴性 | 62 | 33 | 29 | 0.048 | 1.000 |
| 阳性 | 14 | 7 | 7 | ||
| 脉管癌栓 有 | 20 | 8 | 12 | 1.737 | 0.205 |
| 无 | 56 | 32 | 24 | ||
| 肿瘤长径(cm) | n | 阴性 | 阳性 | ||
| + | ++ | +++ | |||
| ≤5 | 43 | 28 | 1 | 4 | 10 |
| >5 | 33 | 12 | 4 | 7 | 10 |
| 合计 | 76 | 40 | 5 | 11 | 20 |
体外实验结果显示,正常肝细胞LO2具有较高水平的Cx26表达,且定位显示主要分布于细胞膜,功能性缝隙连接相对丰富;而肝癌细胞SMMC-7721中Cx26表达减少,多分布于细胞质,且缝隙连接通讯功能微弱(图2)。
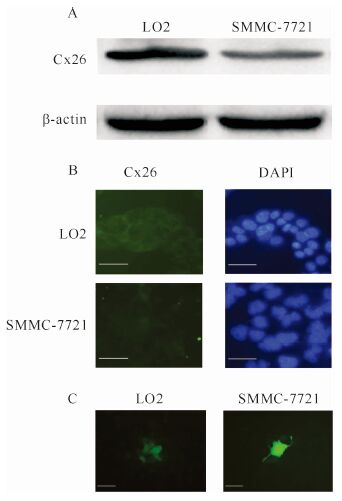
|
| A:蛋白质印迹法结果显示肝癌细胞SMMC-7721上Cx26蛋白表达较正常肝细胞LO2减少;B:免疫荧光显示正常肝细胞LO2中Cx26多呈线状分布于细胞膜上,而肝癌细胞SMMC-7721中Cx26荧光染色较弱,且主要定位于细胞质;C:细胞接种荧光示踪法显示正常肝细胞LO2中缝隙连接功能较为丰富,而肝癌细胞SMMC-7721的缝隙连接功能相对较弱.标尺=50 μm. 图2 LO2及SMMC-7721细胞中Cx26蛋白的表达、定位及缝隙连接状态 Fig.2 Expression and localization of Cx26 and functional gap junction status in LO2 and SMMC-7721 cells |
哺乳动物的组织细胞中广泛存在着一种蛋白质连接通道——缝隙连接。当该通道开放时,可允许离子以及相对分子质量1 ku以下的物质分子(如无机离子、第二信使环磷酸腺苷、环磷酸鸟苷、三磷酸肌醇以及其他参与细胞生长分化的调节物质)通过,从而实现“电耦联”和“化学耦联”。缝隙连接提供了一种细胞与细胞之间的直接联系通道,是细胞之间信号传递的一种重要方式,在细胞的新陈代谢、内环境稳定、增殖和分化等生理过程中起重要的调控作用。研究证明,缝隙连接的异常与肿瘤的发生、发展有密切的关系。通过对恶性肿瘤及其来源的正常组织或细胞的比较研究发现,大多数肿瘤组织Cx表达水平低,缝隙连接功能降低或缺失[10, 11]。恢复肿瘤细胞的缝隙连接,可抑制肿瘤细胞的生长、诱导其分化,有利于重建正常的细胞生长调控机制[12, 13]。因此,缝隙连接是一种公认的肿瘤抑制因素。推测其原因,可能在肿瘤形成的过程中,肿瘤与正常细胞间的缝隙连接减少使肿瘤细胞脱离正常细胞的调控,得以经过选择性生长最终形成恶性肿瘤[10]。然而,研究还发现也有一些肿瘤中存在正常甚至高水平的缝隙连接,如睾丸癌中Cx26和Cx40高表达[14],而Cx43取决于肿瘤类型可以上调或下调[15]。肿块直径较大的肺癌原发灶Cx26表达缺失[16],然而其转移淋巴结中Cx26表达却明显上调[17]。此外,恶性程度高的乳腺癌[18]和卵巢癌[19]中Cx也呈诱导高表达状态,并且体外乳腺癌细胞系中Cx26蛋白表达与实体瘤表达情况不一致,推测可能与肿瘤的分期有关[18, 20]。由此可见,不同种类的恶性肿瘤或恶性肿瘤发生的不同阶段,Cx表达及缝隙连接功能变化不尽相同,其与肿瘤发生发展的关系仍需进一步研究。
肝组织的缝隙连接含量丰富,主要由Cx32和Cx26组成[3]。有研究报道,自发性或化学诱导的肝癌动物模型体内Cx26和Cx32表达降低[21, 22],并且在人类肝硬化向肝癌的演变过程中,Cx32的表达量逐渐下调[4],而在正常肝细胞中检测不到的Cx43可以出现在肿瘤浸润组织中[23]。在人肝癌HepG-2细胞转染表达Cx26而非Cx32能抑制其增殖和逆转其恶性表型[24]。可见,在肝脏生理或病理情况下不同亚型Cx蛋白发挥不同的作用。然而既往对于缝隙连接与肝癌的报道多集中在Cx32,而Cx26作为组成肝脏缝隙连接的重要组分,其在不同来源的肝组织及HCC组织中的比较及在HCC发生发展中的关系,目前国内外未见系统报道。基于此,本研究首先在较大样本的组织学标本上检测HCC及非癌肝组织中Cx26蛋白表达差异,并在明确Cx26表达及定位变化后,使用人正常肝细胞株和肝癌细胞株体外证实组织学研究结果,并进一步检测缝隙连接通讯状态,为揭示HCC发生的病理生理过程提供更多的实验资料和理论依据。
本实验结果显示,20例正常肝组织均表达Cx26蛋白,肝炎、肝硬化及HCC组织中Cx26阳性表达率显著下降,而肝炎、肝硬化及HCC三组间差异不明显。表明Cx26蛋白的下调可发生在肝病的早期肝炎阶段。Cx32和Cx26共同组成肝细胞物质传递和信息通讯功能的结构基础,维持着正常肝细胞的缝隙连接依赖性通讯。我们推测,肝细胞在接受炎症、坏死、纤维化等多种有害因素时,缝隙连接及其组成单位Cx表达损伤,肝细胞对外来刺激的应答水平下降,最终导致肝脏组织内环境紊乱、细胞分化及生长控制失调而参与HCC的发生。此外,我们还观察到Cx26蛋白在HCC的定位存在异常,在正常的细胞均定位于细胞间相互接触的细胞膜,而在HCC中仅有极少量Cx26定位于细胞膜上,Cx26多定位于细胞质内而不能形成有功能性的缝隙连接,且随着从正常肝细胞到HCC的演变,Cx26定位变化趋势逐渐明显。这一点与Nakashima等[4]关于Cx32的报道一致。可见不同亚型Cx蛋白的“内化”现象可能是HCC发生过程中的标志之一。目前关于Cx内化的分子机制尚不清楚,有学者认为与另一类的连接蛋白如钙黏蛋白的作用有关,因为肿瘤细胞中常伴随Cx与钙黏蛋白的共下调或异常定位[21, 25]。钙黏蛋白作为参与上皮细胞间识别过程中的主要蛋白,其异常可导致细胞间的识别损伤,使Cx蛋白不能准确定位到细胞膜上。由此,尽管阳性表达的Cx26染色在HCC组较其他组更为强烈,但从定位上的改变来看,这种表达强度上的变化并未带来缝隙连接功能学上的改变。即可以认为,虽然某些HCC组织样本存在高水平的Cx26表达,但这并不表明这些细胞间的缝隙连接通讯功能正常。随后的体外实验也进一步证实了组织学上的研究结果,并进一步表明,与正常肝细胞株LO2丰富的缝隙连接通讯功能相比,人肝癌细胞株SMMC-7721只有部分残存的缝隙连接功能,并且这部分残存的缝隙连接功能并不能排除Cx32形成的可能性。
在本研究中另一个新的发现是Cx26在HCC组织中的表达与肿瘤大小呈正相关,提示HCC胞内Cx26表达对肿瘤生长可能有促进作用,虽然这部分促生长作用最终没有转化为对肿瘤分期的影响。这一点似乎与传统的Cx抑瘤作用相反,但这也可能是Cx26在HCC中的独特性表现。在肺癌研究中发现,正常肺组织表达Cx26、Cx32、Cx37、Cx40、Cx43和Cx45,其中Cx26、Cx32和Cx40在肿块长径较小(0.5~1.5 mm)的肺癌组织中表达与正常组相似;而在肿块长径较大(>2.5 mm)的肺癌组织中Cx26表达缺失,Cx32和Cx40表达下降,而Cx37和Cx45则在小肿瘤中不表达而在较大肿瘤中表达上调[16]。可见,Cx表达有一定的细胞、组织特异性,同一细胞可以表达多种Cx蛋白,但各Cx蛋白功能及表达方式各异[7]。我们推测,本研究中细胞内Cx26对HCC的部分促生长作用可能与其非通讯功能的介导有关。因为Cx作为一种独立的生物学功能单位,其可以通过非缝隙连接依赖性功能参与对细胞的生长和分化等调节过程[26]。
综上所述,本研究从组织学层面证实在正常肝细胞向HCC恶化演变过程中,存在Cx26蛋白表达下调和定位异常,Cx26的表达下调直接影响缝隙连接的组装数量,而Cx26的定位异常不仅使得Cx26不能在细胞膜上形成有功能性的缝隙连接,甚至有发挥促进肿瘤生长的作用,两者最终导致缝隙连接功能降低或缺失,这可能是HCC发生发展的重要环节之一。体外实验进一步证实了肝细胞癌变后Cx26及缝隙连接功能状态的改变。因此,未来以Cx26为靶点,寻找增强其在HCC中表达进而改善缝隙连接功能的途径和方法,可能为肝癌临床治疗提供新方向和新策略。
| [1] | VERSLYPE C, ROSMORDUC O, ROUGIER P; ESMO Guidelines Working Group. Hepatocellular carcinoma:ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J].Ann Oncol, 2012,23(Suppl 7):vii41-48. |
| [2] | 中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版)[J].临床肿瘤学杂志,2011,16(10):929-946. Ministry of Health of the People's Republic of China.Primary liver cancer diagnosis and treatment standard(2011 Edition)[J]. Chinese Clinical Oncology, 2011,16(10):929-946.(in Chinese) |
| [3] | MAES M, DECROCK E,COGLIATI B,et al. Connexin and pannexin(hemi)channels in the liver[J]. Front Physiol, 2014,4:405. |
| [4] | NAKASHIMA Y, ONO T, YAMANOI A, et al. Expression of gap junction protein connexin 32 in chronic hepatitis, liver cirrhosis, and hepatocellular carcinoma[J]. J Gastroenterol, 2004,39(8):763-768. |
| [5] | LI Q, OMORI Y, NISHIKAWA Y, et al. Cytoplasmic accumulation of connexin 32 protein enhances motility and metastatic ability of human hepatoma cells in vitro and in vivo[J]. Int J Cancer, 2007,121(3):536-546. |
| [6] | OMORI Y, LI Q, NISHIKAWA Y, et al. Pathological significance of intracytoplasmic connexin proteins:implication in tumor progression[J]. J Membr Biol, 2007,218(1-3):73-77. |
| [7] | VINKEN M, VANHAECKE T, PAPELEU P, et al. Connexins and their channels in cell growth and cell death[J]. Cell Signal, 2006,18(5):592-600. |
| [8] | 杨 燕,吴 穷,郑荣生,等.CX26/CX32缝隙连接蛋白的Tet-on HeLa细胞模型的建立及鉴定[J].基础医学与临床, 2013,33(9):1079-1084. YANG Yan, WU Qiong, ZHENG Rong-sheng, et al. Establishment and identification of a Tet-on HeLa cell model of CX26/CX32 gap junction[J]. Basic & Clinical Medicine, 2013,33(9):1079-1084.(in Chinese) |
| [9] | YANG Y, QIN S K, WU Q, et al. Connexin-dependent gap junction enhancement is involved in the synergistic effect of sorafenib and all-trans retinoic acid on HCC growth inhibition[J]. Oncol Rep, 2014,31(2):540-550. |
| [10] | MESNIL M, CRESPIN S, AVANZO J L, et al. Defective gap junctional intercellular communication in the carcinogenic process[J]. Biochim Biophys Acta, 2005,1719(1-2):125-145. |
| [11] | LEITHE E, SIRNES S, OMORI Y, et al. Downregulation of gap junctions in cancer cells[J]. Crit Rev Oncog, 2006,12(3-4):225-256. |
| [12] | MOMIYAMA M, OMORI Y, ISHIZAKI Y, et al. Connexin26-mediated gap junctional communication reverses the malignant phenotype of MCF-7 breast cancer cells[J]. Cancer Sci, 2003,94(6):501-507. |
| [13] | LIU C L, HUANG Y S, HOSOKAWA M, et al. Inhibition of proliferation of a hepatoma cell line by fucoxanthin in relation to cell cycle arrest and enhanced gap junctional intercellular communication[J]. Chem Biol Interact, 2009,182(2-3):165-172. |
| [14] | POINTIS G, SEGRETAIN D.Role of connexin-based gap junction channels in testis[J]. Trends Endocrinol Metab, 2005,16(7):300-306. |
| [15] | RUTTINGER C, BERGMANN M, FINK L, et al. Expression of connexin 43 in normal canine testes and canine testicular tumors[J]. Histochem Cell Biol, 2008,130(3):537-548. |
| [16] | UDAKA N, MIYAGI Y, ITO T. Connexin expression in mouse lung tumor[J]. Cancer Lett, 2007,246(1-2):224-229. |
| [17] | ITO A, KOMA Y, UCHINO K, et al. Increased expression of connexin 26 in the invasive component of lung squamous cell carcinoma:significant correlation with poor prognosis[J]. Cancer Lett, 2006,234(2):239-248. |
| [18] | JAMIESON S, GOING J J, D'ARCY R,et al. Expression of gap junction proteins connexin 26 and connexin 43 in normal human breast and in breast tumours[J]. J Pathol, 1998,184(1):37-43. |
| [19] | ZHAI Y, WU R,SCHWARTZ D R, et al. Role of beta-catenin/T-cell factor-regulated genes in ovarian endometrioid adenocarcinomas[J]. Am J Pathol, 2002,160(4):1229-1238. |
| [20] | SAUNDERS M M, SERAJ M J, LI Z, et al. Breast cancer metastatic potential correlates with a breakdown in homospecific and heterospecific gap junctional intercellular communication[J]. Cancer Res, 2001,61(5):1765-1767. |
| [21] | TSUJIUCHI T, SHIMIZU K, ITSUZAKI Y, et al. CpG site hypermethylation of E-cadherin and Connexin 26 genes in hepatocellular carcinomas induced by a choline-deficient L-amino acid-defined diet in rats. Mol Carcinog, 2007,46(4):269-274. |
| [22] | PLANTE I, CHARBONNEAU M, CYR D G. Decreased gap junctional intercellular communication in hexachlorobenzene-induced gender-specific hepatic tumor formation in the rat[J]. Carcinogenesis, 2002,23(7):1243-1249. |
| [23] | WANG Z S, WU L Q,YI X, et al. Connexin-43 can delay early recurrence and metastasis in patients with hepatitis B-related hepatocellular carcinoma and low serum alpha-fetoprotein after radical hepatectomy[J]. BMC Cancer, 2013,13:306. |
| [24] | YANO T, HERNANDEZ-BLAZQUEZ F J, OMORI Y, et al. Reduction of malignant phenotype of HEPG2 cell is associated with the expression of connexin 26 but not connexin 32[J]. Carcinogenesis, 2001,22(10):1593-1600. |
| [25] | ZHAO J Q, SUN F J, LIU S S, et al. Expression of connexin 43 and E-cadherin protein and mRNA in non-small cell lung cancers in Chinese patients[J].Asian Pac J Cancer Prev, 2013,14(2):639-643. |
| [26] | JIANG J X, GU S. Gap junction-and hemichannel-independent actions of connexins[J]. Biochim Biophys Acta, 2005,1711(2):208-214. |




